陈俊梅, 李文鹏, 赵素雅, 黄冰纷, 王博文, 惠丰立, 尹晓燕, 牛秋红


南阳师范学院生命科学与技术学院, 河南 南阳 473061
收稿日期:2018-12-04;修回日期:2019-03-11;网络出版日期:2019-05-05
基金项目:国家自然科学基金(31770138,31570120);河南省高校科技创新人才支持计划(17HASTIT041);南阳师范学院研究生创新基金(2018CX015,2018CX004)
作者简介:牛秋红,博士,南阳师范学院教授,首届优秀硕士研究生导师。中国微生物学会医学微生物学与免疫学专业委员会委员,河南省教育厅学术技术带头人,河南省高校科技创新人才,河南省科技厅高校科技创新团队带头人,河南省植物保护学会理事,南阳师范学院“卧龙****”。长期从事微生物资源的开发利用研究,尤其是植物寄生线虫的生物防治菌株的开发与机制,探索自然条件下线虫伴生菌与病原菌、宿主三者之间的互作机制,为最终设计药物靶标减少病原细菌感染性疾病的发生或提高病原微生物对宿主的生防效果等提供理论基础。主持(完成)国家自然科学基金项目3项,主持完成河南省高等学校青年骨干教师资助计划项目1项,主持完成企业合作项目1项,授权国家发明专利2项。发表SCI论文13篇.
*通信作者:牛秋红, Tel:+86-377-63503060, E-mail: qiuhongniu723@163.com.
摘要:[目的] 从蠼螋肠道细菌菌株Q5中获得一个新型耐碱纤维素酶基因,通过异源表达、酶学性质及功能分析,旨在为以后进一步研究开发高温碱性纤维素酶提供一些理论参考。[方法] 采用刚果红平板初筛法,从河南南阳宝天曼国家级自然保护区落叶堆下的昆虫蠼螋肠道中,获得具有分泌较高活性碱性纤维素酶的细菌菌株。基于该菌株的形态学、生理学及16S rRNA序列特征等对高活性菌株进行分类鉴定。并通过设计简并引物,从高活性菌株中克隆出该菌株的纤维素酶基因,并进行序列分析,并导入大肠杆菌BL21中表达。[结果] 获得1株具有分泌较高活性碱性内切葡聚糖酶的细菌菌株Q5,经鉴定为甲基营养型芽孢杆菌,进一步从Q5菌株中成功克隆出该菌株的一个全长1500 bp的内切葡聚糖酶基因(GenBank KR067575),在NCBI比对后发现该基因的氨基酸序列与芽孢杆菌菌株LM 4-2的耐碱性β-1,4-内切葡聚糖酶基因(AKE23721.1)有98%的同源性。重组菌经优化培养,细胞破碎后上清液中的酶活力可达3.46 U/mL,是出发菌株Q5(2.05 U/mL)的1.69倍。经正交实验优化后的酶活力为4.99 U/mL。酶学性质研究表明:该酶的最适反应温度与pH值分别为50℃与pH 8.5,在pH 8.0和9.0保温48 h,其酶活力仍然维持到最高酶活的82%和81%;该酶在50℃以下较稳定,60℃以上酶活迅速降低。10 mmol/L的Ca2+和Mg2+对酶的活性有明显促进作用,重组酶Ega5的Km和Vmax分别是2.217 mol/mL和9.606μmol/(min·L)。该重组酶对棉花黄萎病病原菌大丽轮枝菌具有显著抑制作用。[结论] 本文首次从蠼螋肠道中筛选到了一株产碱性内切葡聚糖酶的细菌菌株并从中克隆出了一个碱性纤维素酶基因,为该酶在碱性条件的应用奠定了理论基础。
关键词:蠼螋肠道碱性内切葡聚糖酶基因克隆异源表达酶学性质和功能
Cloning, expression and function of an alkaline resistance endo-glucanase gene isolated from guts of earwig
Junmei Chen, Wenpeng Li, Suya Zhao, Bingfen Huang, Bowen Wang, Fengli Hui, Xiaoyan Yin, Qiuhong Niu


College of Life Science and Technology, Nanyang Normal University, Nanyang 473061, Henan Province, China
Received: 4 December 2018; Revised: 11 March 2019; Published online: 5 May 2019
*Corresponding author: Qiuhong Niu, Tel:+86-377-63503060, E-mail: qiuhongniu723@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31770138, 31570120), by the Scientific and Technological Innovative Talents in Universities of Henan Province (17HASTIT041) and by the Postgraduate Innovation Fund Project of Nanyang Normal University (2018CX015, 2018CX004)
Abstract: [Objective] To provide some theoretical references for further research and development of alkaline cellulase via obtaining a novel alkaline resistance cellulase in bacteria from intestines of earwig, and heterologously express, characterize the functions of the enzyme. [Methods] First, we isolated the bacterial strains from earwig gut samples in Nanyang Baotianman National Reserve Area, Henan province, China by primarily screening according to Congo red plate methods. Then, we obtained and identified the bacterial strains with high alkaline cellulase activities by phenotypic and genotypic characteristics. We designed degenerate primes according to the known endoglucanase gene sequences in GenBank to carry out PCR, analyzed the cloned sequence, and expressed the enzyme in Escherichia coli BL21. [Results] We obtained one bacterial strain with high alkaline cellulase activities named strain Q5. The bacterium was classified to be Bacillus methylotrophicus. The full length of a cellulase gene cDNA (1500 bp) (GenBank KR067575) coding region was successfully cloned. The homogeneous analysis demonstrated that the deduced amino acid of the gene showed 98% similarities with the alkaline β-1, 4 endoglycosidase from Bacillus sp. 2190 (ALE32753.1). The activity of the recombined endoglucanase was 3.46 U/mL, which was 1.69 times higher than that of the wild Bacillus methylotrophicus Q5 (2.05 U/mL). The highest cellulase activity reached 4.99 U/mL after orthogonal experiment. The properties of the recombined enzyme were determined. The optimum temperature and pH value were 50℃ and pH 8.5, respectively. The enzyme maintained over 80% of the original enzyme activity at pH 8.0 and pH 9.0 after incubated at 50℃ for 48 h. The enzyme was stable below 50℃ and the activity decreased sharply above 60℃. The activity of this enzyme was activated by 10 mmol/L Ca2+和Mg2+. The values of Km and Vmax were 2.217 mol/mL and 9.606 μmol/(min·L), respectively. The enzyme showed obviously inhibiting the growth of the cotton pathogenic fungi Verticillum dahliae. [Conclusion] It was the first time we got an alkaline resistance endoglucanasegene from Bacillus methylotrophicus isolated from guts of earwig. Our findings will lay a theoretical foundation for the application in alkaline environments.
Keywords: earwig gutsalkaline endoglucanasegene cloneheterogeneous expressionenzyme characteristics and functions
纤维素是植物细胞壁中的一种主要成分,也是地球上最廉价、最丰富的一种可再生资源,并在自然界中广泛存在,同时也是化工业原料、食品和未来能源的主要来源之一[1]。在中国植物纤维资源非常丰富,每年种植的秸秆超过5亿t,以及1000万t森林采伐加工剩余物和400万t甘蔗渣,还有工业纤维产生的废物量,城市纤维废物等都是相当巨大的[2-3]。但是,目前大多数这些资源都没有得到很好的利用。对这种丰富资源进行更有效的转化和利用的研究已成为世界上许多国家关注的最重要领域之一。
纤维素酶是一种多组分的复合酶系,主要组分包括内切型-β-葡聚糖酶(EC 3.2.1.4)、外切型-β-葡聚糖酶(EC 3.2.1.91)和β-葡萄糖苷酶(EC 3.2.1.21)[4]。在纤维素酶将纤维素转化为葡萄糖的过程中,只有在上述三种酶的协同作用下,纤维素酶才能将纤维素分子转化为葡萄糖。于是微生物能够生成这些酶的复合物,同时将纤维素转化成葡萄糖分子供自身使用[3]。
纤维素酶的种类繁多,分布十分广泛,在昆虫肠道内、食草动物的消化道内、真菌、放线菌和细菌等都能发现纤维素酶的存在[3-4]。此外,自然界中还存在大量的分解纤维素的细菌,它们拥有易于培养、生长周期短等特点,并且由于大部分细菌的最适pH值处于碱性范围,因而多数细菌产的纤维素酶均为碱性纤维素酶。碱性纤维素酶属于葡聚糖内切酶,它主要作用于约10%棉纤维的无定形区域中的纤维素分子,并且对结晶区域中的纤维素具有低水解活性,而且具有水解细小织物纤维的能力,因此它不会显著降低棉纤维的硬度[5]。近年来,碱性纤维素酶创建了新的去污机制,彻底改变了古老传统的去污办法,大大提高了洗涤的效率,具有增白、提亮、软化的功能,已经成功应用到了洗涤剂工业当中。此外,碱性纤维素酶在纺织、食品、制浆造纸工业、化工、环境保护等领域中也发挥着重要作用[6]。大部分的碱性纤维素酶是在碱性条件下产生的,最早是从两株嗜碱性的芽孢杆菌中发现的,后来又发现某些种类的链霉菌也可以合成碱性纤维素酶[7],目前分离到的能产碱性纤维素酶最多的为革兰氏阳性芽孢杆菌[8]。芽孢杆菌因其抗性强、繁殖快等特点,目前研究最多的仍是芽孢杆菌属。
昆虫是世界上分布最广泛,数量最繁多,种类最丰富的动物类群[9]。昆虫肠道中存在着数目众多、种类多样的微生物,是微生物分布的一种特殊场所。昆虫的肠道由前肠、中肠和后肠三部分组成。像半翅目、双翅目、鳞翅目和膜翅目等大多数昆虫主要是在中肠进行食物消化,但有些像蜚蠊目的白蚁等种类的昆虫,因其中肠纤细,后肠肥大,主要是在后肠进行食物消化[10]。不同的昆虫肠道其存在的微生物种类存在着很大的差别,它会因肠道的pH、生理结构、肠道免疫特性、理化特征以及肠道的组成结构不同产生很大的影响。绝大部分昆虫肠道呈中性,但鳞翅目昆虫中肠为碱性(pH 11–12),蚊幼虫中肠后部也为碱性[10]。昆虫肠道微生物是同一个属但不同种的种群结构十分类似[11]。在肠道中分布着各种各样的微生物,细菌、原生动物、真菌、古细菌和病毒等为主要的组成部分,其中细菌占的比例最大,约占肠道微生物总数的99%以上[12]。肠道微生物调节昆虫宿主的生理、病理过程是目前昆虫微生物领域研究的主要内容。并且有研究表明这些微生物的生物学功能在工业生产中(如木质纤维素降解、聚乙烯塑料降解[13])、害虫防控以及昆虫资源利用等领域方面具有很大的应用潜力[14]。因此,从昆虫肠道中寻找出具有特定生物学功能的微生物并对其进行功能机制研究,再将其应用于生产实践中,具有十分重要的理论意义和实践价值。大部分昆虫肠道细菌能产生纤维素酶,是一种有效的生物降解物质和很好的生物资源[15]。
纤维素酶虽然在很多领域具有巨大的应用潜力,但是,纤维素酶在开发和应用过程中也存在很多问题,首先,筛选获得能产纤维素酶的菌株较少,而且有的酶活力较低或者生产成本太高;其次是纤维素酶的酶学性质不稳定,单独使用无法把纤维素完全彻底有效地分解,必须依靠微生物来分解转化;还有的是因为产酶条件比较严格、耐热性差、菌株的安全性未知等种种原因无法应用于生产实践。所以,从自然界这个巨大宝库中发掘出新的具高活性、酶学性能优异的纤维素酶基因,经基因克隆、优化诱导条件等手段对基因进行高效表达,这样可以有效改变纤维素酶实际应用中的不足,以便更好地应用到生产实践,具有非常重大的意义。
目前已有40多种细菌内切葡聚糖酶基因被克隆[16-18]。目前,通过基因工程技术,对纤维素酶基因进行重组构建,诱导表达出高活性纤维素酶工程菌已成为研究热点[19],并且能合理充分地利用我国的自然资源,对解决能源的可持续发展具有重要的理论意义。
本文从河南南阳宝天曼国家级自然保护区落叶堆下捕捉到植食性昆虫蠼螋,解剖后取其肠道用无菌水清洗、研磨,利用刚果红平板筛选出一株产生碱性纤维素酶的细菌甲基营养型芽孢杆菌Bacillus methylotrophicus Q5菌株,并进一步对该菌的纤维素酶基因进行克隆及异源表达,同时进行酶活力的测定以及酶学性质分析,为获得一株高产的碱性纤维素酶应用于洗涤行业中奠定了基础。
1 材料和方法 1.1 材料
1.1.1 试验材料: 采自河南南阳宝天曼国家级自然保护区落叶堆下的昆虫蠼螋样品。
1.1.2 培养基: (1) 初筛培养基(g/L):硫酸锰0.0016,磷酸氢二钾2.0,羧甲基纤维素钠10.0,硫酸铵1.4,氯化钙0.3,七水合硫酸亚铁0.005,氯化锌0.0017,氯化钴0.002,七水合硫酸镁0.3,琼脂18.0,pH调至9.5。
(2) 种子培养基(g/L):蛋白胨10.0,酵母粉5.0,葡萄糖10.0,磷酸氢二钾1.0,无水碳酸钠10.0,pH值调至9.5。
(3) 发酵培养基(g/L):磷酸氢二钾1.0,酵母膏20.0,羧甲基纤维素钠20.0,氯化钠5.0,七水合硫酸镁1.0,pH调至9.5。
(4) LB培养基(g/L):蛋白胨10.0,酵母膏5.0,NaCl 10.0,琼脂15.0。
(5) PDA培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂20.0。
1.1.3 主要试剂和仪器: 全自动凝胶成像系统(Bio-Rad),引物合成及序列测定(上海生工),ZSD-1160生化培养箱,分子生物学试剂(TaKaRa),PCR仪(美国ABI公司),核酸电泳仪(北京六一仪器厂)。
1.2 产碱性纤维素酶细菌菌株的筛选 采用刚果红染色法对蠼螋肠道中的菌株进行初筛:于无菌操作台上先用75%酒精棉球擦拭蠼螋2–3次,再用无菌水冲洗3次,吸干水分,将蠼螋解剖,取其肠道用75%酒精消毒5 s,再用无菌水冲洗3–5次,吸干水分,以无菌方式,称取0.5 g的蠼螋肠道,充分研磨均匀,利用梯度稀释法稀释,取研磨液依次稀释10倍至合适的梯度。采用稀释涂布平板法,涂布于初筛培养基平板上,置于恒温培养箱中37 ℃培养48 h。然后,挑取形态、大小、色泽不同的单菌落在初筛培养基平板上划线,在初筛培养基平板上,用划线培养法对细菌进行3次纯化。挑取纯化后的单菌落转接到初筛培养基中培养24 h后,进行刚果红(1 mg/mL)染色,染色2 h后弃去染液,再加入适量的NaCl (1 mol/L)溶液,脱色1 h,如果在菌落周围出现透明的水解圈,说明该菌株产纤维素酶,并用游标卡尺测量每个菌株的水解圈直径和菌落生长直径[20],根据水解圈直径的大小筛选出产酶的菌株,对比值较大的菌株进行复筛。复筛采用摇瓶发酵。从初筛获得的菌株中挑取一个单菌落接到30 mL的种子培养基中,在37 ℃、150 r/min的摇床中振荡培养24 h,获得种子液。再按照1%的比例将其转接到50 mL的新鲜发酵培养基中,于37 ℃、150 r/min振荡培养48 h。将发酵液在4 ℃、5000 r/min的转速下离心30 min,所得的上清即为粗酶液。按照下面1.3纤维素酶活测定方法来测定各菌株的发酵产酶活力。
1.3 纤维素酶活测定 采用DNS试剂测定发酵液中的酶活力,具体配制方法参照QB2583-2003附录B[5],所用的缓冲液为0.05 mol/L、pH 9.5的甘氨酸-NaOH缓冲液。所涉及到的量化实验3次重复,并做3个平行实验,取平均值。酶活单位定义:在pH 9.5、(50.0±0.1)℃的条件下,每分钟催化1 μmol羧甲基纤维素钠转化为葡萄糖的酶量定义为1个酶活力单位,以U表示。
1.4 高活性细菌的分类鉴定 利用革兰氏染色法鉴定了高活性菌株Q5,同时进行形态学观察。并对高活性的细菌菌株进行V-P试验、葡萄糖产酸产气实验、甲基红反应和接触酶实验等生理生化实验,具体步骤参照《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》。提取细菌的基因组以及16S rDNA的扩增都参照参考文献[21]。对通过扩增获得的序列进行分析,使用CLUSTALX和MEGA 6.0软件构建系统发育树以鉴定菌株[22-24]。
1.5 碱性纤维素酶基因的克隆 从GenBank数据库中选择并下载与Q5菌株具有高度同源性的现有细菌纤维素酶序列进行比较分析。利用Primer 5.0软件基于这些序列的保守区域设计引物,对高活性菌株Q5的纤维素酶基因进行了扩增试验。设计的引物序列为:ac1:5′-GCG GGGATCCATGAACGKTCAWTCTCTAKT-3′;ac2:5′-CGCTAAGCTTTYGGTTCTGTKCCSCAA-3′。PCR扩增条件:95 ℃ 5 min,95 ℃ 30 s,58–44 ℃每隔0.5 ℃ 1个循环,44 ℃ 5个循环(1 min),72 ℃ 2 min,72 ℃ 10 min。利用凝胶回收试剂盒对扩增产物进行切胶回收,回收后连接到pMD18-T (TaKaRa)克隆载体中,从抗性平板上筛选出阳性克隆,并提取质粒送去测序。利用BLAST软件通过GenBank数据库搜索对已经获得的序列的相似性。把已知的纤维素酶基因序列和扩增的序列在DNAMAN软件中进行核苷酸和氨基酸比对,根据比对结果分析这些序列的特征。
1.6 碱性纤维素酶基因的异源表达 利用BamH Ⅰ和Hind Ⅲ酶对所提取的阳性克隆质粒进行双酶切,酶切成功获得纤维素酶基因,并与pET-32a(+)载体连接,构建原核表达载体pET-ega5,重组质粒pET-ega5经双酶切验证成功,于是转入大肠杆菌宿主菌E. coli BL21中进行表达,取转化后的重组菌活化,摇至对数期后稀释100倍加到含有卡那霉素的发酵培养基中,继续培养至对数期,同时加入终浓度为1 mmol/L的IPTG进行诱导表达。SDS-PAGE电泳检测重组菌细胞内的表达产物[25]。分别取不含有纤维素酶基因的空载体E. coli BL21以及诱导表达前、后的菌悬液作为阴性对照,进行SDS-PAGE分析。通过超声波细胞破碎方法进行细胞裂解,测定上清液的酶活性,并分析表达产物的酶学性质。
1.7 表达条件优化 通过设计正交实验,优化诱导时间、诱导温度、诱导剂IPTG浓度、诱导时菌液浓度4个因素,以提高重组酶的表达水平,正交试验见表 1。
表 1. 重组酶表达量优化正交设计及优化表达结果 Table 1. Orthogonal test and optimization expression of the extracellular recombinant cellulases
| Factors | Induction time/h | IPTG concentration/(mmol/L) | Concentration of bacteria/A600 | Induction temperature/℃ | Enzyme activity/(U/mL) |
| Experiment 1 | 8 | 0.8 | 0.6 | 30 | 2.92 |
| Experiment 2 | 8 | 0.8 | 0.6 | 37 | 1.49 |
| Experiment 3 | 8 | 1.0 | 0.8 | 30 | 3.33 |
| Experiment 4 | 8 | 1.0 | 0.8 | 37 | 3.01 |
| Experiment 5 | 16 | 0.8 | 0.8 | 30 | 3.49 |
| Experiment 6 | 16 | 0.8 | 0.8 | 37 | 1.98 |
| Experiment 7 | 16 | 1.0 | 0.6 | 30 | 4.99 |
| Experiment 8 | 16 | 1.0 | 0.6 | 37 | 3.05 |
表选项
1.8 酶学性质分析 酶学性质分析参考文献[25]进行。在pH=3到pH=11的范围内测定酶活力,从而确定酶的最适作用pH;将1.0 mL原酶液(适当稀释)分别置于不同pH的缓冲液中于50 ℃保温48 h,每隔6 h加入1.0 mL的1%的羧甲基纤维素钠作为底物,在50 ℃保温的条件下反应后,测定残余酶活力。以酶活最高为100%,其余酶活与之相比计算相对酶活,从而确定该酶的pH稳定性。在30–70 ℃范围内,通过每间隔5 ℃与底物反应30 min来测定酶活性,从而确定酶的最佳反应温度。在相对稳定的最佳pH下,使酶在30–60 ℃时,每隔5 ℃保温24 h,每隔4 h再测定相对酶活。以酶活最高为100%,其余酶活与之相比计算相对酶活,从而确定该酶的热稳定性。
用底物为1.0%羧甲基纤维素钠(溶于最适pH缓冲液中)来检测金属离子对重组酶酶活性的影响,添加到反应混合物中的最终浓度分别为1 mmol和10 mmol的金属离子(Na+、K+、Ca2+、Fe2+、Mg2+、Zn2+、Cu2+、Pb2+、Hg2+、Mn2+),在最适pH和最适温度的条件下反应20 min,每组进行3次平行实验,酶活性通过1.3的方法测定。在相同的反应条件下,将没有任何金属离子的酶活性作为100%,并计算其他实验组的相对酶活性。
以浓度为0.05%–1.00% (W/V)的CMC-Na为底物,在适宜的pH和最佳温度下测定酶活性,并使用双倒数方程法(Lineweaver-Burk法)计算相应的初反应速度,确定重组纤维素酶的Km值和Vmax。
1.9 抑制病原真菌活性测试 采用琼脂打孔法进行重组酶的抑菌活性测试[26],取事先培养好的大丽轮枝菌用打孔器打出直径为1 cm的菌饼,接在PDA平板中央,25 ℃培养箱中倒置培养5 d。在距大丽轮枝菌菌饼约2 cm的等距离的2个位置用直径为1 cm的打孔器打孔,一孔加入100 μL的重组纯酶液作为处理组,另一孔加入100 μL的蛋白buffer作为对照组。25 ℃恒温培养7 d,测量大丽轮枝菌菌落生长直径,并按照下列公式计算抑菌率[27]。
抑菌率=(对照真菌生长直径–处理真菌生长直径)/对照真菌生长直径×100%。
2 结果和分析 2.1 菌株的分离筛选 通过对蠼螋肠道中的细菌进行分离和初筛,共获得3株(编号为1.1,1.2和2.1)在CMC平板上刚果红染色后产生水解圈的菌株,结果如图 1所示。由于水解圈与菌落直径的比值大小初步可以判断酶活力的大小,因此,发现菌株1.1产酶活力最高;但根据文献报道,菌株产纤维素酶活力的高低如果仅仅根据水解圈与菌落直径的比值大小来作为唯一的定量指标是不可靠的[28]。因此,对初步筛选得到的3株产碱性纤维素酶的菌株进行摇瓶发酵是十分必要的。结果见表 2。由表 2可以看出,菌株1.1的产酶活力最高,根据该菌株的来源将其命名为Q5,选择该菌株进行后续的研究。
 |
| 图 1 菌株纤维素水解圈照片 Figure 1 Cellulose hydrolysis photos of strains. |
| 图选项 |
表 2. 各菌株纤维素水解圈直径和酶活力测试结果 Table 2. The diameter of cellulose hydrolysis circle for each strain and enzyme activity test results
| Number | Colony diameter/cm | Hydrolytic circle/cm | Hydrolytic circle/Colony diameter | Enzyme activity/(U/mL) |
| 1.1 | 0.187 | 1.996 | 10.67 | 2.05 |
| 1.2 | 0.413 | 2.469 | 5.98 | 1.51 |
| 2.1 | 0.222 | 1.147 | 5.17 | 1.48 |
表选项
2.2 分离菌株Q5的鉴定 细菌Q5兼性厌氧,G+,菌落呈白色,扁平,不透明。细胞呈杆状,大小为(0.4–1.0)μm× (1.2–2.3) μm,芽孢中生(图 2)。
 |
| 图 2 菌株Q5的形态学特征 Figure 2 Morphological characterizations of strain Q5. A: colony morphology; B: cell morphology. |
| 图选项 |
依据《常见细菌系统鉴定手册》及《伯杰氏细菌鉴定手册》中对芽孢杆菌的特征描述,并结合形态学特征,最终将Q5确定为芽孢杆菌属,菌株Q5的生理生化实验结果如表 3所示。
表 3. Q5菌株的生理生化特征 Table 3. Physiological and biochemical characteristics of strain Q5
| Physiology biochemistry experiment | Q5 |
| Catalase | + |
| Methyl red test | + |
| V-P test | + |
| Hydrogen sulfide gas | – |
| Mobility | + |
| Casein hydrolysis | + |
| Indole reaction | – |
| Starch hydrolization | + |
| Gelatin hydrolization | – |
| Glucose produced acid | + |
| Gas production fromglucose | – |
| Mannitol produces acid | + |
| Fructose produce acid | + |
| Nitrate reduction | + |
| The urea | – |
| Dihydroxy acetone | – |
| 10% NaCl | + |
| 50 ℃ | – |
| +: indicates that the substance is available or has this feature; –: indicates that the substance is not available or does not have this feature. | |
表选项
对菌株Q5的16S rRNA序列进行分析,结果发现跟Q5菌株同源性最高的是甲基营养型芽孢杆菌Bacillus methylotrophicus,达到100%;选择与该序列具有99%或更高同源性的8个菌株,选择Bacillus atrophaeus作为外群,使用MEGA 6.0软件构建系统发育树,结果见图 3。菌株Q5与Bacillus methylotrophicus属于同一个分支。根据16S rRNA基因同源性比较,并结合菌株的形态学观察和生理生化特征,可将Q5鉴定为甲基营养型芽孢杆菌。
 |
| 图 3 依据16S rRNA序列构建的菌株Q5的系统发育树 Figure 3 Neighbour-joining tree based on nearly completed 16S rRNA sequences. The numbers at each branch points indicate the percentage supported by bootstrap. Numbers in parentheses are accession numbers of sequence in GenBank. |
| 图选项 |
2.3 菌株Q5纤维素酶基因的克隆及序列分析 使用细菌Q5菌株的基因组DNA作为模板,通过PCR扩增纤维素酶基因。再通过12%琼脂糖凝胶电泳分析产物。结果表明,在1.5 kb左右有一特异性的扩增条带(图 4,箭头所指line 3),该DNA片段的大小与预期大小一致。将PCR产物与pMD18-T载体连接,然后转化到大肠杆菌JM109中,利用菌落PCR对获得的转化子进行验证,筛选阳性转化子在液体培养基中过夜培养,然后按照试剂盒说明书的要求提取质粒,将重组质粒送到上海生物技术公司进行测序。
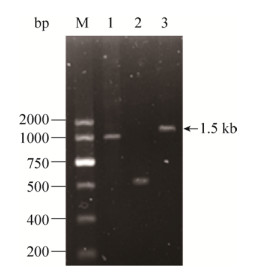 |
| 图 4 PCR扩增产物电泳检测结果 Figure 4 Electrophoresis analysis of PCR amplification products. M: marker; lines 1–3 are amplified bands for different reaction systems. Where line 3 indicates the same size as the expected size. |
| 图选项 |
测序结果显示,该DNA片段长为1500 bp,编码499个氨基酸,并将其命名为ega5。并把此序列输入到GenBank数据库中,以此获得基因号KR067575.1。将克隆的基因序列与数据库中的纤维素酶基因进行了比较分析,结果显示该氨基酸序列与不可培养细菌中的β-1, 4-内切葡聚糖酶基因(AFX88666.1)有98%的同源性;
与芽孢杆菌菌株LM 4-2的耐碱性β-1, 4-内切葡聚糖酶基因(AKE23721.1)有98%的同源性。选取与此序列同源性最高的来源于不同细菌的11个氨基酸序列,使用MEGA6.0软件构建了纤维素酶Ega5的系统发育树,如图 5所示。根据以上分析结果,可推测从甲基营养型芽孢杆菌Q5中克隆到的Ega5属于一个耐碱性的内切葡聚糖酶。
 |
| 图 5 基于氨基酸序列构建纤维素酶Ega5的系统发育树 Figure 5 Phylogenetic tree of cellulase Ega5 based on amino acid sequence. The numbers of nodes indicate bootstrap values and represent the percentages of 1000 bootstrap replications in which the taxa to the right are placed together. Accession number for each enzyme is showed in bracket behind the bacterial name. |
| 图选项 |
2.4 纤维素酶基因ega5的异源表达 采用BamH I和Hind Ⅲ双酶切对构建的重组表达质粒pET-ega5进行酶切验证,鉴定结果如图 6所示,转化子1和3所提的质粒切出1500 bp的片段,与预期结果一致,从而说明这2个质粒构建成功,选取第3个转化子的质粒进行异源表达。
 |
| 图 6 重组表达质粒pET-ega5的双酶切验证 Figure 6 The recombinant expression plasmid pET-ega5 was verified by double digestion. M: marker; 1–3 are verification results of extractive plasmid double enzyme digestion for 3 transformants. |
| 图选项 |
将重组质粒pET-ega5转化大肠杆菌所得的转化子,即大肠杆菌BL-Ega5,接种于含50 μg/mL卡那霉素和IPTG的CMC培养基平板,同时将已导入pET32a质粒的大肠杆菌BL21作为阴性对照接种在此平板上,37 ℃培养后发现作为阴性对照组的大肠杆菌菌落周围没有出现透明圈(图 7-A-2),而大肠杆菌BL-Ega5菌落周围产生了较小的透明圈(图 7-A-1),说明在大肠杆菌BL21中内源β-1, 4-内切葡聚糖酶基因不能表达,然而,外源β-1, 4-内切葡聚糖酶基因在大肠杆菌中却能表达,虽然表达的水平较低但所产的酶具有一定的酶活性。
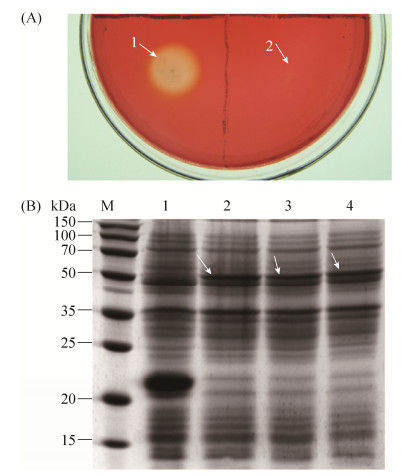 |
| 图 7 Ega5的诱导表达检测 Figure 7 Ega5 induced expression assay. A: plate assay; B: expression product SDS-PAGE analysis. M: marker, 1 is the expression product containing the empty prokaryotic expression vector pET32a, 2–4 is an expression product containing prokaryotic expression recombinant plasmid pET-ega5. |
| 图选项 |
把BL-Ega5菌株进行IPTG诱导培养,然后采用SDS-PAGE法进行跑胶检测,跟空白载体的BL21菌株相比,BL-Ega5菌株产生了1条特异性的蛋白质条带,并计算了该条带的相对分子质量,发现与计算出的内葡聚糖酶成熟蛋白的相对分子质量的理论值相同,都为50 kDa (图 7)。在通过超声波破碎后,发现含有内切葡聚糖酶Ega5的细菌裂解物具有更高的酶活性,在最适温度下总比酶活为3.46 U/mL,是出发菌株Q5 (2.05 U/mL)的1.69倍。
通过设计正交试验对重组酶的表达条件进行优化,结果表明:按照表 1设计的正交实验1–实验8,所测的酶活分别是2.92、1.49、3.33、3.01、3.49、1.98、4.99、3.05 U/mL (表 1)。重组酶Ega5的酶活在实验7的条件下(即菌浓A600达到0.6时,加1.0 mmol的IPTG,30 ℃诱导16 h)最高,为4.99 U/mL。比优化之前的酶活(3.46 U/mL)有所提高。
2.5 表达产物的部分酶学性质测定 pH对重组酶Ega5的酶活力影响见图 8-A。结果表明:该酶最适反应pH值为pH 8.5,在pH 7.0–9.5范围内酶活可达最高酶活的80%以上。将原酶液置于不同pH值的缓冲液于50 ℃保温不同时间,测定残余酶活力,以最高酶活作为100%,结果见图 8-B。从表中可以看出,内切葡聚糖酶在碱性环境下(pH > 7.0)比较稳定,保温18 h其酶活力仍然维持到最高酶活的60%以上,在pH 8.0和9.0保温48 h,其酶活力仍然维持到最高酶活的82%和81%。以上结果显示该酶在碱性条件下具有较好的应用前景。
 |
| 图 8 酶学性质测定 Figure 8 Determination of enzymatic properties. A: The optimum reaction pH of endoglucanase; B: Effect of pH on enzyme stability; C: The optimum reaction temperature of endoglucanase; D: The effect of temperature on the stability of the enzyme. |
| 图选项 |
在pH 8.5的条件下,测定了不同温度20–70 ℃下的酶活力,结果表明,此酶的最佳反应温度为50 ℃,30 ℃下酶活力仅为50 ℃时的50%,到70 ℃时酶活仅剩20%。如图 8-C所示。
在pH 8.5条件下,将酶溶液在不同温度下保温不同时间,然后测定酶的残留活性。按50 ℃以下酶活力为100%计,结果如图 8-D所示,可以看出该酶在50 ℃以下比较稳定,60 ℃以上酶活迅速降低。
将不同浓度的金属离子添加到酶反应体系中,并且在最佳反应条件下测定酶的活性,用没有加金属离子的作为参照,结果如表 4所示。
表 4. 不同金属离子对酶活性的影响
| Metal ion | Relative enzyme activity | |
| 1 mmol | 10 mmol | |
| Na+ | 102 | 102 |
| K+ | 99 | 101 |
| Ca2+ | 101 | 121 |
| Fe2+ | 98 | 105 |
| Mg2+ | 105 | 116 |
| Zn2+ | 99 | 99 |
| Cu2+ | 96 | 97 |
| Pb2+ | 95 | 60 |
| Hg2+ | 96 | 73 |
| Mn2+ | 99 | 109 |
表选项
从表 4可知,在离子浓度为1 mmol时,各种离子对酶的反应所起的作用都不明显,但当离子浓度增大到10 mmol时,Ca2+和Mg2+对酶的活性明显有促进作用,酶活力与不加金属离子的作比较,分别提高了21%和16%,而Pb2+和Hg2+却有显著的抑制作用,酶活力分别降低了40%和27%,Fe2+和Mn2+有一定的促进作用,但作用不明显,Na+和K+则对酶活没有影响。
图 9表示重组酶Ega5的动力学常数拟合曲线,由图 9得到Ega5的Km=2.217 mol/mL,Vmax=9.606 μmol/(min·L)。
 |
| 图 9 重组酶Ega5的双倒数曲线 Figure 9 The Lineweaver-Burk graph of recombinant Ega5. |
| 图选项 |
2.6 重组酶抑制大丽轮枝菌活性 取事先培养好的大丽轮枝菌用打孔器打出直径为1 cm菌饼,接在PDA平板中央,25 ℃培养5 d后在平板两侧等距离打孔,一孔加入100 μL的重组纯酶液(图 10-B),另一孔加入100 μL的蛋白buffer (图 10-A)。培养7 d后,测量B侧菌落生长直径为1.5 cm,A侧菌落生长直径为3.4 cm,根据公式计算得出抑菌率为55.88% (表 5)。以上结果表明,纯酶液对大丽轮枝菌菌丝的生长有较强的抑制作用。
 |
| 图 10 重组酶Ega5抑制大丽轮枝菌活性 Figure 10 The activities of the recombinant enzyme Ega5 inhibited V. dahlia. A: negative control; B: enzyme Ega5. |
| 图选项 |
表 5. 重组酶抑制大丽轮枝菌菌丝生长的抑制效果 Table 5. The inhibitory effect of the recombinant enzyme Ega5 on mycelial growth of V. dahliae
| Treatment | Diameter of V. dahilia/cm | Inhibition rate/% |
| Recombinant enzyme Ega5 | 1.5 | 55.88 |
| Control | 3.4 | – |
表选项
3 讨论 纤维素酶的应用范围十分广泛,目前市场上的纤维素酶商品,大多由丝状真菌产生,比如青霉、木霉或毛霉等。这些菌产生的纤维素酶通常在酸性或中性偏酸性条件下起作用,而在碱性条件下无活性或活性非常低,因此在纺织、造纸、洗涤行业中的应用受到限制[29]。所以,细菌产生的碱性或耐碱性纤维素酶逐渐兴起,很多****都希望从细菌中筛选获得能够在碱性条件下有活性的纤维素酶,并对获得的纤维素酶的酶学性质进行研究。比如,徐庆强等从海洋细菌Bacillus sp. HN07中分离获得碱性纤维素酶[30];山东大学刘相梅等也对碱性纤维素酶开展了一系列研究,目前对于碱性纤维素酶的数量仍然有限,而且耐碱的机理仍然不是很清楚。关于从昆虫蠼螋肠道中获取的碱性纤维素酶目前还没有报道。
本文从河南南阳宝天曼国家级自然保护区的昆虫蠼螋肠道中,分离筛选到1株产碱性内切葡聚糖酶的细菌菌株Q5,并对其进行分类鉴定,认为其属于甲基营养型芽孢杆菌。进一步通过设计简并引物,PCR扩增方法从菌株Q5基因组DNA中克隆出一个β-1, 4-内切葡聚糖酶基因,该基因编码499个氨基酸,该氨基酸序列与不可培养细菌中的β-1, 4-内切葡聚糖酶基因(AFX88666.1)有98%的同源性;与芽孢杆菌菌株LM 4-2的耐碱性β-1, 4-内切葡聚糖酶基因(AKE23721.1)有98%的同源性。基因工程菌经优化培养,细胞破碎后上清中的酶活力可达3.46 U/mL,是出发菌株Q5 (2.05 U/mL)的1.69倍。经正交实验优化后的酶活力为4.99 U/mL。酶学性质研究表明:该酶的最适反应温度与pH值分别为50 ℃与pH 8.5,在pH 8.0和9.0保温48 h,其酶活力仍然维持到最高酶活的82%和81%,该酶在50 ℃以下较稳定,60 ℃以上酶活迅速降低。10 mmol的Ca2+和Mg2+对酶的活性明显有促进作用,酶活分别提高了21%和16%,而Pb2+和Hg2+则明显起抑制作用,酶活力分别下降了40%和27%,Fe2+和Mn2+有一定的促进作用,但作用不明显,Na+和K+则对酶活性没有什么影响。重组酶Ega5的Km和Vmax分别是2.217 mol/mL和9.606 μmol/(min·L)。该酶显示出对棉花黄萎病的病原菌大丽轮枝菌具有很好的抑制效果,在棉花黄萎病的生物防治上具有良好的工业应用潜力。
棉花是重要的纤维植物,在我国国民经济中占有非常重要的地位[31]。棉花黄萎病是典型的土传维管束病害,病原菌寄主范围广[32]。它会引起棉花叶片枯萎凋落,蕾铃大量脱落,纤维品质明显下降,严重影响棉花的产量与品质,被称为“棉花癌症”[33],防治十分困难。它的微菌核抗逆性很强,能在土壤中一直存活,通过轮作减少土壤中微菌核的数量是非常困难的,而且黄萎病的致病性差异很大,很难获得抗病品种,或是有抗性但容易丧失[34]。虽然化学农药可以在某些程度上减轻黄萎病对棉花的危害,但由于农药残留引起的环境污染问题也越来越突出。因此,具有安全高效、耐抗性强、环保、发展前景大等优点的生物防治措施已越来越受到人们的关注,这在黄萎病的防治中占有非常重要的地位,近年来已成为棉花黄萎病防治的研究热点[35]。
真菌细胞壁的主要组成成分是葡聚糖和几丁质,Prapagdee等[36]发现β-葡聚糖酶可以通过降解或抑制真菌细胞壁或抑制真菌细胞周期等方式,使真菌细胞水解或死亡,从而阻碍病原菌的致病能力。Xu等[37]发现β-1, 3-1, 4-葡聚糖酶对多种植物病原真菌具有抗真菌活性,是具有商业用途的有效抗菌酶。本文研究发现,重组酶Ega5也能有效抑制大丽轮枝菌菌体的生长,从而有效控制棉花黄萎病的发生和发展。该酶在棉花黄萎病的生物防治中发挥着重要作用,在生物工程领域有非常好的应用前景。
本文从昆虫蠼螋肠道中首先筛选获得了一株碱性纤维素酶的甲基营养型芽孢杆菌,然后克隆了该酶的基因,实现了酶在大肠杆菌的异源表达,表达的重组酶经纯化后对其性质进行了研究,丰富了碱性纤维素酶资源,为进一步实现碱性纤维素酶的定向改造,从而获得可应用的高活性纤维素酶活奠定了理论基础。并且该酶还对棉花黄萎病的病原菌大丽轮枝菌有明显的抑制作用,为棉花黄萎病的防治提供微生物资源,有一定的理论意义和应用价值。
本实验虽然对重组酶Ega5的表达条件进行优化,优化后的酶活力为4.99 U/mL,是出发菌株Q5 (2.05 U/mL)的2.43倍,酶活力有所提高,但不足之处在于表达前后酶活力提升不明显。可能是因为表达条件没有达到最优,可以尝试更多不同的诱导时间、诱导温度及诱导剂的浓度。
References
| [1] | Apte AA, Senger RS, Fong SS. Designing novel cellulase systems through agent-based modeling and global sensitivity analysis. Bioengineered, 2014, 5(5): 243-253. |
| [2] | Zhou TC. Cloning and expression of an endoglucanase gene from Bacillus thermoliquefaciens. Master Dissertation of Nanjing Forestry University, 2008. (in Chinese) 周潭澈.嗜热液化芽孢杆菌内切葡聚糖酶基因的克隆和表达.南京林业大学硕士学位论文, 2008. http://cdmd.cnki.com.cn/article/cdmd-10298-2008112940.htm |
| [3] | Li ZH, Yao GS, Wu RM, Gao LW, Kan QB, Liu M, Yang P, Liu GD, Qin YQ, Song X, Zhong YH, Fang X, Qu YB. Synergistic and dose-controlled regulation of cellulase gene expression in Penicillium oxalicum. PLoS Genetics, 2015, 11(9): e1005509. DOI:10.1371/journal.pgen.1005509 |
| [4] | Xu JT, Zhao GL, Kou YB, Zhang WX, Zhou QX, Chen GJ, Liu WF. Intracellular β-Glucosidases CEL1a and CEL1b are essential for cellulase induction on lactose in Trichoderma reesei. Eukaryotic Cell, 2014, 13(8): 1001-1013. DOI:10.1128/EC.00100-14 |
| [5] | Wu Q, Yuan L, Lu FP, Shen MH, Liu CY, Bai YC. Screening and identification of an alkaline cellulase-producing strain. Biotechnology Bulletin, 2010(9): 205-209. (in Chinese) 吴琼, 苑琳, 路福平, 申明华, 刘纯燕, 白宇辰. 高碱性纤维素酶产生菌的筛选及鉴定. 生物技术通报, 2010(9): 205-209. |
| [6] | Xu WQ, Gao HL, Huang J, Wu ZR, Yang XX. The progress of the alkaline cellulase that use in laundry detergents. Microbiology China, 2002, 29(6): 90-94. (in Chinese) 徐卿, 高红亮, 黄静, 吴自荣, 杨雪霞. 洗涤剂用碱性纤维素酶的研究进展. 微生物学通报, 2002, 29(6): 90-94. DOI:10.3969/j.issn.0253-2654.2002.06.022 |
| [7] | Liu G, Yu SW, Kong S, Xing M. Recent advances of alkaline cellulase and its application. Chinese Journal of Bioprocess Engineering, 2005, 3(2): 9-14. (in Chinese) 刘刚, 余少文, 孔舒, 邢苗. 碱性纤维素酶及其应用的研究进展. 生物加工过程, 2005, 3(2): 9-14. DOI:10.3969/j.issn.1672-3678.2005.02.002 |
| [8] | Li ZL, Wang WW, Ren P, Zhao WJ, Zhang HY, Chen WF. Screening of facultative anaerobic strain producing alkaline cellulase and study on enzymatic properties. Microbiology China, 2008, 35(6): 851-854. (in Chinese) 李忠玲, 王卫卫, 任平, 赵文娟, 张红艳, 陈卫锋. 产碱性纤维素酶兼性厌氧菌株的筛选和酶学性质的初步研究. 微生物学通报, 2008, 35(6): 851-854. DOI:10.3969/j.issn.0253-2654.2008.06.003 |
| [9] | Basset Y, Cizek L, Cuénoud P, Didham RK, Guilhaumon F, Missa O, Novotny V, ?degaard F, Roslin T, Schmidl J, Tishechkin AK, Winchester NN, Roubik DW, Aberlenc HP, Bail J, Barrios H, Bridle JR, Casta?o-Meneses G, Corbara B, Curletti G, Duarte da Rocha W, De Bakker D, Delabie JHC, Dejean A, Fagan LL, Floren A, Kitching RL, Medianero E, Miller SE, Gama de Oliveira E, Orivel J, Pollet M, Rapp M, Ribeiro SP, Roisin Y, Schmidt JB, S?rensen L, Leponce M. Arthropod diversity in a tropical forest. Science, 2012, 338(6113): 481-1484. |
| [10] | Mei C, Fan S, Yang H. The strategies of isolation of insect gut microorganisms. Acta Microbiologica Sinica, 2018, 58(6): 985-994. (in Chinese) 梅承, 范硕, 杨红. 昆虫肠道微生物分离培养策略及研究进展. 微生物学报, 2018, 58(6): 985-994. |
| [11] | Li DH, Wang Y, Yang H. Gut microbiome of wood-feeding termites. Acta Microbiologica Sinica, 2017, 57(6): 876-884. (in Chinese) 李丹红, 王誉, 杨红. 高效降解木质纤维素的白蚁肠道微生物组. 微生物学报, 2017, 57(6): 876-884. |
| [12] | Zhang ZY, Sheng P, Huang SW, Zhao YS, Zhang HY. Diversity, function and application of insect gut microbiota. Amino Acids and Biotic Resources, 2017, 39(4): 231-239. (in Chinese) 张振宇, 圣平, 黄胜威, 赵永顺, 张宏宇. 昆虫肠道微生物的多样性、功能及应用. 生物资源, 2017, 39(4): 231-239. |
| [13] | Yang J, Yang Y, Wu WM, Zhao J, Jiang L. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms. Environmental Science & Technology, 2014, 48(23): 13776-13784. |
| [14] | Whitten MAM, Facey PD, Del Sol R, Fernández-Martínez LT, Evans MC, Mitchell JJ, Bodger OG, Dyson PJ. Symbiont-mediated RNA interference in insects. Proceedings of the Royal Society B:Biological Sciences, 2016, 283(1825): 20160042. DOI:10.1098/rspb.2016.0042 |
| [15] | Liang XL, Sun C, Chen BS, Du KQ, Yu T, Luang-In V, Lu XM, Shao YQ. Insect symbionts as valuable grist for the biotechnological mill:an alkaliphilic silkworm gut bacterium for efficient lactic acid production. Applied Microbiology and Biotechnology, 2018, 102(11): 4951-4962. DOI:10.1007/s00253-018-8953-1 |
| [16] | Gaur R, Tiwari S. Isolation, production, purification and characterization of an organic-solvent-thermostable alkalophilic cellulase from Bacillus vallismortis RG-07. BMC Biotechnology, 2015, 15: 19. DOI:10.1186/s12896-015-0129-9 |
| [17] | Jung KH, Chun YC, Lee JC, Kim JH, Yoon KH. Cloning and expression of a Bacillus sp. 79-23 cellulase gene. Biotechnology Letters, 1996, 18(9): 1077-1082. DOI:10.1007/BF00129735 |
| [18] | Khanongnuch C, Ooi T, Kinoshita S. Cloning and nucleotide sequence of β-mannanase and cellulase genes from Bacillus sp. 5H. World Journal of Microbiology and Biotechnology, 1999, 15(2): 249-258. |
| [19] | Pan HB. High activty cellulase engineering strain construction by the method of DNA recombinantion. Master Dissertation of Anhui Polytechnic University, 2010. (in Chinese) 潘海波.利用DNA体外重组技术构建高活性纤维素酶基因工程菌.安徽工程大学硕士学位论文, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10363-1010024179.htm |
| [20] | Wu SS. Screening of high-yield cellulase strains, identification and cut inside glucanase build high expression genetic engineering bacteria. Master Dissertation of Henan Normal University, 2016. (in Chinese) 吴珊珊.高产纤维素酶菌株的筛选、鉴定及内切葡聚糖酶高表达基因工程菌的构建.河南师范大学硕士学位论文, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10476-1016231979.htm |
| [21] | Xu P, Li WJ, Xu LH, Jiang CL. A microwave-based method for genomic DNA extraction from Actinomycetes. Microbiology China, 2003, 30(4): 82-84. (in Chinese) 徐平, 李文均, 徐丽华, 姜成林. 微波法快速提取放线菌基因组DNA. 微生物学通报, 2003, 30(4): 82-84. DOI:10.3969/j.issn.0253-2654.2003.04.020 |
| [22] | Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG. The Clustal X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research, 1997, 25(24): 4876-4882. DOI:10.1093/nar/25.24.4876 |
| [23] | Kumar S, Tamura K, Nei M. MEGA3:integrated software for molecular evolutionary genetics analysis and sequence alignment. Briefings in Bioinformatics, 2004, 5(2): 150-163. |
| [24] | Ausubel FM, Brent R, Kingston RE, Moore DD, Seldman JS, Smith JA, Struhl K. Short protocols in molecular biology. Yan ZY, Wang HL, trans. Beijing: Science Press, 1998: 23-169. (in Chinese) 奥斯伯FM, 布伦特R, 金斯顿RE, 穆尔DD, 塞德曼JG, 史密斯JA, 斯特拉尔K.精编分子生物学实验指南.颜子颖, 王海林, 译.北京: 科学出版社, 1998: 23-169. |
| [25] | Xu B, Chen H, Han XY, Guan XY, Wu Q. Purification and properties of cellulase from Bacillus subtilis C-36. Journal of Sichuan Agricultural University, 2006, 24(4): 398-401. (in Chinese) 胥兵, 陈惠, 韩学易, 官兴颖, 吴琦. 枯草芽孢杆菌C-36纤维素酶的纯化及酶学性质. 四川农业大学学报, 2006, 24(4): 398-401. DOI:10.3969/j.issn.1000-2650.2006.04.006 |
| [26] | Li SJ, Liang M, Zhu TH, Yang CQ. Selection of an antagonistic bacterium against Arthrinium phaeospermum and its antibacterial protein analysis. Journal of Nanjing Forestry University (Natural Sciences Edition), 2013, 37(6): 27-32. (in Chinese) 李姝江, 梁漫, 朱天辉, 杨长青. 杂交竹梢枯病拮抗菌的筛选及抗菌蛋白分析. 南京林业大学学报(自然科学版), 2013, 37(6): 27-32. |
| [27] | Jin LR, Wan P, Huang W. Biocontrol effect on cotton Verticillium wilt and identification of endophytic bacterium HB3S-20 from cotton. Journal of Henan Agricultural Sciences, 2018, 47(3): 70-75. (in Chinese) 金利容, 万鹏, 黄薇. 棉花内生细菌HB3S-20对棉花黄萎病的生防效果评估及其鉴定. 河南农业科学, 2018, 47(3): 70-75. |
| [28] | Cai PL, Wang B, Ji JX, Jiang YS, Wan L, Tian CG, Ma YH. The putative cellodextrin transporter-like protein CLP1 is involved in cellulase induction in Neurospora crassa. Journal of Biological Chemistry, 2015, 290(2): 788-796. DOI:10.1074/jbc.M114.609875 |
| [29] | Wang MM. Expression of alkali-tolerant cellulase and mechanism of enzymatic modification. Doctor Dissertation of Shandong University, 2017. (in Chinese) 王美美.耐碱性纤维素酶的表达及其对纸浆改性和机制研究.山东大学博士学位论文, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10422-1017081882.htm |
| [30] | Xu QQ, Wang YM, Zhang ZM, Zhuo L, Yin LS, Guo L, Du ZJ. Isolation and identification of marine bacteria Bacillus sp. HN07 and characterization of its alkaline cellulase. Industrial Microbiology, 2009, 39(4): 55-59. (in Chinese) 徐庆强, 王延明, 张志明, 卓跞, 殷丽莎, 郭琳, 杜宗军. 海洋细菌Bacillus sp. HN07的分离鉴定及所产碱性纤维素酶性质研究. 工业微生物, 2009, 39(4): 55-59. DOI:10.3969/j.issn.1001-6678.2009.04.0012 |
| [31] | Liu ZX. Impacts of China's cotton subsidies and price supports on world cotton market. Issues in Agricultural Economy, 2014, 35(8): 33-39. (in Chinese) 刘志雄. 我国棉花国内支持政策对世界棉花市场影响研究. 农业经济问题, 2014, 35(8): 33-39. |
| [32] | Zhu HQ, Li ZF, Feng ZL, Feng HG, Wei F, Zhao LH, Shi YQ, Liu SC, Zhou JL. Overview of cotton Verticillium wilt research over the past decade in China and its prospect in future. Cotton Science, 2017, 29(S1): 37-50. (in Chinese) 朱荷琴, 李志芳, 冯自力, 冯鸿杰, 魏锋, 赵丽红, 师勇强, 刘世超, 周京龙. 我国棉花黄萎病研究十年回顾及展望. 棉花学报, 2017, 29(S1): 37-50. |
| [33] | Li CW, Ding JP, Liu DM, Zhou RY, Li FG. Research progress on cotton Verticillium wilt and resistance breeding. Cotton Science, 2008, 20(5): 385-390. (in Chinese) 李成伟, 丁锦平, 刘冬梅, 周瑞阳, 李付广. 棉花黄萎病及抗病育种研究进展. 棉花学报, 2008, 20(5): 385-390. DOI:10.3969/j.issn.1002-7807.2008.05.012 |
| [34] | Hadwiger LA, Druffel K, Humann JL, Schroeder BK. Nuclease released by Verticillium dahliae is a signal for non-host resistance. Plant Science, 2013, 201-202: 98-107. DOI:10.1016/j.plantsci.2012.11.011 |
| [35] | Shi L, Hou ZA, Yin FH. Research and application of biological pesticides in the control of Verticillium wilt of cotton. Xinjiang Farmland Reclamation Science & Technology, 2017, 40(4): 25-29. (in Chinese) 石磊, 侯振安, 尹飞虎. 生物农药在棉花黄萎病防治上的研究与应用. 新疆农垦科技, 2017, 40(4): 25-29. DOI:10.3969/j.issn.1001-361X.2017.04.010 |
| [36] | Prapagdee B, Kuekulvong C, Mongkolsuk S. Antifungal potential of extracellular metabolites produced by Streptomyces hygroscopicus against phytopathogenic fungi. International Journal of Biological Sciences, 2008, 4(5): 330-337. |
| [37] | Xu T, Zhu TH, Li SJ. β-1, 3-1, 4-glucanase gene from Bacillus velezensis ZJ20 exerts antifungal effect on plant pathogenic fungi. World Journal of Microbiology and Biotechnology, 2016, 32(2): 26. |
