唐蜜, 王晴, 杨套伟, 张显, 徐美娟

 , 饶志明
, 饶志明

江南大学生物工程学院, 工业生物技术教育部重点实验室, 江苏无锡 214122
收稿日期:2019-12-23;修回日期:2020-03-27;网络出版日期:2020-04-18
基金项目:国家自然科学基金(31770058, 31570085);江苏省自然科学基金(BK20181205);教育部重点研究项目(113033A); 中央高校基本科研业务费专项资金资助(JUSRP51708A); 国家双一流轻工业技术与工程一级学科计划(LITE2018-06)
*通信作者:徐美娟, E-mail:xumeijuan@jiangnan.edu.cn;
饶志明, Tel/Fax:+86-510-85916881, E-mail:raozhm@jiangnan.edu.cn.
摘要:[目的] 钝齿棒杆菌是重要的氨基酸生产菌株,本研究针对氮代谢PⅡ信号转导蛋白GlnK展开相关功能研究,分析其在钝齿棒杆菌氮代谢调控及L-精氨酸合成中的作用。[方法] 以GlnK蛋白为研究对象,通过基因敲除等遗传方法获得过表达、敲除及敲弱glnK的重组钝齿棒杆菌,研究GlnK对NH4+吸收的影响,通过RT-qPCR和酶活测定,从转录水平和蛋白水平上揭示GlnK对氮代谢和L-精氨酸合成相关基因表达水平及酶活的影响,通过5-L发酵罐发酵产L-精氨酸研究GlnK对L-精氨酸合成的影响。[结果] 过表达glnK能明显促进NH4+的吸收,而敲除glnK后则会抑制NH4+的摄取;RT-qPCR和酶活测定发现,相比于野生型菌株Cc5-5,glnK过表达菌株Cc-glnK中与铵吸收相关的基因,表达量平均上调约4.58倍,L-精氨酸合成基因簇中基因的表达水平平均上调1.50倍。Cc-glnK中氮代谢相关蛋白的酶活平均提高46.97%;L-精氨酸合成途径上7个关键酶的酶活平均提高30.00%;5-L发酵罐发酵各重组菌株结果表明,Cc-glnK菌株的产量可达49.53 g/L,产率为0.516 g/(L·h),相比于出发菌株Cc5-5,其L-精氨酸产量提高了28.65%。[结论] 过表达GlnK能促进NH4+的吸收及利用,并通过影响L-精氨酸合成途径上关键基因的表达水平,提高关键酶的酶活,最终提高L-精氨酸的产量。本研究为后续探索钝齿棒杆菌氮代谢调控机制及代谢工程改造钝齿棒杆菌生产L-精氨酸提供了一种新的策略。
关键词:L-精氨酸钝齿棒杆菌氮代谢PⅡ信号转导蛋白GlnK
Role of GlnK in regulating nitrogen metabolism and L-arginine synthesis in Corynebacterium crenatum
Mi Tang, Qing Wang, Taowei Yang, Xian Zhang, Meijuan Xu

 , Zhiming Rao
, Zhiming Rao

The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received: 23 December 2019; Revised: 27 March 2020; Published online: 18 April 2020
*Corresponding author: Meijuan Xu, E-mail: xumeijuan@jiangnan.edu.cn;
Zhiming Rao, Tel/Fax:+86-510-85916881, E-mail: raozhm@jiangnan.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31770058, 31570085), by the Natural Science Foundation of Jiangsu Province (BK20181205), by the Research Project of the Chinese Ministry of Education (113033A), by the Fundamental Research Funds for the Central Universities (JUSRP51708A) and by the National First-class Discipline Program of Light Industry Technology and Engineering (LITE2018-06)
Abstract: [Objective] In this study, we analyzed the roles of PⅡ signal transduction protein GlnK in nitrogen metabolism regulation and L-arginine biosynthesis in Corynebacterium crenatum. [Methods] The glnK overexpressed, glnK deletion and glnK knock-down strains were constructed. RT-qPCR and determination of enzyme activities were carried out to reveal the effects of GlnK on the expression levels and enzyme activities of nitrogen metabolism-related and L-arginine biosynthesis-related genes and enzymes. The changes of various parameters during the fermentation of recombinant strains were also investigated. [Results] Overexpression of GlnK protein had a significant effect on the absorption of NH4+. The expression levels and enzyme activities of nitrogen metabolism-related and L-arginine biosynthesis-related genes and proteins have generally been up-regulated in Cc-glnK strain. Among them, genes encoding ammonium absorption-related enzymes, such as glnA, gltD and gdh, were significantly up-regulated with an average increase about 4.58 times. The L-arginine yield and productivity of Cc-glnK reached 49.53 g/L and 0.516 g/(L·h), respectively, at the end of fermentation. [Conclusion] Overexpression of GlnK could promote the absorption of NH4+, increase the expression levels of genes and enzymes activities on the L-arginine biosynthesis pathway, ultimately increase the yield of L-arginine. It provided guidance for the subsequent exploration of the nitrogen regulation mechanism and metabolic modification of C. crenatum in the production of nitrogen-containing compounds.
Keywords: L-arginineC. crenatumnitrogen metabolismPⅡ signal transduction protein GlnK
棒杆菌作为食品级工业生产菌株,广泛应用于各种氨基酸的生产中,如L-谷氨酸、L-赖氨酸和L-精氨酸等[1]。L-精氨酸是重要的工业氨基酸,因其生理生化功能的多样性,广泛应用于食品、医药及动物饲料等领域。作为天然氨基酸中N:C含量最高的一种氨基酸,L-精氨酸合成与氮源吸收和利用效率密切相关[2]。氮源作为细菌中复杂的生物大分子,是微生物生长与繁殖所必需的一种营养元素,参与多种含氮化合物如蛋白质、核酸以及细胞壁等的合成[3]。为满足细胞对氮源的需求以及确保在氮限量时也有足够的氮源供给,包括谷氨酸棒杆菌在内的微生物已针对不同种类的氮源形成了一套复杂且精细的氮代谢调控网络[4]。
在谷氨酸棒杆菌中,NH4+作为最优先利用的氮源,其吸收及转运主要靠操纵子amtB-glnK-glnD编码的转运子AmtB、信号蛋白GlnK和腺苷转移酶(GlnD/ATase)共同完成,这个过程不但受到氮全局转录调控因子AmtR在转录水平的调控,还受到PⅡ信号转导蛋白GlnK的翻译后修饰调控[5-6]。如图 1所示,当胞内NH4+充足时,GlnK与铵转运蛋白AmtB结合形成复合物来控制铵的转运,此时AmtB不能向胞内转运铵;当胞内NH4+限量时,GlnK被GlnD腺苷酰化后形成GlnK-AMP,不再与AmtB结合形成复合物。同时,AmtR从DNA上释放下来后与GlnK-AMP结合,被AmtR抑制的氮代谢相关基因得以转录,表达量显著提高,此时NH4+通过AmtB铵转运通道进入胞内以维持氮平衡[7]。由此可知,GlnK作为谷氨酸棒杆菌氮代谢中主要的信号转导蛋白,在氮代谢调控网络中起着不可或缺的作用[8]。但GlnK在钝齿棒杆菌中与氮代谢间的关系却未见报道。同时,谷氨酸和谷氨酰胺作为生物合成反应中关键NH4+受体,棒杆菌可以通过谷氨酸脱氢酶(GDH)和谷氨酰胺合成酶/谷氨酸合成酶(GS/GOGAT)两条途径将NH4+转变为谷氨酸和谷氨酰胺[4]。当氮源过量时,即胞内NH4+浓度大于5 mmol/L时,NH4+优先被谷氨酸脱氢酶同化,每摩尔NH4+的吸收消耗1 mol/L的2-酮戊二酸以及氧化1 mol/L的NADPH[9]。当氮源限量时,即胞内NH4+浓度小于1 mmol/L时,NH4+通过谷氨酰胺合成酶和谷氨酸合成酶的同化作用形成谷氨酸[10]。而谷氨酸又作为前体物质在L-精氨酸的合成中发挥重要作用,说明氮代谢调控蛋白GlnK可能在L-精氨酸的合成中起着关键作用。但目前有关GlnK在L-精氨酸合成中所起作用的研究却未见报道。
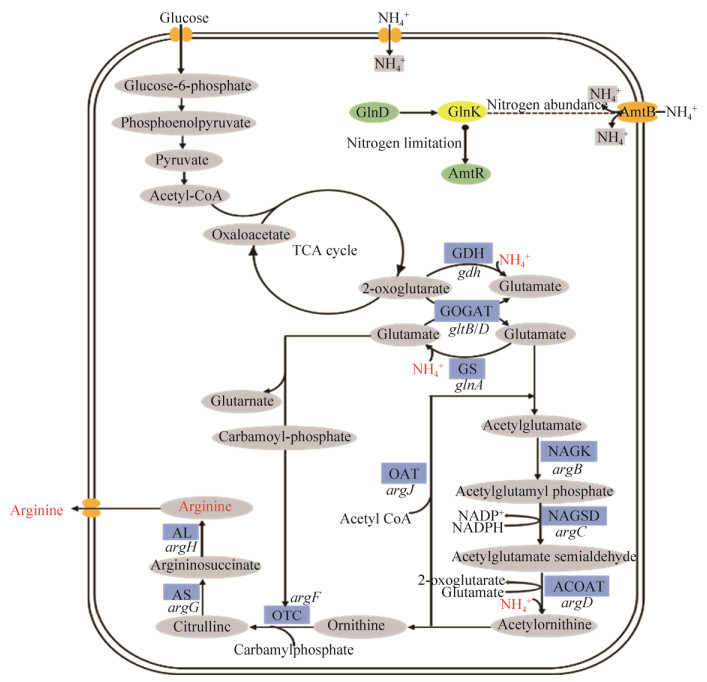 |
| 图 1 棒杆菌中L-精氨酸合成途径及氮代谢调控概况 Figure 1 Schematic representation of the L-arginine biosynthesis pathway and regulation of nitrogen metabolism in Corynebacteria. |
| 图选项 |
钝齿棒杆菌SYPA5-5 (Corynebacterium crenatum SYPA5-5,Cc5-5),为本实验室经传统诱变手段改造得到的一株高产L-精氨酸菌株,L-精氨酸产量达36.1 g/L[11]。但是,目前关于该菌中氮代谢PⅡ信号转导蛋白GlnK在L-精氨酸合成中的调控功能理解依然有限。本研究以GlnK为研究对象,利用基因敲除等遗传方法构建得到glnK过表达(Cc-glnK)、敲除(Cc-ΔglnK)及敲弱菌株(Cc-kd/glnK),发现GlnK正调控钝齿棒杆菌对NH4+的摄取和L-精氨酸的合成。通过GST pull-down实验及检测胞外NH4+的残留量,证实GlnK很有可能通过与AmtR结合,影响钝齿棒杆菌对NH4+的摄取;进一步结合RT-qPCR分析和酶活测定发现,GlnK通过影响L-精氨酸代谢途径关键基因表达水平进而影响关键酶的酶活,最终影响L-精氨酸的产量。该研究为探索钝齿棒杆菌氮代谢调控机制及代谢工程改造生产L-精氨酸提供了一种新的策略。
1 材料和方法 1.1 菌株与质粒 钝齿棒杆菌(Corynebacterium crenatum) SYPA5-5由本实验室保藏[12-13];大肠杆菌(Escherichia coli) JM109和BL21(DE3)购自生工生物工程(上海)股份有限公司;重组质粒pXMJ19-glnK、pGEX-6P-1-glnK等由本研究构建。本研究使用的菌株、质粒和引物见表 1、表 2。
表 1. 本实验所用的菌株及质粒 Table 1. Strains and plasmids used in this study
| Strains/Plasmids | Characteristics | Source |
| Strains | ||
| E. coli BL21 (DE3) | Host for gene expression | Invitrogen |
| C. crenatum SYPA5-5 | A paradigm strain of amino acid production | Our lab |
| Plasmids | ||
| pXMJ19 | Shuttle vector, His-tag, ChlR | Our lab |
| pXMJ19-glnK | A derivative of pXMJ19, harboring the wild-type glnK gene | This study |
| pXMJ19-dCas9 | A derivative of pXMJ19, harboring the dCas9 gene | This study |
| pDXW10 | Shuttle vector, His-tag, KmR | This study |
| pDXW10-sgRNA | A derivative of pDXW10, harboring sgRNA | This study |
| pK18mobsacB | Suicide plasmid carrying sacB for selecting double crossover in C. crenatum, KmR | Our lab |
| pK18-glnKarm | Construct used for in-frame deletion of glnK | This study |
| pGEX-6p-1 | Expression vector, GST-tag, AmpR | Our lab |
| pGEX-6p-1-cc/cgglnK | A derivative of pGEX-6P-1, harboring the C. crenatum/C. glutamicum glnK gene, respectively | This study |
| pET28a-cc/cgamtR | A derivative of pET28a, harboring the C. crenatum/C. glutamicum amtR gene, respectively | Our lab |
| ChlR indicates resistance to chloromycetin; KmR indicates resistance to kanamycin; AmpR indicates resistance to ampicillin. | ||
表选项
表 2. 本研究所用到的引物 Table 2. Primers used in this study
| Primers | Primer sequences (5'→3') |
| PXMJ19-glnK F1 | CCCAAGCTTAAAGGAGGACAACC ATGAAACTCATCACCGCAATTGTCAAG |
| PXMJ19-glnK R2 | GCTCTAGATTAGTGGTGGTGGTGGTGGTGAAGGGCTGCTTCGCCG |
| PK18-glnK F1 | CGCGGATCCTCGGCAAGCGAAAGACGTTTG |
| PK18-glnK R1 | GCTGGATTATTCATAAGTTTGATCGTCTCCTTCAAAAAGACATTCGG |
| PK18-glnK F2 | TCTTTTTGAAGGAGACGATCAAACTTATGAATAATCCAGCCCAGCTG |
| PK18-glnK R2 | CGCAAGCTTTTCCTGAATGCAAAACCTGTGCG |
| Pdcas9-F1 | AAGTATTCCATTGGCCTGGCTATCGGCACCAATTCTGTGGGT |
| Pdcas9-R1 | GAAAGACTGAGGGACGATGGCGTCCACATCGTAATCAGAGAGACGG |
| Pdcas9-F2 | ATCGTCCCTCAGTCTTTCCTGAAAG |
| Pdcas9-R2 | CAGGCCAATGGAATACTTTTTATCCATTAGTTG |
| P6p-1-glnK F1 | CGCGGATCCATGAAACTCATCACCGCAATTGTCAAG |
| P6p-1-glnK R2 | CGCGAATTCTTAAAGGGCTGCTTCGCCG |
| SigA-RT F/R | GCGTCGTCTGTGAAATCCCG/CGCCATTGGTGTTCCTCCTG |
| GlnA-RT F/R | CGAGCATCACTGAAAACGCC/GCAACCTGGGGTGTATCTAATCG |
| GltD-RT F/R | GTTGTCATCATCGGTGGCGG/GTGCGGAAGAGGTTGGGGTA |
| GltB-RT F/R | TGGCTTCTGAATCGGGAGTGT/AGTACGCTTTACGACGCTCTCC |
| GDH-RT F/R | TGGTCATCAACCCAAGGCAC/GGAAAAGGACCCTCATTACGCT |
| AmtR-RT F/R | CTCGTCAAAAGTCCGTGCTCAA/GCGATTGATTGGGTTCCATAAGA |
| GlnD-RT F/R | CCAGCACTTGGGATAACAGCC/TTCTGAGCAGGGCAAAAATAGC |
| AmtB-RT-F/R | TTCGGAACCTTGGGTGTCGT/GCAAAGATACCTGCGATGGACTG |
| GlnK-RT-F/R | ACCGCTATCGTCAAGCCGTT/CCAAATCCCTGGGTTTCGGT |
| ArgC-RT-F/R | GCGTTACCGCAGAACAGGCT/ACTGCTTGGGTTTGTGGCTGT |
| ArgJ-RT-F/R | GACTGTCGGCGGAATGGG/ACGGTGTCATTGGTGGAGGTT |
| ArgB-RT-F/R | CAAGGGTGGTTTCCGTGTGAC/CGGAGGTTCCCACAGCGTAA |
| ArgD-RT-F/R | ATGCCAAGCGGTGTGGAGTT/AAGATAGCAGCCACATCCGTTG |
| ArgF-RT-F/R | TCACAGATGGGTAAGGGCGAG/GAGTTCACCAGCGGCACAGT |
| ArgG-RT-F/R | GGTTGAGGACCGTCTCGTGG/TTGTCCAGGTCACGGATACGA |
| ArgH-RT-F/R | CAGGCAAGACCCACTTCCAG/TTGTCCAGGTCACGGATACGA |
| Restriction sites are shown in underlined parts. | |
表选项
1.2 试剂 质粒DNA提取试剂盒、DNA胶回收试剂盒和细菌基因组DNA提取试剂盒购自生工生物工程(上海)股份有限公司;ClonExpress? Ⅱ One Step Cloning Kit、2×Phanta? Max Master Mix、HiScript? Ⅱ Q RT SuperMix for qPCR (+gDNA wiper) (R223-01)和ChamQTM Universal SYBR? qPCR Master Mix (Q711-02/03)购自南京诺唯赞生物科技有限公司;RNAprep Pure Cell/Bacteria Kit (DP430)购自天根生化科技(北京)有限公司;Glutathione MagBeads购自南京金斯瑞生物科技有限公司;PierceTM GST Protein Interaction Pull-Down Kit及PierceTM Coomassie Plus (Bradford) Assay Kit均购自赛默飞世尔科技有限公司;EcoR I、BamH I和Hind Ⅲ等限制性内切核酸酶购自宝日医生物技术(北京)有限公司;氯霉素、氨苄霉素等购自上海阿拉丁生化科技有限公司;其他试剂均购自国药集团化学试剂有限公司。
1.3 培养基与培养条件 大肠杆菌采用LB培养基(蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,pH 7.0)于37 ℃下180 r/min进行培养;钝齿棒杆菌采用LBG培养基(蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,葡萄糖7 g/L,pH 7.0)于30 ℃下180 r/min进行培养;发酵罐发酵种子培养基(葡萄糖120 g/L,酵母提取物10 g/L,(NH4)2SO4 0.04 g/L,MgSO4·7H2O 0.02 g/L,KH2PO4 1 g/L,FeSO4·7H2O 0.02 g/L,MnSO4 0.02 g/L,CaCO3 20 g/L,pH 7.0)用于5-L发酵罐发酵时种子的培养。发酵培养基(葡萄糖150 g/L,玉米浆20 g/L,(NH4)2SO4 0.04 g/L,MgSO4·7H2O 0.02 g/L,KH2PO4 1.5 g/L,FeSO4·7H2O 0.02 g/L,MnSO4 0.02 g/L,pH 7.0)用于5-L发酵罐发酵产L-精氨酸,5-L发酵罐培养方法参照文献[14]。酶活测定及RT-qPCR分析所用培养基为CGXⅡ基本培养基(葡萄糖50 g/L,FeSO4·7H2O 0.01 g/L,尿素5 g/L,MnSO4·H2O 0.01 g/L,KH2PO4 1 g/L,K2HPO4 1 g/L,ZnSO4·7H2O 0.001 g/L,CuSO4 0.0002 g/L,MgSO4·7H2O 0.25 g/L,NiCl2·7H2O 0.0002 g/L,(NH4)2SO4 0.04 g/L,3-丙磺酸42 g/L,生物素0.0002 g/L,CaCl2 0.01 g/L,原儿茶酸0.0003 g/L,pH 7.0)。
1.4 钝齿棒杆菌SYPA5-5 glnK过表达菌株的构建 以钝齿棒杆菌SYPA5-5基因组DNA为模板,用引物PXMJ19-glnK F1/R1对基因glnK进行扩增(表 2)。使用限制性内切酶Hind Ⅲ和Xba I对扩增产物和载体pXMJ19进行酶切,然后将回收后的glnK片段与pXMJ19载体进行连接,转化E. coli BL21(DE3)感受态细胞,LB培养基(含氯霉素50 mg/mL)中培养12 h。重组质粒pXMJ19-glnK经Hind Ⅲ和Xba I双酶切验证后,与质粒pXMJ19分别电转入SYPA5-5感受态细胞中,从平板上挑选阳性转化子并用0.5 mmol/L IPTG诱导表达,诱导结束后于4℃离心收集菌体,并用0.1 mol/L pH 7.4的PBS缓冲液洗涤重悬后,利用超声破碎仪破碎后离心取上清,处理样品并对其进行SDS-PAGE分析以验证glnK过表达菌株Cc-glnK构建成功。
1.5 钝齿棒杆菌SYPA5-5 glnK敲除菌株的构建 提取钝齿棒杆菌SYPA5-5基因组DNA,并以该基因组DNA为模板,PCR扩增得到glnK基因上下游同源臂。上游同源臂扩增所用引物为PK18-glnK F1和PK18-glnK R1,下游同源臂扩增所用引物为PK18-glnK F2和PK18-glnK R2 (表 2)。然后以上下同源臂为模板,PK18-glnK F1和PK18-glnK R2为引物,通过重叠延伸PCR获得中间缺失glnK基因的DNA片段glnKarm。将获得的目的片段glnKarm与基因敲除载体pK18mobsacB连接,转化至大肠杆菌JM109感受态中,提取质粒酶切验证重组质粒pK18-glnKarm是否构建成功。经验证构建成功的重组质粒pK18-glnKarm随后被转化至钝齿棒杆菌SYPA5-5中,在含卡那霉素的培养基中进行第一次筛选,然后以LBGS培养基(蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,葡萄糖10 g/L,蔗糖100 g/L,pH 7.0)进行再次筛选,最终筛选得到glnK缺失突变株钝齿棒杆菌Cc-△glnK。将glnK基因敲除成功的菌株提取基因组后进行PCR验证并测序,以证实基因glnK敲除成功。
1.6 离子色谱检测NH4+的浓度 采用赛默飞ICS-5000+离子色谱检测各菌株培养过程中胞外NH4+残留量,具体参数为:IonPac CS12A分离柱(4 mm×250 mm)与IonPac CG12A保护柱(4 mm×50 mm),流动相20 mol/L甲基磺酸,流速1 mL/min,时间15 min,柱箱温度30 ℃,进样体积25 μL。样品预处理方式为:每隔4 h取800 μL菌体培养液,12000 r/min离心10 min,收集上清液后用0.22 μm滤膜过滤[15]。
1.7 RNA的提取和RT-qPCR 将钝齿棒杆菌glnK过表达菌株Cc-glnK、敲除菌株Cc-ΔglnK、弱化菌株Cc-kd/glnK和出发菌株Cc5-5分别接种于CGXⅡ基本培养基中30 ℃、180 r/min培养12 h后,取2 mL样品,用RNAprep Pure Cell/Bacteria Kit (DP430)试剂盒(Tiangen Biotech, China)提取细菌总RNA,利用HiScript? Ⅱ Q RT SuperMix for qPCR (+gDNA wiper) (R223-01)试剂盒(Vazyme Biotech, China)进行反转录获得单链cDNA,再利用StepOnePlus荧光定量PCR仪(Applied Biosystems)进行RT-qPCR分析,并选取sigA基因作为内参基因进行定量。具体操作参照ChamQTM Universal SYBR? qPCR Master Mix (Q311)试剂盒说明书进行,反应条件为:95℃ 30 s;95℃ 10 s,60℃ 30 s,40个循环;然后95℃ 15 s,60℃ 60 s,95℃ 15 s。每个目的基因均进行了3次生物学重复,计算平均阈值循环。最后使用2–△△Ct方法计算相对表达水平。本研究中所用的RT-qPCR引物如表 2所示。
1.8 氮吸收及L-精氨酸合成相关酶酶活测定 钝齿棒杆菌glnK过表达菌株Cc-glnK、敲除菌株Cc-ΔglnK、弱化菌株Cc-kd/glnK和出发菌株Cc5-5经平板活化后接种至10 mL的LBG培养基中,于30 ℃恒温摇床中180 r/min培养18 h后以1%的接种量转接至50 mL的CGXⅡ培养基中培养5 h后,加入终浓度为0.5 mmol/L的IPTG,后于30 ℃恒温摇床中180 r/min诱导10 h,诱导结束后4 ℃下收集并破碎细胞。收集上清测定GDH、GS和GOGAT的酶活以及L-精氨酸合成途径上关键酶(NAGSD[16]、OAT[17]、NAGK[18]、ACOAT[19]、OTC[20]、AS[21]、AL[10])的酶活(图 1),测定方法参照文献。谷氨酸脱氢酶和谷氨酰胺合成酶酶活测定的实验步骤参照索莱宝公司的试剂盒说明书;谷氨酸合成酶的酶活测定方法参照文献[22]。
1.9 蛋白质体外结合GST Pull-Down实验的鉴定 GST Pull-Down实验的具体操作步骤参照PierceTM GST Protein Interaction Pull-Down Kit (Thermo Scientific, China)说明书进行。首先参照上述1.4中的方法构建GST-GlnK融合蛋白,将纯化后的GST-GlnK和His-AmtR蛋白在TBS缓冲液(25 mmol Tris-HCl, 0.15 mol/L NaCl, pH 7.2)中于4℃过夜透析以分别去除其中的还原型谷胱甘肽及咪唑。利用PierceTM Coomassie Plus (Bradford) Assay Kit (Thermo Scientific, China)完成纯化后GST-GlnK和His-AmtR蛋白浓度的测定。体外结合实验具体操作为:将150 μg的GST-GlnK蛋白与预先处理好的50 μL的谷胱甘肽琼脂糖凝胶树脂混合后置于垂直混合器上于4 ℃孵育2 h。随后再向GST-GlnK蛋白与谷胱甘肽琼脂糖凝胶树脂的混合物中加入150 μg的His-AmtR蛋白继续孵育2 h。孵育结束后用TBS缓冲液反复清洗蛋白-树脂复合物5次以除去非特异性结合,再将与树脂结合的蛋白质洗脱下来,取10 μL GST pull-down洗脱液进行蛋白电泳分析,电泳得到的蛋白胶用于后续Western blotting分析检测GST-GlnK与His-AmtR的结合情况,具体实验方法参考文献[23]。
1.10 钝齿棒杆菌发酵产L-精氨酸能力分析及发酵参数的测定
1.10.1 菌体生物量的测定: 收集发酵液,测定在紫外分光光度计(UNICOTM-UV2000)的吸光度为562 nm处的吸光值,细菌OD值和菌体干重之间的关系为OD562=0.375 g/L DCW[24]。
1.10.2 葡萄糖含量的测定: 收集发酵液,离心后取上清,采用生物传感器SBA-40C (山东省科学院生物研究院)测定葡萄糖的含量。
1.10.3 L-精氨酸含量的测定: 收集发酵液离心后取上清,采用改良坂口显色反应测定L-精氨酸的产量,反应液含(g/L):NaOH 40,甲萘酚-正丙醇80,双乙酰0.5 mL,取以上3种试剂各1 mL至离心管中,再加入100 μL稀释后的发酵液,30 ℃水浴20 min后于A520处测定吸光值。
2 结果和分析 2.1 谷氨酸棒杆菌与钝齿棒杆菌氮代谢相关基因amtR、amtB、glnK和glnD同源性分析 先前研究表明,谷氨酸棒杆菌中,PⅡ信号转导蛋白GlnK (CgGlnK)通过与同一操纵子上的转运子AmtB (CgAmtB)和腺苷转移酶GlnD (CgGlnD)共同作用,参与调节胞内氮平衡,这个过程还受到转录调控因子AmtR (CgAmtR)的调控[6]。为研究在钝齿棒杆菌中,PⅡ信号转导蛋白GlnK (CcGlnK)对氮代谢及L-精氨酸合成的影响。本研究首先对谷氨酸棒杆菌Corynebacterium glutamicum ATCC 13032和钝齿棒杆菌C. crenatum SYPA5-5操纵子amtB-glnK-glnD编码的基因以及amtR基因的同源性进行了分析(图 2)。如表 3所示,通过同源比对发现,核苷酸水平上,操纵子amtB-glnK-glnD上基因CcamtB、CcglnK和CcglnD与CgamtB、CgglnK和CgglnD的同源性分别为80.79%、83.78%和73.26%,CcamtR与CgamtR的同源性为98.80%。氨基酸水平上CcAmtB (45.59 kDa)、CcGlnK (12.11 kDa)、CcGlnD (76.10 kDa)和CcAmtR (22.66 kDa)与CgAmtB (45.41 kDa)、CgGlnK (12.25 kDa)、CgGlnD (75.98 kDa)和CgAmtR (22.64 kDa)的同源性分别高达81.00%、92.86%、82.07%和99.02%。结果表明,在钝齿棒杆菌中,操纵子amtB-glnK- glnD和转录调控因子CcAmtR可能同样参与调节氮源的吸收及利用,尤其PⅡ信号转导蛋白CcGlnK和转录调控因子CcAmtR可能作为感应胞内氮源浓度变化的关键因子在调控钝齿棒杆菌氮代谢方面起重要作用。本实验室先前已通过实验证实,CcAmtR参与调节钝齿棒杆菌C. crenatum SYPA5-5氮代谢及L-精氨酸的合成[26]。因此,该研究将以CcGlnK为研究对象,研究其在钝齿棒杆菌C. crenatum SYPA5-5氮代谢及L-精氨酸合成中的作用。
 |
| 图 2 谷氨酸棒杆菌与钝齿棒杆菌氮代谢相关基因amtR、amtB、glnK和glnD的结构分析 Figure 2 Structure analysis of amtR, amtB, glnK and glnD between C. glutamicum and C. crenatum. |
| 图选项 |
表 3. 谷氨酸棒杆菌与钝齿棒杆菌氮代谢相关基因amtR、amtB、glnK和glnD的同源性分析 Table 3. Homology analysis of amtR, amtB, glnK and glnD between C. glutamicum and C. crenatum
| Gene | Gene size/bp | Protein | Homologous gene | Homologous protein |
| CcamtR | 669 | CcAmtR (22.66 kDa) | CgamtR (669 bp, 98.80%) | CgAmtR (22.64 kDa, 99.02%) |
| CcamtB | 1317 | CcAmtB (45.59 kDa) | CgamtB (1317 bp, 80.79%) | CgAmtB (45.41 kDa, 81.00%) |
| CcglnK | 339 | CcGlnK (12.11 kDa) | CgglnK (339 bp, 83.78%) | CgGlnK (12.25 kDa, 92.86%) |
| CcglnD | 2079 | CcGlnD (76.10 kDa) | CgglnD (2079 bp, 73.26%) | CgGlnD (75.98 kDa, 82.07%) |
| The percentages in “Homologous gene” and “Homologous protein” indicated the homology between CcamtR, CcamtB, CcglnK, and CcglnD and CgamtR, CgamtB, CgglnK, and CgglnD at the nucleotide and amino acid levels, respectively. | ||||
表选项
2.2 CcGlnK与CcAmtR结合能力分析 谷氨酸棒杆菌中,GlnK通过与氮代谢全局转录调控因子AmtR结合,从而解除AmtR对氮代谢相关基因的转录抑制,进而促进谷氨酸棒杆菌对NH4+的摄取[5]。进一步验证钝齿棒杆菌SYPA5-5中GlnK蛋白对氮代谢的影响。本研究采用GST pull-down蛋白互作的方法体外验证了GST-CcGlnK与His-CcAmtR的结合,并与谷氨酸棒杆菌中GST-CgGlnK与His-CgAmtR的结合情况进行比较。如图 3-A、B、C和D所示,参照上述1.4的方法将钝齿棒杆菌SYPA5-5和谷氨酸棒杆菌ATCC13032来源的glnK分别与带有GST标签的pGEX-6p-1载体连接转化。将获得的重组菌BL21 (DE3)/pGEX-6p-1-ccglnK和BL21 (DE3)/ pGEX-6p-1-cgglnK及本实验室现有的重组菌BL21 (DE3)/pET28a-ccamtR和BL21 (DE3)/pET28a-cgamtR活化后培养至菌液OD约为0.6–0.8再加入0.5 mmol/L IPTG于16 ℃进行诱导,收集并破碎细胞后进行SDS-PAGE分析。分别检测到分子量为36.41-kDa和23.48-kDa的特异性条带,说明融合有GST标签的cc/cgglnK基因以及带有His标签的cc/cgamtR基因在大肠杆菌中成功过表达。随后分别对GST-Cc/CgGlnK和His-Cc/ CgAmtR四种蛋白进行纯化(图 3-C和3-D)及浓度测定,体外结合实验时GST-Cc/CgGlnK和His-Cc/CgAmtR两种蛋白的加入量均为150 μg,确保GST-Cc/CgGlnK与His-Cc/CgAmtR实验时质量比为1:1。采用仅带有GST标签的pGEX-6p-1空载作为对照。从图 3-E和3-F可知,GST-CcGlnK蛋白能与His-CcAmtR蛋白特异性结合,说明在Cc5-5中氮转录调控因子AmtR仍是GlnK蛋白的调控靶点。但其结合强度要弱于模式菌中CgGlnK与CgAmtR结合的强度,分析原因可能是由于CcGlnK中氨基酸的突变导致其与CcAmtR间的结合强度减弱,但不至于使CcGlnK与CcAmtR的结合能力丧失。该结果表明,钝齿棒杆菌中,GlnK很有可能通过与AmtR结合,调控氮代谢相关基因的转录水平,最终达到调控氮代谢的目的。同时,由于NH4+是精氨酸合成前体物质谷氨酸的重要供体,GlnK很有可能也参与调控钝齿棒杆菌中L-精氨酸的合成。
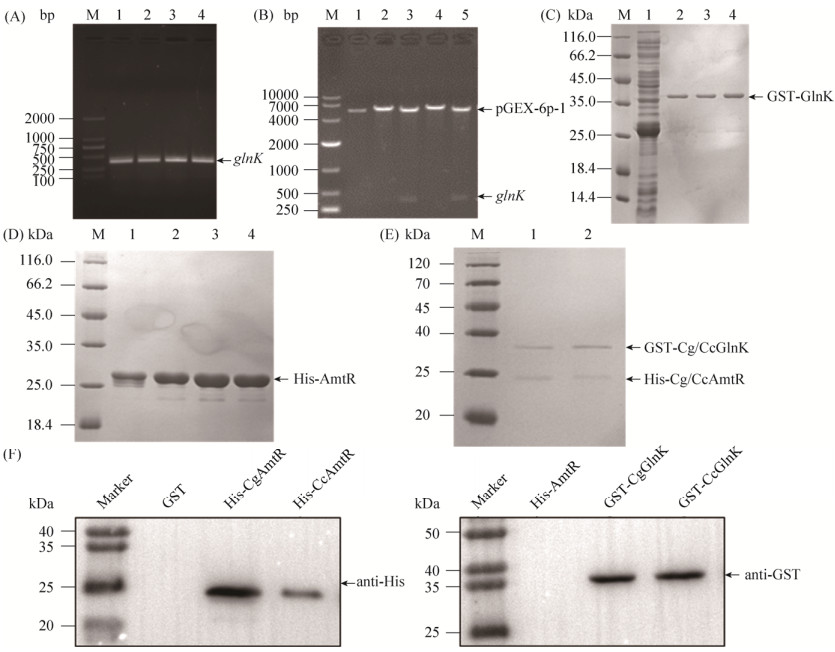 |
| 图 3 GST pull-down验证棒杆菌中GlnK与AmtR间的相互作用 Figure 3 Detection of the interaction between GlnK and AmtR by GST pull-down assays. A: PCR results of glnK gene amplification. M: DL2000 marker; lane 1, 2: ccglnK; lane 3, 4: cgglnK. B: Identification of pGEX-6p-1-cc/cgglnK plasmids by single and double enzyme digestion. M: DL10000 marker; lane 1: Results of single enzyme digestion of pGEX-6p-1; lane 2, 3: Results of single and double enzyme digestion of pGEX-6p-1-ccglnK; lane 4, 5: Results of single and double enzyme digestion of pGEX-6p-1-cgglnK. C: SDS-PAGE analysis of crude proteins and GST-GlnK purification. M: Unstained protein ladder; lane 1: Crude enzyme of E. coli BL21 with plasmid pGEX-6p-1; lane 2, 3: Purified enzyme of E. coli BL21 with plasmid pGEX-6p-1-ccglnK; lane 4: Purified enzyme of E. coli BL21 with plasmid pGEX-6p-1-cgglnK. D: SDS-PAGE analysis of crude proteins and His-AmtR purification. M: Unstained protein ladder; lane 1, 2: Purified enzyme of E. coli BL21 with plasmid pET28a-ccamtR; lane 3, 4: Purified enzyme of E. coli BL21 with plasmid pET28a-cgamtR. E: SDS-PAGE analysis of the interaction between Cg/CcGlnK and Cg/CcAmtR detected by GST pull-down assays. M: marker; lane 1: Interaction of CgGlnK-CgAmtR detected by GST pull-down assays; lane 2: Interaction of CcGlnK-CcAmtR detected by GST pull-down assays. F: Direct binding of Cg/CcGlnK to Cg/CcAmtR detected via Western-blotting. The left panel indicated the detection of CgAmtR and CcAmtR in the eluent of the GST pull-down assays; The right panel indicated the detection of CgGlnK and CcGlnK in the eluent of the GST pull-down assays. |
| 图选项 |
2.3 钝齿棒杆菌glnK过表达、敲除及弱化菌株的构建 为探究GlnK在钝齿棒杆菌氮代谢和L-精氨酸合成中的作用,本研究通过基因敲除等遗传方法,分别构建得到了钝齿棒杆菌glnK过表达菌株Cc-glnK、glnK敲除菌株Cc-ΔglnK和glnK弱化菌株Cc-kd/glnK。
2.3.1 钝齿棒杆菌glnK过表达菌株的构建: 按照材料与方法1.4中所述方法,PCR扩增得到目的基因glnK (339 bp,图 4-A),并整合至载体pXMJ19中,得到重组质粒pXMJ19-glnK (图 4-B)。再将质粒pXMJ19和pXMJ19-glnK分别电转入钝齿棒杆菌SYPA5-5中获得重组菌株Cc-pXMJ19和Cc-glnK,诱导表达后利用超声破碎仪破碎后离心取上清,处理样品并对其进行SDS-PAGE分析。如图 4-C所示,Cc-glnK中GlnK的表达量明显高于对照菌株Cc-pXMJ19,说明GlnK在钝齿棒杆菌SYPA5-5中成功过表达。
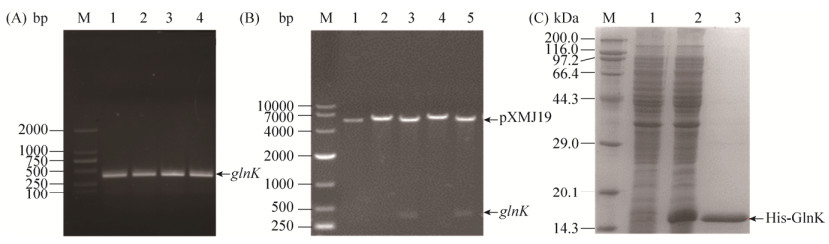 |
| 图 4 钝齿棒杆菌glnK过表达菌株的构建与验证 Figure 4 Construction and verification of the glnK overexpression strain in C. crenatum. A: PCR results of glnK gene amplification. M: DL2000 marker; lane 1–4: glnK. B: Identification of pXMJ19-glnK plasmids by single and double enzyme digestion. M: DL10000 marker; lane 1–5: Results of single and double enzyme digestion of pXMJ19-glnK. C: SDS-PAGE analysis of crude proteins and His-GlnK purification. M: Unstained protein ladder; lane 1: Crude enzyme of C. crenatum SYPA5-5 with plasmid pXMJ19; lane 2: Crude enzyme of C. crenatum SYPA5-5 with plasmid pXMJ19-glnK; lane 3: Purified enzyme of C. crenatum SYPA5-5 with plasmid pXMJ19-glnK. |
| 图选项 |
2.3.2 钝齿棒杆菌glnK敲除菌株的构建:: 按照材料与方法1.5中所述方法,PCR扩增得到glnK长为800 bp和750 bp的上下游同源臂后,通过重叠延伸PCR获得中间缺失glnK基因的DNA片段glnKarm,并整合至载体pK18mobsacB,得到重组质粒pK18-glnKarm (图 5-A)。重组质粒pK18- glnKarm构建成功后转化至钝齿棒杆菌SYPA5-5中,在含卡那霉素的培养基中进行第一次筛选,然后以LBGS培养基进行再次筛选,筛选得到候选glnK缺失突变株。提取突变株基因组DNA,进行PCR验证并测序,最终成功筛选得到glnK缺失突变株Cc-△glnK (图 5-B)。
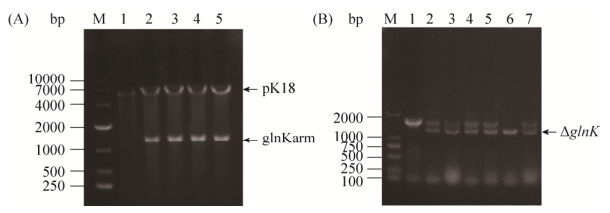 |
| 图 5 钝齿棒杆菌glnK敲除菌株的构建与验证 Figure 5 Construction and verification of the glnK deletion strain in C. crenatum. A: Identification of pK18-glnKarm plasmid by single and double enzyme digestion. M: DL10000 marker; lane 1–5: Results of single and double enzyme digestion of pK18-glnKarm. B: Identification of the glnK deletion strain by colony PCR. M: DL2000 marker; lane 1–7: Results of screening of the glnK deletion strain. |
| 图选项 |
2.3.3 钝齿棒杆菌中CRISPR/dCas9系统的构建及glnK弱化菌株的构建:: 本研究在先前CRISPR/Cas9系统的基础上进行改造[26],获得了适用于棒杆菌中基因弱化的CRISPR/dCas9系统。如图 6-A、C、D和E所示,以质粒pXMJ19-Cas9为模板,反向PCR扩增得到pXMJ19-Cas9质粒骨架及第10位天冬氨酸和第840位组氨酸同时突变成丙氨酸的dCas9蛋白后,通过同源重组的方式构建得到带有无核酸内切酶活性的dCas9蛋白的pXMJ19-dCas9质粒。重组质粒pXMJ19-dCas9经酶切验证成功后转化至钝齿棒杆菌SYPA5-5中。随后根据网站(https://crispy.secondarymetabolites. org/#/input)所提供的数据,选取最适的PAM位点和sgRNA设计引物glnk-sgRNAF1/R1用于扩增靶向glnK基因的sgRNA,并将其整合至载体pDXW-10上,经PCR验证成功获得重组质粒pDXW10-sgRNA (图 6-B和6-F)。转化重组质粒pDXW10-sgRNA到含有pXMJ19-dCas9质粒的感受态中,涂布于含氯霉素和卡那霉素的双抗平板上筛选glnK弱化突变株Cc-kd/glnK。
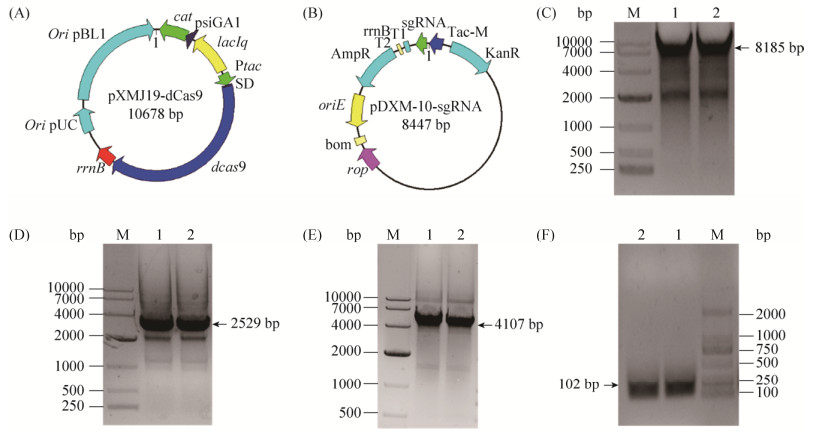 |
| 图 6 钝齿棒杆菌CRISPR/dCas9系统的构建 Figure 6 Design of the CRISPR/dCas9 system for gene knock down in C. crenatum. A: Strategy for construction of pXMJ19-dCas9. B: Strategy for construction of pDXW10-sgRNA. C: Reverse PCR amplification of backbone of pXMJ19-dCas9 vector. D: Reverse PCR amplification of dCas9 fragment. E: PCR verification of pXMJ19-dCas9 plasmid. F: PCR results of sgRNA amplification. |
| 图选项 |
进一步验证glnK基因成功在重组菌株Cc-kd/glnK中被弱化。本研究通过RT-qPCR比较分析了菌株Cc-glnK、Cc-ΔglnK、Cc-kd/glnK和Cc5-5中glnK基因的表达差异。如图 7所示,与出发菌株Cc5-5中glnK的表达水平相比,glnK过表达菌株Cc-glnK中glnK的表达水平提高了约50倍,glnK缺失突变株Cc-△glnK中未检测到glnK的表达,这些结果也进一步证明菌株Cc-glnK中glnK基因被成功过表达,而菌株Cc-△glnK中glnK基因被成功敲除。而在glnK弱化菌株Cc-kd/glnK中glnK的表达水平下调约5.26倍,表明较出发菌株Cc5-5相比,重组菌株Cc-kd/glnK中glnK基因被成功弱化。
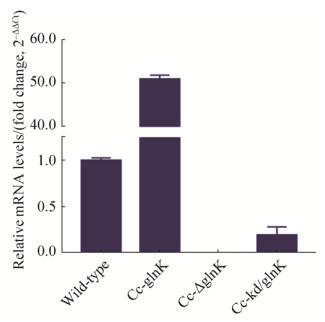 |
| 图 7 RT-qPCR分析glnK在菌株Cc-glnK、Cc-ΔglnK及Cc-kd/glnK中的相对表达水平 Figure 7 RT-qPCR analysis of the expression levels of glnK in Cc-glnK, Cc-ΔglnK and Cc-kd/glnK strains. The standard deviations of the data points were obtained from triplicate measurements and denoted by error bars. |
| 图选项 |
2.4 GlnK对钝齿棒杆菌NH4+吸收的影响 为研究GlnK对钝齿棒杆菌氮代谢的调控作用,我们首先测定了GlnK对NH4+吸收的影响,将各重组钝齿棒杆菌Cc-glnK、Cc-△glnK、Cc-kd/glnK以及出发菌株Cc5-5在含10 mmol/L (NH4)2SO4的基本培养基中培养,每隔4 h取800 μL样品检测胞外NH4+的残留量。由图 8所示,Cc-glnK菌株中NH4+残留量明显低于Cc-△glnK、Cc-kd/glnK及原始菌株Cc5-5,Cc-△glnK菌株中NH4+的残留量明显高于Cc-kd/glnK和原始菌株Cc5-5,Cc-kd/glnK中NH4+的残留量微高于原始菌株Cc5-5。结果表明,PⅡ信号转导蛋白GlnK正调控钝齿棒杆菌对NH4+的吸收利用。
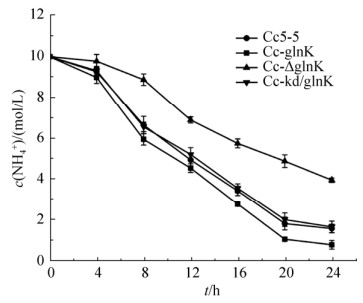 |
| 图 8 比较菌株Cc-glnK、Cc-△glnK、Cc-kd/GlnK和Cc5-5培养基中NH4+的残留量 Figure 8 Comparison of residual NH4+ concentrations of Cc-glnK, Cc-△glnK, Cc-kd/GlnK and Cc5-5 strains. The standard deviations of the data points were obtained from triplicate measurements and denoted by error bars. |
| 图选项 |
2.5 PⅡ信号转导蛋白GlnK对氮代谢及L-精氨酸合成关键基因转录的影响 进一步解析GlnK在钝齿棒杆菌氮代谢和L-精氨酸合成中的作用,本研究通过RT-qPCR分析了菌株Cc5-5、Cc-glnK、Cc-△glnK和Cc-kd/glnK中,氮代谢相关基因amtR、glnD、amtB、glnA、gdh和gltBD以及L-精氨酸合成途径关键基因argC、argJ、argB、argD、argF、argG和argH的转录水平(图 1)。如图 9所示,相比于出发菌株Cc5-5,glnK过表达菌株Cc-glnK中,铵吸收相关基因glnA、gltD和gdh的表达量上调最为显著,分别为出发菌株Cc5-5表达量的5.35倍、5.06倍和3.33倍;铵转运蛋白AmtB和腺苷酰转移酶GlnD编码基因amtB和glnD的表达水平分别上调1.75倍和3.21倍;L-精氨酸合成基因簇中各基因的表达水平也平均上调1.50倍。而glnK缺失突变株Cc-△glnK中基因的表达水平则呈现相反的趋势,即氮代谢相关基因及L-精氨酸合成相关基因的表达量显著下调(图 9)。RT-qPCR实验结果表明,PⅡ信号转导蛋白GlnK正调控氮代谢和L-精氨酸合成关键基因的转录水平。这些基因表达水平的上调,可能影响氮代谢及L-精氨酸合成途径上关键酶的酶活,进一步达到影响氮代谢以及L-精氨酸合成的目的。
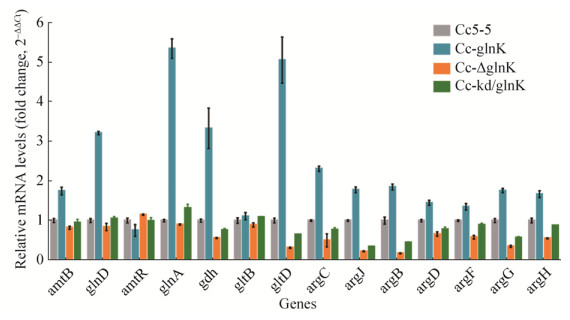 |
| 图 9 RT-qPCR分析GlnK对氮代谢和L-精氨酸合成关键基因转录水平的影响 Figure 9 RT-qPCR analysis of the effect of GlnK on the transcription levels of key genes in nitrogen metabolism and L-arginine biosynthesis. The standard deviations of the data points were obtained from triplicate measurements and denoted by error bars. |
| 图选项 |
2.6 PⅡ信号转导蛋白GlnK对氮代谢及L-精氨酸合成关键酶酶活的影响 棒杆菌中氮源吸收是通过铵转运蛋白AmtB进入胞内,并依赖于谷氨酸脱氢酶(GDH)、谷氨酰胺合成酶(GS)及谷氨酸合成酶(GOGAT)进行同化作用[10],进而维持胞内氮平衡以及为L-精氨酸的合成提供前体物质。进一步验证GlnK对氨同化和L-精氨酸合成的影响,本研究在菌株Cc5-5、Cc-glnK、Cc-△glnK和Cc-kd/glnK中分别测定了GDH、GS和GOGAT以及L-精氨酸合成途径中乙酰谷氨酸激酶(NAGSD)、鸟氨酸乙酰转移酶(OAT)、乙酰谷氨酸激酶(NAGK)、乙酰鸟氨酸转氨酶(ACOAT)、鸟氨酸转氨甲酰酶(OTC)、精氨酸琥珀酸合成酶(AS)和精氨酸琥珀酸酶(AL)7个关键酶的酶活(图 1)。如图 10所示,与出发菌株Cc5-5相比,Cc-△glnK菌株中各酶酶活均下降,而过表达glnK后对酶活有明显促进作用。其中GS、GDH和GOGAT的酶活分别提高55.15%、39.56%和46.20%,L-精氨酸合成途径上关键酶的酶活平均提高30.00%左右。其中NAGSD、ACOAT以及OTC酶活增加最为显著,分别提高了36.59%、40.00%和50.02%。这些结果表明,PⅡ信号转导蛋白GlnK正调控氮代谢和L-精氨酸合成关键酶酶活,可能最终影响L-精氨酸的合成。
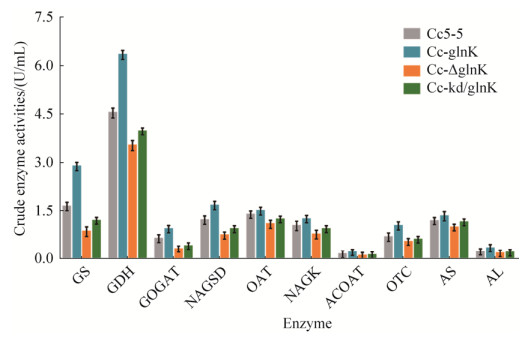 |
| 图 10 重组钝齿棒杆菌粗酶液中氮代谢及L-精氨酸合成关键酶酶活比较 Figure 10 Crude enzyme activities of key enzymes of nitrogen metabolism-related and L-arginine biosynthesis in recombinant strains. GS, GDH, GOGAT, NAGSD, OAT, NAGK, ACOAT, OTC, AS and AL were encoded by glnA, gdh, gltB/D, argC, argJ, argB, argD, argF, argG and argH, respectively. The standard deviations of the data points were obtained from triplicate measurements and denoted by error bars. |
| 图选项 |
2.7 PⅡ信号转导蛋白GlnK对钝齿棒杆菌发酵产L-精氨酸的影响 进一步验证GlnK对钝齿棒杆菌产L-精氨酸的影响,本研究通过5-L发酵罐分析了出发菌株Cc5-5、glnK过表达菌株Cc-glnK、glnK敲除菌株Cc-△glnK和glnK弱化菌株Cc-kd/GlnK发酵产L-精氨酸过程中各参数的变化。如图 11-A所示,各重组菌株与出发菌株Cc5-5生长基本一致,说明GlnK不会对钝齿棒杆菌菌体生长造成影响。与出发菌株Cc5-5相比,发酵前36 h,各重组菌株葡萄糖的消耗量基本一致,L-精氨酸的产量及生产效率之间的差异较小。此后Cc-glnK产L-精氨酸的能力显著增强,而Cc-△glnK和Cc-kd/GlnK菌株中L-精氨酸生产强度增加较为缓慢。如图 11-B所示,发酵结束时,Cc5-5的L-精氨酸产量为38.50 g/L,产率为0.410 g/(L·h),Cc-glnK菌株的L-精氨酸产量为49.53 g/L,产率为0.516 g/(L·h),相比于出发菌株,其产量提高28.65%。此外,Cc-glnK比Cc5-5多消耗约12 g葡萄糖。Cc-△glnK和Cc-kd/GlnK菌株中L-精氨酸的产量分别为28.90 g/L和32.70 g/L,较出发菌株Cc5-5相比,其L-精氨酸合成能力分别下降24.94%和15.07%。这些结果表明,GlnK正调控钝齿棒杆菌L-精氨酸的合成。分析GlnK正调控L-精氨酸合成的原因可能是GlnK通过正调控L-精氨酸合成途径中关键基因的转录水平,进而影响酶活,最终使得L-精氨酸产量提高;或是由于钝齿棒杆菌中腺苷酰转移酶GlnD表达水平本身较高,GlnK被修饰后与AmtR结合,解除AmtR对氮代谢相关基因的抑制,NH4+持续转运进胞内,从而促进L-精氨酸的合成。
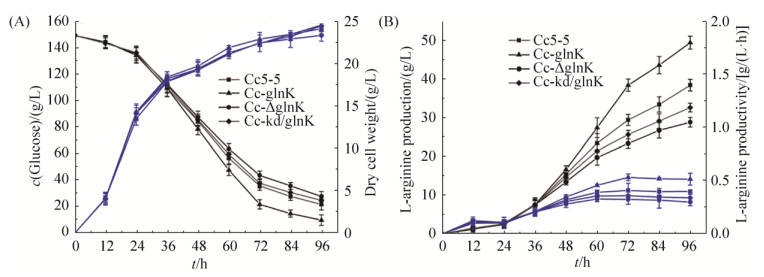 |
| 图 11 重组菌株Cc-glnK、Cc-△glnK、Cc-kd/GlnK与出发菌株Cc5-5的发酵曲线测定 Figure 11 Comparison of L-arginine production among Cc-glnK, Cc-△glnK, Cc-kd/GlnK and Cc5-5 strains. A: Glucose concentration and dry cell weight. B: L-arginine production and L-arginine productivity; Cc5-5 (filled squares), Cc-glnK (filled triangles), Cc-△glnK (filled circles), Cc-kd/GlnK (filled rhombus); The standard deviations of the data points were obtained from triplicate measurements and denoted by error bars. |
| 图选项 |
3 讨论 PⅡ信号转导蛋白是生物界分布最广泛的信号转导蛋白之一,广泛存在于细菌、古细菌和植物中[8, 27]。现已鉴定出多种类型的PⅡ信号转导蛋白,包括GlnK型和NifI调节因子型,这些蛋白通过感知胞内碳源、氮源和能量的变化,自身被共价修饰或诱导后构象改变从而与多种酶、转录调控因子或转运蛋白结合以调节其余蛋白的功能,进而对氮代谢进行调控[28]。但是目前关于钝齿棒杆菌GlnK的功能尚不清楚。本文以钝齿棒杆菌PⅡ信号转导蛋白GlnK为研究对象,研究GlnK蛋白对氮代谢调控及L-精氨酸合成的影响,发现钝齿棒杆菌GlnK正调控氮代谢和L-精氨酸的合成(图 8和图 11)。本研究为深入研究钝齿棒杆菌的氮代谢调控机制及构建L-精氨酸高产菌株奠定了基础。
本研究证实钝齿棒杆菌GlnK正调控NH4+的摄取。研究显示在含10 mmol/L (NH4)2SO4的基本培养基中培养时,同一时间点过表达glnK基因的菌株Cc-glnK培养液中NH4+的残留量明显低于出发菌株,而敲除glnK基因的菌株Cc-ΔglnK培养液中NH4+的残留量明显高于出发菌株(图 8)。谷氨酸棒杆菌GlnK对NH4+的吸收与利用与氮全局转录调控因子AmtR相关,氮饥饿条件下,被腺苷酰化的GlnK将与AmtR结合解除AmtR对氮代谢相关基因的抑制作用[25]。本研究显示,钝齿棒杆菌PⅡ信号转导蛋白GlnK也能与AmtR结合,并且通过RT-qPCR及酶活实验证实GlnK对氮代谢相关基因的表达水平和关键酶酶活有显著的促进作用(图 9和图 10),说明钝齿棒杆菌中,PⅡ信号转导蛋白GlnK很有可能通过与AmtR结合,从而解除AmtR对氮代谢相关基因的抑制作用,使得氮代谢相关基因的表达量和相关酶的酶活提高,最终增强钝齿棒杆菌对NH4+的摄取。
氮源作为有机体内一种必不可少的营养元素,在细胞生长和繁殖过程中起着非常关键的作用。L-精氨酸分子式:C6H14N4O2,氮(N)元素占量高达32.10%,其合成过程中需要大量的氮源供给。课题组前期从氮代谢的角度对钝齿棒杆菌进行一系列系统代谢工程改造研究发现,钝齿棒杆菌对氮源的吸收与钝齿棒杆菌L-精氨酸的合成正相关。在敲除氮全局转录调控因子AmtR的菌株中,整合表达tacM启动子和铵转运蛋白AmtB以提高氮源的摄取与吸收,最终L-精氨酸产量较出发菌株相比提高35.14%[25];对双功能尿苷酰转移/去除酶GlnD进行整合突变,减弱尿苷酰去除酶的活性,增强NH4+的吸收和同化作用,最终重组菌株产L-精氨酸的能力较野生型菌株提高了25.30%[29]。本研究中发现,GlnK正调控L-精氨酸的合成,glnK过表达菌株Cc-glnK最终产L-精氨酸为49.53 g/L,产率为0.516 g/(L·h),相比于出发菌株,其L-精氨酸产量提高了28.65% (图 11)。组合RT-qPCR及酶活实验证实GlnK对L-精氨酸合成基因簇的表达水平和关键酶酶活有显著的促进作用,这或许也就是GlnK正调控L-精氨酸合成的原因。后期我们将进一步研究GlnK在L-精氨酸合成中调控的分子机制,解析GlnK蛋白具体的调控靶点及其中关键的作用位点,为调控钝齿棒杆菌氮代谢及L-精氨酸合成提供新的思路及理论基础。
References
| [1] | Burkovski A. Nitrogen control in Corynebacterium glutamicum:proteins, mechanisms, signals. Journal of Microbiology and Biotechnology, 2007, 17(2): 187-194. |
| [2] | Sahm H, Eggeling L, De Graaf AA. Pathway analysis and metabolic engineering in Corynebacterium glutamicum. Biological Chemistry, 2000, 381(9/10): 899-910. |
| [3] | Brown DR, Barton G, Pan ZS, Buck M, Wigneshweraraj S. Nitrogen stress response and stringent response are coupled in Escherichia coli. Nature Communications, 2014, 5(1): 4115. DOI:10.1038/ncomms5115 |
| [4] | Rehm N, Burkovski A. Engineering of nitrogen metabolism and its regulation in Corynebacterium glutamicum:influence on amino acid pools and production. Applied Microbiology and Biotechnology, 2011, 89(2): 239-248. |
| [5] | Jakoby M, Nolden L, Meier-Wagner J, Kr?mer R, Burkovski A. AmtR, a global repressor in the nitrogen regulation system of Corynebacterium glutamicum. Molecular Microbiology, 2000, 37(4): 964-977. DOI:10.1046/j.1365-2958.2000.02073.x |
| [6] | Hasselt K, Rankl S, Worsch S, Burkovski A. Adaptation of AmtR-controlled gene expression by modulation of AmtR binding activity in Corynebacterium glutamicum. Journal of Biotechnology, 2011, 154(2/3): 156-162. |
| [7] | Hasselt K, Sevvana M, Burkovski A, Muller YA. Crystallization and preliminary crystallographic analysis of the global nitrogen regulator AmtR from Corynebacterium glutamicum. Acta crystallographica Section F:Structural Biology Communications, 2009, 65(11): 1123-1127. DOI:10.1107/S174430910903663X |
| [8] | Forchhammer K. PⅡ signal transducers:novel functional and structural insights. Trends in Microbiology, 2008, 16(2): 65-72. DOI:10.1016/j.tim.2007.11.004 |
| [9] | Lu PL, Ma D, Chen YL, Guo YY, Chen GQ, Deng HT, Shi YG. L-glutamine provides acid resistance for Escherichia coli through enzymatic release of ammonia. Cell Research, 2013, 23(5): 635-644. DOI:10.1038/cr.2013.13 |
| [10] | Schulz AA, Collett HJ, Reid SJ. Nitrogen and carbon regulation of glutamine synthetase and glutamate synthase in Corynebacterium glutamicum ATCC 13032. FEMS Microbiology Letters, 2001, 205(2): 361-367. DOI:10.1111/j.1574-6968.2001.tb10973.x |
| [11] | Zhang JJ, Xu MJ, Ge XX, Zhang X, Yang TW, Xu ZH, Rao ZM. Reengineering of the feedback-inhibition enzyme N-acetyl-L-glutamate kinase to enhance L-arginine production in Corynebacterium crenatum. Journal of Industrial Microbiology & Biotechnology, 2017, 44(2): 271-283. |
| [12] | Zhao QQ, Luo YC, Dou WF, Zhang X, Zhang XM, Zhang WW, Xu MJ, Geng Y, Rao ZM, Xu ZH. Controlling the transcription levels of argGH redistributed L-arginine metabolic flux in N-acetylglutamate kinase and ArgR-deregulated Corynebacterium crenatum. Journal of Industrial Microbiology & Biotechnology, 2016, 43(1): 55-66. |
| [13] | Xu MJ, Rao ZM, Yang J, Xia HF, Dou WF, Jin J, Xu ZH. Heterologous and homologous expression of the arginine biosynthetic argC~H cluster from Corynebacterium crenatum for improvement of L-arginine production. Journal of Industrial Microbiology & Biotechnology, 2012, 39(3): 495-502. |
| [14] | Xu MJ, Zhang X, Rao ZM, Yang J, Dou WF, Jin J, Xu ZH. Cloning, expression and characterization of N-acetylornithine aminotransferase from Corynebacterium crenatum and its effects on L-arginine fermentation. Chinese Journal of Biotechnology, 2011, 27(7): 1013-1023. (in Chinese) 徐美娟, 张显, 饶志明, 杨娟, 窦文芳, 金坚, 许正宏. 钝齿棒杆菌N-乙酰鸟氨酸转氨酶的克隆表达分析及其重组菌的精氨酸发酵. 生物工程学报, 2011, 27(7): 1013-1023. |
| [15] | Zhu Y, Guo YY, Ye ML, James FS. Separation and simultaneous determination of four artificial sweeteners in food and beverages by ion chromatography. Journal of Chromatography A, 2005, 1085(1): 143-146. |
| [16] | Takahara K, Akashi K, Yokota A. Continuous spectrophotometric assays for three regulatory enzymes of the arginine biosynthetic pathway. Analytical Biochemistry, 2007, 368(2): 138-147. |
| [17] | Shinners EN, Catlin BW. Arginine biosynthesis in Neisseria gonorrhoeae:enzymes catalyzing the formation of ornithine and citrulline. Journal of Bacteriology, 1978, 136(1): 131-135. DOI:10.1128/JB.136.1.131-135.1978 |
| [18] | Wolf EC, Weiss RL. Acetylglutamate kinase. A mitochondrial feedback-sensitive enzyme of arginine biosynthesis in Neurospora crassa. Journal of Biological Chemistry, 1980, 255(19): 9189-9195. |
| [19] | Friedrich B, Friedrich CG, Magasanik B. Catabolic N2-acetylornithine 5-aminotransferase of Klebsiella aerogenes:control of synthesis by induction, catabolite repression, and activation by glutamine synthetase. Journal of Bacteriology, 1978, 133(2): 686-691. DOI:10.1128/JB.133.2.686-691.1978 |
| [20] | Kumar A, Vij N, Randhawa GS. Isolation and symbiotic characterization of transposon Tn5-induced arginine auxotrophs of Sinorhizobium meliloti. Indian Journal of Experimental Biology, 2003, 41(10): 1198-1204. |
| [21] | Xu Y, Glansdorff N, Labedan B. Bioinformatic analysis of an unusual gene-enzyme relationship in the arginine biosynthetic pathway among marine gamma proteobacteria:implications concerning the formation of N-acetylated intermediates in prokaryotes. BMC Genomics, 2006, 7(1): 4. DOI:10.1186/1471-2164-7-4 |
| [22] | Tesch M, de Graaf AA, Sahm H. In vivo fluxes in the ammonium-assimilatory pathways in Corynebacterium glutamicum studied by 15N nuclear magnetic resonance. Applied and Environmental Microbiology, 1999, 65(3): 1099-1109. DOI:10.1128/AEM.65.3.1099-1109.1999 |
| [23] | Si MR, Zhao C, Burkinshaw B, Zhang B, Wei DW, Wang Y, Dong TG, Shen XH. Manganese scavenging and oxidative stress response mediated by type VI secretion system in Burkholderia thailandensis. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(11): E2233-E2242. DOI:10.1073/pnas.1614902114 |
| [24] | Xu MJ, Rao ZM, Dou WF, Yang J, Jin J, Xu ZH. Site-directed mutagenesis and feedback-resistant N-acetyl-L-glutamate kinase (NAGK) increase Corynebacterium crenatum L-arginine production. Amino Acids, 2012, 43(1): 255-266. DOI:10.1007/s00726-011-1069-x |
| [25] | Xu MJ, Li J, Shu QF, Tang M, Zhang X, Yang TW, Xu ZH, Rao ZM. Enhancement of L-arginine production by increasing ammonium uptake in an AmtR-deficient Corynebacterium crenatum mutant. Journal of Industrial Microbiology & Biotechnology, 2019, 46(8): 1155-1166. |
| [26] | Peng F, Wang XY, Sun Y, Dong GB, Yang YK, Liu XX, Bai ZH. Efficient gene editing in Corynebacterium glutamicum using the CRISPR/Cas9 system. Microbial Cell Factories, 2017, 16(1): 201. DOI:10.1186/s12934-017-0814-6 |
| [27] | Arcondéguy T, Jack R, Merrick M. PⅡ Signal transduction proteins, pivotal players in microbial nitrogen control. Microbiology and Molecular Biology Reviews, 2001, 65(1): 80-105. |
| [28] | Zhao MX, Jiang YL, Xu BY, et al. Crystal structure of the cyanobacterial signal transduction protein PⅡ in complex with PipX. Journal of Molecular Biology, 2010, 402(3): 552-559. DOI:10.1016/j.jmb.2010.08.006 |
| [29] | Li J, Xu MJ, Shu QF, Zhao YW, Tang M, Zhang X, Yang TW, Xu ZH, Rao ZM. Function of uridylyltransferase and uridylyl-removing enzyme GlnD in Corynebacterium glutamicum JNR. Acta Microbiologica Sinica, 2019, 59(11): 2206-2217. (in Chinese) 李静, 徐美娟, 舒群峰, 赵雅雯, 唐蜜, 张显, 杨套伟, 许正宏, 饶志明. 双功能尿苷酰转移/去除酶GlnD在谷氨酸棒杆菌JNR中的功能. 微生物学报, 2019, 59(11): 2206-2217. |
