张琇1,2

 , 陈海魁1,2, 张学贤3
, 陈海魁1,2, 张学贤3

1. 北方民族大学生物科学与工程学院, 宁夏 银川 750021;
2. 宁夏特殊生境微生物资源开发与利用重点实验室, 宁夏 银川 750021;
3. 梅西大学自然科学与数学研究所, 新西兰 奥克兰 0745
收稿日期:2018-09-17;修回日期:2018-11-23;网络出版日期:2018-12-10
基金项目:宁夏外专项目(T2018016);宁夏科技支撑计划项目(2015)
*通信作者:张琇, Tel/Fax:+86-951-2066292, E-mail:zhangxiu101@aliyun.com;
张学贤, Tel:+64-09-2136593, E-mail:x.x.zhang1@massey.ac.nz.
摘要:假单胞菌铁载体(Pvd)的产生是社会微生物学研究的一个重要模式系统:产生菌是合作者,而不产生菌是欺诈者。欺诈者可以不用付出Pvd合成的能量代价,而利用其他细菌产生的Pvd来获取生长所需的铁离子,因而处于竞争优势地位。合作与欺诈成为了当前解释自然界广泛存在的Pvd不产生菌进化形成的主要原理。本文将阐述荧光假单胞菌Pvd不产生菌形成的多条进化途径,并在此基础上剖析合作与欺诈原理的普遍适用性问题。
关键词:铁载体荧光假单胞菌合作社会微生物学
Evolutionary insights into the emergence of pyoverdine non-producing mutants in Pseudomonas
Xiu Zhang1,2

 , Haikui Chen1,2, Xue-Xian Zhang3
, Haikui Chen1,2, Xue-Xian Zhang3

1. College of Biological Science and Engineering, North Minzu University, Yinchuan 750021, Ningxia Hui Autonomous Region, China;
2. Ningxia Key Laboratory for the Development and Application of Microbial Resources in Extreme Environments, Yinchuan 750021, Ningxia Hui Autonomous Region, China;
3. Institute of Natural and Mathematical Sciences, Massey University, Auckland 0745, New Zealand
Received: 17 September 2018; Revised: 23 November 2018; Published online: 10 December 2018
*Corresponding author: Xiu Zhang, Tel/Fax:+86-951-2066292, E-mail:zhangxiu101@aliyun.com;
Xue-Xian Zhang, Tel:+64-09-2136593, E-mail:x.x.zhang1@massey.ac.nz.
Foundation item: Supported by the Ningxia Foreign Talent Program (T2018016) and by the Ningxia Science and Technology Infrastructure Program (2015)
Abstract: Pyoverdine (Pvd)-a diffusible iron-chelating agent produced by bacteria in the genus of Pseudomonas-has recently become a model system for studying sociomicrobiology. The sociobiology framework (specifically, cooperation and cheating) is used to explain the emergence of Pvd nonproducing mutants that are commonly found in natural environments. Pvd producing and nonproducing cells are considered cooperators and cheaters, respectively. Non-producers can receive the benefit of cooperation by taking up Pvd produced by other cells, but they do not pay the full cost of Pvd biosynthesis. Thus, nonproducing mutants are advantageous in direct competition with the producing cells. This review summarizes the multiple evolutionary pathways of Pvd nonproducing mutants, and further discusses the generality of the conclusion that Pvd production is a cooperative behaviour.
Keywords: pyoverdinPseudomonascooperationsociomicrobiology
近年来,随着社会学的概念引入到微生物学的研究当中,催生了一门新的分支学科,即社会微生物学(Sociomicrobiology)[1-5]。低级的单细胞微生物个体之间存在着广泛的合作(cooperation)、欺诈(cheating)与仇恨(spite)等社会行为,以及通过分泌信号分子进行对话交流(群体感应)等[6, 7]。该分支学科的主要任务是从生物进化的角度,剖析微生物多样性形成的机理和一些遗传学现象的生态学意义,从而将人们对微生物的认识从目前的分子和个体水平提高到群体甚至生态系统的水平。本文将以假单胞菌铁载体的产生为例,着重讨论该研究领域的新发展及可能存在的问题。
1 微生物的社会学属性:合作与欺诈 目前在研的众多社会微生物学现象可以归结到生物进化中的一个核心问题,那就是合作[1, 8]。合作是自然界广泛存在的一种自然现象,一种生物付出自身代价来帮助另外一种生物。它既包括对合作双方都有利的互惠共生关系(mutualism),也包括仅接受一方获益的利他主义行为(altruism)。长期以来,合作一直是生物进化领域的一个热门课题。原因是达尔文进化论的核心是自然选择,而自然选择是在个体水平上进行的:适应者生存,不适应者被淘汰。因此自然选择学说很难解释合作这种让其他个体受益的行为。达尔文本人在“物种起源”第六章也很明确地指出了这一点[9]。
与合作者(cooperators)相伴而行的是欺诈者(cheaters)。因为合作是有代价的,而欺诈者可以从合作关系中获得好处却不用付出全部的代价。故欺诈者在与合作者竞争的时候就必然处于优势。如果没有时间限制的话,欺诈者在群体中所占的比例会逐渐升高,从而导致合作者在正常的自然选择过程中被逐渐淘汰[10]。然而合作的现象在自然界比比皆是。因此合作关系的维持机理尤其是防止欺诈者对合作关系的侵扰的抑制机制,长期以来一直是生物进化领域的一个关键科学问题。
2 假单胞菌铁载体的产生是研究微生物合作行为的一个重要模式系统 微生物之间相互合作的一个主要方式是分泌产生细胞外产物(extracellular products)[8]:包括与营养物质利用和抗生素抗性有关的胞外酶(enzymes)[11],细菌运动所需要的生物表面活性剂(biosurfactants)[12],与生物被膜(biofilm)形成有关的胞外多糖[10],以及群体感应的信号分子等[13]。由此可见,合作这一社会学概念影响到了微生物学研究的方方面面。其中可自由扩散的细胞外产物称为公共物品(public good),因为生长在同一环境中的所有细菌都可以获得它。产生菌是合作者(cooperators),相应地,不产生菌(或产生能力下降的菌株)就是欺诈者(cheaters)。合成这些胞外产物是需要消耗能量的,不产生菌可以不用付出这些代价而从环境中吸收其他细菌产生的胞外产物。因此不产生菌相对于产生菌来说就处于竞争优势。在其没有得到有效控制的前提下,自由竞争就会导致合作关系的解体(图 1)。对不产生菌(欺诈者)的控制机理是研究微生物合作行为的核心内容。
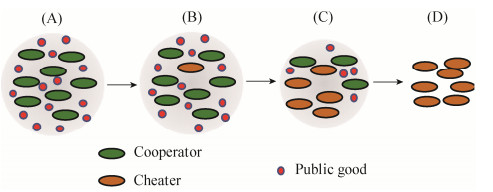 |
| 图 1 合作关系的维持所面临的挑战 Figure 1 The evolutionary challenge for the maintenance of cooperation. Bacteria produce diffusible extracellular products (termed public goods, A). Non-producing mutant arises and increases in frequency (B, C), leading to extinction of the producer and collapse of the cooperative system (D) |
| 图选项 |
对于微生物分泌细胞外产物的合作行为,最重要的一个研究模式是假单胞菌Pseudomonas所产生的铁载体荧光素(pyoverdine,缩写Pvd)[14-17]。铁是细菌生长所必需的营养元素。但是在大多数有氧的自然环境条件下,铁是以不溶于水的三价铁离子(Fe3+)存在的,从而不能被细菌直接吸收利用。因此,包括荧光假单胞菌在内的许多细菌进化获得了产生铁载体Pvd的能力[18-21]。如图 2所示,Pvd在细胞质中合成,经过周质空间进一步修饰,然后分泌到胞外。胞外的Pvd与Fe3+结合之后,由外膜转运蛋白FpvA转运到周质空间。Fe3+释放之后,还原为二价铁离子Fe2+随后进入细胞质,而Pvd则被重新分泌到细胞外而重复循环利用[19, 22]。
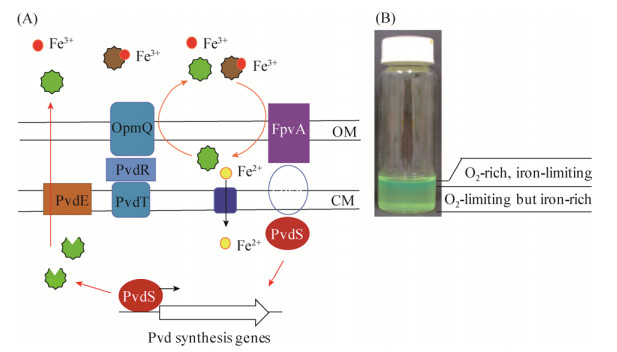 |
| 图 2 假单胞菌合成Pvd铁载体的分子机理(A)和实验室微宇宙系统(B) Figure 2 The molecular mechanism of Pvd regulation (A) and the laboratory microcosm system (B). Under conditions of iron limitation, PvdS activates expression of Pvd synthesis genes; Pvd is then secreted outside of the cell after modification in the periplasmic space between outer membrane (OM) and cytoplasmic membrane (CM). Next, Pvd is bound with Fe3+ and subsequently taken up by FpvA. After releasing iron in the periplasmic space, Pvd is recycled by the OpmQ transporter. Pvd uptake enhances PvdS activities via the membrane-bound FpvA and FpvR system |
| 图选项 |
假单胞菌铁载体不产生菌(Pvd–)在自然界是广泛存在的。从土壤、水、植物表面,到绿脓假单胞菌慢性感染病人的肺部,都可以很容易地分离得到[15, 23-24]。这些Pvd–欺诈者菌株失去了产生铁载体的能力,但可以通过吸收其他菌株(合作者)分泌产生的Pvd而获得生长所需的铁元素。因此“合作与欺诈”被用来解释自然环境当中Pvd–突变体形成的根本原因,是目前大量相关工作的理论基础[25]。
当前报道的试验结果提出了很多有意义的假设来阐明铁载体产生这一合作关系得以维系的机制。例如,Sexton等(2017)发现荧光假单胞菌对自己产生的铁载体比对其他菌株产生的铁载体具有更高的吸收利用能力,从而保证产生菌比不产生菌更有竞争优势[26]。Kummerli & Brown (2010)证明了铁载体的反复循环利用可以减少Pvd合成的耗能,防止Pvd–突变体的侵袭[16]。Jin et al. (2018)发现绿脓假单胞菌在遭遇环境胁迫时会减少Pvd的分泌,产生菌细胞内累积的Pvd转换成私有物品(private goods)用于增强活性氧的抵御能力[27]。另外,在Pvd扩散受限制的环境(如菌落内部)Pvd集中在产生菌的周围,从而可以减少被Pvd–突变体摄取的机会[28]。
3 合作/欺诈理论的普适性问题 铁载体的社会学属性最早源于Griffin et al. (2004)发表在Nature的一篇论文,题为“病原细菌的合作与竞争”[14]。很快这一认知就进入了教科书。激发了大量的研究工作,并在很短的时间之内使假单胞菌Pvd成为研究微生物合作行为的一个最重要的模式系统。然而,当几乎所有的工作都集中在研究合作关系的维持机制的时候,一个关键的基础性任务却被忽视了,那就是对Pvd的产生这一合作行为本身进行严格的科学检验。到目前为止,没有提出足够令人信服的证据来证明:(ⅰ) Pvd是进化学严格意义上的一个公共物品;(ⅱ) Pvd的产生是细菌之间的合作行为;(ⅲ)更进一步Pvd产生的合作行为是可以不受环境条件的限制[29]。换句话来说,从传统微生物学的角度,目前尚缺乏足够证据证明“合作”与“欺诈”是解释自然界众多环境条件下Pvd–突变体形成的唯一机理。需要指出的是,这一状况不仅仅限于Pvd铁载体,而是存在于所有通过产生公共物品的方式来进行合作的微生物合作行为,包括群体感应[13, 30]。
对微生物合作现象的普遍适用性的研究具有重要的理论与现实意义。在理论上,假如认定自然界所有的Pvd–突变体都是通过欺诈的方式而获得竞争优势的话,我们就失去了探索其他潜在进化途径的学术机会。因为科学问题的提出是相关研究工作的第一步。在实践应用上,鉴于Pvd是病原假单胞菌的一个重要致病因子,利用合作与欺诈(例如Pvd–低毒菌株)来防治动植物以及人类细菌侵染性疾病已经被提上了日程[2, 5, 31, 32]。相关的实践应用必须建立在正确的理论基础之上。
4 实验进化(experimental evolution)是检验微生物合作行为的有效技术手段 对于生物学中的合作行为,近年来已经形成了一个大家公认的严格定义:合作是一个生物个体付出代价而让另一个体受益的行为,而且这一行为必须是自然选择的结果[8]。合作的概念是非常清晰的,但是在具体操作上如何判定某一具体行为是否是“合作”(或自然选择的结果)的时候,却面临着技术上的巨大挑战。主要难点在于判断一个具体行为是否是自然选择的结果。我们无从知道一个微生物性状在漫长的生物进化史上进化形成的环境条件,而环境条件对物种的适应性起着决定性的作用。在这种情况下,实验进化就成为了检验微生物合作行为的不可或缺的技术手段[33-34]。
研究细菌的进化问题具有动物和植物所不具备的优势,那就是我们可以准确地量化测定细菌在特定生长环境条件下的相对适应性[34]。对于待比较的两个菌株,需要对其中的一个进行标记,最好是使用非选择性标记基因,对细菌的适应性没有影响,比如lacZ基因。lacZ基因标记和没标记的菌株,在含X-gal的平板上会分别形成蓝色和白色两种菌落。这样一来,就可以在同一个琼脂平板上区分供试的两个菌株。将原始菌株与进化菌株按照一定的比例(如1:1)混合接种到一个新的培养基(或植物),分别测定它们在起始时间t=0的细菌数(Ni)和生长结束时间t=T的细菌数。然后分别计算它们的马尔萨斯氏参数(Malthusian parameter):mi=ln[Ni(T)/Ni(0)]。进化菌株相对于原始菌株的相对适应性可以用选择效率常数来表示,即selection rate constant:rij=mi–mj。rij数值是正数就表明进化菌株比原始菌株的适应性强。反之,负数就表明进化菌株比原始菌株的适应性弱。二者适应性相当的话,rij数值就是零。
在实验进化试验中,我们将起始的微生物菌株在特定的环境条件下传代培养。中间形成的微生物群体可以永久冷冻保藏起来,供后续分析试验(其作用相当于动植物的化石)。随着第二代和第三代高通量测序技术的发展,人们可以很容易地鉴定实验进化过程中所发生的基因突变。最后,利用基因定位突变(site-directed mutagenesis)的技术将相应的基因突变引入原始菌株(或中间体)[35],来分析该基因的生态学功能,并测定突变体在已知的相应环境条件下的适应性(fitness)。这样就可以将基因型、表现型以及环境条件三者有机地结合起来。
5 合作与欺诈不是Pvd-菌株进化形成的唯一途径 Zhang and Rainey (2013)首次使用实验进化的方法,剖析了荧光假单胞菌Pvd铁载体在实验室微宇宙(microcosm)条件下的进化过程[36]。将起始的Pvd产生菌(Pvd+)接种到含6 mL培养基的试剂瓶(图 2-B),在静置和摇床两种培养条件下,进行1000倍稀释的连续传代培养(每转接一次,细菌繁殖约10代)。经过600代之后,对进化形成的Pvd–突变体进行遗传学分析,发现所有的基因突变都发生在pvdS基因。如图 2所示,PvdS是激活Pvd合成基因的正调节子(sigma因子)[20, 22]。Pvd的吸收和合成是偶联的。细胞吸收越多就合成越多,而PvdS是协调Pvd吸收与生物合成的关键调节因子(图 2)。pvdS突变之后,突变体不再合成Pvd,但其吸收Pvd的能力则不受影响,因而具有一个典型的“欺诈者”的特点。但是,对Pvd–的相对适应性进行了大量的研究之后,发现存在着非常复杂的基因型与环境之间的相互作用。Pvd–只在适度缺铁的环境中表现出一个“欺诈者”的特征。而在其他环境条件(包括微宇宙环境)则不是一个“欺诈者”:单独生长的时候,Pvd–突变体比Pvd+产生菌的适应性更强。据此,合作与欺诈的“普适性”被首次质疑[36-38]。
如图 2-B所示,在微宇宙的异质环境条件下,仅仅气液表面是一个好氧的环境,铁离子是以三价的形式出现,从而细菌需要分泌产生Pvd来获得生长所需的铁离子。但是微宇宙的下层则是一个微好氧或厌氧的环境,还原态的二价铁离子是可溶的,可以直接被细菌细胞吸收利用,因此这里的细菌不缺铁,不需要合成Pvd。但是,在静置培养条件下,定植在表层的细菌所产生的Pvd会往下扩散,诱导微宇宙下层的细菌不必要地合成大量的Pvd。具体从分子机理上来讲,在铁供应充分时,Pvd生物合成基因的转录表达是受到Fur阻遏蛋白抑制的,但是Pvd-Fe3+复合体的吸收以及PvdS正调节子的高表达都可以解除Fur阻遏子的抑制作用,从而导致野生型菌株在不缺铁的环境(微宇宙下层)也合成Pvd。很显然,野生型菌株是不适应这种异质性封闭的生长环境的,相反地该环境有利于Pvd–突变体的生长。也就是说,实验室微宇宙试验中Pvd–突变体的出现并不是源于对野生型菌株的“欺诈”。
需要特别说明的是,异质性封闭环境在自然界也是存在的,比如荧光假单胞菌定植的土壤团聚体以及铜绿假单胞菌慢性感染病人的肺部。因此,自然界包括Pvd–在内的胞外产物突变体可能存在多条进化途径。”合作/欺诈”只是其中的一条可能途径,在我们接受它之前应该像对待其他的假说一样进行严格的检验。
6 小结和展望 总而言之,合作与欺诈是近年来解释微生物多样性形成机理的一个积极尝试。单纯从生物进化的角度,利用微生物为研究材料阐明合作的进化机理在方法学上是没有任何问题的,只要满足相关的条件要求就行,就像我们可以用计算机模拟的手段来研究合作的机理一样。但是从微生物学的角度,不能据此就认定Pvd等性状是微生物的一种合作行为。除了螯合铁的主要功能之外,Pvd还参与了其他金属离子如铜和锌的代谢[39],同时具有抗菌和抗逆等功能[27, 40]。另外,绝大多数假单胞菌菌株的基因组都含有多套复杂的Pvd跨膜转运系统,它们既可以吸收自己合成分泌的Pvd,也可以吸收利用环境中存在的其他细菌分泌的Pvd。因此,自然界Pvd进化形成的真实情况显然比我们目前认识到的要复杂的多。对于合作和欺诈的新假说,我们应该像对待其他科学假说一样进行严格的实验检验。剖析在不同生态环境条件下不产生菌的潜在进化途径是当前社会微生物学研究的一项迫切任务。
References
| [1] | Tarnita CE. The ecology and evolution of social behavior in microbes. Journal of Experimental Biology, 2017, 220: 18-24. DOI:10.1242/jeb.145631 |
| [2] | Xavier JB. Sociomicrobiology and pathogenic bacteria. Microbiology Spectrum, 2016, 4(3): 1-16. DOI:10.1128/microbiolspec.VMBF-0019-2015 |
| [3] | Stanley-Wall NR, Coulthurst SJ, Holland IB. A snapshot of the extraordinary world of social microbiology. Journal of Molecular Biology, 2015, 427(23): 3625-3627. DOI:10.1016/j.jmb.2015.10.012 |
| [4] | West SA, Diggle SP, Buckling A, Gardner A, Griffin AS. The social lives of microbes. Annual Review of Ecology, Evolution, and Systematics, 2007, 38: 53-77. DOI:10.1146/annurev.ecolsys.38.091206.095740 |
| [5] | Mellbye B, Schuster M. The sociomicrobiology of antivirulence drug resistance: a proof of concept. mBio, 2011, 2(5): e00131-11. |
| [6] | Inglis RF, Gardner A, Cornelis P, Buckling A. Spite and virulence in the bacterium Pseudomonas aeruginosa. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(14): 5703-5707. DOI:10.1073/pnas.0810850106 |
| [7] | Diggle SP, Griffin AS, Campbell GS, West SA. Cooperation and conflict in quorum-sensing bacterial populations. Nature, 2007, 450(7168): 411-414. DOI:10.1038/nature06279 |
| [8] | West SA, Griffin AS, Gardner A. Social semantics: altruism, cooperation, mutualism, strong reciprocity and group selection. Journal of Evolutionary Biology, 2007, 20(2): 415-432. DOI:10.1111/j.1420-9101.2006.01258.x |
| [9] | West SA, Griffin AS, Gardner A. Evolutionary explanations for cooperation. Current Biology, 2007, 17(16): R661-R672. DOI:10.1016/j.cub.2007.06.004 |
| [10] | Rainey PB, Rainey K. Evolution of cooperation and conflict in experimental bacterial populations. Nature, 2003, 425(6953): 72-74. DOI:10.1038/nature01906 |
| [11] | Medaney F, Dimitriu T, Ellis RJ, Raymond B. Live to cheat another day: bacterial dormancy facilitates the social exploitation of β-lactamases. The ISME Journal, 2016, 10(3): 778-787. DOI:10.1038/ismej.2015.154 |
| [12] | Ben-Jacob E, Finkelshtein A, Ariel G, Ingham C. Multispecies swarms of social microorganisms as moving ecosystems. Trends in Microbiology, 2016, 24(4): 257-269. DOI:10.1016/j.tim.2015.12.008 |
| [13] | Whiteley M, Diggle SP, Greenberg EP. Progress in and promise of bacterial quorum sensing research. Nature, 2017, 551(7680): 313-320. DOI:10.1038/nature24624 |
| [14] | Griffin AS, West SA, Buckling A. Cooperation and competition in pathogenic bacteria. Nature, 2004, 430(7003): 1024-1027. DOI:10.1038/nature02744 |
| [15] | Butait? E, Baumgartner M, Wyder S, Kümmerli R. Siderophore cheating and cheating resistance shape competition for iron in soil and freshwater Pseudomonas communities. Nature Communications, 2017, 8(1): 414. DOI:10.1038/s41467-017-00509-4 |
| [16] | Kümmerli R, Brown SP. Molecular and regulatory properties of a public good shape the evolution of cooperation. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(44): 18921-18926. DOI:10.1073/pnas.1011154107 |
| [17] | Granato ET, Kümmerli R. The path to re-evolve cooperation is constrained in Pseudomonas aeruginosa. BMC Evolutionary Biology, 2017, 17(1): 214. DOI:10.1186/s12862-017-1060-6 |
| [18] | Cezard C, Farvacques N, Sonnet P. Chemistry and biology of pyoverdines, Pseudomonas primary siderophores. Current Medicinal Chemistry, 2015, 22(2): 165-186. |
| [19] | Gasser V, Guillon L, Cunrath O, Schalk IJ. Cellular organization of siderophore biosynthesis in Pseudomonas aeruginosa: evidence for siderosomes. Journal of Inorganic Biochemistry, 2015, 148: 27-34. DOI:10.1016/j.jinorgbio.2015.01.017 |
| [20] | Moon CD, Zhang XX, Matthijs S, Sch?fer M, Budzikiewicz H, Rainey PB. Genomic, genetic and structural analysis of pyoverdine-mediated iron acquisition in the plant growth-promoting bacterium Pseudomonas fluorescens SBW25. BMC Microbiology, 2008, 8(1): 7. DOI:10.1186/1471-2180-8-7 |
| [21] | Silby MW, Cerde?o-Tárraga AM, Vernikos GS, Giddens SR, Jackson RW, Preston GM, Zhang XX, Moon CD, Gehrig SM, Godfrey SA, Knight CG, Malone JG, Robinson Z, Spiers AJ, Harris S, Challis GL, Yaxley AM, Harris D, Seeger K, Murphy L, Rutter S, Squares R, Quail MA, Saunders E, Mavromatis K, Brettin TS, Bentley SD, Hothersall J, Stephens E, Thomas CM, Parkhill J, Levy SB, Rainey PB, Thomson NR. Genomic and genetic analyses of diversity and plant interactions of Pseudomonas fluorescens. Genome Biology, 2009, 10(5): R51. DOI:10.1186/gb-2009-10-5-r51 |
| [22] | Edgar RJ, Hampton GE, Garcia GPC, Maher MJ, Perugini MA, Ackerley DF, Lamont IL. Integrated activities of two alternative sigma factors coordinate iron acquisition and uptake by Pseudomonas aeruginosa. Molecular Microbiology, 2017, 106(6): 891-904. DOI:10.1111/mmi.13855 |
| [23] | Bruce JB, Cooper GA, Chabas H, West SA, Griffin AS. Cheating and resistance to cheating in natural populations of the bacterium Pseudomonas fluorescens. Evolution, 2017, 71(10): 2484-2495. DOI:10.1111/evo.13328 |
| [24] | Folkesson A, Jelsbak L, Yang L, Johansen HK, Ciofu O, H?iby N, Molin S. Adaptation of Pseudomonas aeruginosa to the cystic fibrosis airway: an evolutionary perspective. Nature Reviews Microbiology, 2012, 10(12): 841-851. DOI:10.1038/nrmicro2907 |
| [25] | Sexton DJ, Schuster M. Nutrient limitation determines the fitness of cheaters in bacterial siderophore cooperation. Nature Communications, 2017, 8(1): 230. DOI:10.1038/s41467-017-00222-2 |
| [26] | Sexton DJ, Glover RC, Loper JE, Schuster M. Pseudomonas protegens Pf-5 favours self-produced siderophore over free-loading in interspecies competition for iron. Environmental Microbiology, 2017, 19(9): 3514-3525. DOI:10.1111/1462-2920.13836 |
| [27] | Jin ZY, Li JH, Ni L, Zhang RR, Xia AG, Jin F. Conditional privatization of a public siderophore enables Pseudomonas aeruginosa to resist cheater invasion. Nature Communications, 2018, 9(1): 1383. DOI:10.1038/s41467-018-03791-y |
| [28] | Julou T, Mora T, Guillon L, Croquette V, Schalk IJ, Bensimon D, Desprat N. Cell-cell contacts confine public goods diffusion inside Pseudomonas aeruginosa clonal microcolonies. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(31): 12577-12582. DOI:10.1073/pnas.1301428110 |
| [29] | Niehus R, Picot A, Oliveira NM, Mitri S, Foster KR. The evolution of siderophore production as a competitive trait. Evolution, 2017, 71(6): 1443-1455. DOI:10.1111/evo.13230 |
| [30] | Hense BA, Kuttler C, Müller J, Rothballer M, Hartmann A, Kreft JU. Does efficiency sensing unify diffusion and quorum sensing?. Nature Reviews Microbiology, 2007, 5(3): 230-239. DOI:10.1038/nrmicro1600 |
| [31] | Brown SP, West SA, Diggle SP, Griffin AS. Social evolution in micro-organisms and a Trojan horse approach to medical intervention strategies. Philosophical Transactions of the Royal Society B: Biological Sciences, 2009, 364(1533): 3157-3168. DOI:10.1098/rstb.2009.0055 |
| [32] | McNally L, Brown SP. Building the microbiome in health and disease: niche construction and social conflict in bacteria. Philosophical Transactions of the Royal Society B: Biological Sciences, 2015, 370(1675): 20140298. DOI:10.1098/rstb.2014.0298 |
| [33] | Rainey PB, Remigi P, Farr AD, Lind PA. Darwin was right: where now for experimental evolution?. Current Opinion in Genetics & Development, 2017, 47: 102-109. |
| [34] | Zhang XX, Rainey PB. Construction and validation of a neutrally-marked strain of Pseudomonas fluorescens SBW25. Journal of Microbiological Methods, 2007, 71(1): 78-81. DOI:10.1016/j.mimet.2007.07.001 |
| [35] | Giddens SR, Jackson RW, Moon CD, Jacobs MA, Zhang XX, Gehrig SM, Rainey PB. Mutational activation of niche-specific genes provides insight into regulatory networks and bacterial function in a complex environment. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(46): 18247-18252. DOI:10.1073/pnas.0706739104 |
| [36] | Zhang XX, Rainey PB. Exploring the sociobiology of pyoverdin-producing Pseudomonas. Evolution, 2013, 67(11): 3161-3174. DOI:10.1111/evo.12183 |
| [37] | Kümmerli R, Ross-Gillespie A. Explaining the sociobiology of pyoverdin producing Pseudomonas: a comment on Zhang and Rainey (2013). Evolution, 2014, 68(11): 3337-3343. DOI:10.1111/evo.12311 |
| [38] | Rainey PB, Desprat N, Driscoll WW, Zhang XX. Microbes are not bound by sociobiology: response to kummerli and ross-gillespie (2013). Evolution, 2014, 68(11): 3344-3355. DOI:10.1111/evo.12508 |
| [39] | O'Brien S, Hodgson DJ, Buckling A. Social evolution of toxic metal bioremediation in Pseudomonas aeruginosa. Proceedings of the Royal Society B: Biological Sciences, 2104, 281(1787): 20140858. |
| [40] | Johnstone TC, Nolan EM. Beyond iron: non-classical biological functions of bacterial siderophores. Dalton Transactions, 2015, 44(14): 6320-6339. DOI:10.1039/C4DT03559C |
