董战旗1,2, 蒋亚明1,2, 陈鹏1,2, 潘敏慧1,2


1. 西南大学家蚕基因组生物学国家重点实验室, 重庆 400716;
2. 西南大学农业部蚕桑生物学与遗传育种重点实验室, 重庆 400716
收稿日期:2018-09-20;修回日期:2019-01-12;网络出版日期:2019-03-13
基金项目:国家自然科学基金(31872427);国家蚕桑产业技术体系(CARS-18);中国博士后基金面上项目(2018M633309);重庆市博士后特别资助项目(XmT2018020)
*通信作者:潘敏慧, Tel/Fax:+86-23-68250076, E-mail:pmh047@126.com.
摘要:[目的] 家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)隶属于杆状病毒,需要借助宿主细胞能量代谢进行自身增殖复制。家蚕ADP/ATP转运酶(Bombyx mori ADP/ATP translocase,BmANT)是线粒体转运蛋白,在BmNPV感染条件下和家蚕热休克蛋白60(heat shock protein 60,BmHSP60)具有直接的相互作用。因此,鉴定Bmant基因在BmNPV感染过程中的功能特征,有助于解析杆状病毒劫持宿主细胞因子促进自身增殖复制机制,完善杆状病毒和宿主相互作用网络。[方法] 通过结构域预测BmANT蛋白的结构特征,荧光定量PCR分析Bmant基因在BmNPV感染后的变化特征;并过表达BmANT检测其对病毒DNA复制和病毒蛋白表达变化影响;进一步在转录水平分析Bmant和Bmhsp60基因的调控关系;最后通过流式细胞术等技术鉴定Bmant和Bmhsp60基因共同调控BmNPV增殖复制的机制。[结果] SMART软件预测显示BmANT包含3个线粒体载体结构域,BmNPV感染24 h后Bmant基因持续下调表达。过表达Bmant基因能够显著抑制BmNPV DNA的复制和VP39蛋白表达。荧光定量PCR分析显示Bmant和Bmhsp60基因具有相互拮抗作用,能够相互抑制转录。Bmant和Bmhsp60共同过表达分析显示,BmANT和BmHSP60共同作用BmNPV能够抑制病毒的增殖复制。[结论] 结果表明,BmANT是一个线粒体载体蛋白,具有显著的抗病毒作用,能够下调Bmhsp60基因表达,并抑制BmNPV增殖复制。
关键词:家蚕家蚕核型多角体病毒BmANTBmHSP60抗病毒
Inhibition of BmNPV proliferation by Bombyx mori ADP/ATP transportase (BmANT)
Zhanqi Dong1,2, Yaming Jiang1,2, Peng Chen1,2, Minhui Pan1,2


1. State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China;
2. Key Laboratory of Sericultural Biology and Genetic Breeding, Ministry of Agriculture, Southwest University, Chongqing 400716, China
Received: 20 September 2018; Revised: 12 January 2019; Published online: 13 March 2019
*Corresponding author: Minhui Pan, Tel/Fax: +86-23-68250076; E-mail: pmh047@126.com.
Foundation item: Supported by the National Natural Science Foundation of China (31872427), by the State of Sericulture Industry Technology System (CARS-18), by the China Postdoctoral Science Foundation (2018M633309) and by the Chongqing Special Postdoctoral Science Foundation (XmT2018020)
Abstract: [Objective] Bombyx mori nucleopolyhedrovirus (BmNPV) belongs to the family Baculoviridae. It replicates and proliferates using its host cell's energy metabolism. Bombyx mori ADP/ATP translocase (BmANT) is a transporter that interacts with the host energy metabolism factor, heat shock protein 60 (BmHSP60), during BmNPV infection. To determine which of the functional characteristics of the Bmant gene affect the process of BmNPV infection, we here analyze the mechanism by which the baculovirus hijacks host cytokines to promote viral proliferation and replication. [Methods] The structural characteristics of the Bmant gene were predicted, and qRT-PCR was performed to analyze the changes in the Bmant gene after BmNPV infection. The effect of this gene on viral DNA replication and viral protein expression was analyzed using overexpression of the Bmant gene. We further analyzed the relationship between the Bmant and Bmhsp60 genes in transcriptional regulation. The mechanism by which Bmant and Bmhsp60 regulates the proliferation and replication of BmNPV was identified using flow cytometry and Western blotting analysis. [Results] SMART software predicted that BmANT protein contained three mitochondrial vector domains, and the Bmant gene down-regulated expression 24 h after BmNPV infection. Overexpression of the Bmant gene significantly inhibited BmNPV DNA replication and VP39 protein expression. QRT-PCR analysis showed the Bmant and Bmhsp60 genes to have mutual antagonism and to be capable of inhibiting each other's transcription. Co-transfection analysis of the Bmant and Bmhsp60 genes showed that the Bmant gene can significantly inhibit the action of the Bmhsp60 gene and ultimately inhibit the proliferation and replication of BmNPV. [Conclusion] The results indicated that the Bmant gene is a mitochondrial carrier protein with significant antiviral activity that is capable of down-regulating the expression of Bmhsp60 and inhibiting BmNPV proliferation and replication.
Keywords: Bombyx moriBmNPVBmANTBmHSP60antiviral
家蚕(Bombyx mori)是一种具有重要经济价值的鳞翅目模式昆虫[1],而家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)作为家蚕重大病害血液型脓病的病原每年给我国养蚕业造成巨大的经济损失[2]。因此,解析杆状病毒和宿主相互作用机制,和鉴定新的家蚕抗病毒因子,对家蚕抗病毒育种具有重要的意义。
杆状病毒是双链DNA病毒,编码90?180个基因,具有双向生活史[3]。杆状病毒依赖宿主细胞功能进行增殖感染[4]。研究表明BmNPV能够劫持宿主细胞家蚕热休克蛋白60 (Bombyx mori heat shock protein 60,BmHSP60)促进BmNPV的增殖复制[5-6]。同时,本研究小组确定了BmHSP60在BmNPV感染过程能够和家蚕ADP/ATP转运酶(Bombyx mori ADP/ATP translocase,BmANT)相互作用。BmANT转运蛋白能够跨越线粒体内膜交换细胞溶质二磷酸腺苷(ADP)和ATP,为细胞提供主要的能量[7]。先前研究报道,包括家蚕在内的很多昆虫都具有2个ant同源基因,分别命名为ant1和ant2,ant1在全身组织中均有高量表达,而ant2只特异地在精巢中表达,和生殖细胞的形成有关[8]。宿主的ANT1能够和多个病原的相关蛋白发生相互作用,进而调控病毒增殖复制。比如猪繁殖与综合呼吸征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)包膜蛋白E、对虾白斑综合症病毒(white spot syndromic virus,WSSV) VP12、人类免疫缺陷病毒(human immunodeficiency virus,HIV) Vpr均能与ANT1相互作用,控制线粒体膜通透性;人类巨细胞病毒(human cytomegalovirus,HCMV) miR-UL36-5P能够干涉的ant基因,下调宿主ant3的表达,从而抑制凋亡[9-12]。不同昆虫的ANT1都存在相似的结构,即含有3个线粒体跨膜结构域,锚定在线粒体内膜中,和电压依赖性阴离子通道(voltage-dependent anion channel,VDAC)共同构成线粒体膜孔复合物,参与调节线粒体内膜通透性、电化学平衡和氧化磷酸化链,甚至参与细胞凋亡途径[7]。但是,Bmant在家蚕中的功能以及Bmant对BmNPV增殖复制的调控作用未见报道。本文系统分析了Bmant在BmNPV感染过程中的功能特征以及和Bmhsp60共同调控BmNPV增殖的作用机制,为深入解析杆状病毒和宿主相互作用提供了一定的基础数据,同时也为家蚕抗病毒研究提供了新的抗病毒靶标基因。
1 材料和方法 1.1 材料
1.1.1 细胞和病毒: 家蚕卵巢细胞系BmN-SWU1和BmNPV (vA4prm-EGFP)病毒由家蚕基因组生物学国家重点实验室保存[13-14]。
1.1.2 2试剂和仪器: TC100昆虫细胞培养基(US Biological);澳洲胎牛血清(Gibco);各种限制性内切酶、连接酶、DNA Marker、Protein Marker等分子生物学操作试剂购自TaKaRa公司;胶回收试剂盒购于Omega公司;质粒提取试剂盒(全式金);16 ℃连接仪(Eppendorf);流式细胞仪(BACMAN);倒置显微镜(Olympus)。
1.2 载体构建 本实验以pIZ/V5-His为空载,构建pIZ-ANTHA和pIZ-HSP60Flag载体。首先通过NCBI (https://www.ncbi.nlm.nih.gov/)搜索目标基因序列,设计相应的引物,以家蚕cDNA为模板进行PCR扩增获得Bmant和Bmhsp60基因全长开放阅读框(open reading frame,ORF),并通过相应的酶切连接到pIZ/V5-His空载,测序正确后,进行转染。本研究所用的引物如表 1所示。
表 1. PCR物信息 Table 1. PCR primer information
| Primer | Sequence (5′→3′) |
| BmHSP60Flag-BamH I/F | CGCGGATCCATGGACTACAAAGACGATGACGACAAGTTGCGTCTACCTCGTGTT |
| BmHSP60Flag-Not I/R | ATAAGAATGCGGCCGCTCACTTGTCGTCATCGTCTTTGTAGTCCATCATGCCTCCCATACCA |
| BmANTHA-Kpn I/F | GGGGTACCATGTACCCATACGACGTCCCAGACTACGCTTCGAACCTC GCCGA |
| BmANTHA–Spe I/R: | GGACTAGTGGCGTAGTCGGGCACGTCGTAGGGGTACAGGACCTTCTT GATCTCAT |
| RT-BmANT/F | CGGCGGTGTTGACAAGAAGA |
| RT-BmANT/R | CGAAGTATGAGGCACGGTAGAT |
| RT-BmHSP60/F | ACAATGGGTCCAAAAGGTAGAA |
| RT-BmHSP60/R | CGTGTCCCCGTTAGCAGAT |
| sw22934/F: | TTCGTACTGCTCTTCTCGT |
| sw22934/R: | CAAAGTTGATAGCAATTCCCT |
| gp41/F | CCTATTCTGTGCTGGTGGTGG |
| gp41/R | ATGTTGATGTGCGGAAAGC |
| The restriction enzyme sites are marked in bold, the underline represents the fusion tag. | |
表选项
1.3 细胞培养和转染 在生长贴壁的BmN-SWU1细胞培养瓶中加入3 mL含有10%胎牛血清的TC100培养基,放置于27 ℃智能人工气候箱中培养,72 h更换1次培养基。当细胞铺满80%左右时,吸取原有培养基,加入少量无抗培养基将残留的培养基完全清除,倒掉后再用无抗培养基替换。
24孔细胞培养板中,按照0.8 μg质粒︰2 μL转染试剂︰100 μL无抗培养基混合,在高压灭菌的离心管中轻柔逐滴混匀50次左右,静置30 min,然后滴加到细胞孔中;共转时,24孔板每孔加入质粒各0.5 μg。转染后,细胞放置在27 ℃恒温培养。培养8?12 h后,再将无抗培养基替换成含有10%胎牛血清的完全培养基,继续培养48 h后即可进行下一步处理。
1.4 荧光定量PCR (qRT-PCR) 家蚕组织和BmN-SWU1细胞总RNA使用TRIzol Reagent (Invitrogen)提取,使用反转录试剂盒(Promega)合成cDNA,操作按说明书进行,保存于–20 ℃备用。本研究按照以下体系混合:5 μL iTaqTM Universal SYBR? Green Supermix (Bio-Rad)定量试剂,5 μL dH2O,0.2 μL Primer F/R,1 μL cDNA模板,混匀后加入孔中,即每个反应重复3次。将分装好的反应产物连同定量PCR板4 ℃、3000×g离心3 min后,放置在定量PCR仪中,反应程序为:95 ℃ 10 min;95 ℃ 5 s,60 ℃ 30 s,循环40次,65 ℃以0.5 ℃每5 s梯度增长至95 ℃。以家蚕真核翻译起始因子4A (探针号:sw22934)为内参基因,相对定量PCR的数据处理用2–△CT法。本研究所用引物见表 1。
病毒DNA拷贝数分析采用绝对定量方法,病毒感染细胞样品利用Wizard? Genomic DNA Purification Kit (Promega)试剂盒提取细胞总DNA,具体方法参照试剂盒说明书。以病毒基因GP41作为定量引物,提取的病毒基因组DNA作为模板,采用上述定量PCR体系和条件进行绝对定量检测,根据本研究建立的标准曲线计算病毒基因组拷贝数[5]。
1.5 Western blotting 转染相应的过表达载体到BmN-SWU1细胞48 h后,分别感染BmNPV不同时间后收集细胞。加入100 μL的IP裂解液(含蛋白酶抑制剂PMSF),冰上或4 ℃裂解30 min,14000×g离心10 min后去上清,加入20 μL的5×SDS上样缓冲液,沸水煮沸10 min,室温14000×g离心10 min后Western blotting分析。转移样品到PVDF膜上,5%的脱脂奶粉封闭1 h,一抗分别用α-VP39和α-Tubulin孵育1 h,用TBST洗脱5 min×6次,二抗用相应来源的抗体孵育1 h,用TBST洗脱5 min×6次;将配好的ECL显色液均匀滴在PVDF膜上,避光显色约5 min;在Bio-Rad化学发光成像仪上成像分析。
1.6 流式细胞分析 将感染BmNPV后不同时间的细胞用移液器轻轻吹下,静置在冰上待用;先用流式细胞清洗液清洗仪器管道2 min,然后排尽清洗液,用流式细胞鞘液润洗管道5 min;设置流式细胞仪程序按相同设置程序进样并分析,清洗仪器,并排尽洗液。
2 结果和分析 2.1 Bmant基因表达特征鉴定 为了鉴定家蚕Bmant基因的功能特征,本研究首先通过SMART软件(http://smart.embl-heidelberg.de/smart/save_user_preferences.pl)预测了该蛋白的结构域特征,分析结果显示BmANT蛋白包含3个线粒体载体结构域,定位在线粒体内(图 1-A)。这一结果和先前线粒体共定位结果一致,表明BmANT是一个线粒体蛋白。先前已经证明BmANT能够在BmNPV感染过程和BmHSP60相互作用,本研究为了确定Bmant基因调控Bmhsp60基因的具体作用机制,我们首先分析了Bmant基因在BmN-SWU1细胞感染BmNPV后的转录水平变化。结果显示Bmant基因在BmNPV感染后6 h开始下调表达,一致持续到72 h都维持在一个较低的表达水平,说明BmNPV侵染后能够显著抑制Bmant基因的转录(图 1-B)。
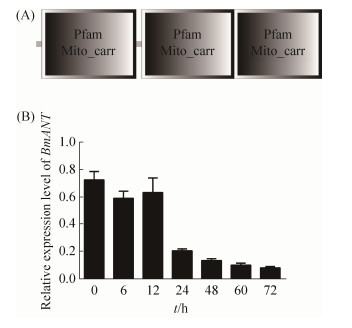 |
| 图 1 Bmant基因表达特征鉴定 Figure 1 The expression characterization of Bmant gene. A: Illustrative diagram of BmANT structure prediction; B: Analysis of Bmant gene expression characteristics after BmNPV infection |
| 图选项 |
2.2 BmANT抑制病毒增殖复制 为了进一步分析Bmant基因对BmNPV增殖复制的影响,本研究首先在家蚕BmN-SWU1细胞中过表达Bmant基因,定量PCR结果显示过表达Bmant基因的细胞,Bmant基因显著上调表达(图 2-A)。感染BmNPV 0、12、24、48 h后,提取不同处理样品的DNA绝对定量,BmNPV DNA拷贝数分析显示过表达Bmant基因的细胞,在不同的感染时间点均具有明显的抑制作用(图 2-B)。为了进一步分析说明BmANT蛋白对BmNPV的抑制作用,我们提取了不同时间点的蛋白样品,Western blotting分析结果显示,过表达Bmant基因后BmNPV蛋白表达明显受到抑制,在感染48 hours post-infection (h p.i.)才能检测到大量VP39蛋白表达,而对照组在24 h p.i.就能检测到大量VP39蛋白表达(图 2-C)。以上结果表明Bmant基因是一个抗病毒因子,能够显著抑制病毒的增殖。
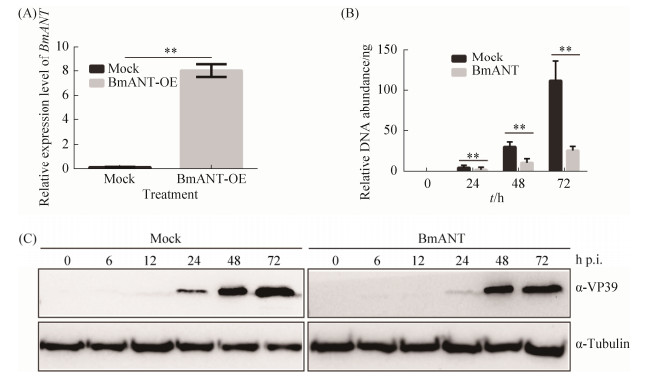 |
| 图 2 Bmant基因抑制病毒增殖复制 Figure 2 Bmant gene inhibits viral proliferation replication. A: Overexpression analysis of Bmant gene; B: Antiviral analysis of BmANT by BmNPV DNA replication abundance. Statistically significant differences: **: P < 0.01; C: Antiviral analysis of BmANT by Western blotting |
| 图选项 |
2.3 BmANT和BmHSP60互为拮抗作用 先前本研究小组已经证明杆状病毒LEF-11能够挟持宿主细胞ATPase家族BmATAD3A和BmHSP60促进自身增殖复制;同时,我们进一步通过免疫共沉淀和质谱数据分析鉴定了BmHSP60能够在BmNPV感染过程中和BmANT相互作用[5]。为了鉴定BmANT和BmHSP60相互作用调控BmNPV作用的机制,本研究进一步分析了Bmant和Bmhsp60基因相互调控关系,过表达Bmant基因后检测Bmhsp60基因的转录水平变化,结果显示过表达Bmant基因后能够显著抑制Bmhsp60基因的表达(图 3-A)。同时我们分析了过表达Bmhsp60基因对Bmant基因转录水平的影响,结果显示过表达Bmhsp60基因也能够显著抑制Bmant基因的表达(图 3-B)。以上结果表明Bmant和Bmhsp60基因能够相互抑制对方基因表达,具有相互拮抗的关系。
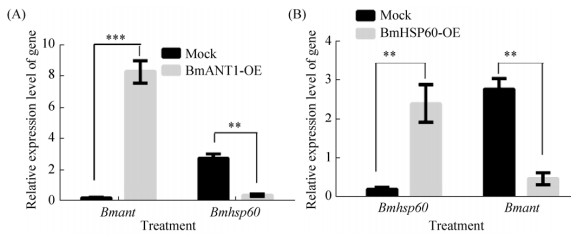 |
| 图 3 Bmant和Bmhsp60基因转录调控分析 Figure 3 Transcriptional regulation analysis of Bmant and Bmhsp60 gene. A: The transcriptional regulation analysis of Bmhsp60 by Bmant gene; B: The transcriptional regulation analysis of Bmhsp60 by Bmant gene. Statistically significant differences: **:P < 0.01 |
| 图选项 |
2.4 BmANT抑制BmHSP60对BmNPV增殖复制的促进作用 先前研究表明BmHSP60能够促进病毒增殖复制[5],BmANT抑制病毒增殖复制,既然Bmant和Bmhsp60基因具有相互拮抗的关系,那么该基因相互拮抗调控BmNPV作用又是如何呢?为了验证Bmant和Bmhsp60基因共同对BmNPV的作用,本研究进一步分析了共同转染后对BmNPV增殖复制的影响。流式细胞术分析显示,单独过表达Bmant基因能够抑制BmNPV的增殖,感染48 h后,BmNPV感染率从24.68%降低到19.09%;而单独过表达Bmhsp60基因能够促进病毒增殖,感染48 h后,BmNPV感染率从24.68%提高到27.07%;共同转染后,BmNPV感染率从24.68%降低到20.57%,整体水平抑制了BmNPV增殖复制(图 4-A)。EGFP阳性细胞数统计结果显示在不同的感染时间点均具有显著性差异(图 4-B)。
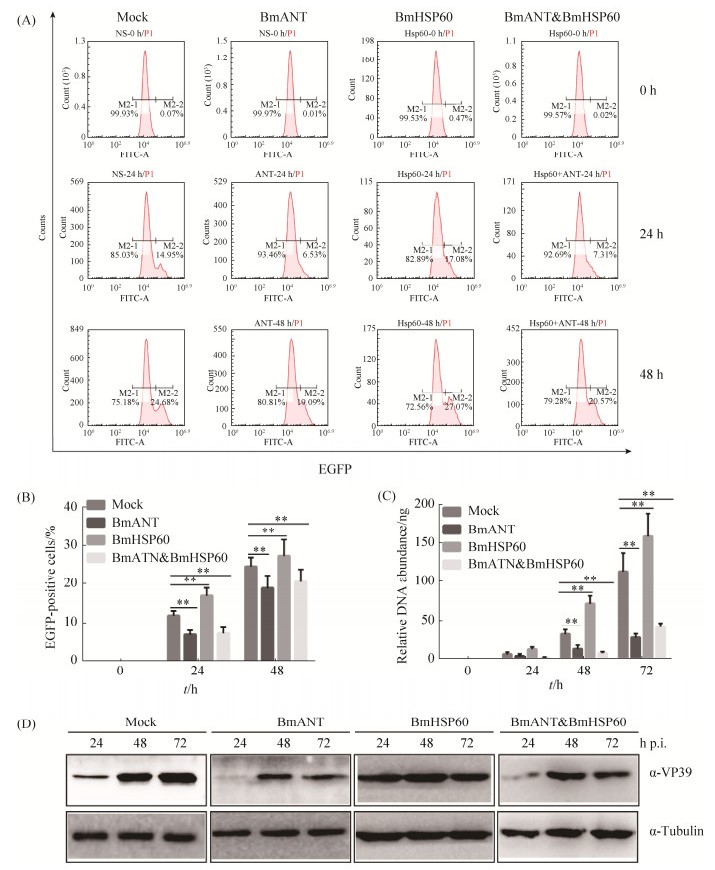 |
| 图 4 BmANT抑制BmHSP60的功能 Figure 4 BmANT inhibits the function of BmHSP60. A: Flow cytometry analysis of Bmant, Bmhsp60 gene and co-overexpression on viral replication; B: Statistical analysis of flow cytometry analysis; C: DNA replication analysis of Bmant, Bmhsp60 gene and co-overexpression on viral replication: D: Western blotting analysis of Bmant, Bmhsp60 gene and co-overexpression on viral replication. Statistically significant differences. **: P < 0.01 |
| 图选项 |
进一步我们通过BmNPV DNA拷贝数和Western blotting分析Bmant和Bmhsp60基因同时过表达对BmNPV增殖复制的作用。病毒DNA分析结果显示BmANT抑制BmHSP60对BmNPV的促进作用,在Bmant基因过表达的细胞中Bmhsp60基因基本不能影响病毒增殖复制(图 4-C)。Western blotting分析显示BmANT抑制BmHSP60对病毒的促进作用,共同过表达后VP39蛋白表达量相比对照明显受到抑制(图 4-D)。结合上述结果,表明Bmant基因能够抑制Bmhsp60基因转录,进而抑制BmNPV增殖复制;而Bmhsp60基因能够负反馈抑制Bmant基因转录,但是通过负反馈调控对病毒增殖影响较小。
3 讨论 BmNPV是对家蚕危害最为严重的病原之一,而杆状病毒和宿主细胞相互作用机制的解析,为家蚕抗病毒基础研究提供了重要的理论支撑[15-16]。目前,杆状病毒和宿主相互作用研究主要包括杆状病毒诱导宿主细胞DNA损伤应答、宿主细胞周期阻滞、关闭宿主蛋白合成、调控宿主细胞信号通路以及诱导宿主细胞细胞凋亡等方式,利用宿主细胞器官和组织为自身增殖复制服务[15, 17-20]。杆状病毒劫持宿主细胞能量代谢促进自身增殖研究还相对较少,本研究通过鉴定宿主能量代谢因子BmHSP60和其相互作用蛋白BmANT调控BmNPV增殖作用机制,鉴定了能够抑制BmNPV增殖复制的蛋白,为进一步解析杆状病毒劫持能量代谢提供了支撑。
ANT是氧化磷酸化途径的一个组成部分,它催化线粒体ATP在线粒体内膜上的细胞质ADP交换[7]。参与通透性转换孔复合物(permeability transition pore complex,PTPC)的形成,释放线粒体产物,从而触发细胞凋亡[21]。先前研究表明,杆状病毒IE-2蛋白能够和BmANT相互作用,结合本研究证明BmANT能够抑制BmNPV增殖复制(图 2),我们推测BmANT在BmNPV感染过程和宿主发生了相互博弈[22]。研究表明PRRSV E蛋白与ANT相互作用能够激活caspase-3诱导细胞凋亡,从而导致PARP分裂,从而导致ATP的产生显著减少[22]。结合BmANT和BmHSP60均为线粒体蛋白,我们推测BmNPV引起宿主Bmant表达下调(图 1-B),可能是防止细胞过早凋亡,因为细胞凋亡是机体应对外界刺激、阻止病原入侵的常用手段之一,在很多物种尤其是昆虫等缺乏获得性免疫的生物中,凋亡被认为是先天免疫机制的重要组成部分[23-24]。先前已经证明杆状病毒LEF-11能够劫持宿主细胞BmATAD3A和BmHSP60促进病毒增殖复制,而BmHSP60进一步能够和BmANT相互作用并调控其表达,因此杆状病毒LEF-11和BmANT蛋白是否具有直接的相互作用关系将是进一步解析杆状病毒调控ATP转运机制的关键[5]。
HSP60作为宿主相应机制的重要分子,在病原微生物如埃博拉病毒、登革热病毒、沙雷氏菌等感染宿主后,参与了对病原的应答反应[25]。先前研究表明Bmhsp60在BmNPV感染后迅速上调表达,并证明了BmHSP60能够促进BmNPV的增殖,结合本研究发现Bmhsp60和Bmant基因在宿主应对BmNPV感染时具有相反的表达模式,并且该蛋白BmHSP60对病毒增殖的影响也是相反的(图 3和4),BmHSP60和BmANT可能共同调控病毒增殖复制[5]。先前研究表明HIV RP蛋白能够诱导线粒体凋亡,介导线粒体蛋白ANT剪切,释放HSP60蛋白,进而抑制病毒增殖[26]。结合本研究同时过表达Bmant和Bmhsp60基因能够减弱Bmhsp60基因促进病毒增殖的能力,我们推测Bmhsp60基因可能受Bmant基因调控(图 4)[25]。BmANT能够和VDAC等线粒体内膜蛋白一起,构成线粒体内膜膜孔复合物的主体结构,调控宿主细胞ADP/ATP转运的功能,进而调控线粒体呼吸作用中电子链的传递和氧化磷酸化,而本研究表达BmANT,导致细胞内ANT过量积累,导致ATP/ADP转运紊乱,进而能够抑制BmNPV增殖复制[27-28]。
本研究结果表明,BmANT是一个线粒体载体蛋白,具有抗病毒作用,可应用于后期家蚕转基因抗病毒研究;家蚕Bmant和Bmhsp60基因具有相互拮抗调控作用,BmHSP60和BmANT共同作用能够抑制BmNPV的增殖复制。
References
| [1] | The International Silkworm Genome Consortium. The genome of a lepidopteran model insect, the silkworm Bombyx mori. Insect Biochemistry and Molecular Biology, 2008, 38(12): 1036-1045. DOI:10.1016/j.ibmb.2008.11.004 |
| [2] | Dong Z, Hu Z, Qin Q, Dong F, Huang L, Long J, Chen P, Lu C, Pan M. CRISPR/Cas9-mediated disruption of the Immediate early-0 and 2 as a therapeutic approach to Bombyx mori nucleopolyhedrovirus in transgenic silkworm. Insect Molecular Biology, 2019, 28(1): 112-122. DOI:10.1111/imb.12529 |
| [3] | Mikhailov VS. Replication of the baculovirus genome. Molecular Biology(Mosk), 2003, 37(2): 250-259. |
| [4] | Nguyen Q, Nielsen LK, Reid S. Genome scale transcriptomics of baculovirus-insect interactions. Viruses, 2013, 5(11): 2721-2747. DOI:10.3390/v5112721 |
| [5] | Dong ZQ, Hu N, Dong FF, Chen TT, Jiang YM, Chen P, Lu C, Pan MH. Baculovirus LEF-11 hijack host ATPase ATAD3A to promote virus multiplication in Bombyx mori cells. Scientific Reports, 2017, 7: 46187. DOI:10.1038/srep46187 |
| [6] | Dong ZQ, Hu N, Zhang J, Chen TT, Cao MY, Li HQ, Lei XJ, Chen P, Lu C, Pan MH. Oligomerization of baculovirus LEF-11 is involved in viral DNA replication. PLoS One, 2015, 10(12): e0144930. DOI:10.1371/journal.pone.0144930 |
| [7] | Louvi A, Tsitilou SG. A cDNA clone encoding the ADP/ATP translocase of Drosophila melanogaster shows a high degree of similarity with the mammalian ADP/ATP translocases. Journal of Molecular Evolution, 1992, 35(1): 44-50. |
| [8] | Sugahara R, Jouraku A, Nakakura T, Kusakabe T, Yamamoto T, Shinohara Y, Miyoshi H, Shiotsuki T. Two adenine nucleotide translocase paralogues involved in cell proliferation and spermatogenesis in the silkworm Bombyx mori. PLoS One, 2015, 10(3): e0119429. DOI:10.1371/journal.pone.0119429 |
| [9] | Pujhari S, Zakhartchouk AN. Porcine reproductive and respiratory syndrome virus envelope (E) protein interacts with mitochondrial proteins and induces apoptosis. Archives of Virology, 2016, 161(7): 1821-1830. DOI:10.1007/s00705-016-2845-4 |
| [10] | Sabbah EN, Druillennec S, Morellet N, Bouaziz S, Kroemer G, Roques BP. Interaction between the HIV-1 protein Vpr and the adenine nucleotide translocator. Chemical Biology & Drug Design, 2006, 67(2): 145-154. |
| [11] | Dampier W, Nonnemacher MR, Sullivan NT, Jacobson JM, Wigdahl B. HIV excision utilizing CRISPR/Cas9 technology: attacking the proviral quasispecies in reservoirs to achieve a cure. MOJ Immunology, 2014, 1(4): 00022. |
| [12] | Guo X, Huang YJ, Qi Y, Liu ZY, Ma YP, Shao YZ, Jiang SJ, Sun ZR, Ruan Q. Human cytomegalovirus miR-UL36-5p inhibits apoptosis via downregulation of adenine nucleotide translocator 3 in cultured cells. Archives of Virology, 2015, 160(10): 2483-2490. DOI:10.1007/s00705-015-2498-8 |
| [13] | Pan MH, Cai XJ, Liu M, Lv J, Tang H, Tan J, Lu C. Establishment and characterization of an ovarian cell line of the silkworm, Bombyx mori. Tissue and Cell, 2010, 42(1): 42-46. DOI:10.1016/j.tice.2009.07.002 |
| [14] | Zhang J, He Q, Zhang CD, Chen XY, Chen XM, Dong ZQ, Li N, Kuang XX, Cao MY, Lu C, Pan MH. Inhibition of BmNPV replication in silkworm cells using inducible and regulated artificial microRNA precursors targeting the essential viral gene lef-11. Antiviral Research, 2014, 104: 143-152. DOI:10.1016/j.antiviral.2014.01.017 |
| [15] | Monteiro F, Carinhas N, Carrondo MJT, Bernal V, Alves PM. Toward system-level understanding of baculovirus-host cell interactions: from molecular fundamental studies to large-scale proteomics approaches. Frontiers in Microbiology, 2012, 3: 391. |
| [16] | Wang F, Zhang CX, Shyam Kumar V, Wu XF. Influences of chitinase gene deletion from BmNPV on the cell lysis and host liquefaction. Archives of Virology, 2005, 150(5): 981-990. DOI:10.1007/s00705-004-0458-9 |
| [17] | Deng ZH, Huang ZH, Yuan MJ, Yang K, Pang Y. Baculovirus induces host cell aggregation via a Rho/Rok-dependent mechanism. Journal of General Virology, 2014, 95(10): 2310-2320. |
| [18] | Byers NM, Vandergaast RL, Friesen PD. Baculovirus inhibitor-of-apoptosis Op-IAP3 blocks apoptosis by interaction with and stabilization of a host insect cellular IAP. Journal of Virology, 2015, 90(1): 533-544. |
| [19] | Mitchell JK, Byers NM, Friesen PD. Baculovirus F-box protein LEF-7 modifies the host DNA damage response to enhance virus multiplication. Journal of Virology, 2013, 87(23): 12592-12599. DOI:10.1128/JVI.02501-13 |
| [20] | Wang L, Xiao Q, Zhou XL, Zhu Y, Dong ZQ, Chen P, Pan MH, Lu C. Bombyx mori Nuclear polyhedrosis virus (BmNPV) induces host cell autophagy to benefit infection. Viruses, 2018, 10(1): 14. |
| [21] | Andersen JL, DeHart JL, Zimmerman ES, Ardon O, Kim B, Jacquot G, Benichou S, Planelles V. HIV-1 Vpr-induced apoptosis is cell cycle dependent and requires Bax but not ANT. PLoS Pathogens, 2006, 2(12): e127. DOI:10.1371/journal.ppat.0020127 |
| [22] | Wu YJ, Wu Y, Wu Y, Tang H, Wu HL, Zhang GZ, Wang WB. Screening of candidate proteins interacting with IE-2 of Bombyx mori nucleopolyhedrovirus. Molecular Biology Reports, 2013, 40(10): 5797-5804. DOI:10.1007/s11033-013-2683-3 |
| [23] | Ikeda M, Yamada H, Ito H, Kobayashi M. Baculovirus IAP1 induces caspase-dependent apoptosis in insect cells. Journal of General Virology, 2011, 92(11): 2654-2663. DOI:10.1099/vir.0.033332-0 |
| [24] | Clarke TE, Clem RJ. Insect defenses against virus infection: the role of apoptosis. International Reviews of Immunology, 2003, 22(5/6): 401-424. |
| [25] | Song EB, Tang S, Xu J, Yin B, Bao ED, Hartung J. Lenti-siRNA Hsp60 promote bax in mitochondria and induces apoptosis during heat stress. Biochemical and Biophysical Research Communications, 2016, 481(1/2): 125-131. |
| [26] | Rumlová M, K?í?ová I, Keprová A, Hadravová R, Dole?al M, Strohalmová K, Pichová I, Hájek M, Ruml T. HIV-1 protease-induced apoptosis. Retrovirology, 2014, 11: 37. DOI:10.1186/1742-4690-11-37 |
| [27] | Brenner C, Lemoine A. Mitochondrial proteins (e.g., VDAC, Bcl-2, HK, ANT) as major control points in oncology. Frontiers in Oncology, 2014, 4: 365. |
| [28] | Kumarswamy R, Chandna S. Putative partners in Bax mediated cytochrome-c release: ANT, CypD, VDAC or none of them?. Mitochondrion, 2009, 9(1): 1-8. |
