周婷婷1

 , 高梦茹2, 杜梦繁2, 于凡1, 冯磊1
, 高梦茹2, 杜梦繁2, 于凡1, 冯磊1 1. 江南大学无锡医学院, 江苏 无锡 214122;
2. 江南大学药学院, 江苏 无锡 214122
收稿日期:2018-06-03;修回日期:2018-08-16;网络出版日期:2018-09-01
基金项目:中央高校基本科研业务费专项资金(JUSRP11863);国家自然科学基金(81800430)
*通信作者:周婷婷, Tel/Fax:+86-510-85914599, E-mail:tingtingchou@126.com.
摘要:[目的] 圣路易斯脑炎病毒(St.Louis encephalitis virus,SLEV)属于黄病毒科,是一种单股正链RNA病毒。黄病毒编码的非结构蛋白NS3在病毒复制以及多聚蛋白加工过程中起着重要作用,NS2B是其发挥作用的重要辅助因子。因此,NS2B-NS3蛋白酶复合物是抗病毒药物的重要靶标。本研究旨在构建SLEV NS2B-NS3蛋白酶的原核表达系统并建立其抑制剂的高通量筛选方法,从而发现其小分子抑制剂。[方法] 通过PCR扩增SLEV NS2B-NS3蛋白的编码区,构建原核表达质粒;在大肠杆菌BL21(DE3)中,经异丙基硫代半乳糖苷(Isopropyl β-D-thiogalactoside)诱导得到可溶性的NS2B-NS3蛋白,并用镍亲和层析方法进行纯化;基于荧光共振能量转移(Fluorescence resonance energy transfer)技术检测NS2B-NS3蛋白酶活性,建立其抑制剂的高通量筛选平台。[结果] SLEV NS2B-NS3蛋白酶纯化程度高达95%以上,基于酶活测定的抑制剂筛选平台准确可行。对700多个上市药物进行筛选后,发现原花青素对SLEV NS2B-NS3蛋白酶具有明显的抑制活性。[结论] 本研究为SLEV NS2B-NS3蛋白酶抑制剂提供了一种操作方便、高通量的筛选方法,并首次发现了原花青素具有抑制SLEV NS2B-NS3蛋白酶活性的功能,可以作为治疗SLEV感染的潜在靶向药物。
关键词:圣路易斯脑炎病毒NS2B-NS3蛋白酶丝氨酸蛋白酶活性抑制剂筛选
Expression and inhibitors screening of St. Louis encephalitis virus NS2B-NS3 protease
Tingting Zhou1

 , Mengru Gao2, Mengfan Du2, Fan Yu1, Lei Feng1
, Mengru Gao2, Mengfan Du2, Fan Yu1, Lei Feng1 1. Wuxi School of Medicine, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu Province, China
*Corresponding author: Tingting Zhou, Tel/Fax: +86-510-85914599, Tel:+86-431-89165602; E-mail: tingtingchou@126.com.
Foundation item: Supported by the Fundamental Research Funds for the Central Universities (JUSRP11863) and by the National Natural Science Foundation of China (81800430)
Abstract: [Objective] St. Louis encephalitis virus (SLEV) is a single-stranded and positive-sense RNA virus, belonging to the Flaviviridae family. Non-structural protein 3 (NS3) encoded by flaviviruses plays an important role in virus replication and polyprotein precursor modification. NS2B is an essential element that acts as a co-factor to enhance the activity of NS3. Therefore, the NS2B-NS3 protease is considered as a crucial target for anti-flavivirus drug development. In the current study, we constructed recombinant plasmid of SLEV NS2B-NS3 protease, and expressed and purified the protein to screen inhibitors. [Methods] We obtained the NS2B-NS3 recombinant gene by PCR and subcloned the prokaryotic recombinant expression plasmid. The NS2B-NS3 protease was expressed in soluble form induced by isopropyl β-D-1-thiogalactopyranoside in Escherichia coli BL21(DE3). The fusion protein was purified with Ni+-NTA affinity column. Then the serine protease activity was determined by a fluorescence resonance energy transfer assay and the screening platform for inhibitors was constructed. [Results] The purity NS2B-NS3 protease was up to 95%. After screening for 700 old drugs, we found that procyanidine efficiently inhibited the enzymatic activity of the NS2B-NS3 protease. [Conclusion] Our current study provided a convenient and high-throughput method for screening of SLEV NS2B-NS3 protease inhibitors. Porcyanidine has been found to inhibit the activity of SLEV NS2B-NS3 protease for the first time, and might become a potential drug to treat SLEV infection.
Keywords: St. Louis encephalitis virus (SLEV)NS2B-NS3 proteaseserine protease enzymatic activityinhibitorscreen
圣路易斯脑炎病毒(St. Louis encephalitis virus,SLEV)属于蚊虫、禽类传播的黄病毒属B组,其基因组为单股正链RNA,与日本脑炎病毒(Japanese encephalitis virus,JEV)和西尼罗河脑炎病毒(West nile virus,WNV)高度相似[1]。该病毒颗粒直径大小为40–50 nm,有表面突起的囊膜和浓集的核心,可在pH 6.0–7.9凝集禽类的红细胞,可导致人畜共患中枢神经系统的感染性疾病。SLEV于1933年在美国被首次发现,该病毒流行于北美洲,主要在密西西比河和俄亥俄河流域以及加利福尼亚、佛罗里达、得克萨斯等地,能够侵袭人中枢神经系统,引发急性脑炎发热[2-3]。有统计显示在美国临床感染病例中每300例患者就有一例为该病毒引起,致死率约为8%,高龄是该病致死的高危因素[4]。虽然由该病毒所致的脑炎主要在美国流行,但是随着气候变暖、人口快速增长与流动,该病毒传入我国的风险不容忽视。对于圣路易斯脑炎的治疗,目前临床上也没有SLEV的特异性治疗药物和疫苗接种,其治疗还是以对症治疗为主。因此,寻找抗该病毒的特异性药物具有重要意义。
SLEV病毒在宿主细胞的细胞质中进行RNA的复制和蛋白质的合成,不影响宿主的新陈代谢。如同其他黄病毒一样,该病毒基因组包含约11 kb的单链RNA,共编码3个结构蛋白分别为C蛋白(核心壳蛋白)、M蛋白(膜蛋白)和E蛋白(包膜蛋白),7个非结构蛋白分别为NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5[5]。NS3在病毒的复制及病毒与细胞的相互作用中扮演着十分重要的角色,它具有丝氨酸蛋白酶、核苷三磷酸酶(Nucleoside triphosphatase,NTPase)、RNA解旋酶活性,主要负责RNA的自我复制以及对病毒的多聚蛋白进行剪切和修饰[6-7]。
为了抑制黄病毒的感染,寻找抑制病毒复制周期的关键酶活性的化合物是一种有效的研究策略。NS3的N端180个氨基酸含有丝氨酸蛋白酶(催化三联体H、D和S)的保守结构域,但作为辅因子的NS2B的中央亲水结构域是NS3发挥催化活性不可缺少的部分[8-9]。NS2B-NS3在多聚体蛋白中的酶切位点主要有NS2A/NS2B、NS2B/NS3、NS3/NS4A、NS4B/NS5的连接位点,以及NS4A、NS3、NS2A和C蛋白内的酶切位点[10]。因此,抑制NS2B-NS3的丝氨酸蛋白酶活性已成为抗病毒研究的重要方向,是近年来抗病毒治疗研究的关键靶标[11]。通过抑制NS2B-NS3的丝氨酸蛋白酶活性有可能成为潜在的治疗SLEV感染的方法。体外研究表明针对其他黄病毒如登革脑炎病毒和WNV,越来越多的NS2B-NS3蛋白酶抑制剂能够发挥抗病毒作用,但是,目前还没有SLEV的NS2B-NS3蛋白酶小分子抑制剂被报道[12]。本研究针对SLEV的非结构NS2B-NS3蛋白酶进行了原核系统的表达与纯化,首次建立了高通量的抑制剂筛选平台,并发现老药原花青素是其小分子抑制剂。
1 材料和方法 1.1 实验材料 DH5α、E. coli BL21及pET22b质粒载体均由本实验室保存。质粒提取、琼脂糖凝胶、DNA回收试剂盒均购自天根公司;高保真酶PrimeSTAR、限制性内切酶EcoR I/Xho I/Nde I、T4 DNA连接酶均购自NEB公司;NTA His·Bind树脂购自GE公司;荧光底物Bz-Nle-Lys-Arg-Arg-AMC (Bz-Nle- KRR-AMC)购自吉尔生化有限公司;抑肽酶(Aprotinin)购自Sigma公司;异丙基硫代半乳糖苷(Isopropyl β-D-thiogalactoside,IPTG)、氨苄青霉素购于上海生工有限公司。PCR仪、水平电泳仪及凝胶成像仪购自伯乐公司,全波长多功能酶标仪(SpectraMax M5)购自美谷生物公司,FPLC购自AKTA公司。
1.2 SLEV NS2B-NS3蛋白酶重组质粒的构建及鉴定 根据SLEV的基因组序列(GenBank序列号为JF460774.1),合成从第4023位到5114位基因片段,分别设计引物(引物序列见表 1)将含有中央亲水结构的NS2B片段(47个氨基酸)和含有蛋白酶活性的NS3 N端(179个氨基酸)片段扩增后,通过EcoR I连接后,形成NS2B-EF-NS3基因序列,再与双酶切后的pET22b载体16℃连接,形成重组质粒(示意图如图 1)。连接产物转化DH5α感受态细胞,转化产物经上海生工公司测序鉴定。
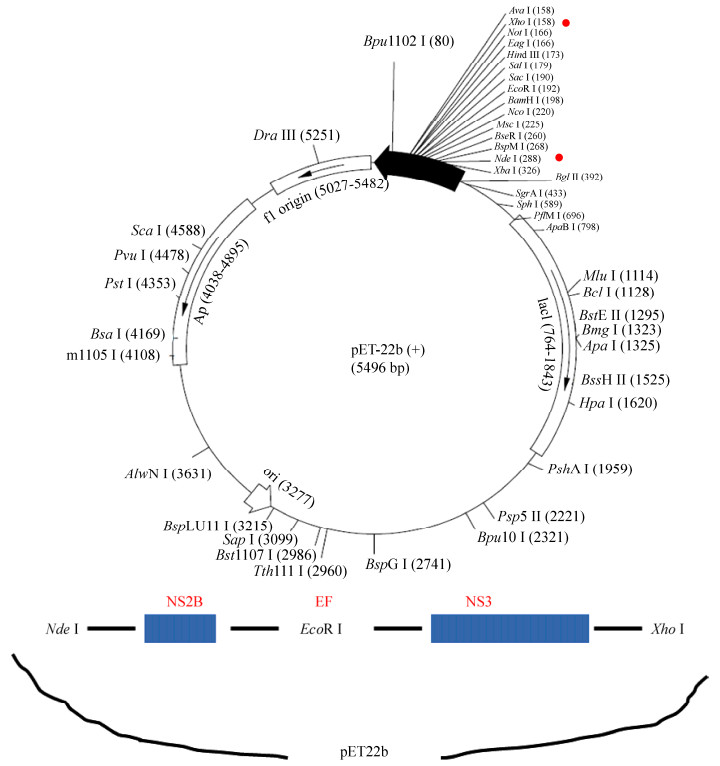 |
| 图 1 重组质粒构建示意图 Figure 1 The schematic diagram of construction for recombinant plasmid SLEV pET22b-NS2B-NS3 protease. |
| 图选项 |
表 1. PCR引物序列 Table 1. Primers used in this study
| Primer name | Primer Sequences (5'→3') | Endonuclease |
| NS2B-F | ACGTTCACATATGGCAGA AATGTGGATTGAGAAAGC | Nde I |
| NS2B-R | TTTGAATTCGTGCACTGGA GCTCCAGG | EcoR I |
| NS3-F | AGAGAATTCGGAAAACAC TCGAAGCGAG | EcoR I |
| NS3-R | CATCTCGAGCTCTTCTGTC CTTTCCCCTTGG | Xho I |
表选项
1.3 SLEV NS2B-NS3蛋白酶的表达与纯化 取测序正确的重组质粒转化E. coli BL21 (DE3)感受态细胞,接种于LB液体培养基(含有100 μg/mL的氨苄青霉素)中,待生长到对数期以后(OD600约为1.2),加入终浓度为0.2 mmol/L的IPTG,诱导表达20 h (16 ℃恒温、210 r/min)。诱导后离心收集菌体,倒去培养基,用裂解液(50 mmol/L HEPES,0.3 mol/L NaCl,5%甘油,pH 7.5)重悬菌体,再一次离心,除去上清,沉淀冻存于–80 ℃冰箱。取出细菌沉淀,加裂解液振荡重悬,冰上超声破碎细胞,离心收集上清和沉淀作SDS-PAGE分析,裂解液上清采用Ni+-NTA亲和层析技术纯化、透析,经FPLC分子筛细纯化、浓缩后,紫外分光光度计下测定蛋白浓度。
1.4 SLEV NS2B-NS3蛋白酶的丝氨酸蛋白酶活性检测 设计一段多肽(Bz-Nle-KRR-AMC,N端标记荧光基团,C端标记淬灭基团)能够被NS3蛋白酶识别并酶切,根据荧光共振能量转移的原理建立蛋白酶活性的测定方法。该多肽完整时荧光被淬灭,加入NS2B-NS3蛋白酶后,多肽被切割,荧光基团和淬灭基团分离,从而可检测到荧光(AMC具有荧光值:激发光380 nm,发射光460 nm)。基于上述的反应原理,我们采用100 μL的反应体系:缓冲液(50 mmol/L Tris-HCl,0.1 mol/L NaCl,5%甘油,pH 9.0)和NS2B-NS3蛋白酶(终浓度0.1、0.2、0.4 μmol/L)。在37 ℃孵育30 min后,加入10 μL的Bz-Nle-KRR-AMC (终浓度100 μmol/L)启动反应。立即在酶标仪中检测荧光值变化,连续测值15 min,取酶反应曲线的斜率为反应初速度来表征NS2B-NS3的丝氨酸蛋白酶活性。
1.5 SLEV NS2B-NS3的丝氨酸蛋白酶抑制剂筛选平台的建立 将待筛选化合物用DMSO溶解成2 mmol/L母液备用,使用上述100 μL的酶反应体系:缓冲液88 μL,NS2B-NS3 1 Μl (终浓度0.4 μmol/L),化合物母液(终浓度20 μmol/L)或DMSO 1 μL。化合物与NS2B-NS3蛋白酶在37 ℃孵育30 min后,加入10 μL Bz-Nle-KRR-AMC (终浓度100 μmol/L)启动反应,迅速在酶标仪中测定NS2B-NS3蛋白酶的活性。在用96孔黑色酶标板进行高通量筛选时,使用广谱的丝氨酸蛋白酶抑制剂Aprotinin作为阳性化合物(终浓度为1 μmol/L)。抑制率按照公式(1)计算。
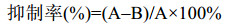 | 公式(1) |
2 结果和分析 2.1 重组质粒SLEV NS2B-NS3的构建及鉴定 将NS2B片段(47个氨基酸,141 bp)和NS3 N端(179个氨基酸,537 bp)片段扩增,DNA凝胶电泳检测,片段大小基本相符(图 2-A)。然后通过T4 DNA连接酶连接,形成NS2B-EF-NS3基因序列,再进一步扩增(684 bp,图 2-B)。与pET22b质粒载体双酶切(Nde I/Xho I)后16 ℃连接过夜,连接产物转化DH5α感受态细胞。转化产物重组质粒经过上海生工公司测序鉴定,与GenBank数据库的参考序列一致。抽取重组质粒转化到BL21(DE3)宿主菌,–80 ℃保存菌种备用。
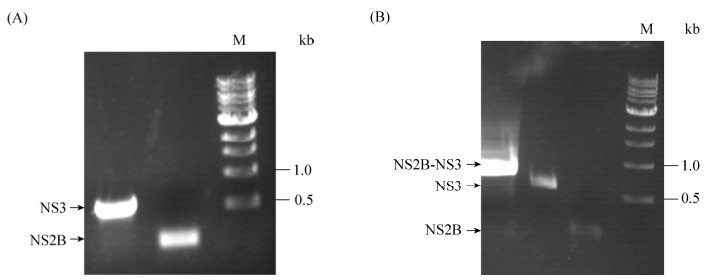 |
| 图 2 重组质粒SLEV NS2B-NS3的构建 Figure 2 Construction of recombinant plasmid SLEV NS2B-NS3 protease. The PCR assay of NS2B/NS3 (A) and NS2B-NS3 (B). M: marker. |
| 图选项 |
2.2 SLEV NS2B-NS3蛋白酶的表达与纯化 将含有质粒SLEV NS2B-NS3的BL21(DE3)均匀涂布在带有抗性(100 mg/mL的氨苄青霉素)的LB培养基固体平板上,37 ℃倒置培养过夜。次日从平板上挑取单克隆至10 mL的带有氨苄抗性的LB液体培养基中,37 ℃、210 r/min条件下培养过夜后,转入1 L含有抗性的LB液体培养基中,在相同条件下培养至OD600为1.2左右时,加入IPTG (终浓度为0.2 mmol/L),在16 ℃、210 r/min的条件下诱导20 h。4000 r/min、30 min、4 ℃离心收集菌体,倒去培养基,用裂解液(50 mmol/L HEPES,0.3 mol/L NaCl,5%甘油,pH 7.5)重悬菌体,再次离心,除去上清,冻存于–80 ℃。初步裂解菌体行SDS-PAGE发现,SLEV NS2B-NS3蛋白酶被IPTG诱导后,表达量明显增加,菌体裂解液上清中也具有高表达(图 3-A)。将冻存于–80 ℃的菌体取出,加入15 mL裂解液,充分悬浮后置于冰上进行超声破碎30 min至菌液变澄清状。13000 r/min、4 ℃离心30 min,收集破碎后的上清。将上清倒入用裂解液平衡过的2–3 mL Ni+-NTA树脂中,混匀,在4 ℃结合2 h (期间每隔15 min上下混匀1次),将上清液缓慢流出。然后依次用5倍柱体积的洗涤缓冲液(20 mmol/L、50 mmol/L、100 mmol/L咪唑,0.3 mol/L NaCl,20 mmol/L Tris-HCl,pH 7.5)梯度洗柱,最后用洗脱缓冲液(200 mmol/L咪唑,0.3 mol/L NaCl,50 mmol/L HEPES,pH 8.0)洗脱下目的蛋白NS2B-NS3蛋白酶,进行SDS-PAGE鉴定纯度大于95% (图 3-B)。
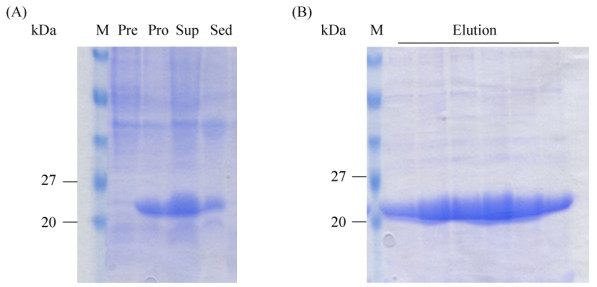 |
| 图 3 SLEV NS2B-NS3蛋白酶的表达(A)与纯化(B) Figure 3 Expression (A) and purification (B) of SLEV NS2B-NS3 protease. M: Protein marker; Pre: Before the induction of IPTG; Pro: After the induction of IPTG; Sup: Supernatant liquor; Sed: Sediment; Elution: Protein elution.s |
| 图选项 |
将洗脱下来的SLEV NS2B-NS3蛋白酶用透析液(50 mmol/L HEPES,0.3 mol/L NaCl,5%甘油,pH 7.5)在4 ℃透析3次,每次时间为3 h。透析后的蛋白经过FPLC进一步分离纯化(图 4-A)后,收集相应的蛋白洗脱液,使用浓缩离心管浓缩(图 4-B)至10 mg/mL,分装于1.5 mL EP管中,并冻存于–80 ℃冰箱。蛋白浓度用紫外分光光度仪测定。
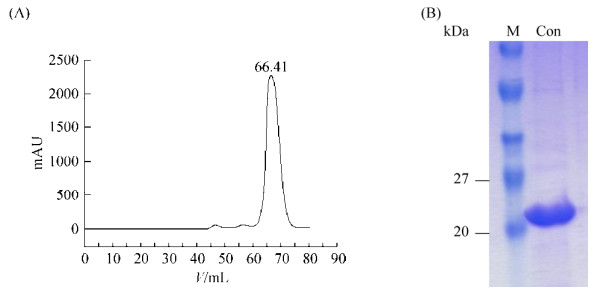 |
| 图 4 SLEV NS2B-NS3蛋白酶的分子筛纯化(A)及物理浓缩(A) Figure 4 Purification of SLEV NS2B-NS3 protease by FPLC (A) and concentration (B) of SLEV NS2B-NS3 protease. M: Protein marker; Con: Concentration. |
| 图选项 |
2.3 SLEV NS2B-NS3的丝氨酸蛋白酶活性的测定 NS2B-NS3蛋白酶可以特异性地酶切底物Bz-Nle-KRR-AMC,从而检测到AMC的荧光值(激发光380 nm,发射光460 nm),以此表征蛋白酶活性。结果表明,NS2B-NS3蛋白酶对底物Bz-Nle-KRR-AMC酶切反应很明显,而且蛋白浓度越高,酶切反应活性越高(图 5-A),Aprotinin (1、2、3 μmol/L)作为阳性化合物对酶活反应具有剂量依赖性抑制(图 5-B),说明我们构建的酶活测定方法准确可行。
 |
| 图 5 SLEV NS2B-NS3的丝氨酸蛋白酶活性的测定 Figure 5 Serine protease activity assay of SLEV NS2B-NS3 protease. A: NS2B-NS3 (0.1, 0.2, 0.4 μmol/L) dose-dependently digested enzyme substrate (100 μmol/L). B: Aprotinin (1, 2, 3 μmol/L) inhibited serine protease activity of SLEV NS2B-NS3 protease in a dose dependent manner. *: P < 0.05; ***: P < 0.001. |
| 图选项 |
2.4 SLEV NS2B-NS3蛋白酶抑制剂的筛选 我们对实验室的老药库(700个上市药物集合)进行20 μmol/L浓度的初筛,发现编号为49、206、376、514、559、587和599的抑制率均超过70%(抑制率依次为72%、83%、86%、90%、83%、87%和95%),其中599号(原花青素Procyanidine, Pro)化合物的抑制率高达95%。因此,选择Pro进行下一步研究,复筛结果显示Pro能够抑制NS2B-NS3的丝氨酸蛋白酶活性(图 6-A)。检测不同剂量的原花青素(10–8–10–4 mol/L)的抑制率,从而拟合出其半抑制浓度(Half maximal inhibitory concentration,IC50)为1.86 μmol/L(图 6-B),并进一步发现原花青素为NS2B-NS3蛋白酶的竞争性抑制剂(图 6-C)。
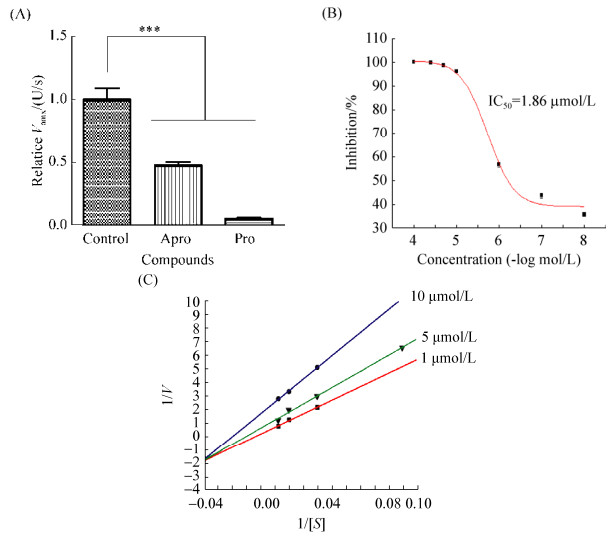 |
| 图 6 原花青素抑制SLEV NS2B-NS3的丝氨酸蛋白酶活性 Figure 6 Procyanidine inhibited serine protease activity of SLEV NS2B-NS3 protease. A: Procyanidine (20 μmol/L) was identified as a potent inhibitor of the protease. B: The dose-dependent inhibitory effect of procyanidine against the serine protease activity of SLEV NS2B/NS3 protease, with an IC50 of 1.86 μmol/L. C: Kinetic analysis of procyanidine against NS2B-NS3 protease via double reciprocal plots of 1/V versus 1/[S]. The Lineweaver-Burk plot analysis indicated that procyanidine acted as a competitive inhibitor against SLEV NS2B-NS3 protease. ***: P < 0.001. Apro: aprotinin; Pro: procyanidine. |
| 图选项 |
3 讨论 SLEV是属于黄病毒属的单链RNA病毒,引起圣路易斯脑炎,经蚊媒介传播可使人畜共患中枢神经系统感染性疾病。到目前为止,仍然没有被批准的针对圣路易斯脑炎的疫苗或药物上市。黄病毒编码的NS2B-NS3蛋白酶复合物,具有丝氨酸蛋白酶、NTPase和RNA解旋酶的活性,完成病毒RNA的复制和前体蛋白的剪切和修饰,在病毒复制和蛋白翻译后加工过程起关键作用。因此通过抑制NS2B-NS3蛋白酶的活性将会成为潜在的治疗SLEV感染的有效策略[13]。丝氨酸蛋白酶作为抗病毒的靶点,已经在治疗人类免疫缺陷病毒和丙型肝炎病毒中取得了显著的疗效[14-15]。因此,对NS2B-NS3蛋白酶活性的抑制已经成为抗病毒研究的重要方向。虽然Aprotinin对黄病毒的NS2B-NS3丝氨酸蛋白酶活性都具有抑制作用,但是Aprotinin的分子量大且没有选择性[16]。所以,特异性的小分子抑制剂研究是比较有前景的治疗圣路易斯脑炎的途径,而且有关SLEV NS2B-NS3蛋白酶小分子抑制剂还没有相关报道。基于老药库的药物发现研究,可以大大缩短新药研发时间,也具有更好的安全性。
因此,我们以NS2B-NS3蛋白酶为靶点对实验室收集的老药库进行抑制剂筛选,得到了具有高抑制丝氨酸蛋白酶活性的原花青素,为研发潜在的抗SLEV药物提供了先导化合物结构,在圣路易斯脑炎治疗研究中具有重要的意义,也开拓了原花青素潜在的新用途。
原花青素是植物中广泛存在的生物类黄酮,是国际上公认的有效清除人体内自由基的天然抗氧化剂。临床上主要用于改善血液循环、治疗糖尿病性视网膜病、减轻水肿和抑制静脉曲张等。已有研究表明,原花青素除了抗氧化,还具有抗微生物、抗糖尿病、抗肥胖和心脏保护作用[17-18]。
由于原花青素是一类特殊结构的化合物总称,究竟是哪些化合物单体是SLEV NS2B-NS3蛋白酶小分子抑制剂还有待进一步研究确证。由于NS2B-N23蛋白酶具有多种蛋白酶活性,本研究只研究了其丝氨酸蛋白酶活性,原花青素对于NS2B-NS3的NTPase和RNA解旋酶活性的影响还有待进一步研究。同时还要深入研究原花青素对其他黄病毒家族NS2B-NS3蛋白酶活性的影响,并且需要评价原花青素的体内外抗病毒活性。
References
| [1] | Zuza AL, Barros HLS, de Mattos Silva Oliveira TF, Chávez-Pavoni JH, Zanon RG. Astrocyte response to St.Louis encephalitis virus. Virus Research, 2016, 217: 92-100. DOI:10.1016/j.virusres.2016.03.005 |
| [2] | Bredeck JF. The story of the epidemic of encephalitis in St.Louis. American Journal of Public Health and the Nation's Health, 1933, 23(11): 1135-1140. DOI:10.2105/AJPH.23.11.1135 |
| [3] | Lumsden LL, Jellison WL.St.Louis encephalitis in 1933: observations on epidemiological features.Public Health Reports, 1958, 73(4): 340-353. |
| [4] | Spinsanti LI, Díaz LA, Glatstein N, Arselán S, Morales MA, Farías AA, Fabbri C, Aguilar JJ, Ré V, Frías M, Almirón WR, Hunsperger E, Siirin M, Da Rosa AT, Tesh RB, Enría D, Contigiani M.Human outbreak of St.Louis encephalitis detected in Argentina, 2005.Journal of Clinical Virology, 2008, 42(1): 27-33. |
| [5] | Chambers TJ, Hahn CS, Galler R, Rice CM. Flavivirus genome organization, expression, and replication. Annual Review of Microbiology, 1990, 44: 649-688. DOI:10.1146/annurev.mi.44.100190.003245 |
| [6] | Melino S, Paci M. Progress for dengue virus diseases.Towards the NS2B-NS3pro inhibition for a therapeutic-based approach. The FEBS Journal, 2007, 274(12): 2986-3002. DOI:10.1111/j.1742-4658.2007.05831.x |
| [7] | Kadaré G, Haenni AL. Virus-encoded RNA helicases. Journal of Virology, 1997, 71(4): 2583-2590. |
| [8] | Pastorino BAM, Peyrefitte CN, Grandadam M, Lebrun R, Moinier D, Rolland D, Tolou HJ, Bessaud M. Unexpected altered specificity is responsible for St.Louis encephalitis virus recombinant protease autoproteolysis. Protein & Peptide Letters, 2007, 14(1): 79-82. |
| [9] | Niyomrattanakit P, Winoyanuwattikun P, Chanprapaph S, Angsuthanasombat C, Panyim S, Katzenmeier G. Identification of residues in the dengue virus type 2 NS2B cofactor that are critical for NS3 protease activation. Journal of Virology, 2004, 78(24): 13708-13716. DOI:10.1128/JVI.78.24.13708-13716.2004 |
| [10] | Leung D, Schroder K, White H, Fang NX, Stoermer MJ, Abbenante G, Martin JL, Young PR, Fairlie DP. Activity of recombinant dengue 2 virus NS3 protease in the presence of a truncated NS2B co-factor, small peptide substrates, and inhibitors. Journal of Biological Chemistry, 2001, 276(49): 45762-45771. DOI:10.1074/jbc.M107360200 |
| [11] | Steuber H, Hilgenfeld R. Recent advances in targeting viral proteases for the discovery of novel antivirals. Current Topics in Medicinal Chemistry, 2010, 10(3): 323-345. |
| [12] | Pastorino B, Rolland D, Peyrefitte CN, Wurtz N, Almeras L, Bessaud M, Tolou HJ. Improvement of the purification of Saint Louis encephalitis virus NS2B-NS3 recombinant protease expressed in Escherichia coli. Journal of Chromatography B, 2008, 868(1/2): 58-63. |
| [13] | Bessaud M, Pastorino BAM, Peyrefitte CN, Rolland D, Grandadam M, Tolou HJ. Functional characterization of the NS2B/NS3 protease complex from seven viruses belonging to different groups inside the genus Flavivirus. Virus Research, 2006, 120(1/2): 79-90. |
| [14] | Hughes PJ, Cretton-Scott E, Teague A, Wensel TM. Protease inhibitors for patients with HIV-1 infection:a comparative overview. P & T: A Peer-Reviewed Journal for Formulary Management, 2011, 36(6): 332-345. |
| [15] | Forns X, Lawitz E, Zeuzem S, Gane E, Bronowicki JP, Andreone P, Horban A, Brown A, Peeters M, Lenz O, Ouwerkerk-Mahadevan S, Scott J, de La Rosa G, Kalmeijer R, Sinha R, Beumont-Mauviel M. Simeprevir with peginterferon and ribavirin leads to high rates of SVR in patients with HCV genotype 1 who relapsed after previous therapy:a phase 3 trial. Gastroenterology, 2014, 146(7): 1669-1679. DOI:10.1053/j.gastro.2014.02.051 |
| [16] | Lin KH, Ali A, Rusere LN, Soumana DI, Kurt Yilmaz N, Schiffer CA. Dengue virus NS2B/NS3 protease inhibitors exploiting the prime side. Journal of Virology, 2017, 91(10): e00045-17. |
| [17] | Cos P, de Bruyne T, Hermans N, Apers S, Vanden Berghe D, Vlietinck AJ. Proanthocyanidins in health care:current and new trends. Current Medicinal Chemistry, 2004, 11(10): 1345-1359. DOI:10.2174/0929867043365288 |
| [18] | Jing SQ, Zhang XM, Yan LJ. Antioxidant activity, antitumor effect, and antiaging property of proanthocyanidins extracted from Kunlun Chrysanthemum flowers. Oxidative Medicine and Cellular Longevity, 2015, 2015: 983484. |
