樊鑫桐1,2, 杜立新2, 高坦坦2, 彭琦2, 张杰2, 宋福平1,2


1.东北农业大学生命科学学院, 黑龙江 哈尔滨 150030;
2.中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193
收稿日期:2018-03-20;修回日期:2018-05-03;网络出版日期:2018-05-23
基金项目:国家自然科学基金(31530095)
*通信作者:宋福平, Tel:+86-10-62896634;E-mail:fpsong@ippcaas.cn
摘要:[目的] 检测苏云金芽胞杆菌HD73中的转录调控因子Sigma H(σH)对spo0A基因转录的调控作用;异源表达纯化Sigma H蛋白,验证其对spo0A基因启动子的直接结合;检测sigH基因的缺失对苏云金芽胞杆菌HD73芽胞形成和晶体蛋白产生的影响。[方法] 通过测定spo0A基因启动子指导的β-半乳糖苷酶活性评价spo0A基因在苏云金芽胞杆菌HD73野生型和sigH缺失突变体中的转录水平;通过PCR扩增苏云金芽胞杆菌HD73的sigH基因并插入到表达载体pET21b上,将质粒转入到表达菌株BL21(DE3)中,得到重组菌株BL21(pETsigH);利用镍柱亲和纯化和阴离子交换纯化得到纯化的Sigma H蛋白;通过凝胶迁移实验(electrophoretic mobility shift assay,EMSA)验证Sigma H蛋白与spo0A基因启动子的直接结合;通过显微镜观察、活芽胞计数的方法对突变株HDΔsigH进行表型特征分析。[结果] sigH缺失后,spo0A基因转录活性降低;在大肠杆菌中正确表达并纯化出大小约为28 kDa的Sigma H-His蛋白;EMSA结果表明纯化后的Sigma H-His蛋白可与spo0A基因启动子结合;镜检和活芽胞计数结果表明突变株HDΔsigH无法产生芽胞和蛋白晶体。[结论] Sigma H蛋白通过与spo0A基因启动子结合直接调控spo0A基因的表达且sigH基因的缺失阻断了苏云金芽胞杆菌中芽胞和晶体蛋白的产生。
关键词:苏云金芽胞杆菌Sigma H表达纯化spo0A基因芽胞形成
Effect of Sigma H on sporulation in Bacillus thuringiensis
Xintong Fan1,2, Lixin Du2, Tantan Gao2, Qi Peng2, Jie Zhang2, Fuping Song1,2


1.College of Life Sciences, Northeast Agricultural University, Harbin 150030, Heilongjiang Province, China;
2.State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China
Received 20 March 2018; Revised 3 May 2018; Published online 23 May 2018
*Corresponding author: Fuping Song, Tel:+86-10-62896634;E-mail:fpsong@ippcaas.cn
Supported by the National Natural Science Foundation of China (31530095)
Abstract: [Objective] To test the regulation of spo0A transcription by the regulatory protein Sigma H (σH) from Bacillus thuringiensis (Bt) HD73;Expressing and purifying Sigma H in Escherichia coli to verify its direct binding to the promoter of spo0A; To detect the effect of deletion of sigH on production of spores and crystal proteins in B.thuringiensis HD73. [Methods] The transcription level of spo0A was determined by measuring the β-galactosidase activities directed by the promoter of spo0A in Bt HD73 and sigH deletion mutant.The open reading frame of the sigH was amplified by PCR from Bt HD73 genome, and then ligated into the vector pET21b to generate pETsigH.The pETsigH was transformed into BL21(DE3) to obtain the recombinant strain BL21(pETsigH).The Sigma H protein was extracted and purified by Ni Sepharose 6 Fast Flow column purification and anion exchange purification.The electrophoretic mobility shift assay (EMSA) was carried out to verify the direct binding of Sigma H and the promoter of spo0A.The phenotypic characteristics of the sigH deletion mutant strain (HDΔsigH) were analyzed by microscopic observation and sporulation efficiency determination. [Results] The deletion of sigH decreased the transcription level of spo0A.The 28 kDa-Sigma H-His was expressed and purified from E.coli strain.EMSA results showed that the Sigma H-His could bind to the promoter of spo0A.Microscopic observation and sporulation efficiency determination demonstrated that the HDΔsigH failed to produce spores and crystal proteins. [Conclusion] The Sigma H-His protein directly regulates the expression of spo0A by binding to the promoter of spo0A.Deletion of the sigH blocks the spores and crystal proteins production in Bt strains.
Keywords: Bacillus thuringiensissigma H proteinexpression and purificationspo0Asporulation
RNA聚合酶(RNA polymerase,RNAP)包括核心酶和Sigma因子。Sigma因子与RNAP核心酶结合后,特异性识别并结合启动子共有序列,从而调控相关基因的表达。模式菌株枯草芽胞杆菌(B. subtilis)在芽胞形成过程中先后激活6个不同的σ因子,即营养期生长因子σA、σH,芽胞形成早期在母细胞和前芽胞中分别表达的σE和σK,以及芽胞形成晚期在母细胞和前芽胞中具有活性的σF和σG因子。通过有序地更换Sigma因子,使RNA聚合酶识别与芽胞形成相关的不同基因的启动子,调控芽胞形成基因在时间和空间上有序且准确无误地表达[1]。σH由sigH (spo0H)基因编码,在营养体细胞中一直以较低水平存在,主要在芽胞杆菌从指数生长期过渡到平稳期时发挥重要功能。σH主要指导芽胞形成和进入感受态的重要基因的转录,包括spo0A、spo0M、spo0F、spoVG、spoVS、spoIIA、kinA等基因和一些编码分泌信号分子的phr家族中的几个基因[2]。除上述基因外,在B. subtilis中,σH还可以指导许多与生理过程相关基因的表达,包括细胞色素合成的相关基因,细胞壁代谢的相关基因和响应营养元素缺乏时所必需的基因[3]。
苏云金芽胞杆菌(B. thuringiensis,Bt)是一种革兰氏阳性细菌,广泛分布于土壤中,其特点是在形成芽胞的同时能够产生具有杀虫活性的晶体蛋白(insecticidal crystal proteins,ICPs)[4]。因Bt具有较广的杀虫谱和对环境安全友好等特点,目前已成为农业上应用最广泛的微生物杀虫剂。Bt形成芽胞的同时,在母细胞中,由cry基因编码的ICPs也在产生和积累。cry基因被分为两类:一类是芽胞形成依赖型cry基因,另一类是非芽胞形成依赖型cry基因。目前已知的cry基因大部分为芽胞依赖型,其中由σH控制转录的为cry4、cry11和cry8[5]基因。但是σH在Bt中是否还控制芽胞形成相关的基因未见报道,尤其是σH如何控制芽胞形成关键调控基因spo0A的表达迫切需要研究。本研究以苏云金芽胞杆菌库斯塔克亚种HD73菌株为研究对象。通过敲除sigH基因得到突变体HDΔsigH,表型研究发现该突变菌株可以正常生长,然而其营养体不能形成不对称隔膜,无法进入芽胞形成期,最终导致无法产生芽胞和Cry1Ac晶体蛋白。通过在遗传水平和蛋白水平上检测,证明了Sigma H蛋白通过与spo0A基因启动子结合直接调控spo0A基因的表达。本研究为进一步揭示σH控制Bt芽胞形成机制奠定了基础。
1 材料和方法 1.1 菌株、质粒和培养基 实验所用菌株与质粒见表 1。大肠杆菌(Escherichia coli)在37 ℃、220 r/min条件下于LB培养基(1% NaCl,1% Tryptone,0.5% Yeast Extract)中培养;Bt在30 ℃、220 r/min条件下于LB培养基中进行常规培养,于1/2 LB培养基(0.5% NaCl,0.5% Tryptone,0.25% Yeast Extract)中进行诱导产胞实验。抗生素使用终浓度:5 μg/mL红霉素,100 μg/mL氨苄青霉素。
表 1. 本实验用到的菌株与质粒 Table 1. Strains and plasmids used in this study
| Strains or plasmids | Characterization | Reference or source |
| Strains | ||
| HD73 | B. thuringiensis subsp. kurstaki carrying the cry1Ac gene | Laboratory collection |
| HDΔsigH | B. thuringiensis HD73 sigH gene mutant | [5] |
| BL21 (DE3) | E. coli B, F-, dcm, ompT, hsdS(rB- mB-), gal, λ(DE3) | [6] |
| BL21 (pETsigH) | BL21 (DE3) with pETsigH plasmid | This study |
| BLpET | BL21 strain carrying pET21b plasmid | Laboratory collection |
| HD73 (pHTPspo0A) | HD73 strain carrying pHTPspo0A | This study |
| HDΔsigH (pHTPspo0A) | HDΔsigH strain carrying pHTPspo0A | This study |
| Plasmids | ||
| pET21b | Expression vector, Ampr, 5.4 kb | Laboratory collection |
| pETsigH | pET21b containing sigH gene, Ampr | This study |
| pHT304-lacZ | B. thuringiensis-E. coli shuttle vector harboring the promoterless lacZ gene | Laboratory collection |
| pHTPspo0A | pHT304-lacZ carring the lacZ gene under the control of the Pspo0A | This study |
表选项
1.2 主要试剂及仪器 限制性内切酶、Solution IDNA连接酶、Prime STAR Max DNA聚合酶(2×)等均购于宝生物(大连)工程有限公司;DNA Marker、2× Taq Mix等购自北京博迈德科技发展有限公司;DNA纯化试剂盒、质粒提取试剂盒等均购自美国Axygen公司。CP750超声波细胞破碎仪购自美国Cole-Parmer公司;蛋白Marker购自赛默飞世尔科技(中国)有限公司;Ni Sepharose 6 Fast Flow column购自美国GE公司;poly(dI:dC)[Poly(ethylene glycol) di-(4-hydroxyphenyl)diphenylphosphine]购自上海Sigma公司;Gel Shift Assay Systems购自Promega公司。其他抗生素与生化试剂均为国产或进口的生化或分析纯级试剂。
1.3 遗传操作 大肠杆菌质粒提取及DNA片段纯化按照试剂盒说明书进行;大肠杆菌转化方法参考分子克隆实验指南;Bt基因组DNA提取和电击转化参考之前发表的实验方法[7-8]。
1.4 引物合成及序列测定 根据Bt HD73菌株的基因组序列设计引物,具体名称及序列见表 2。引物合成和序列测定由生工生物工程(上海)股份有限公司完成。
表 2. 本研究所用引物 Table 2. Primers used in this study
| Primer name | Sequence (5′→3′) | Restriction sites |
| sigH-F | CGGATCCGGTGGAAGCAGGCTTCGTAAG | BamH Ⅰ |
| sigH-R | GTCGACTGAATTTAAAGTTGTACTTTC | Sal Ⅰ |
| Pspo0A-1 | AACTGCAGAGCTCGCTTTTTCTGTTGAA | Pst Ⅰ |
| Pspo0A-2 | CGGGATCCTTCTCCACAGCTTTTCCTC | BamH Ⅰ |
| spo0A-FAMf | AGCTCGCTTTTTCTGTTGAA | |
| spo0A-FAMr | TTCTCCACAGCTTTTCCTC | |
| The underlined part indicates restriction sites; FAM indicates carboxyfluorescein labeling. | ||
表选项
1.5 菌株构建 以Bt HD73基因组(GenBank登录号:CP004069)[9]为模板,Pspo0A-1和Pspo0A-2为引物,PCR扩增出spo0A基因启动子(Pspo0A),利用Pst Ⅰ和BamH Ⅰ酶切并连接到相同酶切处理的穿梭载体pHT304-lacZ上,热激转化到大肠杆菌DH5α感受态细胞(购于中国大连宝生物工程有限公司)中,获得质粒pHTPspo0A,并进行测序确认序列的正确性。进一步将该质粒通过电击分别转进野生菌株HD73和sigH基因缺失突变株HDΔsigH中,得到用于评价spo0A基因转录水平的菌株HD73 (pHTPspo0A)和HDΔsigH (pHTPspo0A)。
根据Bt HD73菌株的sigH(HD73_0093)基因序列设计扩增sigH基因的引物对sigH-F/sigH-R,并以HD73基因组作为模板,PCR扩增出sigH基因的开放阅读框(ORF)。利用Sal Ⅰ和BamH Ⅰ对该片段进行双酶切,胶回收后插入pET21b载体的相应酶切位点,并热激转化到大肠杆菌DH5α感受态细胞中获得蛋白表达重组质粒,命名为pETsigH。提取质粒,利用pET21b质粒上通用引物确认插入序列的正确性。进一步将该质粒热激转化到大肠杆菌BL21 (DE3)中得到蛋白表达菌株BL21 (pETsigH)。
1.6 β-半乳糖苷酶活性测定 挑取Bt菌株单克隆接种于含红霉素抗性的LB培养基中过夜培养。按1%转接于100 mL 1/2 LB培养基中培养至OD600=2.0-2.2,即为对数生长末期,将该时期设为T0,Tn即为T0后第n个小时,分别在T0、T1、T2、T3、T4、T5时取2 mL菌液,12000 r/min,离心2 min收集菌体。加入Z Buffer (0.04 mol/L NaH2PO4·H2O,0.06 mol/L Na2HPO4·2H2O,0.01 mol/L KCl,0.001 mol/L MgSO4·7H2O,使用时加入1 mmol/L DTT)和石英砂破碎2 min;15000 r/min低温离心10 min后取100 μL上清加入700 μL Z Buffer,加入200 μL ONPG开始反应,待反应体系颜色变黄后加入500 μL 1 mol/L Na2CO3终止反应,记录反应时间T;反应液于紫外分光光度计测定OD420的值;再取样品上清15 μL加入到750 μL Bradford中,反应5 min,测定OD595值,β-半乳糖苷酶活性计算公式为unit = (OD420×1500)/(T×V×蛋白浓度)。每组数据独立重复3次。
1.7 Sigma H-His蛋白的表达 将BL21 (pETsigH)菌种活化于含有氨苄青霉素的5 mL LB培养基中,按1%将菌液转接至300 mL LB培养基中,37 ℃、220 r/min培养至OD600=0.7-1.0,加入终浓度为0.5 mmol/L的IPTG,18 ℃、150 r/min诱导过夜(12 h)。在4 ℃、7700 r/min条件下,离心15 min收集菌体,用pH 8.0的50 mmol/L Tris-HCl缓冲液悬浮菌体,超声破碎(功率60%,时间6 min)。4 ℃、7700 r/min离心15 min,分离上清和沉淀,进行12% SDS-PAGE检测,鉴定在该诱导条件下Sigma H-His蛋白表达情况。
1.8 Sigma H-His蛋白的纯化 取3 mL Ni Sepharose 6 Fast Flow column装入层析柱,用5倍柱体积的去离子水清洗柱料;加入5倍柱体积的Binding Buffer (20 mmol/L Tris-HCl pH 8.5,20 mmol/L咪唑,0.5 mol/L NaCl)平衡柱料,将Sigma H-His蛋白上清液上样,反复3次;缓慢加入5倍柱体积的Binding Buffer清洗柱料中的杂蛋白,取10 mL洗脱缓冲液(20 mmol/L Tris-HCl pH 8.5,250 mmol/L咪唑,0.5 mol/L NaCl)把目的蛋白洗脱并收集,每1 mL收集1管。SDS-PAGE检测洗脱下来的蛋白样品。对纯化后的Sigma H-His蛋白用pH 8.0的Tris-HCl进行透析。
1.9 Sigma H-His蛋白的阴离子交换层析纯化和脱盐 将透析过的Sigma H-His蛋白用AKTA avant 25蛋白液相分析系统进行阴离子交换层析纯化。将阴离子交换柱HiTrap Q HP column冲洗后,用8倍柱体积的平衡缓冲液Buffer A (20 mmol/L Tris-HCl pH 8.0)平衡柱子;将蛋白以1 mL/min的速度上样,上样结束用5倍柱体积的Buffer A冲洗柱子,冲洗掉未结合的蛋白;最后用洗脱缓冲液Buffer B (20 mmol/L Tris-HCl pH 8.0,1 mol/L NaCl)进行线性洗脱,将吸光值为260-280 nm的蛋白收集。
通过AKTA avant 25蛋白液相分析系统利用脱盐柱HiTrap Q HP column进行脱盐,用50 mmol/L Tris-HCl pH 8.0缓冲液平衡脱盐柱,将蛋白以5 mL/min的流速上样,收集蛋白峰,用SDS-PAGE检测纯度。
1.10 凝胶迁移实验 spo0A基因启动子与纯化的Sigma H-His蛋白在体外结合实验按照之前发表的方法进行[10]。10 μL反应体系中:10×结合反应液1 μL,Poly (dI:dC) 1 μL (500 mg/L),Sigma H-His蛋白1 μL,去离子水补足混匀,室温静置反应20 min。然后加入1 μL带有FAM标记的Pspo0A混匀,室温继续静置反应20 min。电泳条件:140 V电压,4 ℃,非变性胶(5%)检测。非变性胶用荧光凝胶成像系统(富士公司FLA Imager FLA-5100)进行扫描。
1.11 激光共聚焦显微镜和电镜观察 将野生菌株HD73和sigH基因缺失突变株HDΔsigH在1/2 LB培养基中培养至T0和T3时期,各取1 mL菌液离心收集菌体,用去离子水洗涤3次后悬浮于100 μL去离子水中。取1 μL细胞悬浮液和1 μL细胞膜染液FM4-64 (100 μmol/L;Thermo Scientific,USA)在载玻片上混匀反应染色1 min,加入盖玻片压紧。将玻片置于激光共聚焦显微镜(Carl Zeiss 880,LSM T-PMT)下观察。
将野生菌株HD73和sigH基因缺失突变株HDΔsigH置于电镜下扫描观察其表型差异。将HD73和HDΔsigH菌株在1/2 LB培养基中培养24 h以上,至细胞裂解,收集菌体用固定液悬浮,送至中国农业科学院农产品加工研究所电镜室进行电镜扫描。
1.12 芽胞形成率统计 挑取Bt菌株的3个单克隆于100 mL 1/2 LB培养基30 ℃条件下培养至T1时取出1 mL菌液,利用无菌水进行梯度稀释,取100 μL合适浓度的稀释液涂于LB平板上;培养Bt菌株生长至大多数芽胞释放后,取1 mL菌液在65 ℃条件下温育20 min杀死营养体细胞。梯度稀释后取100 μL合适浓度的稀释液涂于LB平板;平板在30 ℃条件中培养过夜,计算平板上的菌落数;芽胞形成率=芽胞萌发数/T1的细胞总数[11]。每组数据独立重复3次。
2 结果和分析 2.1 Pspo0A-lacZ融合菌株的构建及蛋白表达菌株的构建 为测定spo0A基因的转录活性,首先构建Pspo0A-lacZ融合菌株。spo0A基因启动子片段为287 bp,利用PCR扩增启动子(图 1-A)得到大小正确的片段,酶切后插入pHT304-lacZ载体,获得质粒pHTPspo0A。酶切质粒得到插入的目的片段,大小为287 bp (图 1-B)。经测序验证插入片段序列完全正确。将pHTPspo0A分别电击转入到野生菌株HD73和sigH基因缺失突变株HDΔsigH中,筛选红霉素抗性的单菌落。经PCR测序证明用于评价spo0A基因转录水平的菌株HD73 (pHTPspo0A)和HDΔsigH (pHTPspo0A)构建正确。
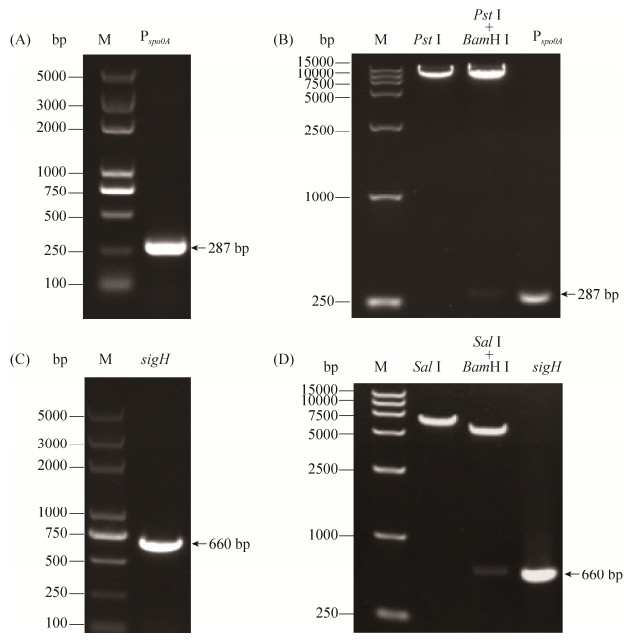 |
| 图 1 目的片段的PCR扩增和重组质粒酶切鉴定 Figure 1 PCR amplification of target gene fragments and digestion of recombinant plasmid. PCR amplification of Pspo0A(A) and digestion of pHTPspo0A(B); PCR amplification of sigH gene (C) and digestion of pETsigH (D). |
| 图选项 |
为了异源表达Sigma H蛋白,构建Sigma H蛋白表达菌株。sigH基因的ORF区全长为660 bp,利用PCR的方法扩增后产物经1%的琼脂糖凝胶电泳鉴定,在500-750 bp处有一条大小与目的片段一致的条带(图 1-C)。提取pETsigH重组质粒进行酶切鉴定,双酶切后出现两条带,且其中一条带与目的片段大小一致(图 1-D)。重组质粒通过测序,显示插入的sigH基因片段序列与sigH在基因组上的序列完全一致,相似度为100%。
2.2 spo0A基因的转录活性分析 为了验证spo0A基因转录水平是否受到Sigma H的影响,测定在野生菌株HD73和突变体HDΔsigH中Pspo0A指导表达的β-半乳糖苷酶转录活性。结果显示Pspo0A在野生株HD73中从T0至T2时期转录活性持续升高,后期趋于稳定,Pspo0A在突变株HDΔsigH中从T0至T5时期转录且活性值缓慢升高;然而在整个测定阶段,Pspo0A在HDΔsigH中的活性显著低于其在野生型菌株中的活性(图 2)。结果表明spo0A基因在转录水平上受Sigma H的控制。
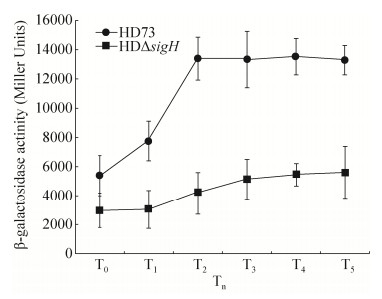 |
| 图 2 Pspo0A在HD73和HDΔsigH菌株中的转录活性分析 Figure 2 Transcriptional activity of Pspo0A in HD73 and HDΔsigH strain. Values represent the means of three independent replicates. Error bars represent standard deviations. |
| 图选项 |
2.3 Sigma H-His蛋白的表达和纯化 选取测序结果正确的重组菌株BL21 (pETsigH)进行Sigma H-His蛋白表达。经IPTG诱导蛋白表达12 h后,用超声法破碎大肠杆菌。通过离心分离上清和沉淀,并进行SDS-PAGE分析,结果显示在重组菌株的菌液中,可溶性组分和不可溶性组分均在相对分子质量为28 kDa处出现特异条带,与预期的Sigma H-His融合蛋白的理论值相符,且可溶性Sigma H-His蛋白表达量高于不可溶性蛋白,而对照组空载体转化的菌株均无特异条带出现(图 3-A)。
 |
| 图 3 Sigma H-His蛋白的表达及纯化 Figure 3 Expression and purification of Sigma H-His protein. A: expression of Sigma H-His protein; B: Sigma H-His protein purification by nickel column; C: Sigma H-His protein purification by desalting. |
| 图选项 |
Sigma H-His粗蛋白通过离心收集,其上清通过Ni2+螯合琼脂糖亲和纯化后,得到了Sigma H-His蛋白,经紫外分光光度计测得浓度约为0.4 g/L。用50 mmol/L Tris-HCl pH 8.0透析后得到Sigma H-His蛋白进行SDS-PAGE (图 3-B)。对透析后的Sigma H-His蛋白进行阴离子交换层析纯化,用1 mol/L NaCl进行线性洗脱,再用50 mmol/L Tris-HCl pH 8.0进行脱盐后,通过SDS-PAGE结果显示,所得蛋白纯度较高且分子量大小正确(图 3-C)。
2.4 Sigma H-His蛋白的结合活性 利用FAM标记的引物对spo0A-FAMf/spo0A-FAMr扩增spo0A启动子(287 bp,包含ATG上游243 bp及44 bp ORF)与纯化的Sigma H-His蛋白进行体外结合实验。如图 4所示,凝胶底部的条带为带有FAM标记的自由DNA即spo0A基因的启动子Pspo0A,自由DNA上层的条带为Sigma H-His蛋白与Pspo0A的结合条带,随着蛋白浓度的逐渐增加,底部Pspo0A条带浓度逐渐降低,上层条带浓度逐渐升高,说明Sigma H-His蛋白可以与spo0A启动子特异性结合,但是具体结合区域还未经检测。
 |
| 图 4 Sigma H-His蛋白与spo0A基因启动子的结合 Figure 4 Sigma H-His protein binding to the promoter of spo0A gene. |
| 图选项 |
2.5 突变株HDΔsigH产生芽胞和杀虫晶体蛋白能力的分析 将野生株HD73和突变株HDΔsigH在1/2 LB培养基中培养至T3时期,利用激光共聚焦显微镜观察细胞中不对称隔膜的形成。结果显示,在T3时期,野生株HD73进入不对称隔膜形成期,大部分细胞开始形成不对称隔膜,然而突变株HDΔsigH中无不对称隔膜形成,表明HDΔsigH无法进入芽胞形成期,不能形成芽胞(图 5)。在HD73菌株中仅产生一种依赖芽胞形成的Cry蛋白Cry1Ac,因此可以确定突变株HDΔsigH同样不可产生Cry1Ac晶体蛋白。
 |
| 图 5 HD73和HDΔsigH菌株不对称隔膜的形成观察 Figure 5 Obsevation of asymmetrical septum formation of wild-type HD73 and HDΔsigH cells. |
| 图选项 |
为了进一步确认上述实验结果,取两个菌株进行电镜观察。结果表明在1/2 LB培养基中培养24 h后,野生菌株HD73能够释放出大量椭球形的芽胞和双锥体的晶体蛋白(图 6-A),而突变株HDΔsigH则仍以营养体的形式存在,没有芽胞和伴胞晶体出现(图 6-B)。结果表明sigH基因的缺失导致Bt HD73菌株丧失了产生芽胞和伴胞晶体的能力。
 |
| 图 6 不同菌株的扫描电镜观察 Figure 6 Observation of different strains under scanning electron microscopy. A: HD73; B: HDΔsigH. |
| 图选项 |
进一步通过芽胞形成率计算确定突变株HDΔsigH不能形成芽胞。将野生菌株HD73和突变株HDΔsigH在1/2 LB液体培养基中培养至HD73的芽胞和晶体完全释放时,各取1 mL菌液进行活芽胞计数。结果显示野生菌株每1 mL菌液可产生2.4×107个活芽胞,而突变菌株中则检测不到活芽胞数(图 7),表明sigH基因的缺失,阻断了菌体产生芽胞的能力。
 |
| 图 7 不同菌株活芽胞计数分析 Figure 7 Analysis of live spores production in different strain. Values represent the means of three independent replicates. Error bars represent standard deviations. |
| 图选项 |
3 结论和讨论 利用大肠杆菌的BL21 (DE3)表达系统[12]对Bt HD73中Sigma H蛋白进行了成功的表达与纯化,得到了相对分子质量与理论值一致的Sigma H-His蛋白。1988年Dubnau等在B. subtilis中表达了地衣芽胞杆菌spo0H基因的蛋白,即σH蛋白[13]。2003年,Imamura等从E. coli中纯化出单细胞蓝藻的9种σ因子,其中包括σH[14]。2013年Barriuso-Iglesias等对谷氨酸棒状杆菌的GST-Sigma H蛋白进行了表达纯化及相关研究[15]。1997年Cosby等在不同pH值下对B. subtilis中σH进行了表达[16],但到目前为止,还没有Bt的Sigma H蛋白表达纯化的相关研究报道。通过NCBI进行Blast,HD73中sigH基因与炭疽芽胞杆菌(B. anthracis)的sigH在核苷酸水平上一致性为93%,与B. subtilis的sigH一致性为67%,在氨基酸水平上与B. anthracis和B. subtilis的一致性分别为99%和85%[2]。
Spo0A是一种DNA结合蛋白,对芽胞形成起始至关重要,spo0A的转录受到两种RNA聚合酶σA和σH的控制[17],但是还没有明确报道在Bt菌株中Sigma H蛋白对spo0A基因表达的直接调控作用。本实验利用酶活测定及EMSA证明Sigma H是通过结合在spo0A基因启动子上面直接控制spo0A基因的表达。2007年Hadjifrangiskou等构建了B. anthracis的sigH基因缺失突变株,该突变株丧失了形成芽胞和炭疽毒素的能力[18],在B. subtilis中sigH基因缺失后菌体无法形成不对称隔膜[3],本实验也表明了在Bt中sigH基因的缺失会导致Bt丧失产生芽胞和杀虫晶体蛋白的能力。
在B. subtilis芽胞形成早期,σH对于激活参与芽胞形成的特定基因发挥不可缺少的作用。但在Bt中,Sigma H因子控制的基因表达的研究甚少。通过与B. subtilis全基因组相比,Bt全基因组多了1000多个基因,因此推测在Bt中σH可能控制更多基因的表达。已有报道σH因子是控制不对称隔膜形成的关键调控因子,纯化其蛋白为深入研究σH控制的基因谱奠定基础,对苏云金芽胞杆菌芽胞形成的调控机制并构建工程菌提供理论基础。
References
| [1] | Errington J. Bacillus subtilis sporulation: regulation of gene expression and control of morphogenesis. Microbiological Reviews, 1993, 57(1): 1-33. |
| [2] | 杜立新.苏云金芽胞杆菌cry8E基因转录调控机制研究.保定: 河北农业大学博士学位论文, 2011. |
| [3] | Britton RA, Eichenberger P, Gonzalez-Pastor JE, Fawcett P, Monson R, Losick R, Grossman AD. Genome-wide analysis of the stationary-phase sigma factor (sigma-H) regulon of Bacillus subtilis. Journal of Bacteriology, 2002, 184(17): 4881-4890. DOI:10.1128/JB.184.17.4881-4890.2002 |
| [4] | Ibrahim MA, Griko N, Junker M, Bulla LA. Bacillus thuringiensis: a genomics and proteomics perspective. Bioengineered Bugs, 2010, 1(1): 31-50. DOI:10.4161/bbug.1.1.10519 |
| [5] | Du LX, Qiu LL, Peng Q, Lereclus D, Zhang J, Song FP, Huang DF. Identification of the promoter in the intergenic region between orf1 and cry8Ea1 controlled by sigma H factor. Applied and Environmental Microbiology, 2012, 78(12): 4164-4168. DOI:10.1128/AEM.00622-12 |
| [6] | Bravo A, Likitvivatanavong S, Gill SS, Soberón M. Bacillus thuringiensis: a story of a successful bioinsecticide. Insect Biochemistry and Molecular Biology, 2011, 41(7): 423-431. DOI:10.1016/j.ibmb.2011.02.006 |
| [7] | Stobdan T, Kaur S, Singh A. Cloning and nucleotide sequence of a novel cry gene from Bacillus thuringiensis. Biotechnology Letters, 2004, 26(14): 1153-1156. DOI:10.1023/B:BILE.0000035488.85309.df |
| [8] | Lereclus D, Arantès O, Chaufaux J, Lecadet MM. Transformation and expression of a cloned δ-endotoxin gene in Bacillus thuringiensis. FEMS Microbiology Letters, 1989, 60(2): 211-217. |
| [9] | Liu GM, Song L, Shu CL, Wang PS, Deng C, Peng Q, Lereclus D, Wang XM, Huang DF, Zhang J, Song FP. Complete genome sequence of Bacillus thuringiensis subsp. kurstaki strain HD73. Genome Announcements, 2013, 1(2): e0008013. DOI:10.1128/genomeA.00080-13 |
| [10] | Li R, Liu G, Xie ZJ, He XH, Chen WQ, Deng ZX, Tan HR. PolY, a transcriptional regulator with ATPase activity, directly activates transcription of polR in polyoxin biosynthesis in Streptomyces cacaoi. Molecular Microbiology, 2010, 75(2): 349-364. DOI:10.1111/mmi.2010.75.issue-2 |
| [11] | Zhang Z, Yang M, Peng Q, Wang GN, Zheng QY, Zhang J, Song FP. Transcription of the lysine-2, 3-aminomutase gene in the kam locus of Bacillus thuringiensis subsp. kurstaki HD73 is controlled by both σ54 and σK factors. Journal of Bacteriology, 2014, 196(16): 2934-2943. DOI:10.1128/JB.01675-14 |
| [12] | Yang M, Peng Q, Huang MZ, Kao GW, Zhang J, Song FP. Expression and purification of Bacillus thuringiensis Sigma K in Escherichia coli. Microbiology China, 2016, 43(1): 69-75. (in Chinese) 杨敏, 彭琦, 黄闽忠, 考桂伟, 张杰, 宋福平. 苏云金芽胞杆菌Sigma K在大肠杆菌中的表达与纯化. 微生物学通报, 2016, 43(1): 69-75. |
| [13] | Dubnau E, Weir J, Nair G, Carter Ⅲ L, Moran Jr C, Smith I. Bacillus sporulation gene spo0H codes for sigma σ30 (σH). Journal of Bacteriology, 1988, 170(3): 1054-1062. DOI:10.1128/jb.170.3.1054-1062.1988 |
| [14] | Imamura S, Yoshihara S, Nakano S, Shiozaki N, Yamada A, Tanaka K, Takahashi H, Asayama M, Shirai M. Purification, characterization, and gene expression of all sigma factors of RNA polymerase in a cyanobacterium. Journal of Molecular Biology, 2003, 325(5): 857-872. DOI:10.1016/S0022-2836(02)01242-1 |
| [15] | Barriuso-Iglesias M, Barreiro C, Sola-Landa A, Martín JF. Transcriptional control of the F0F1-ATP synthase operon of Corynebacterium glutamicum: Sigma H factor binds to its promoter and regulates its expression at different pH values. Microbial Biotechnology, 2013, 6(2): 178-188. DOI:10.1111/1751-7915.12022 |
| [16] | Cosby WM, Zuber P. Regulation of Bacillus subtilis σH (spo0H) and AbrB in response to changes in external pH. Journal of Bacteriology, 1997, 179(21): 6778-6787. DOI:10.1128/jb.179.21.6778-6787.1997 |
| [17] | Buckner CM, Moran Jr CP. A region in Bacillus subtilis σH required for Spo0A-dependent promoter activity. Journal of Bacteriology, 1998, 180(18): 4987-4990. |
| [18] | Hadjifrangiskou M, Chen YH, Koehler TM. The alternative sigma factor σH is required for toxin gene expression by Bacillus anthracis. Journal of Bacteriology, 2007, 189(5): 1874-1883. DOI:10.1128/JB.01333-06 |
