段育龙1,4#, 武发思2,3,6#, 汪万福1,2,3,4,6

 , 贺东鹏2,6, 马千5, 董广强5
, 贺东鹏2,6, 马千5, 董广强5 1.中国科学院, 西北生态环境资源研究院, 甘肃省极端环境微生物资源与工程重点实验室, 甘肃 兰州 730000;
2.敦煌研究院, 国家古代壁画与土遗址保护工程技术研究中心, 甘肃 敦煌 736200;
3.兰州大学生命科学学院, 细胞活动与逆境适应教育部重点实验室, 甘肃 兰州 730000;
4.中国科学院大学, 北京 100049;
5.敦煌研究院, 麦积山石窟艺术研究所, 甘肃 天水 741000;
6.甘肃省古代壁画与土遗址保护重点实验室, 甘肃 敦煌 736200
收稿日期:2018-03-12;修回日期:2018-07-16;网络出版日期:2018-08-13
基金项目:国家自然科学基金(31560160,31500430);甘肃省科技计划(1604WKCA003);中国科学院“西部之光”人才培养引进计划(18JR3RA004);甘肃省文物局课题(GWJ2014003)
*通信作者:汪万福。Tel:+86-937-8869043;E-mail:wwanfu@hotmail.com
#并列第一作者
摘要:[目的] 空气微生物沉降及污染与文化遗产的微生物退化密切相关,本文对世界文化遗产地麦积山石窟赋存环境空气中细菌浓度和群落结构的季节性变化特征进行了系统研究,为石窟环境监测预警和文物预防性保护提供依据。[方法] 利用生物气溶胶采样器,在2016年春、夏、秋和冬季分别采集空气样品;基于传统培养方法获得空气中细菌浓度及纯培养菌株;通过提取基因组DNA、扩增细菌16S rRNA、测序和系统发生树等分子技术研究细菌群落时空动态变化规律;结合环境监测数据,分析影响遗产地空气细菌变化的主要因素。[结果] 监测期内,空气细菌浓度在(281.20-1409.20)CFU/m3之间,最高浓度出现在MJ4处的夏季,最低浓度出现在MJO处的春季;具有明显季节性变化特征,在空间层位分布上有所差异,但不显著(P>0.05)。培养的细菌菌株经鉴定属于4个门11个属;芽孢杆菌属(Bacillus)、Paenarthrobacter、节杆菌属(Arthrobacter)、薄层菌属(Hymenobacter)和考克氏菌属(Kocuria)等为优势属。[结论] 麦积山石窟空气细菌群落结构具有明显的季节性和空间分布动态变化特征;在石窟不同层位,空气中细菌群落分布与相对湿度、温度与降雨量相关;部分细菌种属如芽孢杆菌属、微球菌属(Micrococcus),为壁画及彩塑生物腐蚀的潜在病害菌;麦积山石窟及周边环境空气细菌的监测可为石窟保护和旅游开放管理提供重要参考。
关键词:石窟寺空气细菌群落组成时空变化监测预警
Spatial and temporal distribution characteristics of the airborne bacteria in the Maijishan grottoes, China
Yulong Duan1,4#, Fasi Wu2,3,6#, Wanfu Wang1,2,3,4,6

 , Dongpeng He2,6, Qian Ma5, Guangqiang Dong5
, Dongpeng He2,6, Qian Ma5, Guangqiang Dong5 1.Northwest Institute of Eco-Environment and Resources, CAS, Key Laboratory of Extreme Environmental Microbial Resources and Engineering of Gansu Province, Lanzhou 730000, Gansu Province, China;
2.National Research Center for Conservation of Ancient Wall Paintings and Earthen Sites, Dunhuang Academy, Dunhuang 736200, Gansu Province, China;
3.MOE Key Laboratory of Cell Activities and Stress Adaptations, School of Life Sciences, Lanzhou University, Lanzhou 730000, Gansu Province, China;
4.University of Chinese Academy of Sciences, Beijing 100049, China;
5.Institute of Maijishan Grottoes Art, Dunhuang Acadenly, Tianshui 741000, Gansu Province, China;
6.Key Laboratory for Conservation of Ancient Wall Paintings and Earthen Sites, Gansu Province, Dunhuang 736200, Gansu Province, China
Received 12 March 2018; Revised 16 July 2018; Published online 13 August 2018
*Corresponding author: Wanfu Wang, Tel: +86-937-8869043; E-mail: wwanfu@hotmail.com
Supported by the National Natural Science Foundation of China (31560160, 31500430), by the Gansu Province Science and Technology Plan (1604WKCA003), by the CAS "Light of West China" Program (18JR3RA004) and by the Project of Gansu Cultural Relics Bureau (GWJ2014003)
# These authors contributed equally to this work
Abstract: [Objective] The deposition of the airborne microorganisms and air pollution were closely related to the biodeterioration of the cultural heritage. In this study, a systematic survey of seasonal variation characteristics of bacterial concentration and community structure was carried out in the surrounding atmosphere of Maijishan Grottoes, a renowned cultural heritage site in China. The results will be helpful for the environmental monitoring and precaution of cave temples and preventive protection of cultural relics. [Methods] The Bio-aerosol sampler was used for sampling in all seasons in 2016. Traditional culture-based method to acquire the airborne bacterial concentration information and purified strains; by the extraction of genomic DNA, amplification of bacteria 16S rRNA region, sequencing, and phylogenetic analysis, thereafter the bacteria community composition and distribution characteristics were clarified. Combined with environmental monitoring data, to find out the main factors which may responsible for the dynamic changes of the airborne bacteria. [Results] The concentrations of culturable bacteria were in a range from 281.2 to 1409.2 CFU/m3, the highest and the lowest concentration appears at MJ4 in summer and at MJO in spring, which varied apparently with seasonal characteristics, but no significant difference among different sites. A total of 11 different bacterial genera that affiliated to four phyla were detected in this study, among which, Bacillus, Paenarthrobacter, Arthrobacter, Hymenobacter and Kocuria were dominant genera. [Conclusion] The airborne bacterial community structures of the Maijishan grottoes show a dynamic characteristic of the seasonal variation and spatial distribution; RH, temperature and rainfall all have influenced on the airborne bacteria distribution in different layers of the Grottoes; some of the genus, such as Bacillus and Micrococcus, has potentials that could result in the biodeterioration of the ancient wall paintings and painted sculptures at this site; the monitoring of the airborne bacteria in its surrounding atmosphere of the Maijishan grottoes may contribute to the grottoes conservation and tourism management.
Keywords: Cave templesairborne bacteriacommunity compositionspatial-temporal variationmonitoring and precaution
近年来,文化遗产保护工作已逐渐从抢救性保护向预防性保护过渡,保护对象也从文物本体扩展到其赋存环境,涉及温度、湿度、光照、粉尘和生物因子等各要素,这些因子与文化遗产的劣化、毁坏及长久保存紧密相关。其中,生物因子中的细菌、真菌等微生物,在适宜的温度、湿度和光照条件下,可利用壁画制作材料中的动物胶、植物纤维等有机成分而大量增殖,其或渗入壁画基质,或向胞外分泌色素和有机酸,引起壁画结构特征和美学价值的破坏。在世界范围内,因微生物的过度增殖引起文物生物侵蚀的例子屡见不鲜,典型的如阿尔塔米拉岩穴(Altamira Cave)和拉斯科岩穴(Lascaux Cave)史前岩画、Tito Bustillo及La Garma洞穴等[1-5]。大气作为与文物本体直接接触的介质,是许多细菌和真菌孢子的载体,此外,花粉、病毒和动植物机体及其残留物等有机颗粒成分也是空气颗粒物的主要组分[6]。空气流动作为微生物扩散的主要方式,空气微生物也是壁画表面微生物的重要来源。对文物赋存环境中空气微生物进行监测已成为文化遗产地环境监测的重要内容,相关数据可为文化遗产的预防性保护提供科学依据[7]。
针对文化遗产地空气微生物的来源、浓度变化、群落组成、分布特征及影响因素,国内外已有大量研究。研究表明,大气中微生物多依附于灰尘等溶胶粒子而以微生物气溶胶的形式存在,其来源十分复杂,主要有自然来源和人工来源,包括植物、土壤、水体、废物处理厂、畜牧业和农业等[8]。不同研究位点间空气微生物的浓度、群落结构和时空分布特征有很大差异,即便在同一文化遗产地内,空气微生物的日变动和季节变动程度也十分剧烈,这与当地植被类型、气象和季节因子及人类活动,以及规律性排放源等因素有关[6, 9-10]。其中,人为活动对微环境及空气微生物的影响尤为深刻,对室内外空气细菌研究表明,汽车尾气带来的局部湍流会促进周边空气微生物的气溶胶化[11-13],车辆运输时还会将地表微生物孢子、菌丝体悬浮至空气中。近年来,大量游客涌入文化遗产地参观,对于洞窟内微生态平衡造成严重扰动,在敦煌莫高窟、阿尔塔米拉洞穴等重要文化遗产地的研究发现,游客扰动会导致洞窟微环境CO2浓度、温度、相对湿度等显著增加[14-15];游客还会将外源性颗粒物带入文物原生环境或将地表沉积粉尘重悬至空气,造成大气颗粒物和空气微生物浓度激增[16-17];部分空气微生物既是壁画病害菌,又是某些人类疾病的致病菌[18-19],如铜绿假单胞菌(Pseudomonas aeruginosa)、鼻疽假单胞菌(P. mallei)和类鼻疽假单胞菌(P. pseudomallei)等;亦有研究指出游客扰动是导致文化遗产地微生境改变的主要因素[20-21]。以上研究为文化遗产地环境质量评价和文物及游客安全评估提供了重要支撑。
麦积山石窟于2014年入选《世界文化遗产名录》,其石窟艺术具有很高的知名度和国际影响力。受当地潮湿温润气候和游客人数逐年剧增的影响,麦积山石窟文物正面临着诸多病害的威胁,其中微生物活动对石窟彩塑壁画的退化具有较大影响[22]。截至目前,对于该遗址的赋存环境中空气微生物浓度、群落结构及分布特征尚未有相关报道。针对麦积山石窟多数洞窟开凿于山体之上、位于不同层位的分布特点,本研究首次以不同海拔高度层位典型性洞窟(4窟、9窟和29窟)及瑞应寺前广场为研究位点,探究不同各层位高度空气细菌浓度、群落组成变化规律,明确优势细菌类群,揭示影响该地空气细菌群落结构及分布特征的关键环境因子;相关研究对于石窟环境微生物监测预警和文物预防性保护具有重要意义。
1 材料和方法 1.1 材料
1.1.1 样点简介: 麦积山石窟位于甘肃省天水市东南30 km的秦岭小陇山区,海拔1740 m,年降水量680 mm,无霜期200 d,年平均气温10.4 ℃,相对湿度69.2%。气候区域属于湿润区和半湿润区,气候温和、降水充沛。麦积山石窟始建于公元5世纪,上迄北魏下至清代等10多个朝代1600多年的营建,现存大小洞窟221个,各类造像3938件10632身,壁画约1000 m2,以及大量经卷文书、碑碣,是著名的佛教艺术圣地,被誉为“东方雕塑馆”,与敦煌莫高窟、洛阳龙门石窟和大同云冈石窟并称“四大石窟”。1961年,麦积山石窟被国务院公布为第一批全国重点文物保护单位。2014年,联合国教科文组织第38届世界遗产委员会会议上,麦积山石窟作为中、哈、吉三国联合申遗的“丝绸之路:长安-天山廊道路网”的重要遗址点,被联合国教科文组织世界遗产委员会正式认定为世界文化遗产。
1.1.2 样品采集: 选取麦积山石窟第4窟(上七佛阁)、第9窟(中七佛阁)和第29窟(下七佛阁)及瑞应寺前广场(入口处对照)作为采样位点,分别命名为MJ4、MJ9、MJ29和MJO,其海拔高度分别为1610、1595、1579和1547 m。2016年4月(春季)、6月(夏季)、10月(秋季)和12月(冬季)中旬,采用美国A. P. Buck公司的生物气溶胶采样器Bio-Culture Pump?采集空气样品,采样器距离地面1.5 m,将直径9 cm的含R2A培养基平皿置于采样器内,每次3个重复。空气流量设置为90 L/min,采样时间为2 min。R2A固体培养基:酵母提取物0.5 g,蛋白胨0.5 g,酪蛋白氨基酸0.5 g,葡萄糖0.5 g,可溶性淀粉0.5 g,K2HPO4 0.3 g,MgSO4·7H2O 0.05 g,丙酮酸钠0.3 g,琼脂15 g溶于1 L去离子水中,调pH至7.2。
1.2 菌落计数 采用寡营养的R2A培养基,与PCA、m-SPC等常用富营养培养基相比,其具有敏锐度高、菌落生长较慢、菌落不易融合等特点,配合较低的生长温度(20–28 ℃)和较长的培养时间(> 7 d)可以获得较多数量的单菌落[23-24]。将R2A平板置于室温培养7–15 d后,用菌落形成单位(colony forming units, CFU)计数菌落,并将其换算为单位体积空气细菌浓度,按公式(1)计算。
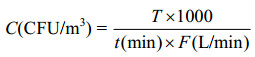 | 公式(1) |
1.3 基因组DNA提取 在对生长于R2A培养平板上的菌落进行计数时,对其进行简单的形态学分类,包括菌落的形状、大小、色泽、折光性等指标。经形态分类、计数、划线分离和纯化后的所有单菌落,直接使用DNA提取试剂盒(Tiangen Co., Beijing, China)提取细菌基因组DNA,操作步骤按照试剂盒附带说明书,将DNA置于–70 ℃保存待用。
1.4 目标片段扩增 合成细菌通用引物27F (5'-AGAGTTTGATCC TGGCTCAG-3')和1492R (5'-TACGGCTACCTTG TTACGACTT-3'),完成细菌16S rRNA基因序列的扩增。反应体系(25 μL):2.5 μL 10×缓冲液,1单位Taq DNA聚合酶(Tiangen Co., Beijing, China),0.2 mmol/L dNTPs,2.5 mmol/L MgCl2,0.2 μmol/L引物,2.5 μL DNA模板(约10 ng)。扩增程序为:94 ℃ 3 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 1.5 min,共30个循环;72 ℃延伸10 min。1.0%琼脂糖凝胶电泳检测扩增片段大小和特异性。
1.5 扩增片段酶切、纯化及克隆 所有单菌落的PCR产物均经过限制性酶切片段多态性分析(RFLP),在此采用基于BsuRⅠ和Csp6Ⅰ两种限制性内切酶的双酶切体系,初筛出不同酶切谱型的PCR产物。筛选获得的各酶切谱型PCR产物经过琼脂糖凝胶纯化试剂盒(Tiangen)纯化后,与pGEM-T载体(Tiangen)于16 ℃过夜连接,连接产物克隆至E. coli DH 5α感受态细胞中。
1.6 测序与嵌合体检测 每一菌株挑取3–5个阳性菌斑(白色菌斑),利用通用引物T7/SP6扩增验证阳性克隆子中插入片段的大小。验证后的菌斑挑至装有LB液体培养基的离心管中(含Amp 100 mg/L),37 ℃、150 r/min过夜摇培后送交测序公司完成序列测定(Shanghai Majorbio Bio-technology Co., Ltd.)。所有有效序列提交至NCBI数据库GenBank。
1.7 序列比对及系统发育树构建 所得序列与GenBank数据库中已知序列进行比对,获得与其相似性最高的序列。通过MEGA 7.0软件用邻接法(Neighbor-Joining method)分析构建克隆文库所得典型序列与相似序列间系统发育树。
1.8 群落结构分析 统计系统发育树中相同种属的相关序列总量,计算对应菌株在各培养平板上的数目,并将其换算为CFU占比,完成群落组成与结构分析。群落结构图用Origin Pro 2016软件输出。
1.9 环境数据获取与数据分析 在4处位点安装Onset HOBO温湿度记录仪,用于监测环境温度和相对湿度变化,记录仪数据采集频次:每30 min采集1次。自2016年4月起至2017年4月进行监测,同时收集降雨量数据(由麦积山石窟艺术研究所提供)。以上环境数据用SPSS 16.0软件分析,细菌浓度与各环境因子相关性应用皮尔森相关系数分析(Pearson correlation analysis)进行计算;空气细菌群落结构与各环境因子间关系分析基于CANOCO 4.5 Software进行典型对应分析(canonical correlation analysis, CCA)。
2 结果和分析 2.1 空气中细菌浓度变化 在选取的4个位点中,空气中可培养细菌的总浓度为281.20–1409.20 CFU/m3,平均为754.65± 63.77 (表 1)。MJO、MJ29、MJ9和MJ4样点间差异不显著(P > 0.05)。
表 1. 不同位点间空气中细菌浓度(CFU/m3)变化 Table 1. Total culturable airborne bacteria concentration (CFU/m3) at four different sampling sites
| Sampling sites | Mean | Median | Minimum | Maximum |
| MJO | 816.59±122.69 | 857.40 | 281.20 | 1270.40 |
| MJ29 | 882.02±106.28 | 927.02 | 507.43 | 1166.60 |
| MJ9 | 608.99±118.80 | 488.79 | 352.85 | 1105.50 |
| MJ4 | 711.01±158.52 | 534.25 | 366.30 | 1409.20 |
| Sum | 754.65±63.77 | 705.55 | 281.20 | 1409.20 |
| MJO, MJ29, MJ9 and MJ4 represent Ruiying Temple square, Cave 29, Cave 9 and Cave 4 of the Maijishan Grottoes, respectively. | ||||
表选项
各位点空气细菌浓度呈现出明显的季节性变动特征(图 1)。监测期内,空气细菌最高浓度为MJ4位点的夏季,(1409.20±187.93) CFU/m3,最低浓度出现在MJO监测点的春季,(281.20±63.12) CFU/m3;然而,在秋、冬两季,MJO处浓度高于其他各点。总体来看,各位点夏、秋两季空气细菌总浓度普遍高于冬、春两季,浓度在4个季节均呈现出正态分布。
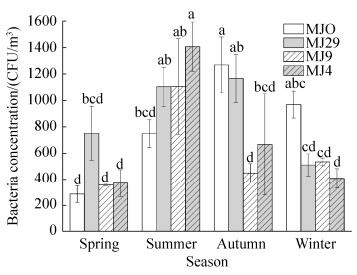 |
| 图 1 不同季节(4月、6月、10月和12月)中各位点空气细菌浓度(CFU/m3) Figure 1 The bacteria concentrations (CFU/m3) at the four sites in different seasons (April, June, October, December). MJO, MJ29, MJ9 and MJ4 represent Ruiying Temple square, Cave 29, Cave 9 and Cave 4 of the Maijishan Grottoes, respectively. a, b means significant difference (P < 0.05). |
| 图选项 |
在相同季节,不同高度层位的监测点空气可培养细菌浓度也有较大差异。春季,各位点间细菌浓度接近,差异不显著;夏季,高层位MJ4细菌浓度显著高于最低位点MJO处(P < 0.05),同时高于其他中层位点,但差异不显著。相反,在秋季MJO处细菌浓度显著高于MJ9和MJ4位点(P < 0.05);冬季MJO处细菌浓度最高,MJ4处浓度最低,二者差异显著(P < 0.05),但与MJ9和MJ29两位点无显著差异。
各监测位点空气细菌浓度与相应温度、相对湿度和降雨量等自然环境因子间的相关性关系如表 2所示。各位点空气细菌浓度与温度成正相关,但只有29窟呈显著相关(P < 0.05);各位点中除MJO与相对湿度呈负相关外,其余各位点均与相对湿度呈正相关;MJO处细菌空气浓度与季节性降雨量呈正相关,但不显著。
表 2. 空气细菌CFU与环境因子间的相关性分析 Table 2. Pearson Correlation Analysis for bacterial concentrations (CFU/m3) and environmental parameters
| Factors | T/℃ | RH/% | Rainfall/mm |
| MJO | 0.334 | –0.279 | 0.558 |
| MJ29 | 0.956* | 0.871 | – |
| MJ9 | 0.666 | 0.111 | – |
| MJ4 | 0.948 | 0.318 | – |
| *Correlation is significant at the 0.05 level (2-tailed). | |||
表选项
2.2 分离细菌的系统发育地位鉴定 对麦积山石窟各位点可培养细菌16S rRNA测序,共得到片段大小合适的序列23条,提交至NCBI数据库,序列号为MG694473–MG694499。通过BLAST序列比对,确定了NCBI数据库中与本研究所得序列相似度最高的序列所属科属、物种及分离源等信息(表 3)。通过对比NCBI数据库中相似序列的分离源信息发现,这些序列来源十分复杂,土壤、壁画、岩石、水体、植物根系和生物制品均有。
表 3. 麦积山石窟窟区空气中细菌16S rDNA典型序列比对分析 Table 3. Analysis of typical 16S rDNA sequence in the air environment of Maijishan Grottoes
| Typical clones (Accession No.) | Family | Species | Source | Identity/% |
| A1(MG694473) | Bacillaceae | Bacillus subtilis | Fermented soybeans | 99 |
| A6(MG694478) | Micrococcaceae | Paenarthrobacter sp. | Hydrocarbon | 99 |
| A3(MG694475) | Micrococcaceae | Arthrobacter oxydans | Siltstone | 99 |
| A2(MG694474) | Hymenobacteraceae | Hymenobacter sp. | Water | 99 |
| A5(MG694477) | Micrococcaceae | Kocuria sp. | Water | 100 |
| C8(MG694490) | Microbacteriaceae | Mycetocola sp. | Murals | 100 |
| A11(MG694483) | Staphylococcaceae | Staphylococcus saprophyticus | Infectious disease | 99 |
| F12(MG694496) | Sphingomonadaceae | Sphingomonas roseiflava | Root | 99 |
| C3(MG694486) | Oxalobacteraceae | Massilia sp. | Soil | 98 |
| C7(MG694489) | Streptomycetaceae | Streptomyces sp. | Murals | 100 |
| C18(MG694495) | Micrococcaceae | Micrococcus luteus | Murals | 100 |
表选项
2.3 分离细菌物种组成 本研究共得到11个细菌属,属放线菌门(Actinobacteria, 54.55%)、变形菌门(Proteobacteria, 18.18%)、厚壁菌门(Firmicutes, 18.18%)和拟杆菌门(Bacteroidetes, 9.09%)。麦积山石窟窟区空气中分离细菌组成详见图 2。
 |
| 图 2 麦积山石窟空气细菌组成(属) Figure 2 Proportions of bacteria genera detected among the airborne community in the Maijishan Grottoes. |
| 图选项 |
麦积山石窟空气中可培养细菌群落结构因季节和位点不同而有所差异(图 3)。
 |
| 图 3 麦积山石窟优势空气细菌相对丰度(属) Figure 3 Relative abundance of the predominant bacterial genera at the four sites. |
| 图选项 |
春季,MJO处最优势菌属为节杆菌属(92.7%),其他位点均为Paenarthrobacter,依次为MJ4 (97.56%)、MJ9 (75%)和MJ29 (53.16%)。夏季,MJO处节杆菌属占比下降59.58%,薄层菌属和芽孢杆菌属分别从3.64%升至21.91%和14.38%;MJ29处,Paenarthrobacter降至5.53%,芽孢杆菌属占比升至88.37%;MJ9处,最优菌属为Paenarthrobacter,其占比有一定升高,占77.44%;MJ4处,Paenarthrobacter的优势地位被芽孢杆菌属(41.57%)、节杆菌属(34.83%)和薄层菌属(13.48%)取代。秋季,MJO处芽孢杆菌属(56.28%)和薄层菌属(32.93%)占比上升,节杆菌属减少;MJ29处,节杆菌属、栖霉菌属和薄层菌属分占39.08%、37.93%和21.83%;MJ9处,Paenarthrobacter被考克氏菌属替代,占88.71%;MJ4处,优势菌属为芽孢杆菌属、薄层菌属和节杆菌属,分占26.67%、28.88%和35.36%。冬季,MJO处芽孢杆菌属占比60.57%,其次为薄层菌属(15.38%);MJ29处由节杆菌属(42.46%)、薄层菌属(33.33%)和鞘氨醇单胞菌属(23.81%)组成;MJ9处,芽孢杆菌属和Paenarthrobacter分占45.45%和27.27%;MJ4处Paenarthrobacter占比60%。
通过CCA分析,麦积山石窟各位点在不同季节间的空气细菌群落结构差异较大(图 4),各环境因子对其差异的贡献率由高到低依次为相对湿度 > 温度 > 海拔高度 > 降雨量,对应值分别为0.526、0.454、0.386和0.318。细菌群落结构在春季、夏季、秋季更为相似,但与冬季间差别较大;各位点间也具有一定差异,MJ29和MJO及MJ4间有较大不同,与MJ9间更为接近。
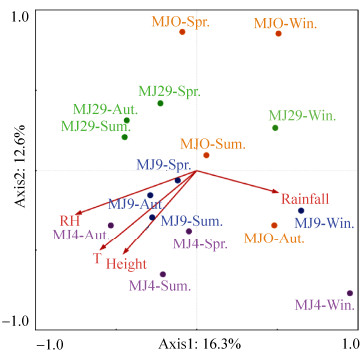 |
| 图 4 不同监测点四个季节空气细菌群落组成与环境因子间的典型相关性分析 Figure 4 Canonical correlation analysis for bacterial communities and environmental parameters from the four sites at different seasons. |
| 图选项 |
3 结论和讨论 麦积山石窟各监测点空气细菌浓度具有明显的季节性变动规律,总体呈现夏秋两季高、冬春两季低的特点。在同一季节,各位点间空气中细菌浓度有所不同,这可能与各位点微环境条件、采样时差及天气状况有关[25]。皮尔森相关性分析显示,各位点空气细菌浓度与温度呈正相关性,第29窟呈显著性正相关;除MJO外,石窟上其他各位点空气细菌浓度均与相对湿度呈正相关;降雨量对外环境MJO处的空气细菌浓度有影响,二者呈正相关。在麦积山石窟,降水主要集中在夏、秋季,降水在一定程度上会减少空气颗粒物的浓度,降低空气中微生物数量;但夏、秋季因气温较高,降雨又能增高湿度,促进微生物萌发和增殖。监测期内,空气细菌总浓度在(281.20–1409.20) CFU/m3内,平均浓度(754.65±63.77) CFU/m3,与城市大气空气微生物浓度相比[26],该地空气中细菌浓度保持在较低水平;与其他文化遗产地相比,如敦煌莫高窟在国庆期间最高空气细菌浓度达3800 CFU/m3[16],该地空气细菌浓度水平仍较低,这与麦积山石窟地处小陇山林区,高密度森林植被对空气微生物的抑制作用有很大关系[27]。参照我国室内空气质量标准(GB/T18883-2002),室内空气微生物的总浓度应小于2500 CFU/m3,麦积山石窟洞窟内空气细菌浓度尚在国标范围内,但因该地近年来游客激增及随之而来的人为扰动加剧,仍需加强在人流密集等特殊情况下空气微生物浓度的实时监测。针对文化遗产地的特殊环境,有研究认为可将空气微生物CFU作为洞窟等受微生物侵染的指示子,当CFU在500–1000之间时,表明洞窟已经遭受到大量游客活动的影响;当CFU大于1000时,洞窟已经面临不可逆的生态失衡[28]。
目前,针对文化遗产地空气微生物群落结构的研究仍以传统培养基分离法结合基于16S/18S rDNA的基因序列扩增为主,因位点特异性及培养方法的差异,各文化遗产地间空气细菌组成有所不同,如莫高窟主要为变形菌门(54.24%)和放线菌门(23.67%)[29],阿尔塔米拉洞穴则为放线菌门和厚壁菌门,二者约占70%[30],而拉斯科洞穴优势细菌门为放线菌门(44.1%)、变形菌门(26.5%)和厚壁菌门(23.5%)[31],本研究鉴定得到的11个细菌属则分属放线菌门、厚壁菌门、拟杆菌门和变形菌门。然而,通过培养能鉴定的微生物种类仅占自然环境中微生物类群的1%,绝大部分微生物目前难以在实验室中培养,加之不同微生物的营养偏好性,仅通过单一培养基培养的模式很难全面反映空气中微生物群落信息。现代分子生物学技术的发展可解决这一难题,如Gaüzère等借助454-焦磷酸测序技术对法国卢浮宫内空气微生物群落组成稳定性进行调查,连续6个月监测数据显示,卢浮宫内空气中细菌组成随时间延长趋于稳定,而真菌群落稳定性较低[32]。未来可借鉴类似方法对麦积山石窟等文化遗产地空气微生物群落结构进行深入揭示。
麦积山石窟各位点空气细菌群落结构有明显的季节性差异,这应与空气温度、相对湿度、太阳辐射、风向、降雨等自然因素和人为扰动有关[25, 29]。通过CCA分析(图 4),相对湿度、温度、海拔高度及降雨量等环境因子均会对各样点空气细菌群落产生影响。其中,在春、夏、秋三季,相对湿度、温度及海拔高度对位于高层的4窟和9窟影响最大,对低层29窟影响次之,对最低处瑞应寺广场影响最小;降雨对夏、秋两季广场空气细菌群落结构影响较大,而对冬、春两季影响较小,这可能与当地季节性降水有关,即夏、秋季降雨量较多,而冬、春季较少。此前,研究人员主要针对城市医院和学校等公共环境中空气微生物浓度及群落组成与环境因子间的耦合关系进行研究[26],但对文化遗产地的研究较少[16-17, 29]。一般来说,除温度、湿度和降雨等因素外,太阳辐射、气压、大气运动、空气污染物等也会影响空气微生物群落结构,需今后进一步研究。
本研究鉴定的部分种属,如芽孢杆菌属、节杆菌属和考克氏菌属等是文化遗产地常见细菌类群,如芽孢杆菌属,在拉斯科洞穴[33]、阿尔塔米拉洞窟[34]和莫高窟[29]等地均有报道。研究表明,洞穴和墓室壁画表面附生芽孢杆菌属、节杆菌属、考克氏菌属、链霉菌属和鞘氨醇单胞菌属等[35-39],它们在壁画劣化中起着非常重要的作用[40-42],如早在1999年,Gonzalez等在对西班牙南部一处岩画表面微生物进行调查时发现芽孢杆菌属为最优势细菌属,其中以巨大芽孢杆菌(Bacillus megaterium)分布最为广泛,该菌属与壁画常用红色颜料铁红[Fe2O3, Fe(Ⅲ)-(hydr)oxides]在TSB培养液中摇培一段时间后,会将Fe(Ⅲ)转变为Fe(Ⅱ),导致铁红褪色[43];本研究中较少鉴定到的微球菌属(Micrococcus)也可向外分泌红色色素,污染壁画[34]。可以说,麦积山石窟赋存环境中空气细菌种属具备引起壁画微生物病害的潜势,但这些分离菌株对古代壁画颜料及其胶结材料的腐蚀退化能力,还有待今后进一步测试评估。
针对麦积山石窟空气细菌浓度、群落结构和分布特征,结合当地常年高湿的气候特点,以及近年来游客数量较大、人为扰动程度高等新时期的特点,本研究认为麦积山石窟壁画、彩塑等文物面临微生物侵蚀的风险性较大。有必要对石窟赋存环境中空气微生物进行长期监测,并将其纳入整体的监测预警体系,以期为该遗产地旅游开放和预防性保护提供科学依据。
致谢: 感谢敦煌研究院麦积山石窟艺术研究所和保护研究所相关工作人员给予本研究的帮助。
References
| [1] | Bastian F, Jurado V, Nováková A, Alabouvette C, Saiz-jimenez C. The microbiology of Lascaux cave. Microbiology, 2010, 156(3): 644-652. DOI:10.1099/mic.0.036160-0 |
| [2] | Dupont J, Jacquet C, Dennetière B, Lacoste S, Bousta F, Orial G, Cruaud C, Couloux A, Roquebert MF. Invasion of the French Paleolithic painted cave of Lascaux by members of the Fusarium solani species complex. Mycologia, 2007, 99(4): 526-533. DOI:10.1080/15572536.2007.11832546 |
| [3] | Portillo MC, Saiz-Jimenez C, Gonzalez JM. Molecular characterization of total and metabolically active bacterial communities of "white colonizations" in the Altamira Cave, Spain. Research in Microbiology, 2009, 160(1): 41-47. |
| [4] | Schabereiter-Gurtner C, Saiz-Jimenez C, Pi?ar G, Lubitz W, R?lleke S. Phylogenetic 16S rRNA analysis reveals the presence of complex and partly unknown bacterial communities in Tito Bustillo cave, Spain, and on its Palaeolithic paintings. Environmental Microbiology, 2002, 4(7): 392-400. DOI:10.1046/j.1462-2920.2002.00303.x |
| [5] | Schabereiter-Gurtner C, Saiz-Jimenez C, Pi?ar G, Lubitz W, R?lleke S. Phylogenetic diversity of bacteria associated with Paleolithic paintings and surrounding rock walls in two Spanish caves (Llonín and La Garma). FEMS Microbiology Ecology, 2004, 47(2): 235-247. DOI:10.1016/S0168-6496(03)00280-0 |
| [6] | Jones AM, Harrison RM. The effects of meteorological factors on atmospheric bioaerosol concentrations-a review. Science of the Total Environment, 2004, 326(1/3): 151-180. |
| [7] | E J, Wu FS, Wang WF, Chen GL, Zhao LY, He DP, Xu RH. Monitoring and research on microbes in the environment of the wall paintings in No. 5 of the Wei and Jin Tombs. Dunhuang Research, 2013(6): 109-116. (in Chinese) 俄军, 武发思, 汪万福, 陈庚龄, 赵林毅, 贺东鹏, 徐瑞红. 魏晋五号壁画墓保存环境中空气微生物监测研究. 敦煌研究, 2013(6): 109-116. DOI:10.3969/j.issn.1000-4106.2013.06.015 |
| [8] | Bonazza A, de Nuntiis P, Mandrioli P, Sabbioni C. Aerosol impact on cultural heritage: deterioration processes and strategies for preventive conservation//Tomasi C, Fuzzi S, Kokhanovsky A. Atmospheric Aerosols: Life Cycles and Effects on Air Quality and Climate. Weinheim: Wiley, 2017: 645-670. |
| [9] | Huang CY, Lee CC, Li FC, Ma YP, Su HJJ. The seasonal distribution of bioaerosols in municipal landfill sites:a 3-yr study. Atmospheric Environment, 2002, 36(27): 4385-4395. DOI:10.1016/S1352-2310(02)00322-9 |
| [10] | Maron PA, Mougel C, Lejon DPH, Carvalho E, Bizet K, Marck G, Cubito N, Lemanceau P, Ranjard L. Temporal variability of airborne bacterial community structure in an urban area. Atmospheric Environment, 2006, 40(40): 8074-8080. DOI:10.1016/j.atmosenv.2006.08.047 |
| [11] | Giorgio CD, Krempff A, Guiraud H, Binder P, Tiret C, Dumenil G. Atmospheric pollution by airborne microorganisms in the city of Marseilles. Atmospheric Environment, 1996, 30(1): 155-160. DOI:10.1016/1352-2310(95)00143-M |
| [12] | Liu LJS, Krahmer M, Fox A, Feigley CE, Featherstone A, Saraf A, Larsson L. Investigation of the concentration of bacteria and their cell envelope components in indoor air in two elementary schools. Journal of the Air & Waste Management Association, 2000, 50(11): 1957-1967. |
| [13] | Lugauskas A, Sveistyte L, Ulevicius V. Concentration and species diversity of airborne fungi near busy streets in Lithuanian urban areas. Annals of Agricultural and Environmental Medicine, 2003, 10(2): 233-239. |
| [14] | Zhang GB, Xue P, Hou WF, Guo QL. The study on micro-environment of the cave affected by the visitors of the Mogao grottoes. Dunhuang Research, 2005(4): 83-86. (in Chinese) 张国彬, 薛平, 侯文芳, 郭青林. 游客流量对莫高窟洞窟内小环境的影响研究. 敦煌研究, 2005(4): 83-86. DOI:10.3969/j.issn.1000-4106.2005.04.015 |
| [15] | Saiz-jimenez C, Cuezva S, Jurado V, Fernandez-Cortes A, Porca E, Benavente D, Ca?averas JC, Sanchez-Moral S. Paleolithic art in peril:policy and science collide at Altamira Cave. Science, 2011, 334(6052): 42-43. DOI:10.1126/science.1206788 |
| [16] | Wang WF, Ma YT, Ma X, Wu FS, Ma XJ, An LZ, Feng HY. Seasonal variations of airborne bacteria in the Mogao Grottoes, Dunhuang, China. International Biodeterioration & Biodegradation, 2010, 64(4): 309-315. |
| [17] | Wang WF, Ma X, Ma YT, Mao L, Wu FS, Ma XJ, An LZ, Feng HY. Seasonal dynamics of airborne fungi in different caves of the Mogao Grottoes, Dunhuang, China. International Biodeterioration & Biodegradation, 2010, 64(6): 461-466. |
| [18] | Bastian F, Alabouvette C, Jurado V, Saiz-Jimenez C. Impact of biocide treatments on the bacterial communities of the Lascaux Cave. Naturwissenschaften, 2009, 96(7): 863-868. DOI:10.1007/s00114-009-0540-y |
| [19] | Yan F, Ge QY, Li Q, Yu M, Zhu XD, Pan J. Analysis of microbial community on the surface of the historic stone and nearby rock samples in Yungang Grottoes. Acta Microbiologica Sinica, 2012, 52(5): 629-636. (in Chinese) 颜菲, 葛琴雅, 李强, 于淼, 朱旭东, 潘皎. 云冈石窟石质文物表面及周边岩石样品中微生物群落分析. 微生物学报, 2012, 52(5): 629-636. |
| [20] | Sanchez-Moral S, Luque L, Cuezva S, Soler V, Benavente D, Laiz L, Gonzalez JM, Saiz-Jimenez C. Deterioration of building materials in Roman catacombs:the influence of visitors. Science of the Total Environment, 2005, 349(1/3): 260-276. |
| [21] | Godoi RHM, Potgieter-Vermaak S, Godoi AFL, Stranger M, van Grieken R. Assessment of aerosol particles within the Rubens' House Museum in Antwerp, Belgium. X-Ray Spectrometry, 2010, 37(4): 298-303. |
| [22] | Duan YL, Wu FS, Wang WF, He DP, Gu JD, Feng HY, Chen T, Liu GX, An LZ. The microbial community characteristics of ancient painted sculptures in Maijishan Grottoes, China. PLoS One, 2017, 12(7): e0179718. DOI:10.1371/journal.pone.0179718 |
| [23] | Li XD, Qu JH, Zhou J, Zhang LJ, Li HF, Tian HL. Effect of sediment extract on the culturable aerobic bacterial diversity in the sediments of Taihu Lake. Microbiology China, 2017, 44(3): 554-560. (in Chinese) 李晓丹, 屈建航, 周佳, 张璐洁, 李海峰, 田海龙. 泥浸汁对太湖沉积物中的好氧可培养细菌多样性的影响. 微生物学通报, 2017, 44(3): 554-560. |
| [24] | Bai XH, Wu HL, Wang HL, Zhu B. Comparison of different measurement methods of heterotrophic plate count in drinking water. Water Purification Technology, 2007, 26(5): 65-67. (in Chinese) 白晓慧, 吴汉靓, 王海亮, 朱斌. 饮用水中异养菌平板计数检测方法的比较. 净水技术, 2007, 26(5): 65-67. DOI:10.3969/j.issn.1009-0177.2007.05.019 |
| [25] | Tanaka D, Terada Y, Nakashima T, Sakatoku A, Nakamura S. Seasonal variations in airborne bacterial community structures at a suburban site of central Japan over a 1-year time period using PCR-DGGE method. Aerobiologia, 2015, 31(2): 143-157. DOI:10.1007/s10453-014-9353-3 |
| [26] | Xue LG, Jiang JR, Famous E. Progress in research and monitoring of urban airborne microbes. Environmental Engineering, 2017, 35(3): 152-157. (in Chinese) 薛林贵, 姜金融, FamousE. 城市空气微生物的监测及研究进展. 环境工程, 2017, 35(3): 152-157. |
| [27] | 韩明臣.城市森林保健功能指数评价研究——以北宫国家森林公园为例.中国林业科学研究院博士学位论文, 2011. |
| [28] | Porca E, Jurado V, Martin-Sanchez PM, Hermosin B, Bastian F, Alabouvette C, Saiz-Jimenez C. Aerobiology:an ecological indicator for early detection and control of fungal outbreaks in caves. Ecological Indicators, 2011, 11(6): 1594-1598. DOI:10.1016/j.ecolind.2011.04.003 |
| [29] | Wang WF, Ma YT, Ma X, Wu FS, Ma XJ, An LZ, Feng HY. Diversity and seasonal dynamics of airborne bacteria in the Mogao Grottoes, Dunhuang, China. Aerobiologia, 2012, 28(1): 27-38. DOI:10.1007/s10453-011-9208-0 |
| [30] | Laiz L, Gonzalez JM, Saiz-Jimenez C. Microbial communities in caves: ecology, physiology, and effects on Paleolithic paintings//Koestler RJ. Art, Biology, and Conservation: Biodeterioration of Works of Art. New York: The Metropolitan Museum of Art, 2003: 210-215. |
| [31] | Martin-Sanchez PM, Jurado V, Porca E, Bastian F, Lacanette D, Alabouvette C, Saiz-Jimenez C. Airborne microorganisms in Lascaux Cave (France). International Journal of Speleology, 2014, 43(3): 295-303. DOI:10.5038/1827-806X |
| [32] | Gaüzère C, Moletta-Denat M, Blanquart H, Ferreira S, Moularat S, Godon JJ, Robine E. Stability of airborne microbes in the Louvre Museum over time. Indoor Air, 2014, 24(1): 29-40. |
| [33] | Orial G, Bousta F, Fran?ois A, Pallot-Frossard I, Warscheid T. Managing biological activities in Lascaux: identification of microorganisms, monitoring and treatments//Coye N. Lascaux and preservation Issues in Subterranean Environments. Proceedings of the International Symposium. Paris: éditions de la Maison des sciences de l'homme, 2011: 219-251. |
| [34] | Laiz L, Groth I, Gonzalez I, Saiz-Jimenez C. Microbiological study of the dripping waters in Altamira cave (Santillana del Mar, Spain). Journal of Microbiological Methods, 1999, 36(1/2): 129-138. |
| [35] | Pangallo D, Krakova L, Chovanova K, Simonovi?ová A, de Leo F, Urzì C. Analysis and comparison of the microflora isolated from fresco surface and from surrounding air environment through molecular and biodegradative assays. World Journal of Microbiology and Biotechnology, 2012, 28(5): 2015-2027. DOI:10.1007/s11274-012-1004-7 |
| [36] | Bassi M, Ferrari A, Realini M, Sorlini C. Red stains on the Certosa of Pavia:a case of biodeterioration. International Biodeterioration & Biodegradation, 1986, 22(3): 201-205. |
| [37] | Ciferri O. Microbial degradation of paintings. Applied and Environmental Microbiology, 1999, 65(3): 879-885. |
| [38] | Heyrman J, Mergaert J, Denys R, Swings J. The use of fatty acid methyl ester analysis (FAME) for the identification of heterotrophic bacteria present on three mural paintings showing severe damage by microorganisms. FEMS Microbiology Letters, 1999, 181(1): 55-62. DOI:10.1111/fml.1999.181.issue-1 |
| [39] | de Leo F, Iero A, Zammit G, Urzì CE. Chemoorganotrophic bacteria isolated from biodeteriorated surfaces in cave and catacombs. International Journal of Speleology, 2012, 41(2): 125-136. DOI:10.5038/1827-806X |
| [40] | Capodicasa S, Fedi S, Porcelli AM, Zannoni D. The microbial community dwelling on a biodeteriorated 16th century painting. International Biodeterioration & Biodegradation, 2010, 64(8): 727-733. |
| [41] | Jroundi F, Fernandez-Vivas A, Rodriguez-Navarro C, Bedmar EJ, González-Mu?oz MT. Bioconservation of deteriorated monumental calcarenite stone and identification of bacteria with carbonatogenic activity. Microbial Ecology, 2010, 60(1): 39-54. |
| [42] | Pi?ar G, Jimenez-Lopez C, Sterflinger K, Ettenauer J, Jroundi F, Fernandez-Vivas A, Gonzalez-Mu?oz MT. Bacterial community dynamics during the application of a Myxococcus xanthus-inoculated culture medium used for consolidation of ornamental limestone. Microbial Ecology, 2010, 60(1): 15-28. |
| [43] | Gonzalez I, Laiz L, Hermosin B, Caballero B, Incerti C, Saiz-Jimenez C. Bacteria isolated from rock art paintings:the case of Atlanterra shelter (South Spain). Journal of Microbiological Methods, 1999, 36(1/2): 123-127. |
