肖汉玉1,2, 王鹏1,2

 , 刘君政1,2, 李传琼1,2, 李燕1,2, 赵君1,2
, 刘君政1,2, 李传琼1,2, 李燕1,2, 赵君1,2 1.江西师范大学鄱阳湖湿地与流域研究教育部重点实验室, 江西 南昌 330022;
2.江西师范大学地理与环境学院, 江西 南昌 330022
收稿日期:2018-03-23;修回日期:2018-06-05;网络出版日期:2018-07-19
基金项目:国家自然科学基金(41661017);江西省自然科学基金(20151BAB213035);江西省重大生态安全问题监控协同创新中心资助项目(JXS-EW-00)
*通信作者:王鹏。Tel/Fax:+86-791-88120440;E-mail:wangpengjlu@jxnu.edu.cn
摘要:[目的] 分析乐安江从上游至下游水体细菌群落结构组成变化,揭示细菌群落结构组成变化的影响因素。[方法] 分析不同河段水体中C、N、P、Cu、Zn、As和Pb等化学指标。对水体DNA的16S rRNA基因进行高通量测序确定细菌群落特征。基于Bray-Curtis距离的采样点非度量多维尺度(NMDS)分析和聚类分析研究乐安江水体细菌群落结构差异,基于冗余分析(RDA)研究环境因子与细菌群落的关系。[结果] 乐安江水体中C、N、P、Cu、Zn、As和Pb等化学指标含量中下游偏高。中游河水受德兴铜矿废水影响,细菌群落多样性降低,下游受农业、生活废水影响,细菌群落丰富度和多样性升高。水体中优势菌群为β-变形菌纲(Beta-proteobacteria,53.03%)、放线菌门(Actinobacteria,20.24%)和拟杆菌门(Bacteroidetes,14.75%)。中游受德兴铜矿废水影响,Beta-proteobacteria丰度增大,而Actinobacteria丰度减小;下游受微生物间捕食影响,Bacteroidetes丰度下降。在细菌群落与环境因子的关系中,DO是解释乐安江细菌群落结构变化的最佳环境因子。[结论] 乐安江中游德兴铜矿废水和中下游农业、生活废水明显改变了水体细菌群落结构组成,使水体细菌群落特征从上游到下游发生显著变化。本研究为揭示人类活动对乐安江水生态环境的影响提供了参考性数据。
关键词:乐安江高通量测序细菌群落环境因子
Characteristics of bacterial community in Le'an River in winter based on high-throughput sequencing
Hanyu Xiao1,2, Peng Wang1,2

 , Junzheng Liu1,2, Chuanqiong Li1,2, Yan Li1,2, Jun Zhao1,2
, Junzheng Liu1,2, Chuanqiong Li1,2, Yan Li1,2, Jun Zhao1,2 1.Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022, Jiangxi Province, China;
2.School of Geography and Environment, Jiangxi Normal University, Nanchang 330022, Jiangxi Province, China
Received 23 March 2018; Revised 5 June 2018; Published online 19 July 2018
*Corresponding author: Peng Wang, Tel/Fax: +86-791-88120440; E-mail: wangpengjlu@jxnu.edu.cn
Supported by the National Natural Science Foundation of China (41661017), by the Natural Science Foundation of Jiangxi Province (20151BAB213035) and by the Key Ecological Security Monitoring Collaborative Innovation Center of Jiangxi Province (JXS-EW-00)
Abstract: [Objective] The aims of this study were to analyze the compositional changes of bacterial community in Le'an River from upstream to downstream, and to reveal the main environmental factors shaping the bacterial community. [Methods] The hydrochemical indicators in different reaches, such as C, N, P, Cu, Zn, As and Pb, were measured. High-throughput sequencing of 16S rRNA gene was used to profile the bacterial community structure. Non-metric Multidimensional Scale (NMDS) Analysis and Cluster Analysis of sampling sites based on Bray-Curtis distance were used to explore the bacterial community structure along Le'an River. Redundancy analyzed (RDA) was used to analyze the relationship between environmental factors and bacterial communities. [Results] The concentrations of C, N, P, Cu, Zn, As and Pb were higher in the middle and lower reaches than those in the upper reaches. The diversity of bacterial communities decreased in the middle reaches because of the wastewater from the Dexing Copper Mine, and the richness and diversity increased in the lower reaches because of the wastewater from the agricultural and domestic wastewater. The predominant bacteria composition was Beta-proteobacteria (53.03%), Actinobacteria (20.24%) and Bacteroidetes (14.75%). Due to the influence of Dexing Copper Mine, the abundance of Beta-proteobacteria increased in the middle reaches, while the abundance of Actinobacteria decreased. In the lower reaches, the abundance of Bacteroidetes decreased due to the inter-microbial predation. In the relationship between the bacterial community and environmental factors, dissolved oxygen (DO) was the best environmental factor explaining the changes of bacterial community structure along the Le'an River. [Conclusion] Wastewater from the Dexing Copper Mine in the middle reaches of Le'an River and the agricultural and domestic wastewater in the middle and lower reaches changed the bacterial community structure, resulting the significant changes of the bacterial community along Le'an River. These findings provide a reference for revealing the influences of human activities on the water ecology of the Le'an River.
Keywords: Le'an Riverhigh-throughput sequencingbacterial communityenvironmental factors
细菌群落是生物地球化学循环的重要参与者,是水生生态系统的重要组成部分,在污染物降解及营养物质循环过程中具有重要作用[1]。高通量测序技术[2-3]以其低成本、通量高和流程自动化以及快速准确获得样品微生物群落组成的特点,在河流[4-8]、湖泊水库[9-11]和海洋[12]等水体细菌群落结构研究中得到广泛应用。
河流是人类工农业用水和生活用水的主要来源,同时也是水循环和碳、氮、磷等元素循环的重要环节[1]。随着社会经济发展、城市化进程加快和污染物排放量的增加,很多河流水质开始下降,出现富营养化[13]、重金属污染[14]和有机污染[15]等环境问题,造成河流生态功能的退化。细菌群落是河流生态系统的重要组成部分,在河流污染物降解和转化中起关键作用[16]。Actinobacteria、Bacteroidetes和Proteobacteria是河流水体中常见的优势菌群[4, 6, 17-18]。河流细菌群落结构受河岸土壤细菌输入和各种类细菌的生长速率、捕食关系等因素影响,从上游至下游呈现趋势性变化。如英国泰晤士河[19]和欧洲多瑙河[20]从上游到下游细菌多样性逐渐降低,优势菌群由Bacteroidetes向Actinobacteria转变。人类活动引起的污水细菌输入以及污水中的水化学物质也会明显改变河流细菌群落[7]。如俄罗斯叶尼塞河[21]水体细菌群落结构与沿岸不同植被和人为活动强度相关;巴西西诺斯河[18]流经中游农业区和下游工业区后细菌群落结构发生显著的改变。
乐安江发源于江西省婺源县鄣公山南麓,全长279 km,流域面积9616 km2,是影响鄱阳湖水质的重要河流[22]。乐安江年平均入湖水量约占鄱阳湖支流入湖总水量的5%,但水体污染物中氨氮和总磷的年平均通量占入湖支流总通量的比值分别高达25%和15%[23],重金属污染也是鄱阳湖流域最为严重的河流之一[24]。乐安江污染物输入主要集中在中下游地区,包括中游矿区影响下的水体重金属污染[25]和中下游大面积耕地和城区建设用地影响下的水体氮磷营养盐污染[26]。目前没有针对乐安江水体细菌群落的研究,特别是中下游人类活动引起的河流污染对水体细菌群落的影响尚不清楚。本研究基于高通量测序技术分析乐安江水体细菌群落特征及其影响因素,主要目的是:(1)阐明乐安江水体细菌群落特征及其从上游到下游的变化趋势;(2)探讨人类活动引起的污水输入、河岸土壤细菌输入以及细菌的生长速率、捕食关系等因素对乐安江细菌群落的影响。
1 材料和方法 1.1 样品采集与水化学分析 本研究于2016年12月对乐安江干流进行采样(图 1),从上游到下游设置了15个采样点,河流上游地区(L01–L04)从源头婺源县至德兴铜矿,中游(L05–L10)从德兴铜矿矿区至乐平市,乐平市以下为下游(L11–L15)河段。为了降低环境条件和人为活动对于河流水体细菌群落结构的影响,采样时及其此前1周的时间内流域无降水事件发生,水体平均温度为14.3 ℃,流量大约为60 m3/s (参照虎山水文站当日流量值)。
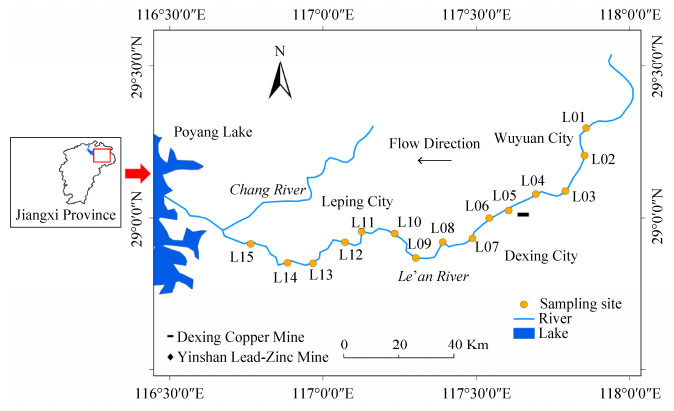 |
| 图 1 乐安江采样点位置示意图 Figure 1 Sampling sites in the Le'an River. |
| 图选项 |
用柱状采水器采集表层(深度50 cm)水样,利用便携式水质分析仪(HI9828,HANNA,Italy)现场测定水温(T)、电导率(EC)、溶解氧(DO)和pH值。用于水化学分析的水样采集250 mL,用于高通量测序的水样采集3 L。水样采集后冷藏运回实验室进一步分析。采用纳氏比色法测定水体氨态氮(NH4+-N)、酚二磺酸光度法测定水体硝态氮(NO3–-N)、过硫酸钾消解-钼锑抗分光光度法测定水体总磷(TP),用于测定NH4+-N和NO3–-N的水样通过0.45 μm孔径滤膜过滤。利用电感耦合等离子体质谱仪(ICP-MS)分析测定水体中可溶性重金属元素含量,样品检测之前,仪器采用标准物质(SRM,Accu Standard,Inc.,USA)进行3次重复检测并且进行极限检测,4种重金属的极限检测值分别为Cu 0.091 μg/L、Zn 0.025 μg/L、As 0.100 μg/L、Pb 0.026 μg/L。用于高通量测序的水样先通过5 μm孔径滤膜过滤去除颗粒杂质,然后通过0.22 μm孔径滤膜过滤。将过滤后的0.22 μm孔径滤膜放入–80 ℃冰箱保存,进行后续的DNA提取。
1.2 DNA提取和高通量测序 采用E.Z.N.A.? Soil DNA Kit(Omega Bio- tek,Norcross,GA,U.S.)提取基因组DNA,完成基因组DNA提取后,利用1%琼脂糖凝胶电泳检测抽提基因组DNA。对16S rRNA基因的V3–V4高变区片段进行PCR扩增。引物序列[27]为338F (5′-ACTCCTACGGGAGGCAGCA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)。反应条件:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,15个循环。循环结束后72 ℃最终延伸5 min。每个样本3个重复并进行混合来降低在DNA提取过程中实验操作产生的误差,然后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,混合后用Tris_HCl洗脱;2%琼脂糖电泳检测参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合。高通量测序在上海美吉生物医药科技有限公司Illumina Miseq PE300平台进行。
1.3 统计方法 利用Mothur (V.1.36.1)对原始DNA序列进行过滤处理,去除嵌合体,得到优化序列;按照97%相似性将优化序列划分可操作分类单元(OTU,Operational Taxonomic Units);采用RDP classifier贝叶斯算法对照Silva数据库以70%置信度对OTU代表序列进行物种分类。为避免各样品生物量的差异,按最小样本序列数进行样本序列抽平处理,得到标准化数据进行后续统计分析。基于OTU进行稀释性曲线分析,计算覆盖度(Coverage)、Chao1丰富度指数和Shannon-Weiner多样性指数。采用单因素方差分析进行不同河段水化学指标、细菌群落丰富度指数、多样性指数和细菌丰度差异的显著性检验(显著性水平P≤0.05视为差异显著)。利用R语言“Vegan”[28]软件包做基于Bray-Curtis距离的采样点非度量多维尺度(NMDS)分析和聚类分析,通过冗余分析(RDA)研究环境因子与细菌群落的关系。
2 结果和分析 2.1 水体理化性质 乐安江水体理化参数如表 1所示。pH值上游(8.10±0.43)>下游(7.06±0.41)>中游(7.05±0.51),上游显著大于下游(P=0.05)和中游(P=0.04),下游和中游间无显著差异(P=0.96)。德兴铜矿下游第一个点L05采样点,在所有采样点中pH值最低,但是EC和NO3–-N浓度最高。NO3–-N的平均浓度为1.298 mg/L,从上游到下游呈逐渐增加的趋势。水体NH4+-N的平均浓度为0.70 mg/L,属于国家地表水水质Ⅲ类标准(0.5–1.0 mg/L),其浓度中游(0.87±1.23 mg/L)>下游(0.85±0.30 mg/L)>上游(0.26±0.14 mg/L),各河段之间无显著差异,中游L07采样点浓度高达3.30 mg/L超过了国家地表水水质Ⅴ类1.15倍。TP浓度从上游到下游逐渐增大,较大的2个值出现在L07和L12采样点。DO的平均浓度为5.26 mg/L,从上游到下游逐渐降低。Cl–浓度平均值为10.0 mg/L,从上游到下游逐渐升高。SO42–浓度在中游最高,特别是德兴铜矿以下的L05、L06和L07采样点,平均浓度高达165.1 mg/L,显著高于平均值64.1 mg/L。
表 1. 乐安江水体理化参数 Table 1. Water physicochemical parameters of the Le'an River
| Reaches | Simple | pH | EC/ (μS/cm) | NH4+-N/ (mg/L) | NO3--N/ (mg/L) | Cl–/ (mg/L) | SO42–/ (mg/L) | DOC/ (mg/L) | TP/ (mg/L) | DO/ (mg/L) | Cu/ (μg/L) | Zn/ (μg/L) | As/ (μg/L) | Pb/ (μg/L) |
| Upper reaches | L01 | 7.9 | 67 | 0.18 | 0.57 | 1.6 | 3.3 | 5.67 | 0.001 | 6.6 | 3.37 | 29.24 | 1.23 | 1.47 |
| L02 | 7.6 | 64 | 0.46 | 0.77 | 1.1 | 2.2 | 5.34 | 0.056 | 6.8 | 2.50 | 9.68 | 1.04 | 0.50 | |
| L03 | 8.4 | 99 | 0.17 | 0.89 | 1.8 | 6.1 | 7.48 | 0.040 | 6.1 | 4.94 | 20.02 | 1.42 | 14.07 | |
| L04 | 8.5 | 133 | 0.21 | 0.90 | 1.8 | 16.4 | 9.06 | 0.025 | 6.4 | 4.78 | 16.75 | 1.28 | 0.69 | |
| Middle reaches | L05 | 6.2 | 520 | 0.39 | 4.68 | 4.8 | 202.4 | 5.89 | 0.060 | 5.6 | 10.16 | 34.42 | 2.07 | 2.58 |
| L06 | 7.1 | 388 | 0.19 | 1.02 | 5.3 | 141.6 | 8.90 | 0.009 | 5.2 | 6.77 | 21.04 | 3.01 | 0.93 | |
| L07 | 6.9 | 430 | 3.30 | 1.12 | 8.1 | 151.2 | 8.33 | 0.273 | 4.8 | 4.10 | 12.60 | 3.87 | 0.39 | |
| L08 | 7.0 | 221 | 0.99 | 1.06 | 5.9 | 59.8 | 8.31 | 0.064 | 4.3 | 3.49 | 32.80 | 1.72 | 0.40 | |
| L09 | 7.4 | 207 | 0.20 | 1.09 | 5.1 | 54.6 | 7.05 | 0.032 | 4.6 | 6.95 | 56.94 | 2.63 | 1.19 | |
| L10 | 7.7 | 204 | 0.16 | 1.04 | 4.5 | 46.7 | 7.12 | 0.036 | 4.7 | 4.51 | 25.31 | 2.86 | 0.55 | |
| Lower reaches | L11 | 6.8 | 224 | 0.14 | 1.07 | 4.2 | 45.0 | 5.10 | 0.001 | 5.7 | 3.13 | 24.84 | 1.92 | 0.38 |
| L12 | 6.7 | 406 | 1.98 | 1.30 | 36.7 | 70.7 | 6.16 | 0.229 | 4.7 | 3.24 | 39.42 | 2.40 | 0.31 | |
| L13 | 7.3 | 302 | 0.72 | 1.42 | 22.7 | 62.5 | 9.04 | 0.092 | 4.3 | 8.59 | 30.04 | 2.71 | 0.96 | |
| L14 | 7.6 | 313 | 0.69 | 1.28 | 20.8 | 50.8 | 6.49 | 0.084 | 4.9 | 4.76 | 11.59 | 2.02 | 0.54 | |
| L15 | 6.9 | 321 | 0.74 | 1.26 | 24.7 | 48.2 | 9.14 | 0.131 | 4.2 | 5.31 | 13.50 | 0.84 | 0.71 |
表选项
4种重金属Cu、Zn、As和Pb的平均浓度分别为5.11、25.21、2.07、1.71 μg/L,都达到了国家地表水水质Ⅰ类(Cu≤10 μg/L、Zn≤50 μg/L、As≤50 μg/L和Pb≤10 μg/L)标准。重金属Cu、Zn和As浓度在中游分别大于上游和下游地区,重金属Pb浓度上游 > 中游 > 下游,但未达到显著性水平。由于受德兴铜矿和银山铅锌矿的影响,中游L05采样点的Cu和Zn达到10.16 μg/L和34.42 μg/L,明显高于平均值。
水体理化参数的相关分析表明(表 2),EC与DO和pH之间存在显著的负相关关系。TP与NH4+-N和Cl–之间显著正相关。NO3–-N与Cu、Zn、Pb和As都呈正相关关系,SO42–与Cu、As和NO3–-N也是正相关,并且NO3–-N与SO42–显著正相关,说明中游水体较高浓度的NO3–-N、SO42–以及Cu、Zn、Pb和As都来自于德兴铜矿废水的输入。
表 2. 乐安江水体理化参数的相关性分析 Table 2. Correlation analysis of physicochemical parameters of the Le'an River
| Cu | Zn | Pb | As | NO3–-N | NH4+-N | DOC | EC | DO | pH | TP | Cl– | SO42– | |
| Cu | 1 | ||||||||||||
| Zn | 0.34 | 1 | |||||||||||
| Pb | 0.11 | -0.05 | 1 | ||||||||||
| As | 0.28 | 0.23 | -0.22 | 1 | |||||||||
| NO3--N | 0.71** | 0.23 | 0.01 | 0.09 | |||||||||
| NH4+-N | -0.21 | -0.13 | -0.23 | 0.51 | -0.01 | 1 | |||||||
| DOC | 0.30 | -0.16 | 0.01 | 0.20 | -0.18 | 0.17 | 1 | ||||||
| EC | 0.53* | 0.11 | -0.27 | 0.57* | 0.66** | 0.50 | 0.18 | 1 | |||||
| DO | -0.26 | -0.30 | 0.30 | -0.49 | -0.07 | -0.39 | -0.48 | -0.56* | 1 | ||||
| pH | -0.27 | -0.25 | 0.43 | -0.34 | -0.58* | -0.40 | 0.15 | -0.79** | 0.49 | 1 | |||
| TP | -0.12 | -0.12 | -0.17 | 0.41 | 0.06 | 0.95** | 0.18 | 0.55* | -0.46 | -0.42 | 1 | ||
| Cl- | 0.05 | 0.08 | -0.25 | 0.11 | 0.05 | 0.43 | 0.15 | 0.49 | -0.61* | -0.39 | 0.63* | 1 | |
| SO42- | 0.60* | 0.14 | -0.20 | 0.62* | 0.72** | 0.39 | 0.14 | 0.90** | -0.35 | -0.72** | 0.35 | 0.08 | 1 |
| *: Correlation is significant at the 0.05 level (2-tailed); **: Correlation is significant at the 0.05 level (2-tailed). | |||||||||||||
表选项
2.2 细菌群落结构 15个水样的高通量测序共得到563742条高质量基因序列,以97%相似度划分,得到436条OTUs,单个水样的OTU数量为188–331,平均值为255。各样本文库的覆盖率(coverage)范围均在99.7%以上,能够代表乐安江水体细菌群落的真实情况。Chao1指数范围为218–393,下游(339) > 中游(305) > 上游(71),下游显著大于上游(P=0.007), 其他河段之间无显著性差异。Shannon-Weiner多样性指数变化范围为2.74–4.21,平均值为3.37,下游(3.68) > 上游(3.34) > 中游(3.14),下游显著大于中游(P=0.017),其他河段之间无显著性差异。
表 3相关分析显示Chao1指数与环境因子DO显著负相关(P < 0.01),与Cl–显著负相关(P < 0.05)。Shannon-Weiner指数与环境因子无显著相关性。除重金属Cu离子与Shannon-Weiner指数呈正相关外,其他重金属离子均与Shannon-Weiner指数和Chao1指数呈负相关关系。NH4+-N、NO3–-N和TP与Shannon-Weiner指数负相关,与Chao1指数都呈正相关。
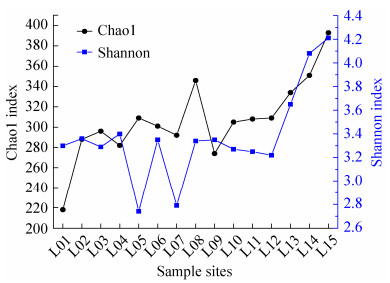 |
| 图 2 乐安江水体细菌群落多样性指数变化图 Figure 2 Dynamics of bacterial community diversity index in the Le'an River. |
| 图选项 |
表 3. 多样性指数与环境因子相关性 Table 3. Correlation between diversity index and environmental factors
| pH | EC | NH4+-N | NO3--N | DOC | TP | DO | Cu | Zn | As | Pb | Cl- | SO42- | |
| Shannon-Weiner | 0.24 | -0.20 | -0.27 | -0.37 | 0.30 | -0.11 | -0.28 | 0.17 | -0.25 | -0.07 | -0.12 | 0.46 | -0.48 |
| Chao1 | -0.39 | 0.42 | 0.14 | 0.18 | 0.40 | 0.29 | -0.66** | -0.09 | -0.29 | -0.43 | -0.11 | 0.56* | 0.16 |
| *: Correlation is significant at the 0.05 level (2-tailed); **: Correlation is significant at the 0.05 level (2-tailed). | |||||||||||||
表选项
基于Bray-Curtis距离的采样点聚类(图 3-A)和NMDS分析(图 3-B)表明,离德兴铜矿最近的L05采样点水体细菌群落结构与其他采样点差异明显,除此之外,其余14个采样点沿河水流向被分成4组,分别是上游的Group 1 (L01、L02、L03和L04采样点)、中游德兴铜矿到乐平市的Group 2 (L06、L07、L08、L09和L10采样点)、乐平市下游Group 3 (L11、L12和L13采样点)和Group 4 (L14和L15采样点),说明乐安江水体(除L05外)细菌群落结构从上游到下游发生显著的变化。单因素方差分析表明,Chao1指数Group 4 (371.77) > Group 3 (316.94) > Group 2 (303.75) > Group 1 (271.07),其中Group 4中Chao1指数显著大于Group 1和Group 2。Shannon-Weiner多样性指数Group 4 (4.14) > Group 3 (3.37) > Group 1 (3.34) > Group 2 (3.22),Group 4中Shannon-Weiner指数显著高于Group 1、Group 2和Group 3,其他组之间没有显著性差异。L05采样点的Chao1指数为309,与Group 2 (303.75)相当,但是Shannon-Weiner多样性指数2.74是15个采样点中最低的。
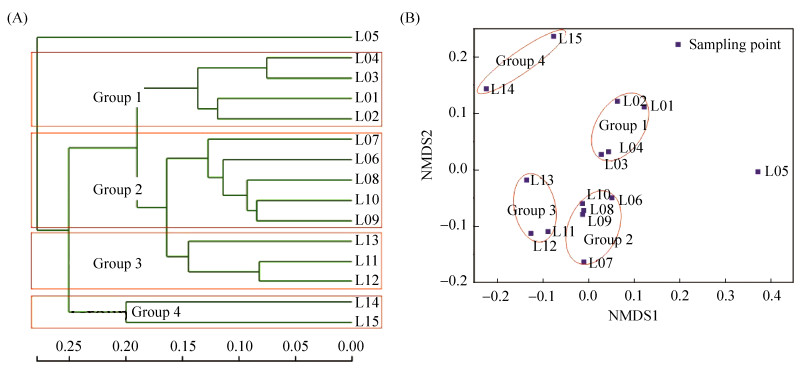 |
| 图 3 基于Bray-Curtis距离的采样点聚类(A)和非度量多维尺度(NMDS)分析(B) Figure 3 Hierarchical clustering tree (A) and nonmetric multidimensional scale (NMDS) plots (B) based on Bray-Curtis dissimilarity between water samples. ■: Sampling point. |
| 图选项 |
2.3 水体细菌群落组成 本次研究中436条OTUs属于27个门137个属。图 4为门水平细菌分类,丰度最高的是变形菌门(Proteobacteria,62.10%),其次是放线菌门(Actinobacteria,20.24%)、拟杆菌门(Bacteroidetes,14.75%)、疣微菌门(Verrucomicrobia,2.36%)、厚壁菌门(Firmicutes,0.14%)、蓝藻菌门(Cyanobacteria,0.11%)和绿弯菌门(Chloroflexi,0.07%),其他门类别的丰度均小于0.05%。变形菌门中β-变形菌纲(Beta-proteobacteria,53.03%)丰度最高,其次是α-变形菌纲(Alpha-proteobacteria,4.65%)和γ-变形菌纲(Gamma-proteobacteria,3.97%)。Proteobacteria、Actinobacteria和Bacteroidetes占基因序列总数的比例高达97.09%,是乐安江水体优势种群。
 |
| 图 4 乐安江水体门水平细菌分类 Figure 4 Phylum-level taxonomic composition of the bacterial community in the Le'an River. |
| 图选项 |
图 5为属水平细菌群落分类,图中Others是所有丰度小于1%的属类细菌群落总和,其他15种属水平分类有2种属于分类学数据库分类学谱系的中间等级,没有明确的分类名称,以norank作为标记。2种细菌在属分类级别分值较低,在数据库中没有找到对应于该序列的分类信息,统计时以Unclassified标记。Beta-proteobacteria中的Limnohabitans (31.35%)丰度最高,其次是Actinobacteria中的Sporichthyaceae_Unclassified (9.43%)、Beta-proteobacteria中的Polynucleobacter (5.29%)、Gamma-proteobacteria中的Pseudospirillum (5.14%)和Bacteroidetes中的Flavobacterium (3.19%)。
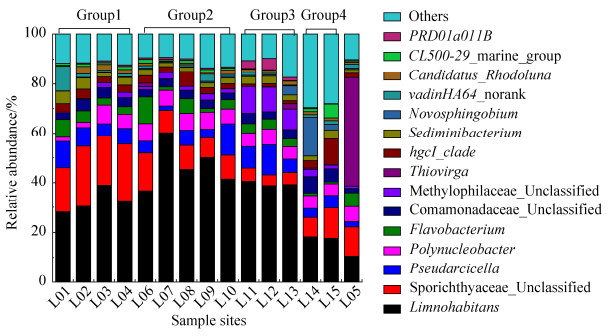 |
| 图 5 乐安江水体属水平细菌分类 Figure 5 Genus-level taxonomic composition of the bacterial community in the Le'an River. |
| 图选项 |
根据图 3-A基于Bray-Curtis距离的采样点聚类分组的单因素方差分析结果(表 4)显示,丰度最高的Beta-proteobacteria呈现先升高后降低的变化趋势,在中游Group 2和下游Group 3显著高于上游Group 1和Group 4,其他组间无显著性差异;Actinobacteria与Beta-proteobacteria变化趋势相反,在Group 2和Group 3的丰度较低,Group 3丰度为10.02%,是4个组中最低的,显著低于上游Group 1和下游Group 4;Bacteroidetes丰度Group 1 > Group 2 > Group 3 > Group 4,随河流流向逐渐降低,各组间无显著性差异。L05采样点的优势种群为Gamma-proteobacteria (45.10%)、Beta-proteobacteria (22.50%)和Actinobacteria (17.09%),Gamma-proteobacteria的丰度明显大于其他组别平均丰度。
表 4. 主要门水平细菌群落平均相对丰度基于Bray-Curtis距离分组均值表 Table 4. The average relative abundance of the main phyla level bacterial community based on the Bray-Curtis dissimilarity grouping mean table
| Beta-proteobacteria | Actinobacteria | Bacteroidetes | Alpha-proteobacteria | Gamma-proteobacteria | Verrucomicrobia | |
| Group 1 | 44.29b | 29.58a | 18.03a | 3.83a | 0.29b | 3.51a |
| Group 2 | 63.39a | 17.75cd | 13.60a | 2.65a | 0.76ab | 1.32a |
| Group 3 | 66.03a | 10.02d | 16.28a | 3.45a | 1.76a | 0.85a |
| Group 4 | 40.30b | 24.67abc | 11.30a | 13.99b | 2.08a | 5.29a |
| L05 | 22.50 | 17.09 | 9.71 | 2.87 | 45.10 | 1.71 |
| Unit: %. Different letters in the same column indicate the significant difference between groups through the LSD test at P < 0.05. | ||||||
表选项
在属水平上,对丰度大于1%的细菌群落单因素方差分析结果(文中未给出数据表格)显示,只有丰度最高的Limnohabitans在不同组之间存在显著差异。L05采样点Gammaproteobacteria中的Thiovirga (14.45%)丰度最高,明显大于其他组别的平均丰度。
2.4 细菌群落与环境因子 图 6为环境因子对主要门分类水平细菌群落的冗余分析结果。Monte Carlo检验可知,DO (P=0.018)是对门水平细菌群落具有显著影响的环境因子。其他环境因子对细菌群落结构也有一定程度的影响,但未达到显著性水平。第一主轴解释了门分类群落43.2%的方差变化,第一主轴和第二主轴共解释了60.6%的方差变化。其中大部分细菌与重金属Cu、Zn、As和Pb呈负相关,与营养物质DOC、TP和NH4+-N呈正相关关系。而丰度最高的Beta-proteobacteria与重金属Cu、Zn、As和Pb呈较强的正相关,与营养物质DOC、TP和NH4+-N呈负相关,与NO3–-N呈正相关。Actinobacteria与NH4+-N正相关,与其他营养物质及重金属呈负相关。Bacteroidetes与NH4+-N和重金属Pb正相关,与营养物质DOC、TP和NO3–-N呈负相关。环境因子NO3–-N与重金属Cu、Zn和As呈显著的正相关关系,说明乐安江水体NO3–-N浓度受到矿区污水排放影响较大,各细菌群落与矿区废水的排放关系密切。
 |
| 图 6 乐安江细菌门分类群落与环境因子的冗余分析 Figure 6 Redundancy analysis of bacterial phyla and environmental parameters in the Le'an River. |
| 图选项 |
3 讨论和结论 本次研究发现,乐安江水体细菌群落丰富度从上游到下游逐渐增大,多样性先减小后增大,下游最大。Savio等[20]对欧洲多瑙河研究发现,由于下游相对于上游河流宽度增加和来自沿岸自然环境影响的减弱,细菌群落丰富度和多样性随河流流向逐渐降低。本文研究的乐安江上游源头地区细菌多样性相对于中游地区较高,可能是因为源头与两岸之间的面积比值较大,易受两岸植被的影响[29]。中游水体流经德兴铜矿后pH值较上游有所下降,NO3–-N和SO42–的浓度也明显升高,说明河水受德兴铜矿酸性废水的影响,从而导致较低的细菌多样性。沿着河流流向细菌丰富度不断升高,表明有外源细菌的持续输入,而下游沿岸大面积的农业和城市生活污水正是大量外源细菌的来源,并且导致该河段相对较高多样性。de Oliveira等[18]对全长约200 km的巴西西诺斯河研究表明,从源头往下游先后受到农业和城镇的影响,大量的外源细菌输入河流中导致水体细菌多样性逐渐升高,与本文研究结果相似。
本研究发现乐安江水体优势菌群为β-变形菌纲(Beta-proteobacteria,53.03%)、放线菌门(Actinobacteria,20.24%)和拟杆菌门(Bacteroidetes,14.75%)。Beta-proteobacteria作为淡水生态系统中最重要的菌群之一,在河流中常常是最丰富的菌群[5, 30-31]。Beta-proteobacteria丰度沿乐安江先增大后减小。Ulrike Burkert等[32]对德国东北部的淡水湖泊格罗夫湖研究发现,Beta-proteobacteria随营养物质(N、P)的添加而迅速增加。乐安江中下游地区的Group 2和Group 3流经德兴铜矿和乐平市区,NH4+-N、NO3–-N和TP等营养物质浓度较上游迅速升高(表 1),促进了Beta-proteobacteria的生长和发育,导致了较高的丰度。Beta-proteobacteria还容易受到捕食的影响[33]。乐安江地处赣东北地区,发源于婺源县,上游主要以山地和丘陵为主,地势落差较大,水流较快,而中下游流经鄱阳湖平原,水流速度较上游变缓,水体停滞时间变长,水体细菌群落之间以及细菌群落与其他微生物群落之间的相互作用加强[19],被原生动物和其他菌群捕食的概率增大,从而导致下游Group 4中Beta-proteobacteria丰度下降。Actinobacteria的变化规律与Beta-proteobacteria的变化相反,丰度随水流方向先减小后增大,Taipale等[34]研究发现,Actinobacteria的丰度随DO浓度的降低而降低,乐安江水体DO浓度中游显著低于上游地区(P < 0.01),导致Actinobacteria丰度在中游最低,但是在下游地区Actinobacteria丰度有所升高,主要原因是Actinobacteria的体型相对其他细菌种类来说更小[35],这对于捕食比较强的下游地区来说使得Actinobacteria被捕食的概率大大降低。Bacteroidetes为乐安江水体第三丰富的细菌群落,沿河流流向逐渐下降。因为Bacteroidetes体型相对较大,易受到捕食的影响[36],沿着河流流向微生物间捕食压力逐渐加强,所以Bacteroidetes丰度呈现沿河流流向逐渐下降的趋势。
细菌群落与环境因子的RDA分析发现,DO是解释乐安江细菌群落结构变化最主要的环境因子。DO是影响水体细菌生存和繁殖的重要指标之一;同时DO受到水体多方面因素的影响,如温度,N、P营养盐和重金属,这些指标的变化又会影响细菌群落,从而使DO成为解释细菌群落结构变化的主要环境因子。Spietz等[37]调查了影响美国胡德运河水体细菌群落结构的多个指标发现,DO的作用比评估的其他非生物因子更强,与细菌丰度之间呈显著的负相关关系,主要原因是随着氧气消耗与减少,好氧生物为了避免缺氧区域和死亡,能量从大型动物转移到微生物。这种向细菌群落的能量转移会增加群落的丰富度,其中增加生物可利用的能量可以允许更多的细菌群落并存,从而导致更高的生物多样性[38]。本文还发现,DOC与大部分的细菌群落呈正相关关系,与其他****的研究结果相似[39],DOC是细菌生长过程中重要的能量来源,其含量的多少直接影响细菌的生长速度和生存时间。NO3–-N作为细菌生长过程中重要的营养物质来源,具有促进细菌生长的作用。但是在本文中发现,NO3–-N只与少数细菌群落呈正相关关系,例如Beta-proteobacteria这种能快速利用营养物质生长的菌群。NO3–-N与SO42–显著正相关,与环境因子中的重金属Cu、Zn和Pb呈正相关关系,说明乐安江水体NO3–-N受矿区的影响较大,而采矿废水中的有毒物质对大部分细菌的生长具有抑制作用。中游较低的pH值可能导致细菌群落结构组成的变化,RDA分析结果显示,pH值对细菌群落结构组成影响较大。Krause等[40]对Helgoland Roads海域水体进行酸化实验,研究发现Gamma-proteobacteria、Flavobacteriaceae、Rhodobacteraceae和Campylobacteraceae等菌群对pH值的变化比较敏感,其他细菌群落丰度也会随pH的适当改变发生变化。另外,乐安江中游NO3–-N和SO42–的浓度明显高于上下游,说明水体受到德兴铜矿工业废水的影响。
本研究的乐安江水体重金属Cu、Zn、As和Pb浓度最大值分别为11、39、4、14 μg/L。胡春华等[41]研究发现,2010年乐安江重金属Cu和Zn浓度在中游最高,分别为343 μg/L和90 μg/L。尚小龙等[42]研究发现,2012年乐安江重金属Cu的浓度在德兴铜矿的影响下达到最高值531 μg/L。与上述研究结果相比,本文研究的乐安江水体重金属含量明显降低,并且未发现重金属与细菌群落结构组成之间存在显著性关系,但结果分析表明德兴铜矿对中游水体细菌群落结构组成产生了较大的影响,说明德兴铜矿中的其他物质可能对细菌群落产生了影响,如上文已讨论过的DO、NO3–-N和pH等。
本次研究基于高通量测序技术,分析了2016年12月乐安江水体细菌群落从上游到下游的变化及其与人类活动的关系,结果表明德兴铜矿废水的输入降低了水体细菌群落的多样性,农业和生活污水中的营养物质和携带的外源细菌使得水体细菌群落的多样性升高。另外,细菌的生长速度和微生物间的捕食关系对乐安江水体细菌群落的组成和结构产生了较大的影响。本研究结果为揭示人类活动对乐安江水生态环境的影响提供了参考性数据。
References
| [1] | Cole JJ, Prairie YT, Caraco NF, McDowell WH, Tranvik LJ, Striegl RG, Duarte CM, Kortelainen P, Downing JA, Middelburg JJ, Melack J. Plumbing the global carbon cycle:Integrating inland waters into the terrestrial carbon budget. Ecosystems, 2007, 10(1): 172-185. DOI:10.1007/s10021-006-9013-8 |
| [2] | Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Lozupone CA, Turnbaugh PJ, Fierer N, Knight R. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4516-4522. |
| [3] | Liu C, Li JB, Rui JP, An JX, Li XZ. The applications of the 16S rRNA gene in microbial ecology:current situation and problems. Acta Ecologica Sinica, 2015, 35(9): 2769-2788. (in Chinese) 刘驰, 李家宝, 芮俊鹏, 安家兴, 李香真. 16S rRNA基因在微生物生态学中的应用. 生态学报, 2015, 35(9): 2769-2788. |
| [4] | Wang P, Chen B, Li CQ, Li Y. Bacterial communities in Nanchang section of the Ganjiang River in wet season. China Environmental Science, 2016, 36(8): 2453-2462. (in Chinese) 王鹏, 陈波, 李传琼, 李燕. 赣江南昌段丰水期细菌群落特征. 中国环境科学, 2016, 36(8): 2453-2462. DOI:10.3969/j.issn.1000-6923.2016.08.027 |
| [5] | Tang J, Xu XR, Shang CY, Niu XJ, Zhang XM, Yi Y. Association of bacterial diversity in city area of Nanming river with environmental factors. Acta Microbiologica Sinica, 2015, 55(8): 1050-1059. (in Chinese) 唐婧, 徐小蓉, 商传禹, 牛晓娟, 张习敏, 乙引. 南明河城区河段细菌多样性与环境因子的关系. 微生物学报, 2015, 55(8): 1050-1059. |
| [6] | Gibbons SM, Jones E, Bearquiver A, Blackwolf F, Roundstone W. Human and environmental impacts on river sediment microbial communities. PLoS One, 2014, 9(5): e97435. DOI:10.1371/journal.pone.0097435 |
| [7] | Wang P, Chen B, Yuan RQ, Li CQ, Li Y. Characteristics of aquatic bacterial community and the influencing factors in an urban river. Science of the Total Environment, 2016, 569-570: 382-389. DOI:10.1016/j.scitotenv.2016.06.130 |
| [8] | Sun HH, He XW, Ye L, Zhang XX, Wu B, Ren HQ. Diversity, abundance, and possible sources of fecal bacteria in the Yangtze River. Applied Microbiology and Biotechnology, 2017, 101(5): 2143-2152. DOI:10.1007/s00253-016-7998-2 |
| [9] | Liu LY, Lü X, Li W, Chen LH, Li YR, Lin BJ. Relationship between bacterial community and its environmental in Zuohai Lake, China. Acta Microbiologica Sinica, 2015, 55(9): 1177-1189. (in Chinese) 刘兰英, 吕新, 李巍, 陈丽华, 李玥仁, 林碧娇. 福州左海湖细菌群落与环境的关系. 微生物学报, 2015, 55(9): 1177-1189. |
| [10] | Kou WB, Huang ZY, Zhang J, Liu QC, Liu FP, Liu YZ, Wu L. Bacterial community structure and composition in Lake Poyang:a case study in the Songmenshan Region, China. Acta Ecologica Sinica, 2015, 35(23): 7608-7614. (in Chinese) 寇文伯, 黄正云, 张杰, 刘倩纯, 刘芳鹏, 刘以珍, 吴兰. 鄱阳湖湖泊细菌群落组成及结构——以松门山为例. 生态学报, 2015, 35(23): 7608-7614. |
| [11] | Chen ZJ, Ding CY, Zhu JY, Li B, Huang J, Du ZM, Wang Y, Li YY. Community structure and influencing factors of bacterioplankton during low water periods in Danjiangkou Reservoir. China Environmental Science, 2017, 37(1): 336-344. (in Chinese) 陈兆进, 丁传雨, 朱静亚, 李冰, 黄进, 杜宗明, 王亚, 李玉英. 丹江口水库枯水期浮游细菌群落组成及影响因素研究. 中国环境科学, 2017, 37(1): 336-344. |
| [12] | Bai J, Liu XS, Hou R, Zhao YG, Gao HW. Community structure and influencing factors of bacterioplankton in the southern South China Sea. China Environmental Science, 2014, 34(11): 2950-2957. (in Chinese) 白洁, 刘小沙, 侯瑞, 赵阳国, 高会旺. 南海南部海域浮游细菌群落特征及影响因素研究. 中国环境科学, 2014, 34(11): 2950-2957. |
| [13] | Yu LY, Yang H, Huang CC, Huang T, Yu YH, Jiang QL, Liu DQ, Li SD. Characteristic of nitrogen and phosphorous pollution in Lake Dianchi and its inflow rivers in summer. Journal of Lake Sciences, 2016, 28(5): 961-971. (in Chinese) 余丽燕, 杨浩, 黄昌春, 黄涛, 余艳红, 姜泉良, 刘大庆, 李帅东. 夏季滇池和入滇河流氮、磷污染特征. 湖泊科学, 2016, 28(5): 961-971. |
| [14] | Du XL, Qu JH, Liu HJ, Qi WX. Distributions of trace metals in the surface water in Wenyu River. Acta Scientiae Circumstantiae, 2012, 32(1): 37-42. (in Chinese) 杜晓丽, 曲久辉, 刘会娟, 齐维晓. 温榆河水体中重金属含量分布及赋存状态解析. 环境科学学报, 2012, 32(1): 37-42. |
| [15] | Sarria-Villa R, Ocampo-Duque W, Páez M, Schuhmacher M. Presence of PAHs in water and sediments of the Colombian Cauca River during heavy rain episodes, and implications for risk assessment. Science of the Total Environment, 2016, 540: 455-465. DOI:10.1016/j.scitotenv.2015.07.020 |
| [16] | Findlay S. Stream microbial ecology. Journal of the North American Benthological Society, 2010, 29(1): 170-181. DOI:10.1899/09-023.1 |
| [17] | Chen ZJ, Chen HY, Li YY, Huang J, Lu KJ, Zhao HJ, Li B, Zhu JY, Hu LQ. Community structure and influencing factors of bacterioplankton in the Main Cancel of the Mid-line Project of South-to-North Water Division in sections of Henan Province. China Environmental Science, 2017, 37(4): 1507-1513. (in Chinese) 陈兆进, 陈海燕, 李玉英, 黄进, 鲁开杰, 赵海军, 李冰, 朱静亚, 胡兰群. 南水北调中线干渠(河南段)浮游细菌群落组成及影响因素. 中国环境科学, 2017, 37(4): 1507-1513. |
| [18] | de Oliveira LFV, Margis R. The source of the river as a nursery for microbial diversity. PLoS One, 2015, 10(3): e0120608. DOI:10.1371/journal.pone.0120608 |
| [19] | Read DS, Gweon HS, Bowes MJ, Newbold LK, Field D, Bailey MJ, Griffiths RI. Catchment-scale biogeography of riverine bacterioplankton. The ISME Journal, 2015, 9(2): 516-526. DOI:10.1038/ismej.2014.166 |
| [20] | Savio D, Sinclair L, Ijaz UZ, Parajka J, Reischer GH, Stadler P, Blaschke AP, Bl?schl G, Mach RL, Kirschner AKT, Farnleitner AH, Eiler A. Bacterial diversity along a 2600 km river continuum. Environmental Microbiology, 2015, 17(12): 4994-5007. DOI:10.1111/1462-2920.12886 |
| [21] | Kolmakova OV, Gladyshev MI, Rozanov AS, Peltek SE, Trusova MY. Spatial biodiversity of bacteria along the largest arctic river determined by next-generation sequencing. FEMS Microbiology Ecology, 2014, 89(2): 442-450. DOI:10.1111/fem.2014.89.issue-2 |
| [22] | Chen B, Wang P, Zhang H. The review of nitrogen and phosphorus pollution in Poyang lake water. Journal of Jiangxi Normal University (Natural Science), 2016, 40(4): 437-441. (in Chinese) 陈波, 王鹏, 张华. 鄱阳湖水体氮磷污染研究进展. 江西师范大学学报(自然科学版), 2016, 40(4): 437-441. |
| [23] | Liu FG, Wang SG, Guo YY, Cao M. Spatial-temporal variations of pollutant fluxes of inflow and outflow of Lake Poyang (2008-2012). Journal of Lake Sciences, 2014, 26(5): 641-650. (in Chinese) 刘发根, 王仕刚, 郭玉银, 曹美. 鄱阳湖入湖、出湖污染物通量时空变化及影响因素(2008-2012年). 湖泊科学, 2014, 26(5): 641-650. |
| [24] | 周雪玲.乐安河-鄱阳湖段湿地水生植物对重金属的富集效应研究.江西师范大学硕士学位论文, 2014. |
| [25] | He ZJ, Yuan SL. Analysis on source and distribution of heavy metal of Le'an river. Guangdong Chemical Industry, 2009, 36(7): 139-141, 148. (in Chinese) 何宗健, 袁胜林. 乐安江流域重金属的来源与分布探析. 广东化工, 2009, 36(7): 139-141, 148. DOI:10.3969/j.issn.1007-1865.2009.07.053 |
| [26] | Li M, Gao HY, Zhang Q, Jiang SY. Spatial and temporal variations of non-point phosphorus leaching in Le'an River of Poyang Lake Basin. Journal of Southeast University (Natural Science Edition), 2015, 45(4): 805-810. (in Chinese) 李淼, 高海鹰, 张奇, 姜三元. 鄱阳湖乐安江流域非点源磷输移的时空变化. 东南大学学报(自然科学版), 2015, 45(4): 805-810. |
| [27] | Dennis KL, Wang YW, Blatner NR, Wang SY, Saadalla A, Trudeau E, Roers A, Weaver CT, Lee JJ, Gilbert JA, Chang EB, Khazaie K. Adenomatous polyps are driven by microbe-instigated focal inflammation and are controlled by IL-10-producing T cells. Cancer Research, 2013, 73(19): 5905-5913. DOI:10.1158/0008-5472.CAN-13-1511 |
| [28] | Oksanen J, Kindt R, Legendre P, Hara B, Stevens MHH, Oksanen MJ. The Vegan Package: Community Ecology Package. 2010. |
| [29] | Besemer K, Singer G, Quince C, Bertuzzo E, Sloan W, Battin TJ. Headwaters are critical reservoirs of microbial diversity for fluvial networks. Proceedings of the Royal Society B:Biological Sciences, 2013, 280(1771): 20131760. DOI:10.1098/rspb.2013.1760 |
| [30] | Liu ZH, Huang SB, Sun GP, Xu ZC, Xu MY. Phylogenetic diversity, composition and distribution of bacterioplankton community in the Dongjiang River, China. FEMS Microbiology Ecology, 2012, 80(1): 30-44. DOI:10.1111/j.1574-6941.2011.01268.x |
| [31] | Xia N, Xia XH, Liu T, Hu LJ, Zhu BT, Zhang XT, Dong JW. Characteristics of bacterial community in the water and surface sediment of the Yellow River, China, the largest turbid river in the world. Journal of Soils and Sediments, 2014, 14(11): 1894-1904. DOI:10.1007/s11368-014-0974-5 |
| [32] | Burkert U, Warnecke F, Babenzien D, Zwirnmann E, Pernthaler J. Members of a readily enrichedβ-Proteobacterial clade are common in surface waters of a humic lake. Applied and Environmental Microbiology, 2003, 69(11): 6550-6559. DOI:10.1128/AEM.69.11.6550-6559.2003 |
| [33] | ?imek K, Pernthaler J, Weinbauer MG, Hornák K, Dolan JR, Nedoma J, Ma?ín M, Amann R. Changes in bacterial community composition and dynamics and viral mortality rates associated with enhanced flagellate grazing in a mesoeutrophic reservoir. Applied and Environmental Microbiology, 2001, 67(6): 2723-2733. DOI:10.1128/AEM.67.6.2723-2733.2001 |
| [34] | Taipale S, Jones RI, Tiirola M. Vertical diversity of bacteria in an oxygen-stratified humic lake, evaluated using DNA and phospholipid analyses. Aquatic Microbial Ecology, 2009, 55(1): 1-16. |
| [35] | Hahn MW, Lünsdorf H, Wu QL, Schauer M, H?fle MG, Boenigk J, Stadler P. Isolation of novel ultramicrobacteria classified as Actinobacteria from five freshwater habitats in Europe and Asia. Applied and Environmental Microbiology, 2003, 69(3): 1442-1451. DOI:10.1128/AEM.69.3.1442-1451.2003 |
| [36] | Jürgens K, Pernthaler J, Schalla S, Amann R. Morphological and compositional changes in a planktonic bacterial community in response to enhanced protozoan grazing. Applied and Environmental Microbiology, 1999, 65(3): 1241-1250. |
| [37] | Spietz RL, Williams CM, Rocap G, Horner-Devine MC. A dissolved oxygen threshold for shifts in bacterial community structure in a seasonally hypoxic Estuary. PLoS One, 2015, 10(8): e0135731. DOI:10.1371/journal.pone.0135731 |
| [38] | Horner-Devine MC, Leibold MA, Smith VH, Bohannan BJM. Bacterial diversity patterns along a gradient of primary productivity. Ecology Letters, 2003, 6(7): 613-622. DOI:10.1046/j.1461-0248.2003.00472.x |
| [39] | Kirchman DL, Dittel AI, Findlay SEG, Fischer D. Changes in bacterial activity and community structure in response to dissolved organic matter in the Hudson River, New York. Aquatic Microbial Ecology, 2004, 35(3): 243-257. |
| [40] | Krause E, Wichels A, Giménez L, Lunau M, Schilhabel MB, Gerdts G. Small changes in pH have direct effects on marine bacterial community composition:a microcosm approach. PLoS One, 2012, 7(10): e47035. DOI:10.1371/journal.pone.0047035 |
| [41] | Hu CH, Zhou P, Huang P, Du J, Zhou WB. Behavior characteristics of dissolved heavy metals and health risks assessment from Poyang Lake basin, China. Journal of Agro-Environment Science, 2012, 31(5): 1009-1014. (in Chinese) 胡春华, 周鹏, 黄萍, 杜洁, 周文斌. 鄱阳湖流域溶解态重金属行为特征及健康风险评价. 农业环境科学学报, 2012, 31(5): 1009-1014. |
| [42] | Shang XL, Yu HP, Chen PQ, Jian MF. The impact of water environmental factors on the migration and transformation of heavy metals of Cu, Pb, Cd in Le'an River and Poyang Lake. Journal of Jiangxi Normal University (Natural Science), 2014, 38(6): 650-655. (in Chinese) 尚小龙, 余厚平, 陈朴青, 简敏菲. 乐安河-鄱阳湖段水环境因子对重金属Cu、Pb、Cd迁移转化的影响. 江西师范大学学报(自然科学版), 2014, 38(6): 650-655. DOI:10.3969/j.issn.1000-5862.2014.06.021 |
