王芙仙1,2,3, 郑世玲4, 邱浩1,2,3, 曹长乾1,2, 唐旭1, 郝立凯5, 刘芳华4, 李金华1,2


1.中国科学院地质与地球物理研究所, 地球与行星物理重点实验室, 中国科学院地球科学研究院, 北京 100029;
2.青岛海洋科学与技术国家实验室海洋地质过程与环境功能实验室, 山东 青岛 266061;
3.中国科学院大学, 北京 100029;
4.中国科学院烟台海岸带研究所, 海岸带生物学与生物资源保护重点实验室, 山东 烟台 264003;
5.中国科学院地球化学研究所, 环境地球化学国家重点实验室, 贵州 贵阳 550081
收稿日期:2018-01-18;修回日期:2018-03-12;网络出版日期:2018-03-18
基金项目:国家自然科学基金(41522402,41621004);青岛海洋科学与技术国家实验室海洋地质过程与环境功能实验室开放基金(MGQNLM201704);中国科学院“****”
作者简介:李金华, 中国科学院地质与地球物理研究所研究员, 博士生导师。地球生物学和生物地磁学专业, 长期从事地球科学与生命科学的前沿交叉研究, 先后主持国家自然科学基金优秀青年基金、面上项目(青年-面上连续资助)、国家自然科学基金青年基金等重要课题。已经发表SCI文章50余篇, 包括第一和通讯作者文章17篇, 主要发表在Earth and Planetary Science Letters、Geochemistry、Geophysics、Geosystems、JRS Interface、Geophysical Journal International和Applied Environmental Microbiology等期刊上, 并获邀为国际知名期刊Chemical Geology和中国科学撰写长篇综述文章。文章共被SCI引用461次, SCI他引268次, 其中, 第一作者论文SCI他引122次。获2015年度国家自然科学基金"优秀青年科学基金"资助和中国地球物理学会2015年"傅承义青年科技奖"称号
*通信作者:李金华, Tel:+86-10-82998323;Fax:+86-10-62010846;E-mail:lijinhua@mail.iggcas.ac.cn
摘要:[目的]研究铁还原细菌Shewanella oneidensis MR-4在细胞外诱导形成含铁矿物的矿物相、化学成分和形貌结构等特性及其变化,深化对铁还原细菌细胞外诱导矿化过程的认识。[方法]在以30 mmol/L乳酸钠为电子供体,10 mmol/L水合氧化铁为电子受体,[HCO3-]为30 mmol/L,[PO43-]为5 mmol/L条件下,30恒温下厌氧培养,进行细菌生长和细胞外诱导矿化实验,定期采样测量反应体系的pH、生物量、Fe(Ⅱ)浓度;采用激光拉曼光谱(Raman)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)和X-射线衍射(XRD)等方法对不同时间点的矿化产物进行分析。[结果]MR-4在还原Fe(Ⅲ)的过程中,细胞快速生长,表明MR-4的Fe(Ⅲ)还原和乳酸氧化过程相互耦合,从而进行细胞生长,并在细胞外诱导矿物形成。对不同阶段矿化产物的综合分析表明,反应进行到约8 d时,无定形-弱结晶的水合氧化铁部分地转化为纳米尺寸的磁铁矿晶体颗粒;约16 d时,反应体系中开始出现蓝铁矿晶体颗粒;约20 d后,几乎所有矿物转化为纤维状或者叶片状的蓝铁矿。[结论]铁还原细菌Shewanella oneidensis MR-4细胞外诱导矿化过程受环境条件控制,当以乳酸钠和水合氧化铁分别作为电子供体和受体,相对高的[PO43-]/[HCO3-](1:6)时,水合氧化铁先转化为磁铁矿,最后大量转化为蓝铁矿。本研究为全面认识铁还原细菌的生物诱导矿化过程和评估其参与铁元素地球化学循环提供了新的数据。
关键词: 铁还原细菌 生物诱导矿化 磁铁矿 蓝铁矿 电子显微学 激光拉曼 X射线衍射
Ferrihydrite reduction and vivianite biomineralization mediated by iron reducing bacterium Shewanella oneidensis MR-4
Fuxian Wang1,2,3, Shiling Zheng4, Hao Qiu1,2,3, Changqian Cao1,2, Xu Tang1, Likai Hao5, Fanghua Liu4, Jinhua Li1,2


1.Key Laboratory of Earth and Planetary Physics, Institute of Geology and Geophysics, Institutions of Earth Science, Chinese Academy of Sciences, Beijing 100029, China;
2.Laboratory for Marine Geology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266061, Shandong Province, China;
3.University of Chinese Academy of Sciences, Beijing 100029, China;
4.Key Laboratory of Coastal Biology and Biological Resources Conservation, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, Shandong Province, China;
5.State Key Laboratory of Environmental Geochemistry, Institute of Geochemistry, Chinese Academy of Sciences, Guiyang 550081, Guizhou Province, China
Received 18 January 2018; Revised 12 March 2018; Published online 18 March 2018
*Corresponding author: Jinhua Li, Tel: +86-10-82998323; Fax: +86-10-62010846; E-mail:lijinhua@mail.iggcas.ac.cn
Supported by the National Natural Science Foundation of China (41522402, 41621004), by the Open Project of Laboratory forMarine Geology, by the Qingdao National Laboratory for Marine Science and Technology (MGQNLM201704) and by the 100Talents Program of The Chinese Academy of Sciences
Abstract: [Objective]To explore the mineralogical, chemical and microscopic properties of extracellular vivianite formation induced by iron-reducing bacteria Shewanella oneidensis MR-4.[Methods]MR-4 cells grown with 30 mmol/L of lactate and 10 mmol/L of amorphous ferrihydrite, which were used as electron donor and electron acceptor, respectively. The medium was buffered with 30 mmol/L[HCO3-] and 5 mmol/L[PO43-], and the culture was incubated at 30℃. The headspace of serum bottle flushed with N2/CO2(V/V, 80/20). The pH, biomass and[Fe(Ⅱ)] of the culture were measured by sampling at different time points. Meanwhile, the combination of X-ray diffraction, scanning electron microscope, laser Raman and transmission electron microscope approaches were applied to characterize the mineralogical, chemical and morphological properties of products produced within the culture.[Results]MR-4 could couple the reduction of Fe(Ⅲ) with the oxidation of lactate for their cell growth and mineral transformation of Ferrihydrite. Specifically, ferrihydrite was initially transformed to nanometer-sized magnetite particles and majorly to micrometer-sized vivianite with bladed and fibrous morphologies finally.[Conclusion]The biomineralization process and products by MR-4 were strongly affected by environmental conditions such as the types and concentration of anions. In this case with relatively high[PO43-] within the culture, ferrihydrite was initially converted to nanometer-sized magnetite, and was transformed into vivianite dominantly at the end of the culture. The result of this paper provides a new insight for comprehensive understanding of the microbial induced biomineralization of iron-reducing bacteria and its role in the iron element biogeochemical cycle.
Key words: iron-reducing bacteria biomineralization magnetite vivianite electron microscopy laser Raman X-ray diffraction
铁是地壳中含量第四丰富的元素,是地球上分布最广的变价金属元素之一,也是地球上所有动物、植物和微生物的生命必需元素[1-2]。在自然环境中,微生物介导的铁循环及其与生物源要素碳、氮、氧、硫等耦合的氧化还原反应是微生物地球化学循环的重要驱动力[3]。一方面,铁细菌通过Fe(Ⅱ)的氧化或Fe(Ⅲ)的还原反应获得能量,供其细胞生长;另一方面,铁细菌介导的铁氧化或铁还原过程可直接或者间接地参与自然界含Fe矿物的迁移、富集、转化和沉淀,并直接影响碳、氮、氧等多种元素的生物地球化学循环[4-5]。
铁还原细菌是一类能够以Fe(Ⅲ)为电子受体进行代谢的微生物,广泛分布于厌氧和微好氧环境中,通过氧化电子供体耦联Fe(Ⅲ)还原,在细胞外诱导形成Fe(Ⅱ)(如菱铁矿、蓝铁矿)或Fe(Ⅱ)/Fe(Ⅲ)矿物(如磁铁矿),其反应式为:4Fe(Ш)+CH2O+H2O→4Fe(Ⅱ)+CO2+4H+[6]。近年来研究发现,异化铁还原(也被称为铁呼吸)是普遍存在的一种微生物代谢形式,可能是地球上最早的呼吸形式之一。因此,铁还原细菌研究对全面认识铁细菌参与铁元素的生物地球化学循环、揭示地球早期生命的能量代谢特征和生命演化具有重要意义[7]。此外,铁还原细菌通常还可以将水溶性的Cr(Ⅵ)、Se(Ⅳ)/Se(Ⅵ)、Tc(Ⅶ)和U(Ⅵ)等金属离子污染物分别还原成水溶性很低的Cr(Ⅲ)、Se(0)、Tc(Ⅳ)和U(Ⅳ),并将这些有毒重金属离子锁定到铁矿物的晶格中或者吸附在其表面,因此在重金属污染环境的生物修复中具有广阔的应用前景[8]。最后,通过诱导矿化和生物仿生方法,铁还原细菌通常能在细胞外大量形成十几纳米大小的磁铁矿晶体,其作为一种新型磁性纳米材料在生物医药或生物纳米材料领域具有广阔的应用前景[9]。
研究表明,铁还原细菌细胞外诱导矿化过程及其矿化产物主要受控于环境因素,包括微生物种类、培养基组成、培养条件、电子供体和电子受体的浓度比例、矿化底物的结晶程度等[10]。铁还原细菌可以将弱结晶的铁氧化物还原为离子态Fe(Ⅱ)或者含Fe(Ⅱ)矿物,已报道的有磁铁矿、菱铁矿、蓝铁矿和绿绣等[10-15]。前人对铁还原细菌诱导形成磁铁矿的过程和机制开展了大量研究[9, 12-14],相比较而言,目前对菱铁矿和蓝铁矿等非磁性矿物的铁还原细菌诱导矿化过程研究较少,其机制并不十分清楚。菱铁矿和蓝铁矿不仅是重要的Fe(Ⅱ)矿物,也是很多铁矿石的重要组分,甚至参与地球上一些古老岩层中微化石的保存[16-17]。同时,铁还原细菌将铁氧化物还原为菱铁矿和蓝铁矿或者绿绣时,比终产物为磁铁矿时有更强的有机物和污染物的氧化能力[18]。
铁还原细菌在1987年由美国科学家Lovley首次报道[19],目前的研究表明,铁还原细菌广泛分布于古菌和细菌,其群落结构与环境条件密切相关,两类比较重要的铁还原细菌分属于地杆菌属(Geobacteraceae)和希瓦氏菌属(Shewanella),常在湖泊、海底沉积物中发现,它们可以利用不同的有机物作为电子供体还原Fe(Ⅲ)并在细胞外诱导形成磁铁矿等含Fe(Ⅱ)矿物[20]。本研究以铁还原细菌Shewanellaoneidensis MR-4为材料,以30 mmol/L乳酸钠为电子供体,10 mmol/L水合氧化铁为电子受体,在[HCO3–]为30 mmol/L,[PO43–]为5 mmol/L,30恒温下厌氧培养,进行细菌生长和细胞外诱导矿化实验,研究铁还原细菌Shewanella oneidensis MR-4在细胞外诱导形成铁矿物的矿物相、化学成分和形貌结构等特性及其变化,认识铁还原细菌体外诱导形成蓝铁矿的矿化过程。
1 材料和方法 1.1 菌株及培养条件 Shewanellaoneidensis MR-4菌种获赠于德国图宾根大学(University ofTübingen) Kappler Andreas教授。MR-4是革兰氏阴性杆菌,长约2 μm,直径约0.7μm。MR-4于1991年分离自黑海,是最早被发现能利用含Fe(Ⅲ)以及含Mn(Ⅲ, Ⅳ)矿物作为末端电子受体的微生物之一[21]。
将冻存于–80冰箱中MR-4菌种接种至ATCC-1768培养基[22],接种前加入30mmol/L乳酸钠作为电子供体,培养基中柠檬酸铁作为电子受体,接种量为5%,30恒温条件下,厌氧避光培养。
培养基配方及制备方法如下(1L):柠檬酸铁6.85g (需溶解于提前加热煮沸的蒸馏水中,调pH至6.5),Wolfe’s维生素混合液10.0mL,Wolfe’s矿物质混合液10.0 mL,NaHCO32.50 g,NaH2PO4·H2O 0.60g,NH4Cl0.25 g,KCl0.10 g,使用NaOH溶液调节pH至6.5–7.0。其中,Wolfe’s矿物质混合液(1L):NTATrisodium Salt (Free acid) 1.50 g,MgSO43.00 g,MnSO4·H2O0.50 g,NaCl1.00 g,FeSO4·7H2O0.10 g,CaCl2·2H2O0.10 g,CoCl2·6H2O0.10 g,ZnCl20.13 g,CuSO4·5H2O 0.01 g,AlK(SO4)2·12H2O0.01 g,H3BO30.01 g,NaMoO4·2H2O0.09 g;Wolfe’s维生素混合液(1L):生物素0.002 g,泛酸0.005 g,维生素B12 0.0001 g,对氨基苯甲酸0.005g,硫辛酸(α-)0.005 g,烟酸0.005g,硫胺素0.005g,核黄素0.005g,盐酸吡哆醇0.01g,叶酸0.002g。培养基分装至100mL规格的西林瓶中(每瓶50mL),用硅胶塞密封瓶口,加盖铝盖,采用实验室定制的多通道厌氧气站(真空泵与充气装置),先抽真空后充气N2/CO2(V/V,80/20),重复7次,瓶内形成厌氧环境[23]。将高压蒸汽灭菌(121,1.01x105Pa,20min)后的培养基置于厌氧操作培养箱中[Coy厌氧手套箱,N2/H2(V/V,95/5)]完成菌种的转接和培养。
1.2 水合氧化铁(Ferrihydrite)制备 矿化实验利用无定形-弱结晶的水合氧化铁作为矿物底物(电子受体)。制备方法[6]为:先将1 mol/L氢氧化钠溶液匀速滴加至1mol/L FeCl3·6H2O溶液中,并不断快速搅拌,同时监测pH变化,直至pH达到7–8,之后继续搅拌约30min,溶液pH保持不变,用无菌除氧蒸馏水洗涤5–6次,备用。
1.3 MR-4细胞生长和矿化实验 将100mL经活化培养的MR-4细菌经无菌除氧蒸馏水洗涤(6000r/min,5min,4次,并浓缩到10mL,用无菌注射器转接1mL的初始MR-4细胞到矿化培养基中,初始接种细胞生物量(蛋白质浓度)为13.27μg/mL。矿化培养基配方修改自ATCC-1768培养基[22](无柠檬酸铁),接种前加入10mmol/L水合氧化铁和30mmol/L乳酸钠;接种后,30恒温条件下,厌氧避光培养。实验过程中设置一个空白对照(不接种细菌)和3个平行实验组。
1.4 pH测量 在矿化实验过程中,每隔一段时间用注射器取样4 mL,用来测量培养体系中的pH、生物量和Fe(Ⅱ)浓度的变化,取样间隔设置为0 (刚接种细菌)、2、4、6、8、10、12、14、16、20 d。取2 mL样品用于pH测量。另取2 mL样品经13000 r/min、5 min离心,其上清用于可溶性Fe(Ⅱ)浓度测量,沉淀用于生物量的测量,具体方法见1.5和1.6。
1.5 Fe(Ⅱ)浓度测量 培养体系中Fe(Ⅱ)离子浓度变化通过Ferrozine方法测量获得[24],其原理是Fe(Ⅱ)离子与Ferrozine试剂结合形成一种紫色络合物,通过分光光度计测量波长为562nm处的吸光值,再通过标准曲线校正,即可得到溶液中实际的Fe(Ⅱ)离子浓度。本实验中所测为矿化体系溶液中的可溶性Fe(Ⅱ)浓度,具体方法参照文献[14]。
1.6 生物量测量 由于矿物与MR-4细胞混合难以通过细菌计数法进行生物量测量,因此,本实验采用测量蛋白质浓度来间接反映培养体系中MR-4细胞的生长情况。具体方法为:将2 mL经13000 r/min、5 min离心后的样品重悬至300 μL 0.1 mol/L NaOH溶液中,90孵育15 min;将孵育后的样品离心(8000 r/min,20 min)后,使用BCA试剂盒(Thermo FisherScientific公司,中国)测量上清液中的蛋白浓度。
1.7 SEM和TEM观察 矿化实验中,在厌氧箱内对不同培养时间收集的矿物经除氧蒸馏水洗涤3次后收集,真空冷冻干燥,取少量溶解于无水乙醇中。对于扫描电镜(SEM)分析,将上述样品滴至载玻片上,在厌氧箱内干燥,镀金后,利用Nova NanoSEM450型SEM观察矿物形态及元素分布,观察电压为5–15kV。对于透射电镜(TEM)分析,将上述样品滴至碳支持膜上,在厌氧箱内干燥后,利用JEM-2100HR型TEM对样品形貌和结构进行分析(加速电压为200 kV),对感兴趣的区域或者颗粒进行选区电子衍射图谱(SAED)分析,从而获得产物的形貌、成分和晶体结构信息。
1.8 XRD和Raman分析 与SEM和TEM制样相类似,在厌氧箱中对不同培养时间收集的矿物经除氧蒸馏水洗涤3次后,真空冷冻干燥。对于XRD分析,将真空冷冻干燥后的样品用D/MAX-2400型X射线衍射仪进行分析,单色Cu靶Kα辐射,所加电流80mA,电压40kV,采集范围3–70°,精度1.2°/min,时间为6s。对于Raman分析,制样方法同SEM,之后利用LabRamHR800型激光共焦显微拉曼光谱仪对矿物结构和成分进行分析,激发波长为532 nm,光栅为600 gr/mm,物镜放大倍数为50倍,聚焦光斑大小约为1.5μm。
2 结果和分析 2.1 MR-4矿化过程中培养体系pH、细胞生物量和[Fe(Ⅱ)]的变化 在加入水合氧化铁作为电子受体后,反应体系溶液的颜色最初为红褐色,随着矿化过程的进行,颜色逐渐变黑,最终变透明,且底部有白色沉淀(图 1-A)。而整个过程中,反应体系的pH却没有明显的变化趋势,在7.2–7.6之间波动(图 1-B)。这可能与初始培养体系中有较高浓度的HCO3–作为缓冲有关。同时,每次取样时都会补入相同体积的N2︰CO2 (V/V,80/20)混合气来平衡气压,二者的共同作用下使得反应体系中的pH变化不明显。
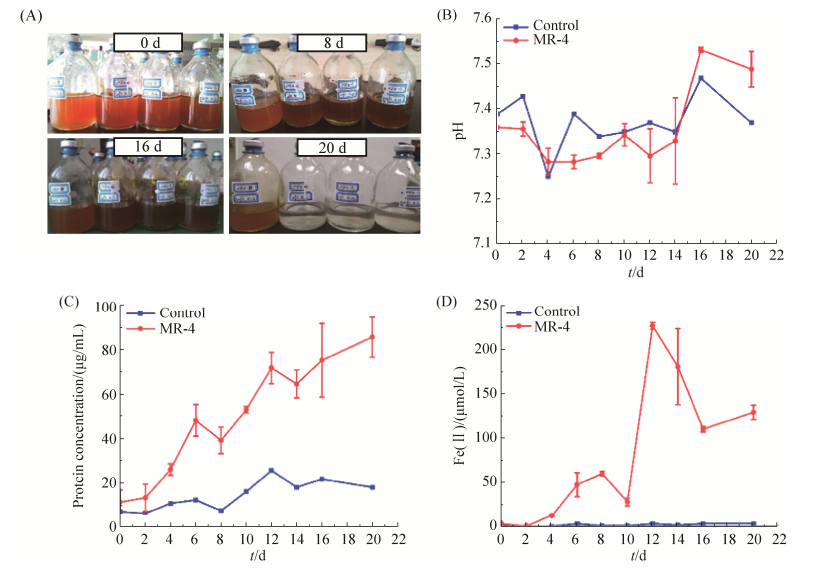 |
| 图 1 MR-4矿化过程中的细胞培养照片(A)、矿化体系溶液的pH(B)、蛋白浓度(C)和Fe(Ⅱ)离子浓度(D)随时间变化的曲线 Figure 1 The culture ofMR-4 cell (A), time lapse changes of solution pH (B), protein concentration (C)and Fe(Ⅱ) concentration(D) during MR-4 biomineralization. |
| 图选项 |
随着时间延长,蛋白总浓度的增长表明培养体系中生物量整体呈增长趋势,如图 1-C所示,指示在矿化过程中MR-4细胞快速生长。伴随着体系中生物量的变化,反应体系溶液中Fe(Ⅱ)离子浓度也发生了明显变化,如图 1-D所示,在0–10d时,溶液中Fe(Ⅱ)浓度增长相对缓慢,此时形成纳米尺寸磁铁矿,可能指示还原形成的Fe(Ⅱ)可能直接与周围临近的水合氧化铁作用,通过重结晶形成磁铁矿。在10–12d中,溶液中Fe(Ⅱ)浓度快速增加,指示Fe(Ⅲ)还原速率继续增快,同时水合氧化铁底物浓度降低,不足以将还原生成的Fe(Ⅱ)在原位进行反应,因此释放到溶液中。随着继续培养,12–20d时溶液中Fe(Ⅱ)浓度的持续降低,可能指示大量释放到溶液中的Fe(Ⅱ)与溶液中的阴离子基团共沉淀形成含Fe(Ⅱ)矿物。
2.2 矿化产物矿物相和形貌变化 对反应底物和矿化产物的XRD分析表明(图 2),反应底物的XRD谱没有明显的衍射峰,在2θ为约25°和34°附近出现2个弱且宽的峰,表明合成的底物为无定形-弱结晶的2线水合氧化铁。当反应进行至8d时,在2θ约为35°、57°处,分别出现几个微弱且宽的衍射峰,对应磁铁矿(PDF#19-0629)的(311)和(440)晶面,表明此时反应体系中有磁铁矿形成。16d时,除了磁铁矿的衍射峰外,在2θ约为13°和43°处,出现2个尖锐的小峰,分别对应蓝铁矿的(020)和(–350)晶面,指示此时反应体系中已经有少量蓝铁矿产生。20d后,矿化产物XRD谱与标准蓝铁矿(PDF#30-0662)XRD谱的衍射峰基本吻合,其主要衍射峰所对应的晶面见图 2所示,指示矿化终产物主要为蓝铁矿。
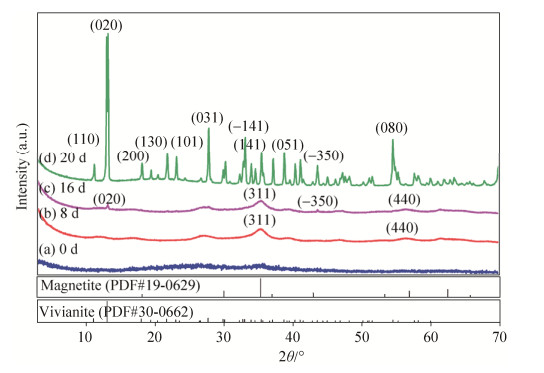 |
| 图 2 矿化反应底物和不同时间矿化产物的X射线衍射图谱 Figure 2 XRD spectra ofbiomineralization products during MR-4 biomineralization. a: 0 d; b: 8 d; c: 16d; d: 20 d. |
| 图选项 |
SEM观察表明(图 3),反应底物水合氧化铁呈不规则形态。当反应进行至16d时,有薄片状的矿物形成;20d时,矿物大多呈纤维状和叶片状规则形态,大小约为30–50μm。对这些矿物进行扫描电镜能谱分析,可看到矿化终矿物主要由O、Fe和P元素组成,如图 3-P–3-U,结合XRD结果,推测该矿物为蓝铁矿[Fe3(PO3)2·8H2O]。值得注意的是,反应过程中生成的磁铁矿尺寸太小,为纳米级,容易吸附在反应底物水合氧化铁或微米级的蓝铁矿上,导致不能清晰地被SEM观测到。由于对收集的矿化产物样品没有进行细胞固定和脱水处理,因此在矿化产物的SEM观察结果中没有观察到完整的细胞结构,但是在矿物表面可以看到明显的细胞形态痕迹以及附着在矿物表面的塌陷的细胞,如图 3-J–3-O。
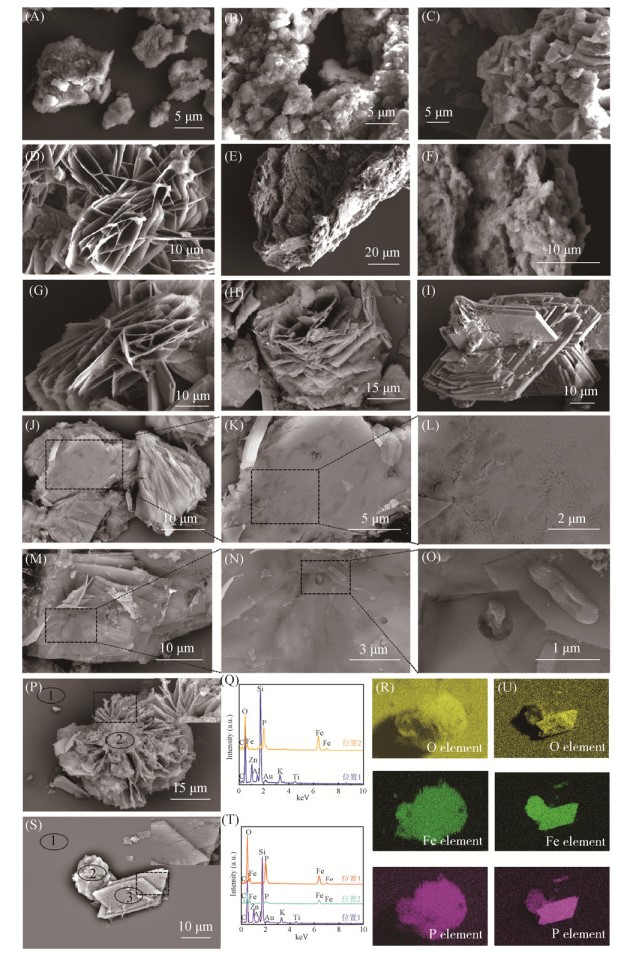 |
| 图 3 MR-4矿化过程中不同时间矿化产物的扫描电子显微镜图像 Figure 3 SEM images of biomineralizationproducts of during MR-4 biomineralization. A: 0 d; B: 8 d; C: 12 d; D–F: 16 d; G–I: 20 d, bladed and fibrous morphology of vivianite; J–L and M–O: microbialtrace and the MR-4 cells on vivianite; P–R and S–U: EDS analyse of fibrous andbladed morphologies of vivianite, respectively. |
| 图选项 |
2.3 矿化产物微区结构和成分的变化 采用Raman和TEM在微观尺度上分析了矿化产物的结构和成分特征。如图 4所示,反应底物水合氧化铁在Raman谱图上的特征波数约在710cm–1处(图 4-c)。随着反应进行到8–16d时,除了水合氧化铁的特征峰,Raman谱图在310cm–1和670 cm–1处,出现了2个特征峰,指示磁铁矿的存在。20d时,磁铁矿的Raman特征峰进一步加强,指示水合氧化铁含量降低或/和磁铁矿含量的进一步增加。此外,Raman检测到蓝铁矿的存在。Raman分析结果与XRD结果一致。
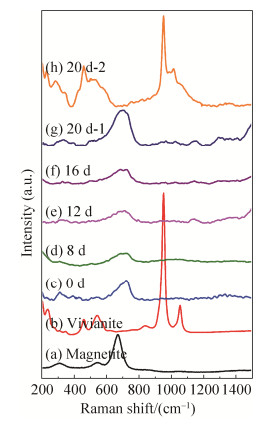 |
| 图 4 MR-4矿化过程中不同时间矿化产物的激光拉曼光谱图 Figure 4 Raman spectra of biomineralizationproducts during MR-4 biomineralization. a: magnetite standard raman spectra; b:vivianite standard raman spectra; c: 0 d; d: 8 d; e: 12 d; f: 16 d; g, h: 20 d. |
| 图选项 |
TEM和SAED分析表明,反应底物水合氧化铁矿物聚集成团块状,为无定形-弱结晶的水合氧化铁(图 5-A,B)。对反应8d的矿化产物分析发现,纳米级颗粒矿物聚集且与水合氧化铁团块相连或聚集。高分辨TEM观察下可见明显的晶格排列,SAED图谱显示了典型磁铁矿的衍射环,从内到外分别对应磁铁矿晶面:(220)、(311)、(400)、(511)和(440)(图 5-C-F)。对20d反应后矿化产物的TEM和SAED分析表明,此时矿化产物以微米级的蓝铁矿为主(图 5-G、H),与SEM和XRD分析结果一致。
 |
| 图 5 MR-4矿化过程中不同时间矿化产物的透射电子显微镜图像和选区电子衍射图谱 Figure 5 TEM images and SAED spectra ofbiomineralization products of during MR-4 biomineralization. A, B: 0 d, ferrihydrite; C–F: 8 d, nanosized crystallized magnetite; G, H: 20 d, vivianite. |
| 图选项 |
3 讨论 本研究详细研究了铁还原细菌Shewanellaoneidensis MR-4在给定实验条件下,以弱结晶的水合氧化铁为反应底物,在细胞外诱导矿化形成铁矿物的过程。对整个过程中反应体系的生物量和Fe(Ⅱ)浓度变化、矿化产物的矿物相和微观结构等特征的综合分析表明,MR-4在还原Fe(Ⅲ)的过程中,伴随着细胞的生长,水合氧化铁首先被转换成纳米尺寸的磁铁矿,这些纳米尺寸的磁铁矿通常与团块状的水合氧化铁临近或相连,这可能是因为反应初期MR-4细胞处于适应期,Fe(Ⅲ)还原速度相对较慢,Fe(Ⅱ)释放速度也相对较慢,直接与水合氧化铁发生重结晶反应生成磁铁矿。随着时间延长和MR-4细胞活力增强,Fe(Ⅲ)还原速度加快,大量的Fe(Ⅱ)释放到溶液中,与PO43–发生反应,大量生成微米尺寸的纤维状或叶片状蓝铁矿。
研究已经发现,铁还原细菌矿化产物与培养基中阴离子的种类及其浓度显著相关[25]。当以HEPES为缓冲液的培养基中,水合氧化铁被还原的终产物为磁铁矿(Fe3O4);在HCO3–缓冲的培养基中,水合氧化铁容易被还原为菱铁矿(FeCO3);而当培养基中含磷酸盐时,也会有蓝铁矿[Fe3(PO4)2·8H2O]生成[18, 25-26]。在本研究中,[HCO3–]为30mmol/L,[PO43–]为5mmol/L,矿化产物以蓝铁矿为主,还有少量的磁铁矿。这表明,MR-4在细胞外诱导形成铁矿的种类与组成,与培养体系中的阴离子种类密切相关,还受控于这些阴离子之间的相对含量,以及Fe(Ⅱ)的释放速度。总的来讲,相对高的[PO43–]可能更有利于蓝铁矿的形成。
研究发现,磷酸盐是一种严重的水体污染物,是促进水体富营养化的重要因素之一,且难以去除,而铁还原细菌通过矿化过程使Fe(Ⅱ)与磷酸盐结合形成稳定的蓝铁矿从而有效去除水体中的磷酸盐成分,因此研究铁还原细菌矿化形成蓝铁矿的过程对于原位污水治理具有重要的意义[27]。铁还原细菌在细胞外诱导矿化,能形成大量的磁性或非磁性铁矿物。与在细胞内形成磁铁矿的趋磁细菌相比,铁还原细菌转化形成铁矿物的速度快、规模大、产量多,因此,可能对自然界含Fe矿物的迁移、富集、转化和沉淀贡献更大。越来越多的证据表明微生物(如铁氧化细菌和铁还原细菌)可能广泛参与了地球上条带状铁矿建造(BIFs)的沉积过程[3]。本研究在实验室条件下研究了铁还原细菌MR-4还原铁氧化物形成磁铁矿和蓝铁矿的过程,为研究铁还原细菌参与BIFs成矿以及评估其参与铁元素地球化学循环提供了数据支持,同时也为利用铁细菌的生物矿化作用开展环境修复和生物仿生等纳米地球科学应用提供指导。
致谢: 本研究的顺利完成特别感谢德国图宾根大学(Universityof Tübingen) Kappler Andreas教授提供Shewanella oneidensisMR-4菌株;同时,感谢中国科学院地质与地球物理研究所电子显微镜实验室、流体包裹体研究实验室和岩矿制样与分析(岩石物性)实验室提供实验平台完成扫描电镜、透射电镜、激光拉曼和X射线衍射实验分析。
References
| [1] | Chen L, Zhang HX, Li Y, Zheng SL, Liu FH. The role of microorganisms in the geochemical iron cycle. Scientia Sinica:Vitae, 2016, 46(9): 1069-1078. (in Chinese) 陈蕾, 张洪霞, 李莹, 郑世玲, 刘芳华. 微生物在地球化学铁循环过程中的作用. 中国科学:生命科学, 2016, 46(9): 1069-1078. |
| [2] | Zhang GX, Dong HL, Jiang HC, Kukkadapu RK, Kim J, Eberl D, Xu ZQ. Biomineralization associated with microbial reduction of Fe3+ and oxidation of Fe2+ in solid minerals. American Mineralogist, 2009, 94(7): 1049-1058. DOI:10.2138/am.2009.3136 |
| [3] | Kendall B, Anbar AD, Kappler A, Konhauser KO. The global iron cycle//Knoll AH, Canfield DE, Konhauser KO. Fundamentals of Geobiology. Oxford: Blackwell Publishing Ltd, 2012: 65-92. |
| [4] | Melton ED, Swanner ED, Behrens S, Schmidt C, Kappler A. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle. Nature Reviews Microbiology, 2014, 12(12): 797-808. DOI:10.1038/nrmicro3347 |
| [5] | Konhauser KO, Kappler A, Roden EE. Iron in microbial metabolisms. Elements, 2011, 7(2): 89-93. DOI:10.2113/gselements.7.2.89 |
| [6] | Lovley DR, Holmes DE, Nevin KP. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction. Advances in Microbial Physiology, 2004, 49: 219-286. DOI:10.1016/S0065-2911(04)49005-5 |
| [7] | Tor JM, Lovley DR. Anaerobic degradation of aromatic compounds coupled to Fe(Ⅲ) reduction by Ferroglobus placidus. Environmental Microbiology, 2001, 3(4): 281-287. DOI:10.1046/j.1462-2920.2001.00192.x |
| [8] | Lloyd JR, Sole VA, van Praagh CVG, Lovley DR. Direct and Fe(Ⅱ)-mediated reduction of technetium by Fe(Ⅲ)-reducing bacteria. Applied and Environmental Microbiology, 2000, 66(9): 3743-3749. DOI:10.1128/AEM.66.9.3743-3749.2000 |
| [9] | Byrne JM, Coker VS, Moise S, Wincott PL, Vaughan DJ, Tuna F, Arenholz E, van der Laan G, Pattrick RAD, Lloyd JR, Telling ND. Controlled cobalt doping in biogenic magnetite nanoparticles. Journal of the Royal Society Interface, 2013, 10(83): 20130134. DOI:10.1098/rsif.2013.0134 |
| [10] | Dong HL, Fredrickson JK, Kennedy DW, Zachara JM, Kukkadapu RK, Onstott TC. Mineral transformations associated with the microbial reduction of magnetite. Chemical Geology, 2000, 169(3/4): 299-318. |
| [11] | Zachara JM, Kukkadapu RK, Fredrickson JK, Gorby YA, Smith SC. Biomineralization of poorly crystalline Fe(Ⅲ) oxides by dissimilatory metal reducing bacteria (DMRB). Geomicrobiology Journal, 2002, 19(2): 179-207. DOI:10.1080/01490450252864271 |
| [12] | Roh Y, Zhang CL, Vali H, Lauf RJ, Zhou J, PHelps TJ. Biogeochemical and environmental factors in Fe biomineralization:Magnetite and siderite formation. Clays and Clay Minerals, 2003, 51(1): 83-95. DOI:10.1346/CCMN.2003.510110 |
| [13] | Wu WF, Wang FP, Li JH, Yang XW, Xiao X, Pan YX. Iron reduction and mineralization of deep-sea iron reducing bacterium Shewanella piezotolerans WP3 at elevated hydrostatic pressures. Geobiology, 2013, 11(6): 593-601. |
| [14] | Salas EC, Berelson WM, Hammond DE, Kampf AR, Nealson KH. The impact of bacterial strain on the products of dissimilatory iron reduction. Geochimica et Cosmochimica Acta, 2010, 74(2): 574-583. DOI:10.1016/j.gca.2009.10.039 |
| [15] | Sánchez-Román M, Rivadeneyra MA, Vasconcelos C, McKenzie JA. Biomineralization of carbonate and phosphate by moderately halophilic bacteria. FEMS Microbiology Ecology, 2007, 61(2): 273-284. DOI:10.1111/fem.2007.61.issue-2 |
| [16] | Radvanec M, Grecula P, ?ák K. Siderite mineralization of the Gemericum superunit (Western Carpathians, Slovakia):review and a revised genetic model. Ore Geology Reviews, 2004, 24(3/4): 267-298. |
| [17] | Rothe M, Kleeberg A, Hupfer M. The occurrence, identification and environmental relevance of vivianite in waterlogged soils and aquatic sediments. Eatrh-Science Reviews, 2016, 158: 51-64. |
| [18] | Fredrickson JK, Zachara JM, Kennedy DW, Dong HL, Onstott TC, Hinman NW, Li SM. Biogenic iron mineralization accompanying the dissimilatory reduction of hydrous ferric oxide by a groundwater bacterium. Geochimica et Cosmochimica Acta, 1998, 62(19/20): 3239-3257. |
| [19] | Lovley DR, Stolz JF, Nord Jr GL, Phillips EJP. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism. Nature, 1987, 330(6145): 252-254. DOI:10.1038/330252a0 |
| [20] | Lin B, Hyacinthe C, Bonneville S, Braster M, van Cappellen P, R ling WFM. Phylogenetic and physiological diversity of dissimilatory ferric iron reducers in sediments of the polluted Scheldt estuary, Northwest Europe. Environmental Microbiology, 2007, 9(8): 1956-1968. DOI:10.1111/emi.2007.9.issue-8 |
| [21] | Nealson KH, Myers CR, Wimpee BB. Isolation and identification of manganese-reducing bacteria and estimates of microbial Mn(Ⅳ)-reducing potential in the Black Sea. Deep Sea Research A. Oceanographic Research Papers, 1991, 38(S2): S907-S920. |
| [22] | Lovley DR, Giovannoni SJ, White DC, Champine JE, Phillips EJP, Gorby YA, Goodwin S. Geobacter metallireducens gen. nov. sp. nov., a microorganism capable of coupling the complete oxidation of organic compounds to the reduction of iron and other metals. Archives of Microbiology, 1993, 159(4): 336-344. DOI:10.1007/BF00290916 |
| [23] | Zheng SL, Zhang HX, Li Y, Zhang H, Wang QM, Zhang J, Liu FH. Co-occurrence of Methanosarcina mazei and Geobacteraceae in an iron (Ⅲ)-reducing enrichment culture. Frontiers in Microbiology, 2015, 6: 941. |
| [24] | Stookey LL. Ferrozine-a new spectrophotometric reagent for iron. Analytical Chemistry, 1970, 42(7): 779-781. DOI:10.1021/ac60289a016 |
| [25] | Lemos VP, da Costa ML, Lemos RL, de Faria MSG. Vivianite and siderite in lateritic iron crust:an example of bioreduction. Química Nova, 2007, 30(1): 36-40. |
| [26] | Tang J, Zhuang L, Ma JL, Tang ZY, Yu Z, Zhou SG. Secondary mineralization of ferrihydrite affects microbial methanogenesis in Geobacter-Methanosarcina cocultures. Applied and Environmental Microbiology, 2016, 82(19): 5869-5877. DOI:10.1128/AEM.01517-16 |
| [27] | Azam HM, Finneran KT. Fe(Ⅲ) reduction-mediated phosphate removal as vivianite (Fe3(PO4)2·8H2O) in septic system wastewater. Chemosphere, 2014, 97: 1-9. DOI:10.1016/j.chemosphere.2013.09.032 |
