李宁宁1, 张瑞蕊1, 剡文莉2, 张艳2, 倪永清2


1.石河子大学生命科学学院, 新疆 石河子 832000;
2.石河子大学食品学院, 新疆 石河子 832000
收稿日期:2018-01-06;修回日期:2018-04-12;网络出版日期:2018-05-25
基金项目:国家自然科学基金(40961002,41140009,41271268)
*通信作者:倪永清,Tel:+86-993-2058095;E-mail:niyqlzu@sina.com
摘要:[目的] 分析真菌群落结构和多样性随着一号冰川退缩前沿年代序列的变化,揭示真菌群落的演替轨迹及环境因子对群落组成的影响。[方法] 采用宏基因组学研究方法,结合生物信息学和统计学分析技术,对取自一号冰川末端表面冰尘,底部和前沿14个样品进行总DNA的提取,ITS基因的扩增并使用Illumina Miseq平台测序,通过相关生物地理化学特性综合分析在不同年代序列下真菌群落结构及其演替规律。[结果] 经测序,筛选和质控分析获得185103条raw reads,占78.3%的非单序列在97%的相似度聚类分析共得到300个操作分类单元(OTU),共划分为6个门:子囊菌门(Ascomycota,52.7%)、担子菌门(Basidiomycota,16.9%)、壶菌门(Chytridiomycota,15.1%)、接合菌门(Zygomycota,2.4%)和球囊菌门(Glomeromycota,1.2%)。从演替初期到后期阶段虽然子囊菌的序列数逐渐下降而担子菌出现缓慢上升趋势,但子囊菌随着土壤年代序列的增加始终为优势类群,壶菌在冰川底部和前沿基层普遍存在且丰度仅次于子囊菌和担子菌。我们在缺乏植被的最新退缩基层发现依靠自养型宿主存活的活体营养菌,如Taphrinomycetes、Urediniomycetes和Ustilaginomycetes。从冰川底部和前沿基层检测到丰度较高的酵母菌,而粪生真菌(coprophilous fungi)仅仅出现在冰川前沿基层,共23个操作分类单元。球囊菌仅在前沿部分样品中存在,有着十分狭小的生态位分布。[结论] 一号冰川前沿随着年代序列的增加真菌群落存在明显的演替轨迹和多样性的显著变化,不同生态位真菌类群组成的相似性较低且都存在明显的指示性真菌类群。
关键词:真菌真菌群落冰川前沿多样性演替
Community structure and succession of fungi in the forefront of Tianshan No. 1 glacier, China
Ningning Li1, Ruirui Zhang1, Wenli Yan2, Yan Zhang2, Yongqing Ni2


1.School of Life Sciences, Shihezi University, Shihezi 832000, Xinjiang Uygur Autonomous Region, China;
2.School of Food Sciences, Shihezi University, Shihezi 832000, Xinjiang Uygur Autonomous Region, China
Received 6 January 2018; Revised 12 April 2018; Published online 25 May 2018
*Corresponding author: Yongqing Ni, Tel:+86-993-2058095;E-mail:niyqlzu@sina.com
Supported by the National Natural Science Foundation of China (40961002, 41140009, 41271268)
Abstract: [Objective] The objective of this study was to evaluate the influence of environment factors on fungal communities during succession periods along the chrono-sequence in forefront of Tianshan No. 1 glacier. [Methods] Fungal community composition in oligotrophic environment on the forefront of a receding glacier was analyzed by sequencing of 18S rRNA gene fragment of DNA samples from cryoconite and sub-and proglacial sediment near the glacier terminus. [Results] Fungal sequences obtained from zone represented 5 fungal phyla:Ascomycota (52.7%), Basidiomycota (16.9%), Chytridiomycota (15.1%), Zygomycota (2.4%) and Glomeromycota (1.2%). Although the proportion of Ascomycota outclass Basidiomycota-related sequences was identified in younger substrate, Basidiomycota sequences related to Microbotryomycetes, Tremellomycetes and Agaricomycetes increased gradually along the chrono-sequence. Representative sequences related to parasitic, pathogenic and airborne fungal lineages showed deposition of ecdemic fungi and anthropogenic activities directly or indirectly influenced fungal composition and spatial distribution in glacier ecosystem. [Conclusion] Our results suggest the forefront of Tianshan No. 1 glacier provide a favorable platforms for diversity and community succession of fungi adapted to oligotrophic, no vegetated and cold conditions. The different community structure was observed during succession periods along the chrono-sequence in forefront of Tianshan No. 1 glacier.
Keywords: fungicommunity structureglacier forelanddiversitysuccession
近些年来,全球气候变暖致使许多山岳冰川融化速率显著增加[1]。有研究表明,照目前全球变暖趋势预测地球上现有山岳冰川的四分之一将会在2050年消失[2-3]。尤其是位于欧亚大陆中部距人类生活城市最近的天山乌鲁木齐河源一号冰川(以下简称一号冰川),其在最近25年平均气温上升0.8 ℃,冰川面积大幅度减少、厚度变薄、雪线海拔迅速上升,更为严峻的是近25年一号冰川的物质平衡已成为负值,降水的累积量远不及融化造成的损失,预测未来冰川的消融速率会持续增加[4]。冰川的大量退缩致使冰雪层所覆盖的岩石被释放出来形成寡营养、无植被的原生裸地。经冰川融化暴露的沉积物为微生物提供了新的栖息环境,也为冰川前沿极端环境微生物在初级演替过程中群落的构建和多样性的研究提供了绝佳的机会。冰川前沿的主要特征是低温而且季节性温度波动频繁以及较强的紫外辐射,而且营养物质如C、N、P和S较低[5-6]。冰川前沿沉积层的性质基本决定了相应处于发育过程中土壤的物理化学性质,如土壤质地、pH值、营养物质浓度、水分和气体通量等[7]。因此土壤特性和空间异质性决定了冰川前沿不同年代序列下微生物丰度和群落结构组成。
大量研究表明,冰川生态系统中栖息着各种各样的微生物,其中真菌具有重要生态学功能,包括难降解有机物质的分解释放可利用有机碳到土壤环境中增加土壤的营养[8],以及通过分泌几丁质酶和蛋白酶加速土壤氮、磷的矿化、促进岩石风化、营养物质的循环和土壤发育成熟[9-10],因此作为分解者的真菌在维持冰川生态系统平衡方面发挥重要作用。但在冰川前沿演替初期阶段先锋真菌的定植和群落演替轨迹是由什么所决定的呢?有研究认为是植物决定了初级演替阶段微生物的群落组成和生物量[11],然而我们发现一号冰川前沿最新退缩的沉积层几乎没有植被的存在且检测到大量异养型的真菌存在,这与先前研究所阐述的植被决定微生物群落的构建的说法相矛盾[11]。最近有研究报道在极端环境初期演替过程中微生物的定植和群落的构建很大程度上受到外来大气中沉积物的影响,这些沉积物不仅携带微生物同时也伴随着有机物质的沉降[7, 12],所以是冰川前沿微生物和营养物质的主要来源。虽然有机质的沉积量十分有限,但对于初级演替阶段的微生物已经足够[12]。我们推测外来的大气沉积物为演替初期阶段微生物群落的构建和食物网的建立提供了必要条件。
天山1号冰川因60多年连续的检测成为我国目前为止水文径流量、物质平衡和气象变化等资料最为完备的冰川[13-14]。目前有关天山1号冰川新雪的化学特征、土壤酶活性、周边冻土、冰川前沿古菌、甲烷氧化菌、冰尘蓝细菌和冰心细菌已有研究报道[15-17]。张威等[18](2010)对天山1号冰川周边雪坑中的真菌群落组成和多样性随时空的变化进行了研究,除此之外冰川真菌的研究却一直侧重于与植物相关的菌根真菌[19]。先前一些研究已经报道了其他冰川退缩前沿环境中细菌和古菌沿年代序列的群落构建和演替变化[20-22],而对整个冰川表面冰尘、冰川底部和前沿沉积层的真菌群落结构和多样性的研究相对较少,尤其是天山一号冰川生态系统。因此,本研究对天山一号冰川表面冰尘、冰川底部和前沿沉积层真菌的群落组成和多样性的变化进行分析,旨在解析一号冰川生态系统中真核微生物在栖息环境截然不同但又相互偶联的三个生境中的群落的演替轨迹及多样性的变化,揭示冰川极端环境对真核微生物群落的选择作用,同时为冰川环境中有价值真核微生物的挖掘提供理论参考。
1 材料和方法 1.1 材料
1.1.1 研究区自然概况与样品的采集: 乌鲁木齐河源天山一号冰川(N 43°07′,E 86°49′)位于欧亚大陆中部,距乌鲁木齐市120多公里,是世界上最靠近城市的冰川。冰川末端海拔高度3730 m,常年平均温度为-5.1 ℃ [23],随全球气候变暖一号冰川退缩速率显著增加,其平均温度升高0.8 ℃。样品采自2016年8月中旬,共12个样点36个样品(每个样品点取3个平行),每1个样品大约在2 m×2 m的区域采用五点法获得,沿着冰川末端分别取10、25、50、100、150、200、300、400、500、600、800及1000 m (用BS表示),总的时间跨度超过150年,而冰川末端粉尘(用BF表示)和冰川底部基层(用BD表示)各取1个样点(3个平行)。所有的样品被装在事先灭菌处理的封口袋冷冻并在6 h内送回实验室储藏在-80 ℃冰箱用于后续实验研究。
1.1.2 样品总DNA的提取及纯化: 采用直接法结合商业试剂盒提取样品总DNA。直接法参照Zhou[24]等(1996)DNA提取法提取,略有改动。5 g样品中加入DNA裂解液、蛋白酶K及溶菌酶后,37 ℃、220 r/min水平振荡30 min;65 ℃水浴2 h后加入20% SDS溶液,超低温冰箱冻融3次后在水平击打器上击打10 min;用苯酚、氯仿、异戊醇(25:24:1)离心抽提DNA,异丙醇过夜沉淀DNA;70%预冷酒精洗涤2次,最后溶解于100 μL的TE溶液,共提取3份样品,用Wizard DNA Clean-Up System试剂盒纯化提取的总DNA。同时采用PowerSoilTM DNA Isolation Kit (Mo Bio Laboratories,Carlsbad,CA)试剂盒提取DNA,保存在4 ℃,采用分光光度计对核酸浓度和纯度进行定量。
1.1.3 样品真菌ITS基因间隔序列的PCR扩增与测序: 将冰川表面、底部和前沿的3份平行样品总DNA分别混合后,采用真菌ITS区特异引物ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)扩增,每个样品5个平行。扩增体系:Mixture 12.5 μL,引物各0.8 μL,DNA模板1 μL,加灭菌ddH2O补足25 μL。热循环条件:94 ℃预变性5 min;94 ℃变性1 min,65 ℃复性30 s,72 ℃延伸30 s (2个循环);94 ℃变性1 min,60 ℃复性30 s,72 ℃延伸30 s;94 ℃变性1 min,55 ℃复性30 s,72 ℃延伸30 s (2个循环);94 ℃变性1 min,52 ℃复性30 s,72 ℃延伸40 s (28个循环);最后72 ℃延伸8 min。PCR扩增产物用1%的琼脂糖凝胶电泳检测其大小。基于Illumina MiSeq PE300测序平台在上海Majorbio BioPharm Technology Co.,Ltd测序。
1.2 样品理化因子测量 天山一号冰川表面冰尘和底部沉积层样品的pH值(水:样品=2.5:1)、速效磷(VP)、速效钾(VK)、硝态氮(NOx-N)、铵态氮(AN)、总有机质(OM)及全氮(TN)、全磷(TP)、全钾(TK)的测定参照文献[25]进行,每个样品测3个平行。
1.3 生物信息学分析 采用QIIME程序中默认参量对测序序列进行去重和质控分析,最小序列长度150,最小质量分数20,删除模糊不清碱基及连续出现8个相同碱基的序列。所筛选的优质序列与它们所对应的barcodes相匹配,使用UCLUST程序中QIIME在97%的相似度水平划分操作分类单元(OTUs)。选取代表序列通过BLAST软件与GenBank和SILVA数据库进行比对。
1.4 统计学分析 稀释曲线、Chao1和Ace通过使用DOTUR软件在3%、5%和10%的不相似性水平被用来评估种系丰富度。在95%置信度水平使用QIIME程序与SILVA数据库比对,种系的丰度和多样性通过Mothur程序执行(ACE and Chao,Shannin and Simpson)。门水平分层聚类通过非加权配对算术平均法(UPGMA)完成,冗余分析(RDA)使用Monte Carlo permutations test中Canoco进行评估,Non-metric Multidimensional (NMDS)和Heatmap是基于Bray-Curtis distances、weighted UniFrac和unweighted UniFrac distances来完成,统计学分析是通过R 3.3.1来完成。
2 结果和分析 2.1 土壤理化性质 分析表明,乌鲁木齐河源天山1号冰川前沿无植被土壤基层的主要成分是沙石和很少的黏土。C、N、P、S的含量较低,速效磷、速效钾从冰川末端到600 m处并没有显著变化,在600到1000 m有明显的增加(表 1)。pH值一致呈增加趋势,范围从7.47到8.61。硝态氮在整个土壤发育过程中平均增加了2-3倍,铵态氮平均降低了1-2倍。总氮的含量在中期阶段(200-500 m)平均增加了6-8倍,而在后期阶段(600-1000 m)平均增加了3-4倍,说明随着冰川退缩年代序列的增加氮的含量先快速增加然后又逐渐降低,但对于整个土壤发育的过程是起到了氮输入的作用。有机质的含量明显是在冰尘及前沿1000 m处达到最高,这可能与冰尘的结构和成熟土壤成分呈密切相关,而从冰川末端到前沿800 m的过程中呈现出阶段性增加的趋势,这可能与微生物共同作用的土壤发育过程中碳的累积作用相关。全磷、全钾的含量略有增加。
表 1. 天山1号冰川表面冰尘、底部和前沿沉积物的理化特性 Table 1. Physicochemical properties of supraglacial cryoconite, sup- and proglacial sediments from the Glacier No. 1 in the Tianshan Mountains
| Sample ID | VP/(mg/kg) | VK/(mg/kg) | pH/(W: S=2.5:1) | NOx-N/(mg/kg) | AN/(mg/kg) | OM/(% dw) | TN/(% dw) | TP/(% dw) | TK/(% dw) |
| BF | 14.11 | 209.46 | 7.28 | 92.98 | 123.09 | 17.496 | 0.347 | 0.116 | 2.77 |
| BD | 2.57 | 146.32 | 7.54 | 8.89 | 29.03 | 1.374 | 0.031 | 0.072 | 3.55 |
| BS_10 | 2.68 | 94.13 | 7.37 | 4.53 | 27.07 | 1.167 | 0.033 | 0.077 | 3.91 |
| BS_25 | 2.48 | 90.87 | 7.61 | 4.09 | 29.65 | 1.021 | 0.036 | 0.085 | 3.96 |
| BS_50 | 2.87 | 96.45 | 7.94 | 4.45 | 19.63 | 0.917 | 0.037 | 0.091 | 3.93 |
| BS_100 | 2.89 | 91.59 | 7.93 | 4.75 | 22.34 | 1.369 | 0.061 | 0.085 | 3.61 |
| BS_150 | 2.51 | 89.94 | 8.15 | 4.66 | 20.95 | 1.522 | 0.032 | 0.083 | 4.19 |
| BS_200 | 2.80 | 62.54 | 7.98 | 4.05 | 21.15 | 1.116 | 0.137 | 0.087 | 3.54 |
| BS_300 | 2.61 | 67.71 | 8.06 | 4.75 | 20.59 | 1.145 | 0.251 | 0.086 | 3.53 |
| BS_400 | 2.92 | 78.62 | 8.23 | 5.44 | 22.19 | 1.064 | 0.247 | 0.092 | 4.07 |
| BS_500 | 3.01 | 53.56 | 8.19 | 6.05 | 19.45 | 1.326 | 0.173 | 0.104 | 3.43 |
| BS_600 | 3.76 | 60.03 | 8.27 | 8.48 | 19.06 | 1.328 | 0.083 | 0.085 | 3.47 |
| BS_800 | 3.46 | 66.52 | 8.46 | 6.23 | 24.95 | 1.312 | 0.054 | 0.104 | 3.35 |
| BS_1000 | 6.47 | 186.58 | 7.41 | 19.01 | 31.90 | 4.763 | 0.243 | 0.098 | 2.69 |
表选项
2.2 真菌群落的丰富度与多样性 通过比较经测序所得的来自12个一号冰川前沿及2个冰舌末端冰尘和底部基层样品中185103条ITS基因序列分析真菌的多样性和群落组成。在97%的相似度聚类水平分析共得到300个操作分类单元(OTU),其中属于真核而非真菌界的OTUs有Alveolata (6%)、Amoebozoa (3.7%)、Holozoa (2.8%)、Stramenopiles (1.5%)和Rhizaria (1%)。真菌水平共255个OTUs,占85%。此外,仍然还有10.9%的OTUs没有被鉴定。各样品的稀释度曲线(rarefaction curves)均已达到饱和状态(图 1),说明取样合理且充分。采用Non-parametric (Chao,ACE)的方法鉴定真菌群落丰富度(表 2),范围从19到78。Shannon index (香浓指数)表征群落多样性,种系丰富度的评估是从3个序列相似性临界值获得。
 |
| 图 1 天山一号冰川表面冰川、底部和前沿沉积层所有样品的稀释度曲线 Figure 1 Rarefaction analysis of fungal pyrosequencing from supraglacial cryoconite, sup- and proglacial sediments of the Glacier No. 1 in the Tianshan Mountains. |
| 图选项 |
表 2. 天山1号冰川表面冰尘,底部和前沿沉积层真菌多样性指数评估 Table 2. The diversity and richness estimates at 3% dissimilarity level for fungal assemblages from supraglacial Cryoconite, sup- and proglacial sediments of the Glacier No.1 in the Tianshan Mountains
| SampleID | OTUs | Reads | Chao | ACE | Shannon | Simpson |
| BD | 21 | 9077 | 32 | 49 | 0.31 | 0.9093 |
| BF | 14 | 2196 | 19 | 24 | 1.36 | 0.2915 |
| BS_10 | 28 | 10889 | 32 | 33 | 1.76 | 0.2662 |
| BS_25 | 49 | 8907 | 65 | 60 | 2.21 | 0.2601 |
| BS_100 | 50 | 3974 | 58 | 59 | 2.18 | 0.2477 |
| BS_150 | 108 | 2738 | 46 | 42 | 3.12 | 0.0513 |
| BS_200 | 42 | 2273 | 62 | 63 | 2.63 | 0.1432 |
| BS_300 | 66 | 2439 | 78 | 87 | 3.22 | 0.0886 |
| BS_400 | 37 | 3953 | 43 | 51 | 2.28 | 0.1786 |
| BS_500 | 47 | 2498 | 58 | 60 | 2.29 | 0.1801 |
| BS_600 | 35 | 3077 | 43 | 44 | 2.29 | 0.1840 |
| BS_800 | 27 | 2756 | 51 | 61 | 1.25 | 0.4056 |
| BS_1000 | 64 | 2092 | 74 | 82 | 3.46 | 0.0551 |
表选项
使用BLAST软件将代表序列与GenBank和SILVA数据库进行比对得到每条序列在数据库中的真菌注释信息。因此我们得到5个真菌门水平的菌群信息,包括:子囊菌门(Ascomycota,52.7%)、担子菌门(Basidiomycota,16.9%)、壶菌门(Chytridiomycota,15.1%)、接合菌门(Zygomycota,2.4%)和球囊菌门(Glomeromycota,1.2%)(图 2-A)。由于采样深度充分,测序序列代表了在不同的退缩阶段几乎所有的真菌类群。分析表明,真菌的多样性在冰川退缩过程中沿年代序列中期和后期明显高于新退缩的基层,在300 m处达到了最高。虽然随着退缩距离的增加子囊菌的Shannon index有明显的下降趋势,但在整个演替过程中其多样性始终最高。担子菌在演替的初期阶段Shannon index明显较低,但随着演替的发生在中后期阶段其多样性达到最高。
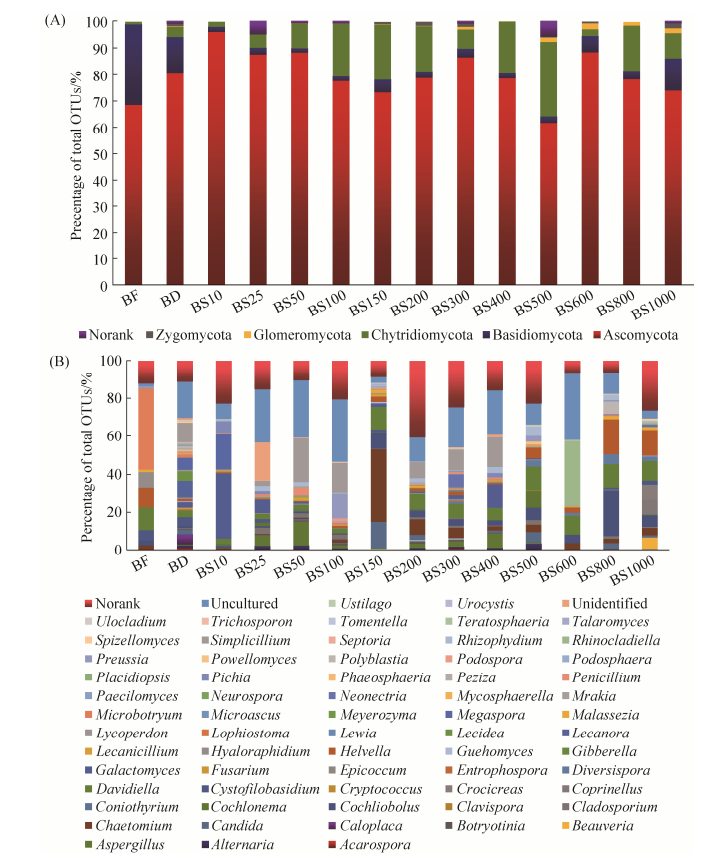 |
| 图 2 一号冰川各样品在门水平(A)与属水平(B)真菌群落相对丰度评估 Figure 2 Fungal community composition across all samples. Relative sequence abundance of different fungal phyla (A) and Genus (B) within the different communities. |
| 图选项 |
2.3 真菌群落结构组成 本研究从冰川末端冰尘、冰川底部及前沿基层共鉴定出20个纲65个属的真菌类群(图 2-B),其中19.3%的真菌指示性OTU在冰川表面环境中被检测到,主要属于Microbotryomycetes和Leotiomycetes。34%真菌指示性OTU与冰川底部基层密切相关,其中优势菌群为Chytridiomycetes、Saccharomycetes和Eurotiomycetes。53%的真菌指示性OTU沿冰川退缩的年代序列广泛分布于冰川前沿土壤基层,其中Chytridiomycetes、Sordariomycetes、Dothideomycetes和Pezizomycetes为优势菌群。随冰川前沿退缩年代序列的增加真菌群落演替结构划分为3个阶段:BS10-BS150为演替初期,BS200-BS500和BS600-BS1000为中期和后期阶段(图 3)。Sordariomycetes、Dothideomycetes、Chytridiomycetes和Eurotiomycetes在演替初期丰度最高,其次是Leotiomycetes和Saccharomycetes;到中期阶段起主导作用的类群为Dothideomycetes、Chytridiomycetes、Pezizomycetes和Sordariomycetes,其次是Leotiomycetes、Saccharomycetes和Eurotiomycetes;而后期过程中优势类群为Sordariomycetes、Pezizomycetes、Eurotiomycetes,其次是Chytridiomycetes和Glomeromycetes。冰尘中的优势菌是Dothideomycetes、Leotiomycetes和Microbotryomycetes,其次是Pezizomycetes和Tremellomycetes;Dothideomycetes、Pezizomycetes和Leotiomycetes是冰川底部基层中丰度最高的类群。此外,代表序列的注释信息也表明从年轻的基层到老的成熟土壤样品中真菌类群很少存在空间上的重叠(图 4)。
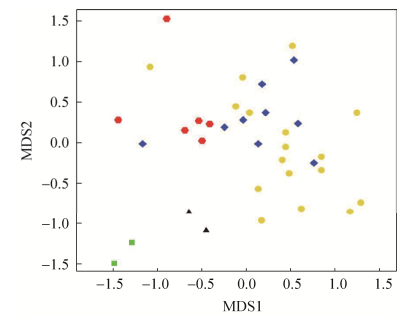 |
| 图 3 天山一号冰川表面冰尘、底部和前沿沉积层样品组间真菌类群相关性分析 Figure 3 Non-metric multi-dimensional scaling (NMDS) analysis of fungal communities based on Bray-Curtis dissimilarities in supra-, sub- and proglacier sediment of Tianshan No.1 glacier. |
| 图选项 |
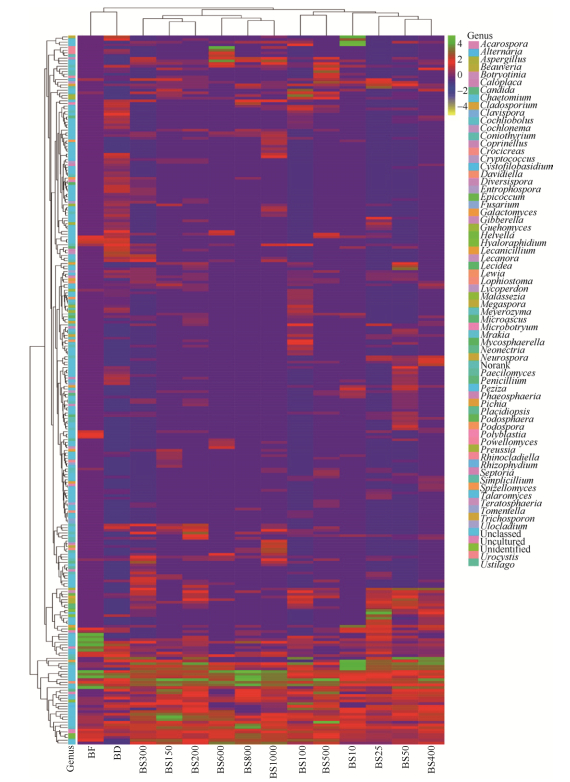 |
| 图 4 一号冰川真菌类群在各环境样品中属水平的分布热图 Figure 4 Heat map of Pearson correlations between environmental variables and genera detected in substrate. Colours represent the r-values of Pearson correlations between relative abundances of the most abundant fungal genera and environmental parameters. Genera were ordered according to taxonomic affiliations. |
| 图选项 |
本研究中出乎意料地发现与动植物形成共生或寄生关系的真菌类群却在冰川前沿演替初期阶段新退缩的无植被的区域被检测到,如锈菌纲(Urediniomycetes),黑粉菌纲(Ustilaginomycetes)和外囊菌纲(Taphrinomycetes)。这些异养的营养类群应该不可能存在于完全缺乏宿主植物的极端环境,所以可能的解释就是外来空气沉降物为它们的生长发育提供了必要的有机营养物质。此外Sordariomycetes (14.7%)是除了Dothideomycetes (17.6%)之外在冰川前沿生态系统中丰度最高的营养类群,其分布范围几乎跨越整个冰川前沿的退缩区域,同时我们也检测到了相对丰富的Agaricomycetes类群,而Sordariomycetes和Agaricomycetes主要是通过降解动物粪便获取能量来维持正常的代谢活动,因此我们猜想一号冰川周边的放牧活动对该生态系统的微生物群落结构造成了很大程度的扰动。此外,通过冗余分析也发现一号冰川前沿土壤理化因子随年代序列的增加与真菌群落结构组成密切相关(图 5),从而说明环境因子的变化对真菌群落演替的导向性。
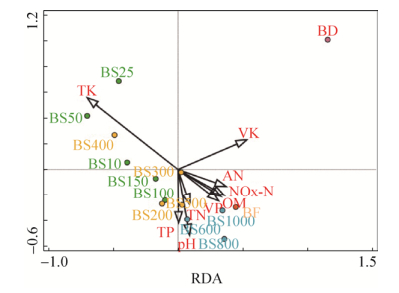 |
| 图 5 一号冰川各环境样品与环境因子之间相关性变化的冗余分析 Figure 5 The relationships between the fungal community composition with measured environmental parameters derived from retreated substrate samples in Tianshan No. 1 glacier forefield (in 2016). |
| 图选项 |
3 讨论 本研究首次采用距离替代时间的概念来研究一号冰川前沿初级演替过程中真菌群落结构和多样性。香浓指数/辛普森指数表明真菌多样性随着演替时间的推移先增加至中期阶段达到最大值,然后又逐渐降低(表 2)。本研究中,整个数据集中有53%的OTU被划分为子囊菌且它们的序列数随年代序列的增加而呈现出逐渐降低的趋势,担子菌的OTU呈稳步上升态势,这就说明在整个冰川前沿随着土壤年龄的增加出现了担子菌逐渐取代子囊菌的趋势,这与Brunner等[26](2011)所报道的达曼冰川前沿和Dong等[27](2016)所报道的高北冰川前沿真菌群落的演替趋势相似。子囊菌在极端环境中是非常丰富的,如形成地衣的茶渍纲(Lecanoromycetes)和在极端环境中通过改善水分和营养物质的获取而增强植物生长的座囊菌纲(Dothidomycetes)[8-9]。相反,担子菌更多生长在植物相对较为丰富的环境[19],这种子囊菌多样性逐渐降低而担子菌逐渐升高的趋势暗示了冰川前沿极端环境下营养物质的逐渐累积和生态系统的成熟。总的来说冰川生态系统虽然是一个强紫外辐射、昼夜和季节性温度波动较大的寡营养的极端环境,但它仍然是一个为微生物提供栖息场所和营养物质的巨大天然储藏室。
一号冰川退缩前沿不同年代序列真菌的群落结构显著不同(图 4)。在演替的初期阶段子囊菌的序列丰度远远超过担子菌序列,但随着冰川退缩年代序列的增加与Microbotryomycetes、Tremellomycetes和Agaricomycetes相关的担子菌的序列显著上升,所以在演替的中后期阶段子囊菌为优势菌的趋势略有降低而担子菌类群有逐渐成为优势菌种的趋势。这与达曼冰川[26]和高北冰川[27]前沿真菌群落沿年代序列演替的轨迹十分相似,因此我们推测真菌在冰川前沿生态系统存在相对稳定的担子菌逐步替代子囊菌的演替轨迹和生存策略。此外,随着演替时间的推移,真菌种群密度和总碳、总氮的浓度在土壤中逐渐升高(表 1),然而在冰川前沿基层中碳和氮的大量累积之前能够持续提供可利用有机质的生态位是十分有限的,因此,能够在营养物质块簇状分布的环境中定殖和利用有限的营养物质进行缓慢生长,且能够适应较高pH值的真菌类群才可能是最早的定殖者[5, 12]。虽然土壤基层的营养物质浓度随土壤发育年龄增加而逐步提高,但中期阶段有机物质的含量仍然很低,这样的环境在生态学上被认为群落之间的竞争作用是十分微弱的[7],因此许多早期的先锋类群与外来的新类群仍然可以共存。相反,在演替的中后期阶段,随着植物的定植和腐生真菌的降解作用[8, 28],土壤基层中的有机物浓度显著升高,因此可以预测真菌群落的多样性将明显高于前期和中期阶段,但先锋真菌群落对环境的要求已经不仅仅是为了满足生存而是为获取更多营养物质扩散到更远的范围[26],由于真菌群落在日趋成熟的土壤中能够获取更多的有机物质资源导致种间的竞争作用加强[7],所以在土壤发育的中后期阶段真菌群落多样性又逐渐降低。壶菌在潮湿的环境中无处不在,尤其是在营养物质相对贫瘠的冰川前沿环境[29],其在一号冰川整个前沿环境的丰度仅次于子囊菌和担子菌。事实上壶菌对冰川生态系统的发展并不是非常重要,但是腐生型的壶菌在高海拔无植被的冷环境中驱动有机物质的转化和营养物质的循环方面有着至关重要的作用[29-30]。总的来说,由于冰川生态系统不同生态位对有机体的筛选作用导致真菌群落空间分布的高度异质性和真菌群落定向演替的趋势。
尽管对于冰川极端环境中的真菌类群代谢能力的认识十分有限,但它们从不同的资源获取碳源[30],这种关于碳利用的有效机制可能对真核微生物群落的构建和生存是十分有利的。本研究发现一些真菌的指示性OTU能够促进难降解化合物的分解从而增加土壤中有机质的浓度和物质的循环速率,如丰度较高的伞菌纲和属于接合菌纲的毛霉菌,它们与木质素和纤维素的降解密切相关[8],从而促进了土壤的发育和后期植被的定植。由于一些真菌指示性的OTU在冰川环境的广泛分布,如Dothideomycetes、Lecanoromycetes、Microbotryomycetes与Tremellomycetes,这些类群在冰尘、冰尘底部和前沿的普遍存在也说明了真菌群落在空间上的扩散模型[31]。细菌的指示性OTU在冰川各生境中的广泛存在已有报道[22],而本研究中所发现的真菌指示性OTU只在极少的生境中存在群落结构的相似,不同的栖息环境群落组成差异性较大,这可能与一号冰川环境因子对真菌群落的影响相关(图 5),虽然冰川表面和前沿在地理分布上没有直接的联系,但它们的指示性OTU却存在偶联。Brown等[7](2014)认为大气中微生物的沉降是冰川表面和冰川前沿新退缩基层微生物定植者的主要来源,而碳、氮和其他有机质的沉降也是重要的营养物质输入[12],因此这些输入可能促进了冰川表面和前沿真菌群落构建。同样,冰川底部和冰川表面真菌指示性OTU存在部分的相似性,Skidmore等[32](2005)认为冰川底部真菌群落的构建可能包括冰川表面经冰川融水运输至冰床裂缝,再通过垂直运输至冰川底部基层的营养类群,以及处于兼性厌氧的冰川底部基层内生真菌。此外,本研究也发现冰川表面环境中的营养物质浓度远高于冰川前沿基层,但是真菌的多样性在冰川前沿反而更高,可能是两个方面造成真菌群落的周转变化:第一,冰川表面紫外照射更强且温度波动较大[4],造成能够适应该极端环境的活体真菌类群相对较少;第二,冰川前沿的真菌类群除了来自大气沉降之外还有一部分来自于冰川底部随冰川退缩而释放出来的内生真菌[7]。这说明外来真菌类群在冰川环境的成功定植和群落构建主要依赖于它们抵达该生态系统的时间顺序及对极端环境的适应能力。
腐生真菌演替的痕迹在一号冰川前沿生态系统中尤为明显,尤其是具有弹射孢子能力的粪生菌,包括毛霉菌(Mucor)、粪壳菌纲(Sordariomycetes)和伞菌纲(Agaricomycetes),而这与先前研究中粪生真菌的消长规律相一致[32],如首先是接合菌(如毛霉菌)→子囊菌(如粪壳菌)→担子菌(如伞菌)。尤其是粪壳菌纲已检测到有23个种系,属于子囊菌门,其中Coniochaetaceae、Magnaporthaceae、Plectosphaerellaceae、Nectriaceae、Chaetomiaceae、Lulworthiaceae、Chaetomiaceae和Plectosphaerellaceae是优势菌种。此外,Agaricostilbomycetes、Exobasidiomycetes、Tremellomycetes和Mucoromycotina这几个纲在演替的各个时期均有被检测到。球囊菌门(Glomeromycota)仅仅在很少的冰川前沿样点检测到,说明该菌群在退缩的冰川前沿存在非常小的生态位分布,这可能是由它们的生存策略和代谢能力所决定。此外,对温度变化较为敏感属于虫囊菌纲(Laboulbeniomycetes)的Pyxidiophora也被发现在整个冰川前沿普遍存在,而Pyxidiophora是动物的主要寄生虫[33],可能冰川周围圈养动物及其粪便为动物寄生虫和粪生真菌提供了稳定的栖息环境和充足的营养物质[34],因此使得它们很容易扩散到冰川周边环境,尤其是乌鲁木齐河源系统,这势必造成对乌鲁木齐河源水环境的影响,因此我们呼吁对天山冰川生态系统采取有效的保护措施,避免对正在退缩的天山冰川和乌鲁木齐河源造成不必要的影响。
酵母菌因它们的结构和适冷机制(如增加膜的流动性和色素的产生)而在整个冰川底部和前沿均被检测到。可能冰川是低温及寡营养的永久性冷环境,因此分离到的酵母菌物种普遍较少。在南极洲冰川底部沉积层中分离得到的酵母菌主要是耐冷的担子菌类[35],如Collophora、Cryptococcus、Sporobolomyces和Torrubiella属;在高北冰川中发现的20多个属中也是担子菌类为优势菌种[36],其中最为丰富的是Cryptococcus和Rhodotorula;在阿尔卑斯冰川分离到23种形态不同的酵母[37],其中Rhodotorula的丰度最高。本研究中检测到了2个丰度最高的担子菌类的属,分别是Cryptococcus和Cystofilobasidium,其余属均属于子囊菌类,主要是Metschnikowia、Candida、Pichia和Galactomyces。我们所鉴定到的真菌和之前Jumpponen等[38](2003)在无植被的达曼冰川前沿所检测到的结果一致,都是子囊菌为绝对优势菌;Turchetti等[37](2013)发现来自阿尔卑斯山脉冰川表层和底部沉积层的真菌菌群大多是嗜冷型的酵母菌,如Rhodotorula、Aureobasidium和Cryptococcus,而这些真菌的组成与达曼冰川中发现的存在显著性差异。与其他冰川相比,一号冰川中最丰富的酵母菌仍然是担子菌类的Cryptococcus,说明该菌在全球范围内冰川环境具有极强的适应能力。而Metschnikowia和Galactomyces却在其他冰川很少被发现,其可能的原因还有待进一步研究。
综上所述,本研究表明正在退缩的天山一号冰川前沿为能够适应寡营养、强紫外线照射环境的真菌提供了良好的栖息环境。在整个冰川前沿生态系统发育过程中随着年代序列的增加担子菌的序列数呈缓慢上升趋势,而子囊菌序列数虽然逐渐降低但始终为优势类群。粪生真菌和动物寄生虫在一号冰川前沿存在非常高的丰度,这与一号冰川旅游业的开发和放牧活动密不可分。球囊菌门则出现在很少的采样点,这也说明在土壤发育过程中部分真菌占据了很小的生态位。总的来说,虽然一号冰川前沿沉积层的真菌群落和营养物质分布存在高度的异质性,但随着年代序列的增加仍然出现明显的真菌群落演替轨迹。
References
| [1] | Schütte U, Abdo Z, Foster J. Bacterial diversity in a glacier foreland of the High Arctic. Molecular Ecology, 2010, 19(1): 54-66. |
| [2] | Wu X, Zhang W, Liu G. Bacterial diversity in the foreland of the Tianshan No. 1 glacier, China. Environmental Research Letters, 2012, 7(1). |
| [3] | Rutter N, Hodson A, Fynn T. Hydrology and hydrochemistry of a deglaciating high-Arctic catchment, Svalbard. Journal of Hydrology, 2011, 410(1): 39-50. |
| [4] | Zhang G, Li Z, Wang W. Rapid decrease of observed mass balance in the Urumqi Glacier No. 1, Tianshan Mountains, central Asia. Quaternary International, 2014, 349: 135-141. DOI:10.1016/j.quaint.2013.08.035 |
| [5] | Bernasconi S, Bauder A, Bourdon B. Chemical and biological gradients along the Damma glacier soil Chronosequence, Switzerland. Vadose Zone Journal, 2011, 10(10): 867-883. |
| [6] | Matthews J, Vater A. Pioneer zone geo-ecological change: Observations from a chronosequence on the Storbreen glacier foreland, Jotunheimen, southern Norway. CATENA, 2015, 135: 219-230. DOI:10.1016/j.catena.2015.07.016 |
| [7] | Brown S, Jumpponen A. Contrasting primary successional trajectories of fungi and bacteria in retreating glacier soils. Molecular Ecology, 2014, 23(2): 481. DOI:10.1111/mec.12487 |
| [8] | Treseder K, Lennon J. Fungal traits that drive ecosystem dynamics on land. Microbiology & Molecular Biology Reviews, 2015, 79(2): 243-62. |
| [9] | Wal A, Geydan T, Kuyper W. A thready affair: linking fungal diversity and community dynamics to terrestrial decomposition processes. FEMS Microbiology Reviews, 2013, 37(4): 477-94. DOI:10.1111/1574-6976.12001 |
| [10] | Burford P, Fomina F, Gadd M. Fungal involvement in bioweathering and biotransformation of rocks and minerals. Mineralogical Magazine, 2003, 67(6): 1127-1155. DOI:10.1180/0026461036760154 |
| [11] | Schumann K, Gewolf S, Tackenberg O. Factors affecting primary succession of glacier foreland vegetation in the European Alps. Alpine Botany, 2016, 126(2): 105-117. DOI:10.1007/s00035-016-0166-6 |
| [12] | Esperschte J, Mora A, Schreiner K. Microbial food web dynamics along a soil chronosequence of a glacier forefield. Biogeosciences, 2011, 8(1): 3283-3294. |
| [13] | Sun M, Li Z, Yao X. Analysis on runoff variation of glacier No.1 at the headwaters of the Urumqi river from 1959 to 2008. Journal of Natural Resources, 2012, 27(4): 650-660. |
| [14] | Li ZQ, Shen YP, Wang FT. Response of glacier melting to climate change——Take Urümqi glacier No.1 as an example. Journal of Glaciology & Geocryology, 2007, 29(3): 333-342. (in Chinese) 李忠勤, 沈永平, 王飞腾. 冰川消融对气候变化-以乌鲁木齐河源1号冰川为例. 冰川冻土, 2007, 29(3): 333-342. DOI:10.3969/j.issn.1000-0240.2007.03.001 |
| [15] | Liu Q, Yao D, Jiao Z. Microbial diversity in the snow, a moraine lake and a stream in Himalayan glacier. Extremophiles, 2011, 15: 411. DOI:10.1007/s00792-011-0372-5 |
| [16] | Zeng J, Wang X, Lou K. Primary succession of soil enzyme activity and heterotrophic microbial communities along the chronosequence of Tianshan Mountains No.1 Glacier, China. Antonie van Leeuwenhoek, 2015, 107(2): 453. DOI:10.1007/s10482-014-0343-9 |
| [17] | Ni XJ, Qi XE, Ni YQ. Community structure and phylogenetic analysis of cyanobacteria in cryoconite from surface of the Glacier No.1 in the Tianshan Mountains. Acta Microbiologica Sinica, 2014, 54(11): 1256-1266. (in Chinese) 倪雪姣, 齐兴娥, 倪永清. 天山乌鲁木齐河源一号冰川表面粉尘蓝细菌群落结构及其系统发育. 微生物学报, 2014, 54(11): 1256-1266. |
| [18] | Zhang W, Zhang G, Liu X. Diversity and its temporal-spatial characteristics of eukaryotic microorganisms on Glacier No.1 at the rümqi river head, Tianshan Montains. Journal of Glaciology & Geocryology, 2010, 32(5): 906-913. |
| [19] | Nara K. Community developmental patterns and ecological functions of ectomycorrhizal fungi: implications from primary succession. Springer, 2008. |
| [20] | Pessi S, Osorio C, Galvez C. Distinct composition signatures of archaeal and bacterial phylotypes in the Wanda Glacier forefield, Antarctic Peninsula. FEMS Microbiology Ecology, 2015, 91(1): 1-10. |
| [21] | Zumsteg A, Luster J, Goransson H. Bacterial, archaeal and fungal succession in the forefield of a receding glacier. Microbial Ecology, 2012, 63(3): 552-564. DOI:10.1007/s00248-011-9991-8 |
| [22] | Knelman J, Legg T, Neill S. Bacterial community structure and function change in association with colonizer plants during early primary succession in a glacier forefield. Soil Biology & Biochemistry, 2012, 46: 172-180. |
| [23] | Ni YQ, Gu YL, Shi XW. Phylogenetic and physiological diversity of cold-adapted bacteria producing protease from sediments of the bottom layer of the Glacier No.1 in the Tianshan Mountains. Acta Microbiologica Sinica, 2013, 53(2): 164-172. (in Chinese) 倪永清, 顾燕玲, 史学伟. 天山一号冰川底部沉积层产蛋白酶耐低温菌株的筛选及其系统发育. 微生物学报, 2013, 53(2): 164-172. |
| [24] | Zhou J, Bruns M, Tiedje J. DNA recovery from soils of diverse composition. Applied and Environmental Microbiology, 1996, 62(2): 316-322. |
| [25] | Gansson H, Welc M, Bunemann K. Nitrogen and phosphorus availability at early stages of soil development in the Damma glacier forefield. Plant and Soil, 2016, 404(1): 251-261. |
| [26] | Brunner I, Plotze M, Rieder S. Pioneering fungi from the Damma glacier forefield in the Swiss Alps can promote granite weathering. Gebiology, 2011, 9(3): 266-279. DOI:10.1111/gbi.2011.9.issue-3 |
| [27] | Dong K, Tripathi B, Moroenyane I. Soil fungal community development in a high Arctic glacier foreland follows a directional replacement model, with a mid-successional diversity maximum. Scientific Reports, 2016, 6: 26360. DOI:10.1038/srep26360 |
| [28] | Osono T, Matsuoka S, Hirose D. Fungal colonization and decomposition of leaves and stems of Salix arctica on deglaciated moraines in high-Arctic Canada. Polar Science, 2014, 8(2): 207-216. DOI:10.1016/j.polar.2013.10.004 |
| [29] | Gutiérrez M, Galand P, Moffat C. Melting glacier impacts community structure of Bacteria, Archaea and Fungi in a Chilean Patagonia fjord. Environmental Microbiology, 2015, 17(10): 3882. DOI:10.1111/1462-2920.12872 |
| [30] | Schmidt S, Naff C, Lynch R. Fungal communities at the edge: Ecological lessons from high alpine fungi. Fungal Ecology, 2012, 5(4): 443-452. DOI:10.1016/j.funeco.2011.10.005 |
| [31] | Skidmore M, Anderson S, Sharp M. Comparison of microbial community compositions of two subglacial environments reveals a possible role for microbes in chemical weathering processes. Applied & Environmental Microbiology, 2005, 71(11): 6986. |
| [32] | Setl H, Mclean M. Decomposition rate of organic substrates in relation to the species diversity of soil saprophytic fungi. Oecologia, 2004, 139(1): 98-107. DOI:10.1007/s00442-003-1478-y |
| [33] | Blackwell M, Bridges J, Moser C. Hyperphoretic Dispersal of a Pyxidiophora Anamorph. Science, 1986, 232(4753): 993. DOI:10.1126/science.232.4753.993 |
| [34] | Richardson M. Diversity and occurrence of coprophilous fungi. Mycological Research, 2001, 105(4): 387-402. DOI:10.1017/S0953756201003884 |
| [35] | Turchetti B, Connell B, Branada E. Psychrophilic yeasts from Antarctica and European glaciers: description of Glaciozyma gen. nov., Glaciozyma martinii sp. nov. and Glaciozyma watsonii sp. nov. Extremophiles, 2011, 15: 573. DOI:10.1007/s00792-011-0388-x |
| [36] | Butinar L, Spencer I, Gunde N. Yeasts in high Arctic glaciers: the discovery of a new habitat for eukaryotic microorganisms. Antonie Van Leeuwenhoek, 2007, 91(3): 277-289. DOI:10.1007/s10482-006-9117-3 |
| [37] | Turchetti B, Goretti M, Branda E. Influence of abiotic variables on culturable yeast diversity in two distinct Alpine glaciers. FEMS Microbiology Ecology, 2013, 86(2): 327-340. DOI:10.1111/fem.2013.86.issue-2 |
| [38] | Jumpponen A. Soil fungal community assembly in a primary successional glacier forefront ecosystem as inferred from rDNA sequence analyses. New Phytologist, 2003, 158(3): 569-578. DOI:10.1046/j.1469-8137.2003.00767.x |
