廖国建1,2, 沈兰1, 胡昌华1,2


1.西南大学药学院, 重庆 400715;
2.重庆药物过程与质量控制工程技术中心, 重庆 400715
收稿日期:2016-11-04;修回日期:2016-12-09;网络出版日期:2017-01-19
基金项目:国家自然科学基金(31670050);中央高校基本科研业务费(XDJK2016A015)
*通信作者:胡昌华.Tel:+86-23-68250520; E-mail:chhhu@swu.edu.cn
摘要: 链霉菌具有独特而复杂的形态分化周期,涉及到染色体复制、浓缩和分离等多个步骤,并伴随着菌丝的分隔和片段化。拟核结合蛋白作为染色体高级结构的重要组成成分,在调控链霉菌的形态分化中发挥了重要作用,调控许多与DNA相关的过程,包括基因表达、DNA保护、重组/修复和拟核的形成与维持等。此外,拟核结合蛋白作为细菌重要的全局性调控因子,也广泛参与了链霉菌次级代谢的调控。本文总结了链霉菌拟核结合蛋白的结构和功能,特别是调控形态分化和次级代谢的最新研究成果。
关键词: 拟核结合蛋白 形态分化 次级代谢 转录调控
Streptomyces nucleoid-associated proteins: role in morphological differentiation and secondary metabolism
Guojian Liao1,2, Lan Shen1, Changhua Hu1,2


1.College of Pharmaceutical Sciences, Southwest University, Chongqing 400715, China;
2.Chongqing Engineering Research Center for Pharmaceutical Process and Quality Control, Chongqing 400715, China
Received 04 November 2016; Revised 09 December 2016; Published online 19 January 2017
*Corresponding author: Hu Changhua.Tel:+86-23-68250520; E-mail:chhhu@swu.edu.cn
Supported by the National Natural Science Foundation of China (31670050) and by the Fundamental Research Funds for the Central Universities (XDJK2016A015)
Abstract: Streptomyces have a unique and complex morphological differentiation process. The process of aerial hyphae differentiating into spore filaments is accompanied by the biosynthesis of secondary metabolites. The morphological differentiation of Streptomyces involves many steps, such as chromosome replication, condensation and separation. As important components of chromosome structure and the global regulatory factors of bacteria, the nucleoid-associated proteins play an important role in the regulation of morphological differentiation and secondary metabolism of Streptomyces. In this paper, we summarize the structures, functions, regulation of nucleoid-associated proteins and especially their role in morphological differentiation and secondary metabolism of Streptomyces.
Key words: nucleoid-associated proteins morphological differentiation secondary metabolism transcriptional regulation
链霉菌具有复杂的形态分化周期和强大的次级代谢能力,能够产生众多具有生物活性的次级代谢产物,如目前广泛应用的各类抗生素、抗肿瘤药物以及免疫抑制剂等。次级代谢的生物合成与链霉菌的形态分化密切相关。在气生菌丝分化为孢子丝的过程中常伴随着次级代谢产物的生物合成。链霉菌形态分化周期涉及到染色体复制、浓缩和分离等多个步骤,并伴随着菌丝的分隔和片段化[1-2]。拟核结合蛋白作为染色体高级结构的重要成分,在形态分化中发挥了重要作用。拟核结合蛋白 (nucleoid-associated proteins,NAPs) 是分子量低、含量丰富的转录调控因子,调控许多与DNA相关的过程,包括基因表达、DNA保护、重组/修复和拟核的形成与维持等[3]。NAPs往往通过结合DNA实现其功能,这种结合能力具有低或无序列特异性。近年来国内外的研究表明,NAPs在调控链霉菌形态分化和次级代谢过程中发挥了重要作用,是一类新型的调控因子。本文将从NAPs分类、结构、功能及调控等方面进行综述。
1 NAP的功能分类 链霉菌NAPs按照功能可以分为DNA曲形蛋白 (HupA、HupS和sIHF)、DNA桥连蛋白 (Lsr2)、DNA保护蛋白 (Dps) 和其他NAPs DdbA等几大类。
1.1 DNA曲形蛋白:HupA、HupS和sIHF HU (heat unstable protein热不稳定蛋白) 和IHF (integration host factor整合宿主因子) 是大肠杆菌典型的DNA曲形蛋白。它们分子量小,呈碱性。大肠杆菌和沙门氏菌HU蛋白有2个旁系同源蛋白 (HUα和HUβ):营养生长期HUα/α同源二聚体占优势,在稳定期或冷激时HUα/β异源二聚体上调。大肠杆菌和沙门氏菌的IHF蛋白也有2个同源蛋白 (IHFα和IHFβ),它们与HU蛋白同属一个蛋白家族,但2个二聚体的功能不同[4]。在分枝杆菌中发现1个分子量更大碱性更强的同源蛋白Mdp1,它包含1个HU蛋白样N端结构域和1个长的富含赖氨酸的尾巴。天蓝色链霉菌中有1个短的HU蛋白HupA和1个长的Mdp1样HU蛋白HupS,这2个蛋白在营养生长期和孢子形成阶段发挥作用[5]。
HupA同大肠杆菌Huα和Huβ相似,HupS则是一个放线菌特有的包含2个结构域的蛋白,其中N端与HU相似,C端与真核组蛋白连接蛋白的C端相似 (H1样结构域),富含丙氨酸和赖氨酸,这可能导致2个同源蛋白功能上的差异[6]。hupS在孢子形成阶段特异性高表达,而hupA受发育控制在基质菌丝和气生菌丝形成时表达。HupS蛋白在hupA突变体中表达上调,暗示二者在功能上存在一定程度上的冗余。
天蓝色链霉菌IHF的同源蛋白sIHF包含1个长的N端α螺旋和C端螺旋-转角-转角-螺旋结构域 (H2TH),这种结构使C端带有2个独立的DNA结合位点[7]。另外,体外 (in vitro) 实验和晶体结构表明,单体sIHF结合DNA时无序列特异性,主要结合到DNA小沟上的8个碱基,sIHF与DNA的亲和力由DNA的长度而非序列和结构决定。分子机制研究表明sIHF能通过影响拓扑异构酶活性而显著改变DNA拓扑结构 (图 1)。
 |
| 图 1. 链霉菌DNA曲形蛋白的结构图 (A) 和结构域分布 (B) Figure 1. Predicted protein structures (A) and conserved domains (B) of DNA bending proteins in Streptomycetes. |
| 图选项 |
1.2 DNA桥连蛋白:Lsr2 Lsr2是首先在分支杆菌中发现的一种新型拟核结合蛋白,作为大肠杆菌H-NS的同功能蛋白,Lsr通过桥连DNA在拟核结构中发挥重要作用[8]。Lsr2由2个结构域组成:N末端二聚化结构域控制蛋白的寡聚化,C末端含有DNA结合结构域负责与靶基因结合 (图 2)。2个结构域之间通过1个柔性可变区相连接。Lsr2的C末端含2个以铰链相连的螺旋,它们相互作用,形成正电荷裂隙,像钳子一样夹住DNA链。铰链氨基酸残基Arg97-Gly98-Arg99组成AT牵引钩,插入DNA小沟,靶向结合富含AT区域。Lsr2二聚体的2个DNA结合区是它们桥连DNA的基础[9]。Lsr2非序列特异性结合AT富集的DNA区域,形成大的低聚态复合体,防止分枝杆菌DNA受到活性氧的损伤[10],或以二聚体形式结合到bfrB启动子区域抑制基因转录从而维持菌体铁平衡[11],此外Lsr2也参与调节涉及应答抗生素,在耻垢分支杆菌中调控包括抗生素耐受操纵子iniBAC启动子在内的多个基因的表达[12]。序列分析发现,Lsr2存在于所有已测序链霉菌基因组中,多数链霉菌基因组中含有2个同源体。
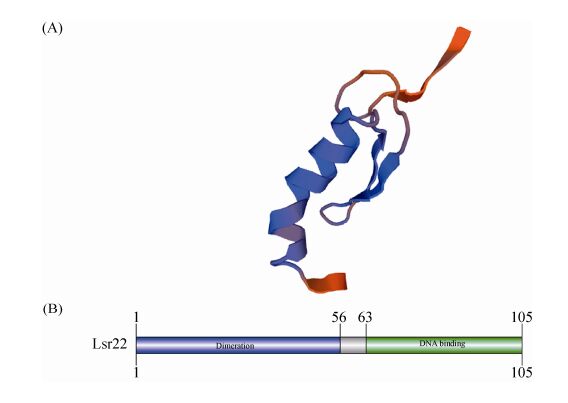 |
| 图 2. 链霉菌DNA桥连蛋白Lsr2结构图 (A) 和结构域分布 (B) Figure 2. Predicted protein structure (A) and conserved domains (B) of DNA bridging protein Lsr2 in Streptomycetes. |
| 图选项 |
1.3 DNA保护蛋白Dps 细菌在进入稳定期,面临压力环境或孢子形成时,拟核与特异性NAPs结合同时被高度压缩,以物理方法保护基因组免受损伤。Dps (DNA-binding protein from starved cells饥饿细胞的DNA结合蛋白) 在这个过程中发挥了重要作用[13]。Dps是存在于几乎所有的细菌中的铁环形蛋白超家族中的一员,为大约19 kDa的环形蛋白。
天蓝色链霉菌有3个同发育分化密切相关的Dps同源蛋白DpsA、DpsB和DpsC[14]。Dps家族都有保守的四螺旋束,但它们末端延伸长度和尾巴的长度不一致。DpsA的N末端和C末端都只带1个正电荷氨基酸 (赖氨酸和精氨酸) 尾巴。DpsB和DpsC N末端则分别为8个和42个氨基酸尾巴 (图 3)。体外实验表明DpsB不同于DpsA和DpsC蛋白会形成二聚体。3个蛋白在长度和氨基酸组成上的差异反映了蛋白功能的不同。许多应激条件 (除氧化压力外) 都会刺激基质菌丝表达Dps蛋白,例如渗透压促进DpsA丰度提高,热休克促进DpsC的表达,但引起其他细菌中Dps蛋白丰度大幅提高的过氧化氢却不影响链霉菌中Dps蛋白的表达[15]。DpsB在绝大多数链霉菌中都存在,而DpsA仅在少数链霉菌中存在,DpsC仅在极少数链霉菌中存在。
 |
| 图 3. 链霉菌的DNA保护蛋白Dps结构图 (A) 和结构域分布 (B) Figure 3. Predicted protein structures (A) and conserved domains (B) of DNA protecting protein Dps in Streptomycetes. |
| 图选项 |
1.4 其他NAPs DdbA是一个最近在天蓝色链霉菌中被发现的NAPs[16]。DdbA含有N末端组蛋白样结构域,含有大量碱性氨基酸 (pI为10.5),C末端含有DksA结构域 (图 4)。DdbA的N末端结构域使其在体外能够有效结合和浓缩DNA。C末端的DksA结构域包含4个丝氨酸组成的锌指结构,这个结构域中的2个天冬氨酸以及镁离子共同作用以稳定ppGpp与RNAP的结合。在大肠杆菌中异源过表达DksA能够抑制ppGpp突变导致的表型。DdbA的缺失导致发育过程DNA浓缩的改变和应对渗透压时DNA的超螺旋能力的降低。
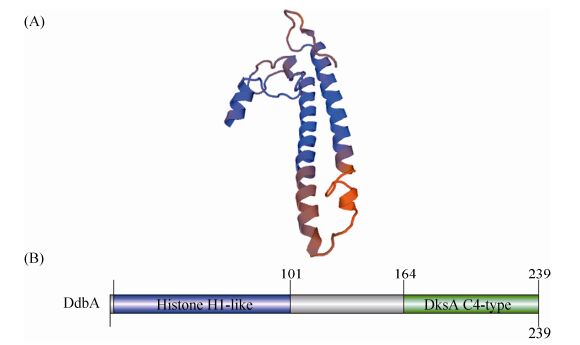 |
| 图 4. 链霉菌的特殊拟核结合蛋白DdbA的结构图 (A) 和结构域分布 (B) Figure 4. Predicted protein structure (A) and conserved domains (B) of nucleoid-associated protein DdbA in Streptomycetes. |
| 图选项 |
2 NAPs的调控 2.1 转录水平调控NAPs 研究发现NAPs转录受到细胞所处环境和发育阶段的调控。Dps的表达在转录水平受到了众多转录因子的调控。Facey等发现天蓝色链霉菌在环境压力或发育阶段诱导单一启动子表达dpsA,而渗透压诱导dpsA表达的原因可能是DNA负超螺旋程度的改变。环境压力和发育阶段诱导dpsA在很大程度上依赖SigH和SigB[17]。此外,WhiB可直接结合dpsA启动子区从而调控dpsA的表达[17]。
2.2 蛋白质水平调控NAPs 蛋白质的翻译后修饰对蛋白功能和基因表达有重要的影响。原核的丝氨酸/苏氨酸蛋白激酶能够磷酸化细菌蛋白。磷酸蛋白质组研究发现,天蓝色链霉菌的lsr2能够被磷酸化修饰 (T78),这个磷酸化修饰位点在链霉菌Lsr2中高度保守[18]。我们课题组的乙酰化蛋白质组研究发现,重要抗生素达托霉素产生菌玫瑰孢链霉菌中sIHF被乙酰化修饰 (K45,K61),这2个乙酰化位点在链霉菌的sIHF中高度保守[19]。
大肠杆菌中拟核蛋白含量受到不同的生长阶段和环境因素的动态调节,这表明蛋白质降解过程在其中发挥了重要作用。在大肠杆菌中,HU和Dps被AAA+蛋白酶降解,其他拟核蛋白的降解机制尚不明确。研究发现Huβ被Lon蛋白酶水解,而Dps则是ClpXP蛋白酶的底物[20]。链霉菌中这2个NAPs是否为Lon和ClpXP的底物尚不明确。研究发现DpsA在链霉菌从指数期转变为稳定期时蛋白表达上调,然而基因转录没有显著变化,这提示在稳定期DpsA蛋白变得更稳定,蛋白酶可能在此过程中发挥了重要作用。
3 NAPs调控链霉菌形态分化和次级代谢 3.1 NAPs调控链霉菌的形态分化 链霉菌从多基因组的气生菌丝阶段进入到单细胞的孢子阶段需要多个染色体的同步分裂和浓缩,NAPs在这个过程中发挥了关键的作用。一个完整的染色体进入到每个孢子的多个过程受到了拟核结合蛋白的帮助。天蓝色链霉菌中的3个Dps蛋白都参与孢子形成相关的拟核分配和压缩及参与渗透压调节。Dps蛋白之间存在精密的相互作用,每个dps的单突变株和双突变株都含有不同的染色体聚集状态[14]。sIHF也参与染色体的分配和压缩。sIHF突变株生长更慢,产孢严重缺陷,孢子大小增大25%,孢子存活率降低。而过表达sIHF时,无拟核的空孢子比例增大,孢子存活率上升[21]。
另外一个DNA曲形蛋白,HupS参与孢子中DNA包裹步骤。HupS同源蛋白未在形态发育简单的放线菌中发现,如棒杆菌和绝大多数的微球菌,但是在所有丝状放线菌和结核杆菌中存在。hupS突变株可产生拟核解聚的白色热敏感孢子,孢子变大。HupS-EGFP融合蛋白甚至作为分子标记运用到孢子形成的形态发育研究中。hupA和hupS的表达受到发育阶段的调控,hupA在基质菌丝和气生菌丝表达,而hupS特异性在产孢部位表达,其表达依赖于WhiA、WhiG和WhiI[2-22]。
链霉菌的形态分化过程除了DNA的同步分裂和浓缩外,也伴随着菌丝的分隔和片段化。在这个过程中SsgA样蛋白发挥了重要作用[23]。SsgA样蛋白的精确功能尚不清楚。SsgA蛋白在孢子超产的突变株中能抑制孢子的形成,过表达该基因促进丝状菌丝的分隔和片段化。ssgB也是孢子发育所需要的。ssgR编码一个IclR家族的调控因子,位于ssgA基因上游,调控其基因转录。SsgA和SsgB参与决定细胞分裂位点和招募FtsZ到该位点。Lsr2能够特异性结合到ssgB的启动子区,而HupA能够结合到ssgA、ssgB和ssgR的启动子区,这表明NAPs可能参与了菌丝分隔和细胞分裂的过程。
3.2 NAPs调控链霉菌次级代谢生物合成 除了作为链霉菌形态分化的关键调控因子外,NAPs也调控链霉菌次级代谢产物的生物合成,这种调控依赖于培养基成分。在天蓝色链霉菌中,hupA突变株中在DNA固体培养基中,放线紫红素 (Act) 产量增加,而在R5+固体培养基中Act的产量降低。有意思的是,液体培养基 (TSB:YEME34%) 中hupA突变株几乎丧失了Act和十一烷基灵菌红素 (Red) 的产生能力。hupS突变株Red产生延迟,最终产生量与野生型接近,但是丧失了Act的合成能力[24]。actII-ORF4和redD是天蓝色链霉菌Act和Red的途径特异性激活子,sIHF能结合到这2个基因的启动子区,调控Act和Red的生物合成[21]。在碳源和氨基酸丰富的培养基如R2YE上,sIHF突变株的Act产量大幅增加,但在氮源丰富的MS培养基上,Act产量降低,因此sIHF对次级代谢产物的调控机制是培养基成分依赖的。天蓝色链霉菌的lsr2 (SCO4076) 敲除株在寡营养的培养基上更有利于产生Act。最近,我们课题组发现Lsr2在玫瑰孢链霉菌中能够激活沉默的mureidomycin生物合成基因簇 (未发表),表明NAPs可能在调控次级代谢生物合成过程中发挥更加重要的作用。
4 结论 NAPs是链霉菌生长发育和次级代谢途径的共同调控元件,对链霉菌形态分化过程和次级代谢产生了重要的影响。链霉菌具有巨大的基因组,与别的微生物相比含有更高比例的NAPs。以天蓝色链霉菌为例,基因组含有2个HU、2个Lsr2和3个Dps同源体,这些蛋白通过直接或间接结合DNA调控大量链霉菌的基因,从而调控链霉菌的生长发育和次级代谢产物的生物合成。因此,深入了解链霉菌NAPs的结构,与DNA相互作用的模式,在转录和蛋白翻译后水平的调控途径,有望全面揭示NAPs调控链霉菌形态分化和次级代谢的重要分子机制。
参考文献
| [1] | Claessen D, de Jong W, Dijkhuizen L, W?sten HAB. Regulation of Streptomyces development:reach for the sky.Trends in Microbiology, 2006, 14(7): 313–319DOI:10.1016/j.tim.2006.05.008. |
| [2] | McCormick JR, Fl?rdh K. Signals and regulators that govern Streptomyces development.FEMS Microbiology Reviews, 2012, 36(1): 206–231DOI:10.1111/j.1574-6976.2011.00317.x. |
| [3] | Dillon SC, Dorman CJ. Bacterial nucleoid-associated proteins, nucleoid structure and gene expression.Nature Reviews Microbiology, 2010, 8(3): 185–195DOI:10.1038/nrmicro2261. |
| [4] | Giangrossi M, Giuliodori AM, Gualerzi CO, Pon CL. Selective expression of the β-subunit of nucleoid-associated protein HU during cold shock in Escherichia coli.Molecular Microbiology, 2002, 44(1): 205–216DOI:10.1046/j.1365-2958.2002.02868.x. |
| [5] | Salerno P, Larsson J, Bucca G, Laing E, Smith CP, Fl?rdh K. One of the two genes encoding nucleoid-associated HU proteins in Streptomyces coelicolor is developmentally regulated and specifically involved in spore maturation.Journal of Bacteriology, 2009, 191(21): 6489–6500DOI:10.1128/JB.00709-09. |
| [6] | Yokoyama E, Doi K, Kimura M, Ogata S. Disruption of the hup gene encoding a histone-like protein HSL and detection of HSL2 of Streptomyces lividans.Research in Microbiology, 2001, 152(8): 717–723DOI:10.1016/S0923-2508(01)01252-9. |
| [7] | Swiercz JP, Nanji T, Gloyd M, Guarné A, Elliot MA. A novel nucleoid-associated protein specific to the actinobacteria.Nucleic Acids Research, 2013, 41(7): 4171–4184DOI:10.1093/nar/gkt095. |
| [8] | Gordon BRG, Imperial R, Wang LR, Navarre WW, Liu J. Lsr2 of Mycobacterium represents a novel class of H-NS-like proteins.Journal of Bacteriology, 2008, 190(21): 7052–7059DOI:10.1128/JB.00733-08. |
| [9] | Gordon BRG, Li YF, Wang LR, Sintsova A, van Bakel H, Tian SH, Navarre WW, Xia B, Liu J. Lsr2 is a nucleoid-associated protein that targets AT-rich sequences and virulence genes in Mycobacterium tuberculosis.Proceedings of the National Academy of Science of the United States of America, 2010, 107(11): 5154–5159DOI:10.1073/pnas.0913551107. |
| [10] | Colangeli R, Haq A, Arcus VL, Summers E, Magliozzo RS, McBride A, Mitra AK, Radjainia M, Khajo A, Jacobs Jr WR, Salgame P, Alland D. The multifunctional histone-like protein Lsr2 protects mycobacteria against reactive oxygen intermediates.Proceedings of the National Academy of Science of the United States of America, 2009, 106(11): 4414–4418DOI:10.1073/pnas.0810126106. |
| [11] | Kurthkoti K, Tare P, Paitchowdhury R, Gowthami VN, Garcia MJ, Colangeli R, Chatterji D, Nagaraja V, Rodriguez GM. The mycobacterial iron-dependent regulator IdeR induces ferritin (bfrB) by alleviating Lsr2 repression.Molecular Microbiology, 2015, 98(5): 864–877DOI:10.1111/mmi.13166. |
| [12] | Colangeli R, Helb D, Vilchèze C, Hazbón MH, Lee CG, Safi H, Sayers B, Sardone I, Jones MB, Fleischmann RD, Peterson SN, Jacobs Jr WR, Alland D. Transcriptional regulation of multi-drug tolerance and antibiotic-induced responses by the histone-like protein Lsr2 in M. tuberculosis.PLoS Pathogens, 2007, 3(6): e87DOI:10.1371/journal.ppat.0030087. |
| [13] | Nair S, Finkel SE. Dps protects cells against multiple stresses during stationary phase.Journal of Bacteriology, 2004, 186(13): 4192–4198DOI:10.1128/JB.186.13.4192-4198.2004. |
| [14] | Facey PD, Hitchings MD, Saavedra-Garcia P, Fernandez-Martinez L, Dyson PJ, Del Sol R. Streptomyces coelicolor Dps-like proteins:differential dual roles in response to stress during vegetative growth and in nucleoid condensation during reproductive cell division.Molecular Microbiology, 2009, 73(6): 1186–1202DOI:10.1111/mmi.2009.73.issue-6. |
| [15] | Hitchings MD, Townsend P, Pohl E, Facey PD, Jones DH, Dyson PJ, Del Sol R. A tale of tails:deciphering the contribution of terminal tails to the biochemical properties of two Dps proteins from Streptomyces coelicolor.Cellular and Molecular Life Sciences, 2014, 71(24): 4911–4926DOI:10.1007/s00018-014-1658-4. |
| [16] | Aldridge M, Facey P, Francis L, Bayliss S, Del Sol R, Dyson P. A novel bifunctional histone protein in Streptomyces:a candidate for structural coupling between DNA conformation and transcription during development and stress.Nucleic Acids Research, 2013, 41(9): 4813–4824DOI:10.1093/nar/gkt180. |
| [17] | Facey PD, Sevcikova B, Novakova R, Hitchings MD, Crack JC, Kormanec J, Dyson PJ, Del Sol R. The dpsA gene of Streptomyces coelicolor:induction of expression from a single promoter in response to environmental stress or during development.PLoS ONE, 2011, 6(9): e25593DOI:10.1371/journal.pone.0025593. |
| [18] | Parker JL, Jones AME, Serazetdinova L, Saalbach G, Bibb MJ, Naldrett MJ. Analysis of the phosphoproteome of the multicellular bacterium Streptomyces coelicolor A3(2) by protein/peptide fractionation, phosphopeptide enrichment and high-accuracy mass spectrometry.Proteomics, 2010, 10(13): 2486–2497DOI:10.1002/pmic.v10:13. |
| [19] | Liao GJ, Xie LX, Li X, Cheng ZY, Xie JP. Unexpected extensive lysine acetylation in the trump-card antibiotic producer Streptomyces roseosporus revealed by proteome-wide profiling.Journal of Proteomics, 2014, 106: 260–269DOI:10.1016/j.jprot.2014.04.017. |
| [20] | Badrinarayanan A, Le TBK, Laub MTT. Bacterial chromosome organization and segregation.Annual Review of Cell and Developmental Biology, 2015, 31: 171–199DOI:10.1146/annurev-cellbio-100814-125211. |
| [21] | Yang YH, Song E, Willemse J, Park SH, Kim WS, Kim EJ, Lee BR, Kim JN, van Wezel GP, Kim BG. A novel function of Streptomyces integration host factor (sIHF) in the control of antibiotic production and sporulation in Streptomyces coelicolor.Antonie Van Leeuwenhoek, 2012, 101(3): 479–492DOI:10.1007/s10482-011-9657-z. |
| [22] | Persson J, Chater KF, Fl?rdh K. Molecular and cytological analysis of the expression of Streptomyces sporulation regulatory gene whiH.FEMS Microbiology Letters, 2013, 341(2): 96–105DOI:10.1111/fml.2013.341.issue-2. |
| [23] | Jakimowicz D, van Wezel GP. Cell division and DNA segregation in Streptomyces:how to build a septum in the middle of nowhere?.Molecular Microbiology, 2012, 85(3): 393–404DOI:10.1111/j.1365-2958.2012.08107.x. |
| [24] | Bradshaw EH. Nucleoid-associated proteins of streptomyces coelicolor:discovery and functions. East Anglia, UK:Doctoral Dissertation of University of East Anglia, 2013. |
