杨瑞先

 , 张拦, 彭彪彪, 蒙城功
, 张拦, 彭彪彪, 蒙城功 洛阳理工学院环境工程与化学学院, 河南 洛阳 471023
收稿日期:2017-02-20;修回日期:2017-04-21;网络出版日期:2017-05-12
基金项目:国家自然科学基金(31500008);河南省科技厅科技攻关项目(152102210328)
*通信作者:杨瑞先, Tel/Fax:+86-379-65928271;E-mail:fairy19790805@163.com
摘要:[目的]研究药用植物芍药(Paeonia lactiflora Pall.)内生真菌的种群多样性,同时对其可能存在的聚酮合酶(Polyketide synthase,PKS)和非核糖体多肽合成酶(Non-ribosomal peptide synthetase,NRPS)基因多样性进行评估,预测芍药内生真菌产生活性次生代谢产物的潜力。[方法]采用组织分离法获得芍药根部内生真菌菌株,结合形态学特征和ITS序列分析,进行鉴定;利用兼并性引物对内生真菌中存在的聚酮合酶(PKS)基因和非核糖体多肽合成酶(NRPS)基因进行PCR扩增及序列测定分析,构建系统发育树,明确芍药内真菌PKS基因序列和NRPS基因序列的系统进化地位。[结果]从芍药组织块中共分离得到105株内生分离物,去重复后获得52株内生真菌,菌株ITS基因序列信息显示,52株芍药内生真菌隶属于7目、13科、15属,其中小球腔菌属(Leptosphaeria)、土赤壳属(Ilyonectria)和镰孢属(Fusarium)为优势种群;从52株内生真菌中筛选获得13株含PKS基因片段的菌株,8株含NRPS基因片段的菌株,部分菌株功能基因的氨基酸序列与GenBank中已知化合物的合成序列具有一定的同源性,预示芍药根部内生真菌具有合成丰富多样的次生代谢产物的潜力。[结论]药用植物芍药根部具有丰富的内生真菌资源,且具有产生活性次生代谢产物的潜力,值得进一步开发研究和应用。
关键词: 芍药 内生真菌 多样性 聚酮合酶(PKS) 非核糖体多肽合成酶(NRPS)
Fungal endophytes in Paeonia lactiflora and their secondary metabolites
Yang Ruixian

 , Zhang Lan, Peng Biaobiao, Meng Chenggong
, Zhang Lan, Peng Biaobiao, Meng Chenggong Department of Environmental Engineering and Chemistry, Luoyang Institute of Science and Technology, Luoyang 471023, Henan Province, China
Received 20 February 2017; Revised 21 April 2017; Published online 12 May 2017
*Corresponding author: Ruixian Yang, Tel/Fax:+86-379-65928271;E-mail:fairy19790805@163.com
Supported by the National Natural Science Foundation of China (31500008) and by the Project of Science and Technology Department of Henan Province (152102210328)
Abstract: [Objective]To explore the biosynthetic potential of endophytic fungi isolated from medicinal plants Paeonia lactiflora, we studied their population diversity and detected richness of their putative polyketide synthase (PKS) and nonribosomal peptide synthetase (NRPS) gene sequences.[Methods]Culture-dependent method was used to obtain endophytes from the surface-sterilized plant samples. Endophytes were identified based on morphological characteristics and ITS gene phylogenies. PKS and NRPS gene fragments were PCR amplified from genomic DNA with degenerate primers. The biosynthetic potential of endophytes was accessed by bioinformatic and phylogenetic analyses of PKS and NRPS gene sequences.[Results]A total of 105 endophytic isolates were isolated from P. lactiflora root tissues, yielding a total of 52 endophytic fungi through dereplication. The analysis results of endophtytic fungi ITS gene sequences showed that they affiliated to 15 genera of 13 families in seven orders, and Leptosphaeria, Ilyonectria and Fusarium were the predominant genera. Thirteen PKSs and eight NRPSs gene fragments were detected in a total of 52 endophytic fungi. Some fungi amino acid translated fragments were similar to sequences of PKS and NRPS involved in the biosynthesis of the antifungal compound in GenBank. Analysis of the detected endophyte gene fragments afforded consideration of the possible bioactivity of the natural products produced by endophytes from P. lactiflora.[Conclusion]This study demonstrated that the endophytic fungi from P. lactiflora roots had great significant diversity and potential to synthesize bioactive secondary metabolite, therefore, their natural products are worth of further research and development.
Key words: Paeonia lactiflora endophytic fungi diversity polyketide synthase nonribosomal peptide synthetase
芍药(Paeonia lactiflora Pall.)隶属于芍药科(Paenoiaeeae)芍药属(Paeonia),是我国兼具观赏和药用价值的著名传统草本花卉,芍药根中含有药用成分芍药苷(Paeoniflorin),具有扩张血管、降压镇痛、清热解痉、抗炎、抗菌和抗癌等多种药用功能,在医学领域被广泛应用[1]。目前多采用有机溶剂回流法提取芍药组织中的芍药苷,其提取效率低且提取过程复杂[2]。近年来,研究表明植物内生菌广泛存在于宿主植物体内,与宿主长期协同进化,由于基因转移及对内化学环境的适应性,能够产生与宿主相同或相似的活性化学物质[3],因此从植物内生菌中获得丰富多样和具有生物学活性的次生代谢产物,突破药用植物生长周期长、产量低、不可再生等限制,已成为目前的研究热点。
植物内生真菌能够产生丰富的活性次生代谢产物,主要包含萜类、生物碱类、芳香类、肽类等化合物,且多具有抗菌、抗肿瘤、抗氧化、杀虫、促生长等生物活性[4]。根据对应的生物合成酶的特性,可以将这些作用效果多样、结构纷繁复杂的化合物分为聚酮类化合物和非核糖体多肽类化合物两大类。聚酮类化合物的生物合成过程是在聚酮合酶(Polyketide synthase,PKS)的催化下完成,聚酮合酶一般分为两类,一类为复合PKS,即PKSⅠ,另一类为芳香PKS,即PKSⅡ[5]。真菌聚酮合酶多属于Ⅰ型聚酮合酶,即以模块形式存在的多功能酶,主要由酮基合成酶(Ketosynthase,KS)、酰基转移酶(Acyltransferase,AT)和酰基载体蛋白(Acylcarrier protein,ACP) 3个核心功能域组成,其中AT结构域负责挑选特异性的酰基辅酶A分子,ACP负责在合成过程中锚定聚酮链,KS结构域负责催化碳链延伸反应,KS区域在整个PKS体系中序列最保守,适合设计兼并引物[6]。非核糖体多肽类化合物由非核糖体肽合成酶(Non-ribosomal peptide synthetase,NRPS)催化合成,NRPS由腺苷酰化(Adenylation,A)结构域、肽酰载体蛋白(Peptidyl carrier protein,PCP)结构域和缩合(Condensation,C)结构域组成,三者通常以C-A-PCP的形式排列,A结构域负责底物识别和活化,PCP结构域负责在合成过程中共价固定中间产物,C结构域负责催化肽键形成[7]。大多数NRPS的模块数为3–15个,最高可达50个,每一个模块负责将一个特异性的氨基酸或芳香酸底物整合到延伸的碳链中,因此模块的数量、排列顺序和底物特异性决定了其最终的产物结构[8]。
目前国内研究者已经对一些药用植物进行了内生真菌的分离,并基于PKS和NRPS功能基因定向筛选的方法,获得了丰富多样的聚酮类化合物和非核糖体多肽类化合物。如Wang等利用PKS基因定向筛选技术,从一株盐生植物的内生真菌发现了一个新的聚酮化合物Penicitriketo[9]。因此从PKS和NRPS功能基因的克隆入手,从分子水平上筛选和预测菌株可能产生的化合物类型,发现新的聚酮类和非核糖体肽类化合物是有效可行的。本研究以传统药用植物芍药为材料,进行内生真菌的分离,并利用形态学特征结合ITS序列系统发育分析,进行内生真菌的鉴定;筛选含有PKS和NRPS基因的功能菌株,预测其产生次生代谢产物的能力,为寻找新的天然活性化合物提供科学依据,并为探讨内生真菌功能基因与内生真菌次生代谢产物间的相关性研究奠定理论基础。
1 材料和方法 1.1 供试材料
1.1.1 植物样品: 于2016年3–4月间采自洛阳牡丹国花园、隋唐遗址植物园、国家牡丹基因库和洛阳理工学院芍药种植区,采用随机取样法收集芍药健康根部组织,装入无菌袋内带回实验室,用于内生真菌的分离。
1.1.2 培养基: 采用PDA培养基进行内生真菌的分离和纯化。
1.1.3 主要试剂: 真菌基因组DNA提取试剂盒购于北京索莱宝科技有限公司;DNA marker和2×Taq PCR Master mix均购于北京康为世纪生物科技有限公司;琼脂糖凝胶回收试剂盒购于北京天根生化科技公司;pM19-T载体购于宝生物工程(大连)有限公司;琼脂糖购自Spanish公司;PCR扩增引物和克隆测序均由上海生工生物工程公司完成。
1.2 内生真菌的分离和纯化 将健康的芍药根部样本在自来水下冲洗干净,晾干待用,剪切成0.5 cm2的小块混匀。采用如下步骤进行消毒处理:75%乙醇表面消毒30 s,灭菌水冲洗3次;3%次氯酸钠表面消毒5 min,灭菌水冲洗5次(30 s/次);置于无菌滤纸上吸干水分。将处理过的根部样品切口面紧贴于PDA平板上,置25恒温培养箱中培养5–10 d,3 d后观察组织块周围是否有菌落出现。待长出菌落后,挑取尖端菌丝转接到新的培养基上进行纯化,经纯化后获得内生真菌分离物。为了验证表面消毒效果,取100 μL最后一次用于清洗表面消毒样品的无菌水涂布到PDA培养基上,25培养以验证表面消毒效果。同时,根据分离组织块数和获得的内生真菌菌株数量计算分离率,分离率指分离获得的菌株数量占分离样品组织块数的百分率。
1.3 内生真菌的鉴定
1.3.1 菌株形态和培养特征观察: 根据内生真菌在PDA培养基上的培养特征进行分类及去重复,采用直接挑取菌丝法和插片培养法,镜检观察真菌孢子、菌丝体、产孢结构和菌核等显微特征,参考文献[10]进行内生真菌的初步分类。
1.3.2 ITS基因序列的PCR扩增与系统发育分析: 利用真菌基因组DNA提取试剂盒提取内生真菌菌株的基因组DNA,以通用引物ITS1 (5′-TCCG TAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCG CTTATTGATATGC-3′)[11]对菌株进行ITS区域扩增。PCR扩增体系为50 μL:2×PCR mixture 25 μL,ddH2O 20 μL,DNA template 1 μL,引物各2 μL。PCR扩增条件为:94;94,55,72,35个循环;72。PCR产物经胶回收后送至上海生工生物工程技术服务有限公司进行测序。测序获得的ITS序列利用GenBank数据库中的BLASTn软件在线比对服务进行同源性分析,选择与靶序列最相近的菌种序列作参考,随后用Clustal X进行序列比对,最终运用MEGA 5.0软件采用邻接法(Neighbour-Joining)构建系统发育树,根据系统发育分析结果,分析芍药根部内生真菌的系统发育地位及物种多样性。
1.4 内生真菌PKS和NRPS基因检测和分析 以内生真菌菌株基因组DNA为模板,分别采用兼并引物KAF1 (5′-GARKSICAYGGIACIGGIA C-3′)、KAR1 (5′-CCAYTGIGCICCRTGICCIGARA A-3′)[12]和AUG003 (5′-CCGGCACCACCGGNAAR CCHAA-3′)、AUG007 (5′-CCGGACCATGTCGCCN GTBYKRTA-3′)[13]进行PKS和NRPS功能基因的筛选和检测。PCR扩增体系为50 μL:2×PCR mixture 25 μL,ddH2O 20 μL,DNA template 1 μL,引物各2 μL。PCR扩增条件为:94;94,60,72,35个循环;72。利用胶回收试剂盒回收PCR产物,按照pM19-T说明书连接T载体与纯化后的DNA片段,转化E. coli DH5α,通过氨苄青霉素筛选挑取阳性克隆进行PCR检测,从检测合格的重组菌株中提取质粒,送至上海生工生物工程技术服务有限公司进行测序。利用BLASTx软件将获得的PKS和NRPS基因序列转化为氨基酸序列,在线进行序列的同源性比对。NRPS功能基因A结构域底物特异性预测采用在线工具NRPSpredictor2 (http://nrps.informatik.uni-tuebingen.de/Controller?cmd=SubmitJob)进行分析[14]。根据氨基酸序列同源性比对结果,选择与靶序列同源性最高的序列作参考,使用Clustal X进行序列同源性比对,最终运用MEGA 5.0软件采用邻接法(Neighbour-Joining)构建系统发育树,根据系统发育分析结果,分析芍药内生真菌PKS和NRPS基因片段的系统发育地位和丰富性。
2 结果和分析 2.1 芍药组织表面消毒结果评估 取100 μL最后一次用于清洗表面消毒芍药组织的无菌水涂布于PDA培养基上,25培养7 d后,观察发现没有微生物的生长,因而可以认定分离得到的微生物为芍药内生真菌,而非外界环境污染或植物表面的真菌。
2.2 内生真菌的分离结果 从200块芍药根部组织中共获得105株内生真菌分离物,其分离率为52.5%;纯化后将菌落形态特征相似的菌株初步归类后,获得内生真菌52株,其菌落形态各异,分离结果表明芍药根部组织中存在丰富的内生真菌种类。通过镜检观察,发现部分菌株的显微形态相似,且数量较多,结合真菌鉴定手册将其初步归为小球腔菌属(Leptosphaeria)、土赤壳属(Ilyonectria)和镰孢属(Fusarium)真菌,这3个属应为芍药根部内生真菌的优势种群,其优势属代表菌株在PDA培养基上的菌落特征及显微形态特征见图 1。
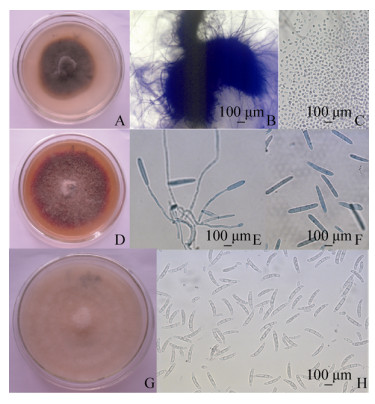 |
| 图 1 芍药根部内生真菌优势属代表菌株菌落特征及显微形态 Figure 1 The colony morphology and morphological characteristics of dominant genus of endophytic fungi isolated from P. lactiflora roots. A, B and C represent colony, pycnidia and conidia of Leptosphaeria, respectively; D, E and F represent colony, conidiophores and conidia of Ilyonectria, respectively; G and H represent colony and conidia of Fusarium. |
| 图选项 |
2.3 内生真菌的鉴定和系统发育分析 基于内生真菌菌落形态观察和显微形态观察,采用扩增ITS序列测定的方法对芍药内生真菌进行鉴定。PCR扩增结果表明,52株内生真菌均可获得1条约500 bp左右的条带,将序列测定结果上传至GenBank,其序列登录号为KY522672–KY522723。利用GenBank数据库中的BLASTn软件比对序列结果后,选取各个菌株的同源性序列,利用MEGA 5.0软件构建芍药内生真菌菌株系统发育树,结合菌株形态,确立了各菌株的种属关系。由系统发育树(图 2)可以看出,52株内生真菌的ITS序列均与其同源性较高的菌株聚为一类,且隶属于2个亚门、7个目、13个科、15个属,其7个目分别为散囊菌目(Eurotiales)、肉座菌目(Hypocreales)、格孢腔菌目(Pleosporales)、葡萄座腔菌目(Botryosphaeriales)、无孢目(Agonomycetales)、伞菌目(Agaricales)和煤炱目(Capnodiales);13个科分别为曲霉科(Aspergillaceae)、发菌科(Trichocomaceae)、丛赤壳科(Nectriaceae)、肉座菌科(Hypocreaceae)、孢黑团壳科(Massarineae)、小球腔菌科(Leptosphaeriaceae)、暗球腔菌科(Phaeosphaeriaceae)、孢腔菌科(Pleosporaceae)、亚隔孢壳科(Didymellaceae)、裂褶菌科(Schizophyllaceae)、无孢菌科(Agonomycetaceae)、葡萄座腔菌科(Botryosphaeriaceae)和枝孢霉科(Cladosporiaceae);15个属分别为曲霉属(Aspergillus)、踝节菌属(Talaromyces)、镰孢属(Fusarium)、土赤壳属(Ilyonectria)、乳突赤壳属(Thelonectria)、头孢霉属(Cephalosporium)、Acrocalymma、小球腔菌属(Leptosphaeria)、Setophoma、链格孢属(Alternaria)、丝核菌属(Rhizoctonia)、裂褶菌属(Schizophyllum)、叶点霉属(Phyllosticta)、茎点霉属(Phoma)和枝孢霉属(Cladosporium)。
 |
| 图 2 芍药根部内生真菌ITS序列系统发育进化树 Figure 2 The phylogenetic relationship of endophytic fungi isolated from P. lactiflora roots based on ITS gene homology. The GenBank accession numbers of ITS sequences are given in the parentheses. The numbers at nodes represent the percentage levels of bootstrap support (%) (expressed as percentages of 1000 replications). The scale bar represents 0.050 nucleotide changes. |
| 图选项 |
52株芍药内生真菌在各个属的具体分布和比例见表 1,其中10株芍药内生真菌属于小球腔菌属(Leptosphaeria),所占比例为19.2%;属于土赤壳属(Ilyonectria)的菌株有8株,所占比例为15.4%;属于镰孢属(Fusarium)的菌株有6株,所占比例11.5%;其他属菌株数量相对较少,所占比例均在10%以下,表明小球腔菌属(Leptosphaeria)、土赤壳属(Ilyonectria)和镰孢属(Fusarium)真菌为芍药根部内生真菌的优势种群,此结果与真菌显微观察结果相一致。该部分研究结果表明,芍药根部内生真菌在种群上具有多样性的特点,能够为进一步筛选具有生物活性天然产物的真菌菌株提供丰富的菌种资源,值得进一步开发利用。
表 1. 芍药根部内生真菌的种群分布 Table 1. The population distribution of endophytic fungi isolated from P. lactiflora roots
| Taxa of endophytes | Number of isolates | Relative abundance/% |
| Ascomycetes | ||
| Aspergillus | Sy1, Sy14 | 3.8 |
| Fusarium | Sy2, Sy4, Sy7, Sy8, Sy12, Sy21 | 11.5 |
| Setophoma | Sy3, Sy18, Sy29 | 5.8 |
| Cephalosporium | Sy9 | 1.9 |
| Ilyonectria | Sy10, Sy11, Sy19, Sy23, Sy26, Sy27, Sy33, Sy34 | 15.4 |
| Acrocalymma | Sy15, Sy16, Sy38, Sy28 | 5.8 |
| Leptosphaeria | Sy17, Sy20, Sy24, Sy25, Sy31, Sy32, Sy35, Sy36, Sy37, Sy39 | 19.2 |
| Talaromyces | Sy22 | 1.9 |
| Thelonectria | Sy30 | 1.9 |
| Alternaria | Sy40, Sy41, Sy48, Sy49, Sy51 | 9.6 |
| Phyllosticta | Sy44, Sy47, Sy50, Sy52 | 7.7 |
| Phoma | Sy45 | 1.9 |
| Cladosporium | Sy46 | 1.9 |
| Basidiomycetes | ||
| Rhizoctonia | Sy5, Sy6, Sy13 | 5.8 |
| Schizophyllum | Sy42, Sy43 | 3.8 |
| Total | 52 | 100.0 |
表选项
2.4 内生真菌的PKS和NRPS基因检测和系统发育分析 利用PCR扩增的方法筛选芍药内生真菌中包含PKS和NRPS功能基因的菌株,扩增结果表明,13株内生真菌含有PKS功能基因,其阳性比率为25%;8株内生真菌含有NRPS功能基因,其阳性比率为15%;其中2个菌株Sy23和Sy30同时包含PKS和NRPS功能基因。将扩增获得的PKS功能基因中的KS结构域基因片段和NRPS功能基因中的A结构域基因片段进行克隆测序,其KS结构域基因片段大小均在700–800 bp之间,NRPS功能基因中的A结构域基因片段约为700 bp,PKS序列和NRPS序列在GenBank中的序列登录号见表 2。利用NCBI数据库中的BLASTx软件将获得的PKS和NRPS核苷酸序列转化为氨基酸序列,进行同源性分析(表 2),结果表明,芍药内生真菌KS结构域的部分氨基酸序列与已知真菌的同源性在52%–97%之间,其中菌株Sy21与镰孢属真菌Fusarium foetens聚酮合酶序列的同源性为97%,菌株Sy1、Sy9、Sy22、Sy30、Sy44和Sy47与其他真菌PKS氨基酸序列也具有一定的同源性,但同源性均在90%以下,表明这些芍药内生真菌中存在丰富的KS结构域片段,且具有合成聚酮类化合物的潜力;另外6株芍药内生真菌Sy10、Sy19、Sy23、Sy26、Sy33和Sy34的PKS序列未找到与其同源性较高的真菌聚酮合酶,主要与真菌Coniochaeta ligniaria的KC结构域蛋白具有一定的同源性。
表 2. 芍药根部内生真菌PKS和NRPS基因 Table 2. PKS and NRPS genes in endophytic fungi isolated from P. lactiflora roots
| Gene | Number of isolates | Amino acid residues | Accession number | Top BLASTx match (GenBank accession No.) | Identity/% | Predicted binding pocket (amino acid substrate) |
| PKS | Sy1 | 276 | KY629564 | Polyketide synthase, Aspergillus ustus (KIA75874) | 139/268(52%) | Not done |
| PKS | Sy9 | 239 | KY629565 | Related to polyketide synthase, Rhynchosporiuma gropyri (CZS97698) | 213/239(89%) | Not done |
| PKS | Sy10 | 238 | KY629566 | Ketoacyl-synt-domain-containing protein, Coniochaeta ligniaria (OIW26903) | 201/240(84%) | Not done |
| PKS | Sy19 | 238 | KY629567 | Ketoacyl-synt-domain-containing protein, Coniochaeta ligniaria (OIW26903) | 199/240(83%) | Not done |
| PKS | Sy21 | 235 | KY629568 | Putative polyketide synthase, Fusarium foetens (ALQ32848) | 227/234(97%) | Not done |
| PKS | Sy22 | 245 | KY629569 | Polyketide synthase, Colletotrichum incanum (OHW98789) | 132/248(53%) | Not done |
| PKS | Sy23 | 238 | KY629570 | Ketoacyl-synt-domain-containing protein, Coniochaeta ligniaria (OIW26903) | 201/240(84%) | Not done |
| PKS | Sy26 | 238 | KY629571 | Ketoacyl-synt-domain-containing protein, Coniochaeta ligniaria (OIW26903) | 201/240(84%) | Not done |
| PKS | Sy30 | 260 | KY629572 | Polyketide synthase, Coccidioides posadasii (XP_003067740) | 164/263(62%) | Not done |
| PKS | Sy33 | 238 | KY629573 | Ketoacyl-synt-domain-containing protein, Coniochaeta ligniaria (OIW26903) | 198/240(83%) | Not done |
| PKS | Sy34 | 235 | KY629574 | Ketoacyl-synt-domain-containing protein, Coniochaeta ligniaria (OIW26903) | 199/237(84%) | Not done |
| PKS | Sy44 | 240 | KY629575 | Polyketide synthase, Byssochlamys spectabilis (GAD98579) | 145/240(60%) | Not done |
| PKS | Sy47 | 232 | KY629576 | Putative polyketide synthase protein, Neofusicoccum parvum (XP_007581405) | 165/233(71%) | Not done |
| NRPS | Sy11 | 194 | KY629582 | Nonribosomal peptide synthetase 1, Neonectria ditissima (KPM37793) | 166/194(86%) | DIGFVGGIF-(Ile) |
| NRPS | Sy14 | 238 | KY629577 | Nonribosomal peptide synthase, Aspergillus ustus (KIA75709) | 205/238(86%) | DVFAIGAII-(Phe) |
| NRPS | Sy23 | 251 | KY629580 | Similar to fatty acid transporter, Leptosphaeria maculans (XP_003836794) | 223/251(89%) | No prediction |
| NRPS | Sy25 | 248 | KY629581 | Similar to fatty acid transporter, Leptosphaeria maculans (XP_003836794) | 225/248(91%) | No prediction |
| NRPS | Sy28 | 234 | KY629578 | Nonribosomal peptide synthetase 3, Pyrenophora teres f. teres (AEZ55900) | 198/229(86%) | --WLWNCEI-(Phe) |
| NRPS | Sy30 | 233 | KY629583 | Linear gramicidin synthase subunit D, Neonectria ditissima (KPM38180) | 201/233(86%) | --WLWNVEV-(Asn) |
| NRPS | Sy38 | 237 | KY629579 | Nonribosomal peptide synthetase 3, Pyrenophora teres f. teres (AEZ55900) | 205/237(86%) | --WLWNCEI-(Phe) |
| NRPS | Sy39 | 229 | KY629584 | Nonribosomal peptide synthetase, Cenococcum geophilum (OCK98900) | 200/229(87%) | DVAFIGSIH-(Phe) |
表选项
8株芍药内生真菌A结构域的部分氨基酸序列与已知真菌序列同源性在86%–91%之间,其中6个菌株NRPS序列与已知真菌NRPS序列具有一定的同源性,其同源性均在87%以下,表明芍药内生真菌中存在一定数量的A结构域,且具有一定的新颖性,推测这些菌株具有催化合成非核糖体多肽类化合物的潜力;2个菌株Sy23和Sy25并未对应到真菌的NRPS序列,其与小球腔菌属真菌Leptosphaeria maculans的脂肪酸转运蛋白具有较高的同源性。利用在线软件NRPSpredictor2对芍药内生真菌A结构域的底物特异性进行预测(表 2),结果表明6株芍药内生真菌A结构域序列中均包含由7–9个活性氨基酸残基组成的特异性授予残基,并表现出对特定底物的选择性。菌株Sy14、Sy28、Sy38和Sy39虽由不同的活性氨基酸残基组成,但其识别的底物均为芳香族氨基酸苯丙氨酸(Phe),表明不同的活性氨基酸残基可能识别相同的底物;菌株Sy11活性氨基酸残基识别的底物为异亮氨酸(Ile);菌株Sy30活性氨基酸残基识别的底物为天冬酰胺(Asn);菌株Sy23和Sy25的A结构域未被预测到。
根据芍药内生真菌PKS序列在NCBI中的BLAST结果,选择与其同源性较高的氨基酸序列进行系统发育树的构建。由芍药内生真菌KS结构域氨基酸序列和同源序列构建的发育树(图 3)可以看出,其扩增获得的芍药内生真菌PKS均为重复性Ⅰ型PKS,且均为Ⅰ型PKS中的高度还原型PKS (Reducing PKS),其系统发育树有2个明显的分支,将芍药内生真菌的PKS序列分为2个亚型,即Reducing PKS clade Ⅱ和Reducing PKS clade Ⅰ,菌株Sy9、Sy10、Sy19、Sy21、Sy23、Sy26、Sy30、Sy33、Sy34、Sy44和Sy47均归于Reducing PKS clade Ⅱ;菌株Sy1和Sy22归于Reducing PKS clade Ⅰ。与菌株Sy47和Sy30具有一定同源性的氨基酸序列主要涉及洛伐他汀九酮合成酶基因(Lovastatin nonaketide synthase,LovB)的合成;黄曲霉属菌株Sy1的PKS序列与洛伐他汀二酮体合成酶(Lovastatin diketide synthase,LovF)具有一定的同源性;6株归于土赤壳属的真菌Sy10、Sy19、Sy23、Sy26、Sy33和Sy34均与其他真菌KC结构域蛋白具有较高的同源性,主要参与次生代谢产物聚合酮的合成。该部分研究结果表明芍药内生真菌具有丰富的PKS序列片段,且与聚合酮类次生代谢产物的合成具有显著的同源性。
 |
| 图 3 芍药根部内生真菌Ⅰ型PKSs氨基酸序列系统发育进化树 Figure 3 The phylogenetic relationship of endophytic fungi isolated from P. lactiflora roots based on type Ⅰ PKSs amino acid sequences homology. The GenBank accession numbers of PKS amino acid sequences are given in the parentheses. The numbers at nodes represent the percentage levels of bootstrap support (%) (expressed as percentages of 1000 replications). The scale bar represents 0.10 amino acid changes. |
| 图选项 |
芍药根部内生真菌A结构域的氨基酸序列与其同源序列构建的系统发育树(图 4)表明,该系统发育树有2个分支,菌株Sy11、Sy14、Sy28、Sy30、Sy38和Sy39明显聚为一类,与其他真菌的非核糖体聚合酶具有一定的同源性;菌株Sy23和Sy25单独聚为一类,主要与真菌的脂肪酸转运蛋白具有一定的同源性。菌株Sy39与HC-toxin合成酶具有较高的同源性,聚为一类;Sy28和Sy38均归于Acrocalymma属,两者A结构域的序列具有较高的同源性,且与真菌短杆菌酪肽合成酶(Tyrocidine synthetase)具有一定的同源性;菌株Sy30与真菌短杆菌肽合成酶(Gramicidin synthase subunit)具有一定的同源性。该结果表明芍药内生真菌中具有丰富的NRPS序列片段,且与非核糖体多肽类次生代谢产物的合成具有显著的同源性。
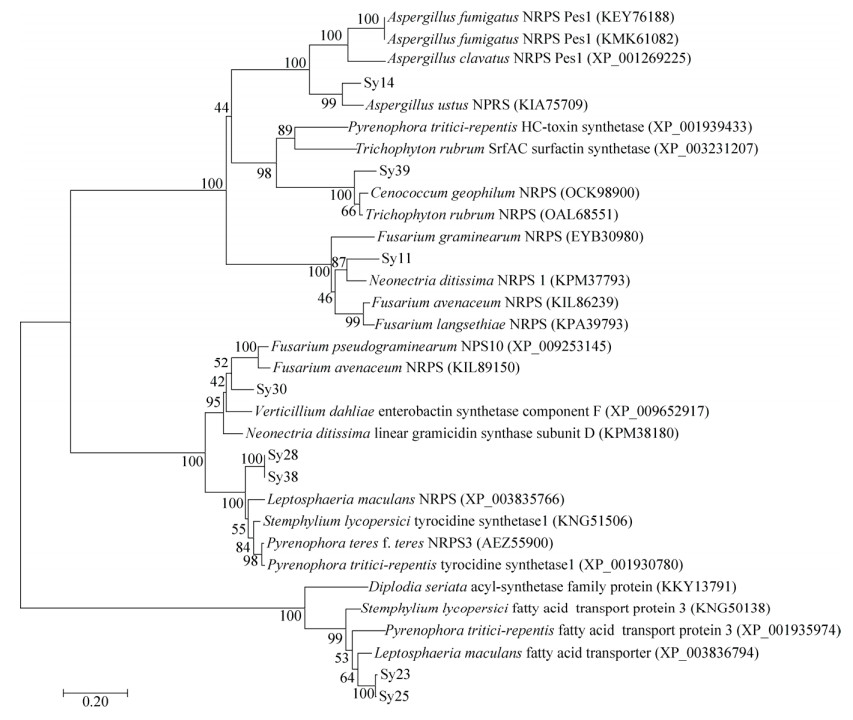 |
| 图 4 芍药根部内生真菌NRPSs氨基酸序列系统发育进化树 Figure 4 The phylogenetic relationship of endophytic fungi isolated from P. lactiflora roots based on NRPSs amino acid sequences homology. The GenBank accession numbers of NRPS amino acid sequences are given in the parentheses. The numbers at nodes represent the percentage levels of bootstrap support (%) (expressed as percentages of 1000 replications). The scale bar represents 0.20 amino acid changes. |
| 图选项 |
2株内生真菌Sy23和Sy30同时包含PKS和NRPS序列,根据ITS序列鉴定结果,Sy23和Sy30归于土赤壳属(Ilyonectria)和乳突赤壳属(Thelonectria),但2个菌株的PKS序列和NRPS序列却与其他真菌具有较高的同源性。菌株Sy23的PKS序列与Coniochaeta ligniaria KC结构域蛋白具有较高的同源性,NRPS序列与Leptosphaeria maculans脂肪酸转运蛋白具有较高的同源性(表 2);菌株Sy30的PKS序列与Coccidioides posadasii PKS序列具有较高的同源性,NRPS序列与Neonectria ditissima短杆菌肽合成酶具有较高的同源性(表 2)。
3 讨论 植物内生菌具有丰富的生物多样性和化学多样性,是天然活性化合物的重要来源,尤其是药用植物特殊的内环境,更是为具有独特生物活性的微生物提供了来源。目前研究者已从多种药用植物中分离获得了具有生物活性的内生菌,如Zhang等从青蒿素(Artemisia annua)中获得了1株曲霉菌(Aspergillus terreus),该菌能产生吲哚生物碱的衍生物,这些物质经研究发现都具有较好的抗肿瘤活性[15];Ebrahim等从红树林植物海桑(Sonneratia caseolaris)中分离获得1株内生真菌Bionectria ochroleuca,其乙酸乙酯提取物能产生2种新的多肽类物质Pullularins E和F,这2种物质具有显著的抗癌活性[16];Wellensiek等研究发现来自沙漠植物的内生真菌能够产生一些新颖的化合物,这些代谢产物能够显著抑制人免疫缺陷病毒HIV-1的复制[17]。研究表明,来自植物内生菌种类繁多的活性物质有许多还是未开发的新物质,同时这些活性物质的毒性相当于已经通过了植物体的筛选,所以对人类一般是低毒、安全和高效的,因此通过药用植物内生菌的分离,从而发现微生物源低毒活性的次生代谢产物具有一定的可行性和重要意义。
芍药作为中国传统的药用植物,目前关于其内生菌的分离研究相对较少,仅有阿依努尔·阿不都热合曼对新疆块根芍药(Paeonia anomala)中的内生细菌进行分离,并获得了1株能够产生灵菌红素的粘质沙雷氏菌(Serratia marcescens),该物质具有显著的抗菌、抗肿瘤和免疫抑制活性[18]。目前尚无关于芍药组织中内生真菌的报道,本研究从芍药根部组织中共分离获得了52株内生真菌,隶属于7目、13科、15属,表明芍药根部内生真菌的种群多样性和丰富性。目前,研究人员已经从83科212种药用植物分离获得了376属以上的内生真菌种类,涉及子囊菌、担子菌和无孢类群等,具有丰富的物种多样性,其中归于子囊菌亚门的有372属,为药用植物内生真菌中的优势类群[19]。本研究中获得的52株芍药内生真菌有5株属于担子菌亚门,47株属于子囊菌亚门,表明子囊菌亚门真菌也是芍药内生真菌的优势类群。研究发现子囊菌亚门中的镰孢属(Fusarium)、链格孢属(Alternaria)、曲霉属(Aspergillus)和拟茎点霉属(Phomopsis)真菌为大多数药用植物内生真菌的优势属[20]。本研究对芍药内生真菌的种类鉴定结果表明,镰孢属(Fusarium)真菌为芍药根部内生真菌的优势种群,其分离频率为11.5%,表明芍药根部也存在大量的镰孢菌,镰孢菌是一大类广泛分布在土壤和植物体内的丝状真菌,且大多数为植物致病菌,在健康芍药根部组织中分离获得大量的镰孢菌,推测这些镰孢菌可能为潜伏的植物致病菌[21],也可能在与植物共进化的过程中,其致病性逐渐减低,与植物形成了共生关系。
植物内生真菌种群多样性也受到宿主植物种类的影响,不同的宿主其内生菌的种群构成不同,本研究结果发现芍药内生真菌中小球腔菌属(Leptosphaeria)真菌数量最多,其分离频率最高,该属真菌在其他药用植物如西藏糙苏(Phlomis younghusbandii Mukerjee)[22]和银杏(Ginkgo biloba L.)[23]中被分离获得,但数量相对较少,表明小球腔菌属真菌对芍药组织具有一定的偏好性,能够在芍药根部大量定殖。土赤壳属(Ilyonectria)及其无性型柱孢属(Cylindrocarpon)真菌广泛分布在木本和草本植物的根部组织和土壤中,属于腐生真菌或弱寄生真菌[24],目前从一些植物如烟草(Nicotiana tabacum L.)中被分离获得[25]。本研究中土赤壳属真菌的分离频率为15.4%,为芍药内生真菌的优势种群,推测芍药根部组织中该属真菌可能来源于土壤,在长期协同进化过程中,侵入植物体内,形成稳定的共生关系。本研究首次揭示了芍药根部内生真菌的种群构成,对于丰富植物内生微生物菌种库具有重要的理论意义,同时也能够为活性次生代谢产物的来源提供更多的资源。
药用植物内生真菌由于其特殊的生存环境,能够产生更为丰富多样的次生代谢产物,基于PKS和NRPS功能基因的分析方法有助于研究者从基因层面上预测化合物结构类型,快速甄别和筛选出能够产生聚酮化合物和非核糖体多肽类化合物的菌株,从而提高菌种的筛选效率。目前研究人员根据真菌Ⅰ型PKS中催化合成聚酮链的还原程度,将真菌Ⅰ型PKS分为非还原型(Non-reduced,NR)、部分还原型(Partially reduced, PR)和高度还原型(Highly reduced,HR) 3类,采用不同的扩增引物能够获得不同的PKS类型[26]。本研究主要采用KAF1和KAR1进行芍药内生真菌中PKS序列的扩增,引物KAF1和KAR1主要用于还原型PKS的扩增,因此本研究扩增获得的PKS均为还原型,还原型PKS根据其核心结构域的不同,又分为4个亚型[27]。52株芍药内生真菌中有13株内生真菌扩增获得了PKS的KC结构域序列,且主要归于2个亚型,11株内生真菌的PKS序列归于Reducing PKS subclade Ⅱ型,主要包含洛伐他汀九酮合成酶(LovB)和桔霉素合成酶(Citrinin),洛伐他汀九酮合成酶参与降胆固醇类药物洛伐他汀聚酮化合物的合成,在医学中应用广泛[28]。菌株Sy30和Sy47的KC结构域序列与洛伐他汀九酮合成酶序列具有一定的同源性,聚为一类,推测这2个菌株具有合成洛伐他汀类聚酮化合物的潜力。菌株Sy9与Rhynchosporiuma属真菌的PKS序列具有一定的同源性,Rhynchosporiuma属真菌基因组包含18个PKS序列,大多数PKS属于Reducing PKS subcladeⅡ型,其PKS 13序列与曲霉属真菌Lov B序列具有63.5%的相似性,表明2个酶能够催化相同的反应[29],这也间接证明Sy9具有合成活性次生代谢产物的能力。菌株Sy21为镰孢属真菌,其PKS序列与镰孢属真菌PKS序列具有较高的同源性,镰孢属真菌PKS序列主要涉及多种聚合酮类化合物的合成,如伏马菌素(Fumonisin)和镰刀菌素(Fusarin)等多种毒素的合成[30]。菌株Sy44与Byssochlamys真菌PKS序列具有一定的同源性,Byssochlamys真菌主要产生展青霉素(Patulin)聚酮类化合物[31]。菌株Sy1的PKS序列与黄曲霉属真菌洛伐他汀二酮体合成酶(LovF)具有一定的序列同源性,表明2个酶具有合成相同物质的能力。土赤壳属真菌Sy10、Sy19、Sy23、Sy26、Sy33、Sy34其PKS序列主要与真菌KC结构域蛋白序列同源性较高,虽然此段序列主要与真菌的生物代谢过程有关,但并未具体表明合成何种聚酮类化合物,推测一些真菌菌株虽然具有PKS序列,但并不一定参与聚酮类化合物的合成。该研究表明,芍药内生真菌PKS序列丰富多样,能够参与聚酮类次生代谢产物的合成,值得进一步探讨其次生代谢产物的多样性和新颖性;同时本研究仅选用了一对引物进行芍药内生真菌PKS序列多样性的调查,仅获得了还原型PKS类型,其是否存在非还原型和部分还原型PKS类型,需做进一步的研究。
非核糖体肽合成酶(NRPS)主要催化合成非核糖体肽类化合物(NRPs),NRPs具有广泛的生物活性,如细菌产生的多肽类抗生素杆菌肽(Bacitracin)、万古霉素(Vancomycin)、短杆菌肽S (Gramicidin S)和Daptomycin等,同时有些病原真菌能够产生一些毒素侵染寄主,从而建立寄生关系,除此之外,一些多肽类物质也可作为铁载体(Siderophores),帮助微生物从寄主或者环境中获取充足的铁离子[32]。本研究中获得了8株含NRPS序列的内生真菌,其中6个菌株与真菌的NRPS序列具有一定的同源性,表明芍药内生真菌具有合成非核糖体多肽类化合物的潜力。菌株Sy14的NRPS序列与曲霉属真菌NRPS Pes1序列具有较高的同源性,菌株Sy11的NRPS序列与Neonectria真菌的NRPS 1序列具有一定的同源性,Pes1序列和NRPS 1基因均参与铁载体的生物合成。目前研究表明铁载体能够螯合环境中多余的铁离子,该类化合物在生物医药、环境修复和健康食品等领域具有广泛的应用前景[33]。目前,研究热点主要集中于能够分泌铁载体的植物内生细菌的筛选,且发现这类细菌在植物促生[34]和环境修复[35]方面能够发挥重要的作用,关于植物内生真菌铁载体产生菌的研究相对较少。从本研究可以推测,黄曲霉属芍药内生菌Sy14和Sy11均具有合成铁载体的潜力,其次生代谢产物具有极其重要的开发意义。菌株Sy39的NRPS序列与真菌HC-toxin的产生具有一定的同源性,研究表明植物病原菌能够产生丰富的毒素物质,如苹果斑点落叶病菌(Alternaria alternata)产生的AM-毒素[36]和玉米圆斑病菌(Cochliobolus carbonum)[37]产生的HC-毒素是病原菌致病性的决定因素。植物内生真菌产生的毒素类物质是否在真菌内生定殖过程中具有一定的作用,需做进一步的分析和研究。系统发育树分析表明菌株Sy30的NRPS序列与短杆菌肽合成酶(Gramicidin synthase subunit)具有一定的同源性,菌株Sy28和Sy38与短杆菌酪肽合成酶(Tyrocidine synthetase)具有一定的相似性,短杆菌肽合成酶和短杆菌酪肽合成酶主要催化环肽类抗生素短杆菌肽和短杆菌酪肽的合成,这2种物质具有强烈的抗菌活性,已被作为抗生素广泛使用[38]。菌株Sy23和Sy25与真菌NRPS序列并未聚到一类,主要与脂肪酸转运蛋白和酰基CoA合成酶(acyl-CoA synthetase)序列具有高度的同源性,两者均属于真菌腺苷酸结构域(Adenylate forming domain)的重要组成部分,主要参与真菌生物代谢过程[39],尽管这2个真菌中均获得了A结构域序列,但并未与已报道的真菌NRPS序列相一致,其合成次生代谢产物的种类和性质,需做进一步的研究和调查。
综上所述,可以看出芍药根部蕴藏着种类丰富的真菌资源,同时基于PKS和NRPS功能基因定向筛选的方法,发现芍药根部内生真菌具有合成丰富多样的聚酮类化合物和非核糖体多肽类化合物的潜力,能够成为生物活性物质的重要来源。此外,含有PKS和NRPS序列内生菌株活性次生代谢产物的分离鉴定将是下一步研究工作的重点,以期从这些菌株中筛选获得新颖的生物活性物质,为芍药内生真菌的进一步开发应用提供理论基础。
References
| [1] | Huang HX, Fu Q, Chen X, Chang SX, Zhang XT, Liu MJ, Zhang T. Study on antioxidant capacities of Paeonia lactiflora extracts. Acta Agriculturae Boreali-Occidentalis Sinica, 2009, 18(4): 280-283. (in Chinese) 黄海霞, 付强, 陈晓, 常圣鑫, 张晓彤, 刘美佳, 张涛. 芍药根提取液的抗氧化作用研究. 西北农业学报, 2009, 18(4): 280-283. |
| [2] | Yu DR, Gu XZ, Zhang C, Chen C, Ma YL. Comparison of different extracting processes for paeoniflorin in Paeoniae Radix Alba. Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(15): 49-51. (in Chinese) 于定荣, 顾雪竹, 张村, 陈畅, 麻印莲. 白芍中芍药苷提取工艺的对比研究. 中国实验方剂学杂志, 2013, 19(15): 49-51. |
| [3] | Staniek A, Woerdenbag HJ, Kayser O. Endophytes:exploiting biodiversity for the improvement of natural product-based drug discovery. Journal of Plant Interactions, 2008, 3(2): 75-93. DOI:10.1080/17429140801886293 |
| [4] | Deshmukh SK, Verekar SA, Bhave SV. Endophytic fungi:a reservoir of antibacterials. Frontiers in Microbiology, 2014, 5: 715. |
| [5] | Shen B. Polyketide biosynthesis beyond the type Ⅰ, Ⅱ and Ⅲ polyketide synthase paradigms. Current Opinion in Chemical Biology, 2003, 7(2): 285-295. DOI:10.1016/S1367-5931(03)00020-6 |
| [6] | Crawford JM, Korman TP, Labonte JW, Vagstad AL, Hill EA, Kamari-Bidkorpeh O, Tsai SC, Townsend CA. Structural basis for biosynthetic programming of fungal aromatic polyketide cyclization. Nature, 2009, 461(7267): 1139-1143. DOI:10.1038/nature08475 |
| [7] | Schwarzer D, Finking R, Marahiel MA. Nonribosomal peptides:from genes to products. Natural Product Reports, 2003, 20(3): 275-287. DOI:10.1039/b111145k |
| [8] | Wang H, Fewer DP, Holm L, Rouhiainen L, Sivonen K. Atlas of nonribosomal peptide and polyketide biosynthetic pathways reveals common occurrence of nonmodular enzymes. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(25): 9259-9264. DOI:10.1073/pnas.1401734111 |
| [9] | Wang XM, Wang H, Liu TX, Xin ZH. A PKS I gene-based screening approach for the discovery of a new polyketide from Penicillium citrinum Salicorn 46. Applied Microbiology and Biotechnology, 2014, 98(11): 4875-4885. DOI:10.1007/s00253-014-5572-3 |
| [10] | 魏景超. 真菌鉴定手册. 上海:上海科学技术出版社, 1979. |
| [11] | Innis MA, Gelfand DH, Sninsky JJ, White TJ. PCR protocols:a guide to methods and applications. New York:Academic Press, 1990. |
| [12] | Amnuaykanjanasin A, Punya J, Paungmoung P, Rungrod A, Tachaleat A, Pongpattanakitshote S, Cheevadhanarak S, Tanticharoen M. Diversity of type Ⅰ polyketide synthase genes in the wood-decay fungus Xylaria sp. BCC 1067. FEMS Microbiology Letters, 2005, 251(1): 125-136. DOI:10.1016/j.femsle.2005.07.038 |
| [13] | Slightom JL, Metzger BP, Luu HT, Elhammer AP. Cloning and molecular characterization of the gene encoding the Aureobasidin A biosynthesis complex in Aureobasidium pullulans BP-1938. Gene, 2009, 431(1/2): 67-79. |
| [14] | R?ttig M, Medema MH, Blin K, Weber T, Rausch C, Kohlbacher O. NRPSpredictor2-a web server for predicting NRPS adenylation domain specificity. Nucleic Acids Research, 2011, 39(S2): W362-W367. |
| [15] | Zhang HW, Zhang J, Hu S, Zhang ZJ, Zhu CJ, Ng SW, Tan RX. Ardeemins and cytochalasins from Aspergillus terreus residing in Artemisia annua. Planta Medica, 2010, 76(14): 1616-1621. DOI:10.1055/s-0030-1249781 |
| [16] | Ebrahim W, Kjer J, El Amrani M, Wray V, Lin WH, Ebel R, Lai DW, Proksch P. Pullularins E and F, two new peptides from the endophytic fungus Bionectria ochroleuca isolated from the mangrove plant Sonneratia caseolaris. Marine Drugs, 2012, 10(5): 1081-1091. |
| [17] | Wellensiek BP, Ramakrishnan R, Bashyal BP, Eason Y, Gunatilaka AAL, Ahmad N. Inhibition of HIV-1 replication by secondary metabolites from endophytic fungi of desert plants. The Open Virology Journal, 2013, 7(1): 72-80. DOI:10.2174/1874357920130624002 |
| [18] | 阿依努尔·阿不都热合曼. 新疆块根芍药(Paeonia anomala)内生菌的分离、XJU-PA-6菌株的鉴定及其红色素的研究. 新疆大学硕士学位论文, 2008. |
| [19] | Rodriguez RJ, White Jr JF, Arnold AE, Redman RS. Fungal endophytes:diversity and functional roles. New Phytologist, 2009, 182(2): 314-330. DOI:10.1111/j.1469-8137.2009.02773.x |
| [20] | Aly AH, Debbab A, Proksch P. Fungal endophytes:unique plant inhabitants with great promises. Applied Microbiology and Biotechnology, 2011, 90(6): 1829-1845. DOI:10.1007/s00253-011-3270-y |
| [21] | Parry DW, Jenkinson P, McLeod L. Fusarium ear blight (scab) in small grain cereals-a review. Plant Pathology, 1995, 44(2): 207-238. DOI:10.1111/ppa.1995.44.issue-2 |
| [22] | Zhang DW, Zhao MM, Chen J, Li C, Guo SX. Isolation, identification and anti-HIV-1 integrase activity of culturable endophytic fungi from Tibetan medicinal plant Phlomis younghusbandii Mukerjee. Acta Pharmaceutica Sinica, 2013, 48(5): 780-789. (in Chinese) 张大为, 赵明明, 陈娟, 李超, 郭顺星. 西藏药用植物螃蟹甲可培养内生真菌的分离、鉴定及抗HIV-1整合酶链转移活性研究. 药学学报, 2013, 48(5): 780-789. |
| [23] | Jia M, Jiang YP, Zhang W, Yu HS, Ming QL, Han T, Qin LP. Comparison on diversity of endophytic fungi from Ginkgo biloba in Tianmu Mountain and Jiande area. Drugs & Clinic, 2014, 29(3): 262-268. (in Chinese) 贾敏, 蒋益萍, 张伟, 于洪升, 明乾良, 韩婷, 秦路平. 浙江天目山和建德地区产银杏中内生真菌多样性的比较研究. 现代药物与临床, 2014, 29(3): 262-268. |
| [24] | Chaverri P, Salgado C, Hirooka Y, Rossman AY, Samuels GJ. Delimitation of Neonectria and Cylindrocarpon (Nectriaceae, Hypocreales, Ascomycota) and related genera with Cylindrocarpon-like anamorphs. Studies in Mycology, 2011, 68(1): 57-78. |
| [25] | Zhou KY, Wang WX, Peng Y, Yu RT, Yue Y, Lai DW, Zhou LG. Endophytic fungi from Nicotiana tabacum L. and their antibacterial activity. Natural Product Research and Development, 2015, 27(11): 1847-1852. |
| [26] | Nicholson TP, Rudd BAM, Dawson M, Lazarus CM, Simpson TJ, Cox RJ. Design and utility of oligonucleotide gene probes for fungal polyketide synthases. Chemistry & Biology, 2001, 8(2): 157-178. |
| [27] | Kroken S, Glass NL, Taylor JW, Yoder OC, Turgeon BG. Phylogenomic analysis of type Ⅰ polyketide synthase genes in pathogenic and saprobic ascomycetes. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(26): 15670-15675. DOI:10.1073/pnas.2532165100 |
| [28] | Gao L, Li HM. Advances in the studies of lovastatin biosynthesis and its related genes. Pharmaceutical Biotechnology, 2005, 12(3): 201-206. (in Chinese) 高蓝, 李浩明. 洛伐他汀生物合成及其相关基因研究进展. 药物生物技术, 2005, 12(3): 201-206. |
| [29] | Penselin D, Münsterk?tter M, Kirsten S, Felder M, Taudien S, Platzer M, Ashelford K, Paskiewicz KH, Harrison RJ, Hughes DJ, Wolf T, Shelest E, Graap J, Hoffmann J, Wenzel C, W?ltje N, King KM, Fitt BDL, Güldener U, Avrova A, Knogge W. Comparative genomics to explore phylogenetic relationship, cryptic sexual potential and host specificity of Rhynchosporium species on grasses. BMC Genomics, 2016, 17(1): 953. DOI:10.1186/s12864-016-3299-5 |
| [30] | Brown DW, Butchko RAE, Baker SE, Proctor RH. Phylogenomic and functional domain analysis of polyketide synthases in Fusarium. Fungal Biology, 2012, 116(2): 318-331. DOI:10.1016/j.funbio.2011.12.005 |
| [31] | Puel O, Tadrist S, Delaforge M, Oswald IP, Lebrihi A. The inability of Byssochlamys fulva to produce patulin is related to absence of 6-methylsalicylic acid synthase and isoepoxydon dehydrogenase genes. International Journal of Food Microbiology, 2007, 115(2): 131-139. DOI:10.1016/j.ijfoodmicro.2006.10.016 |
| [32] | Wang SY. Advances in the study of the mechanism and application of nonribosomal peptide synthetases. Acta Microbiologica Sinica, 2007, 47(4): 734-737. (in Chinese) 王世媛. 非核糖体肽合成酶(NRPSs)作用机理与应用的研究进展. 微生物学报, 2007, 47(4): 734-737. |
| [33] | Nierman WC, Pain A, Anderson MJ, Wortman JR, Kim HS, Arroyo J, Berriman M, Abe K, Archer DB, Bermejo C, Bennett J, Bowyer P, Chen D, Collins M, Coulsen R, Davies R, Dyer PS, Farman M, Fedorova N, Fedorova N, Feldblyum TV, Fischer R, Fosker N, Fraser A, García JL, García MJ, Goble A, Goldman GH, Gomi K, Griffith-Jones S, Gwilliam R, Haas B, Haas H, Harris D, Horiuchi H, Huang JQ, Humphray S, Jiménez J, Keller N, Khouri H, Kitamoto K, Kobayashi T, Konzack S, Kulkarni R, Kumagai T, Lafon A, Latgé JP, Li WX, Lord A, Lu C, Majoros WH, May GS, Miller BL, Mohamoud Y, Molina M, Monod M, Mouyna I, Mulligan S, Murphy L, O'Neil S, Paulsen I, Pe?alva MA, Pertea M, Price C, Pritchard BL, Quail MA, Rabbinowitsch E, Rawlins N, Rajandream MA, Reichard U, Renauld H, Robson GD, de Córdoba SR, Rodríguez-Pe?a JM, Ronning CM, Rutter S, Salzberg SL, Sanchez M, Sánchez-Ferrero JC, Saunders D, Seeger K, Squares R, Squares S, Takeuchi M, Tekaia F, Turner G, de Aldana CRV, Weidman J, White O, Woodward J, Yu JH, Fraser C, Galagan JE, Asai K, Machida M, Hall N, Barrell B, Denning DW. Genomic sequence of the pathogenic and allergenic filamentous fungus Aspergillus fumigatus. Nature, 2005, 438(7071): 1151-1156. DOI:10.1038/nature04332 |
| [34] | Shin DS, Park MS, Jung S, Lee MS, Lee KH, Bae KS, Kim SB. Plant growth-promoting potential of endophytic bacteria isolated from roots of coastal sand dune plants. Journal of Microbiology and Biotechnology, 2007, 17(8): 1361-1368. |
| [35] | Rajkumar M, Ae N, Freitas H. Endophytic bacteria and their potential to enhance heavy metal phytoextraction. Chemosphere, 2009, 77(2): 153-160. DOI:10.1016/j.chemosphere.2009.06.047 |
| [36] | Panaccione DG, Scott-Craig JS, Pocard JA, Walton JD. A cyclic peptide synthetase gene required for pathogenicity of the fungus Cochliobolus carbonum on maize. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(14): 6590-6594. DOI:10.1073/pnas.89.14.6590 |
| [37] | Johnson RD, Johnson L, Itoh Y, Kodama M, Otani H, Kohmoto K. Cloning and characterization of a cyclic peptide synthetase gene from Alternaria alternata apple pathotype whose product is involved in AM-toxin synthesis and pathogenicity. Molecular Plant-Microbe Interactions, 2000, 13(7): 742-753. DOI:10.1094/MPMI.2000.13.7.742 |
| [38] | Xu WY, Zhao SM, Zeng GZ, He WJ, Xu HM, Tan NH. Progress in the study of some important natural bioactive cyclopeptides. Acta Pharmaceutica Sinica, 2012, 47(3): 271-279. (in Chinese) 许文彦, 赵思蒙, 曾广智, 贺文军, 徐会敏, 谭宁华. 一些重要天然活性环肽化学和生物活性研究进展. 药学学报, 2012, 47(3): 271-279. |
| [39] | Zhang L, Ma XL, Yang GP, Zhu BH, Han JC, Yu WG, Pan KH. Isolation and characterization of a long-chain acyl-coenzyme A synthetase encoding gene from the marine microalga Nannochloropsis oculata. Journal of Applied Phycology, 2012, 24(4): 873-880. DOI:10.1007/s10811-011-9707-y |
