陈旋, 李莉蓉


昆明理工大学食品安全研究院, 云南 昆明 650500
收稿日期:2016-02-05;修回日期:2016-03-28;网络出版日期:2016-04-08
基金项目:国家自然科学基金(31460424)
*通信作者:李莉蓉, Tel/Fax:+86-871-65920216;E-mail:lilirong-lily@126.com
摘要: [目的]研究抗菌肽P7抑制大肠杆菌的非膜作用机制。[方法]P7与溴化乙锭竞争结合大肠杆菌基因组DNA的荧光光谱,分析P7与DNA的结合方式;流式细胞术分析P7与大肠杆菌基因组DNA结合对细菌细胞周期的影响;采用磁珠富集和PCR扩增相结合的方法分析P7特异结合的DNA序列;通过实时荧光定量PCR分析P7对大肠杆菌DNA复制和SOS损伤修复基因表达的影响;核酸染料的荧光分析研究P7对大肠杆菌DNA和RNA合成的影响。[结果]P7以嵌插的方式作用于大肠杆菌基因组DNA碱基对并形成肽-DNA复合物,使溴化乙锭-DNA复合体系的荧光强度减弱。P7可以显著增加大肠杆菌细胞周期中S期细胞数目,抑制大肠杆菌DNA复制。P7特异性结合rnhA使该基因表达水平显著下调2.24倍。同时,在肽的影响下参与大肠杆菌DNA复制相关的ssb、dnaG、ligB和rnhA基因的表达水平显著下调(P < 0.05),DNA损伤修复的recA和recN基因显著上调(P < 0.05)。P7可降低大肠杆菌DNA和RNA的合成。[结论]P7特异性地结合rnhA序列引起大肠杆菌DNA的损伤并抑制大肠杆菌的DNA复制。在P7的影响下,参与大肠杆菌DNA复制相关的基因的表达水平下调,DNA损伤修复基因显著上调,同时抑制大肠杆菌DNA和RNA的合成。
关键词: 抗菌肽 抑菌机制 细胞周期 DNA结合
Non-membrane mechanisms of antimicrobial peptide P7 against Escherichia coli
Chen Xuan, Li Lirong


Yunnan Institute of Food Safety, Kunming University of Science and Technology, Kunming 650500, Yunnan Province, China
Received 05 February 2016; Revised 28 March 2016; Published online 08 April 2016
*Corresponding author: Lirong Li Tel/Fax: +86-871-65920216; E-mail: lilirong-lily@126.com
Supported by the National Natural Science Foundation of China (31460424)
Abstract: [Objective]The molecular mechanism of antimicrobial peptide P7 against Escherichia coli was studied.[Methods]The binding mode between P7 and DNA was analyzed through fluorescence spectroscopy of P7 binding with E. coli genome DNA. The effects of P7 on E. coli cell cycle were determined through flow cytometry. Magnetic beads coupled with peptide were ussed to enrich peptide DNA-binding fragments, and PCR methods were used to analyze specific DNA to which P7 bound with. The influence of P7 on the gene expression levels of DNA replication and SOS damage and repair was analyzed through quantitative real-time PCR. The effects of P7 on E. coli DNA and RNA synthesis were analyzed according to the fluorescence spectra of nuclear stains.[Results]P7 intercalated into the base pairs of E. coli genomic DNA and then formed peptide-DNA complexes. As a result, the fluorescence intensity of the EB-DNA complex decreased. P7 could significantly increase the number of E. coli cells in phase S. The effect of P7 on normal E. coli cell cycle could significantly inhibit the DNA replication of E. coli. The binding of P7 with rnhA down-regulated the gene expression level by 2.24 times. The gene expression levels of ssb, dnaG, ligB, and rnhA that participated in E. coli DNA replication significantly decreased, and the gene expression levels of recA and recN in DNA damage and repair were significantly up-regulated under the effect of P7. P7 reduced E. coli DNA and RNA synthesis.[Conclusion]P7 also bound with rnhA. This binding resulted in DNA damage and inhibition of DNA replication of E. coli. P7 down-regulated the gene expression level of DNA replication, and the gene expression levels of DNA damage and repair were significantly up regulated. P7 reduced DNA and RNA synthesis of E. coli.
Key words: antimicrobial peptide antibacterial mechanisms cell cycle DNA-binding
抗菌肽属于抗生素的一个新家族,它们对一种或同时对多种细菌有抑菌活性,甚至具有抗真菌、抗病毒、抗肿瘤、免疫调节、促进伤口愈合等作用[1-2]。抗菌肽具有抗菌谱广、活性强、选择性好、安全性高等特点,因此在医药、食品、化妆品、农作物和畜禽病虫害防治等领域具有较高的开发和应用价值。
穿膜肽为一系列传递大分子载体的两亲或阳离子短肽的统称,能穿透生物膜,以共价或非共价的方式将生物活性货物转运到胞内[3]。穿膜肽有效改善[1]生物分子向细胞内的运输,包括质粒、核苷酸、蛋白、肽和脂质体等,其高效低毒的转运效果对细胞膜损伤小[4]。穿膜肽和抗菌肽在结构特征(多为短的阳离子两亲性肽)和非能量依赖的膜作用机制(如环孔模型、桶板模型、毯式模型)上存在相似之处[5-6]。基于抗菌肽和穿膜肽的共性,本实验室设计获得1个穿膜肽衍生的抗菌肽P7 (GLRRALLRLLRSLRRLLLRA),其抗菌活性强于母肽(最低抑菌浓度范围为4-32 μmol/L),细胞毒性低(4-32 μmol/L浓度范围内无溶血活性)[7]。
目前,对抗菌肽作用机制的研究主要集中在以细胞膜为靶目标的抑菌机制上,抗菌肽非膜作用的胞内机制研究也取得一定进展。非膜作用的胞内活性抗菌肽进入细胞内后主要通过絮凝胞内物质、与核酸结合(如Buforin Ⅱ[8]、Tachyplesin[9]等)、抑制蛋白或酶的活性(Pyrrhocoricin[10]、Histatin 5[11]等)、抑制核酸或/和蛋白的合成(如Indolicidin[12]、Lctoferricin B[13]等)最终达到抑菌或杀菌的目的。抗菌肽F1可破坏金黄色葡萄球菌的细胞膜,同时结合胞内DNA[14]。细菌素LAX可破坏大肠杆菌和金黄色葡萄球菌的细胞壁和细胞膜,抑制DNA代谢发挥抑菌作用[15]。对P7抑制大肠杆菌的研究发现,P7增加大肠杆菌膜的通透性,破坏细胞膜的完整性,同时穿过大肠杆菌细胞膜,在胞内聚集并与基因组DNA结合发挥抑菌活性。但是对P7与胞内DNA的结合模式、序列的特异识别、结合之后对相关基因表达的影响以及对核酸物质合成的影响等的分子机制的研究甚少。本文进一步研究P7抑制大肠杆菌的分子机制,为抗菌肽抑菌分子机制的研究提供理论基础。
1 材料和方法 1.1 材料
1.1.1 菌株 大肠杆菌(Escherich coli ATCC 25922)由无锡市疾病预防控制中心提供。抗菌肽由上海波泰生物科技有限公司采用固相法合成,纯度 > 98%。
1.1.2 主要试剂及仪器 溴化乙锭(EB)购自美国Amresco公司;碘化丙锭(PI)和4’, 6-二脒基-2-苯基吲哚(4’, 6-diamidino-2-phenylindole,DAPI)购自美国Sigma公司;大肠杆菌基因组DNA提取试剂盒、RNA提取试剂盒及随机引物购自生工生物工程(上海)有限公司;M-MLV逆转录酶购自美国Promega公司;SYBR Green Master Mix购自韩国Bioneer公司;其它试剂均为国产分析纯。F-7000荧光分光光度计,日本Hitachi公司;FACS Calibur流式细胞仪,美国Becton Dickinson公司;KS-900超声波细胞粉碎机,宁波科生仪器厂;PTC-200基因扩增仪,美国MJ公司;7900高通量快速实时荧光定量PCR仪,美国应用生物系统公司;SpectraMax M5荧光分光光度计,美国Molecular Devices公司。 1.2 大肠杆菌基因组DNA的提取 参照细菌基因组DNA提取试剂盒方法操作。
1.3 肽与EB竞争性结合DNA的荧光光谱分析 参照Li等[16]方法分析肽与EB竞争性结合DNA的荧光光谱。用蒸馏水将大肠杆菌基因组DNA稀释为50 μg/mL的溶液,每1 mL DNA溶液加入15 μL 100 μg/mL的EB溶液。反应液混匀后于37 °C避光孵育10 min。加入1 mL不同浓度的P7溶液(16、32、64、128 μmol/L),对照组用等体积的蒸馏水替代。反应液混匀后置于生化培养箱中37 °C避光孵育30 min。用荧光分光光度计扫描反应液在550 nm到750 nm波长范围的荧光强度(λ excitation=535 nm,λ emission=550 nm)。
1.4 肽对大肠杆菌细胞周期的影响 用流式细胞术分析肽对细菌细胞周期的影响,根据Steen和Boye的方法稍做修饰[17]。取对数期菌细胞置于1.5 mL离心管内,2000 r/min离心5 min收集细胞。用PBS清洗3遍后用新鲜LB培养基重悬为1.0×108 CFU/mL的菌悬液。加入肽溶液使其终浓度为1倍最低抑菌浓度值,混匀后于37 °C、150 r/min振荡培养0.5 h。4 °C、2000 r/min离心5 min收集细菌细胞,弃上清,用PBS清洗2遍。向沉淀的菌细胞加入1 mL预冷(-20 °C)的70%乙醇,置于4 °C冰箱固定过夜。用PBS清净固定液后在细菌细胞沉淀中加入500 μL含1 mg/mL RNase的PI染色液,混匀后置于4 °C避光孵育15 min。用流式细胞仪收集数据并用ModFit LT 3.0软件进行分析。
1.5 肽特异结合大肠杆菌复制相关的DNA序列分析 取400 μL大肠杆菌基因组DNA溶液加入2 mL离心管内,置于超声波细胞粉碎机,冰水浴下超声1 min,功率20 %,将基因组DNA断裂为小于100-1500 bp的片段,置于4 °C冰箱备用。称取6.5 g 1, 6-已二胺、2 g无水醋酸钠和1 g FeCl3,置于圆底烧瓶中,加入30 mL的乙二醇。将烧瓶置于50 °C中剧烈搅拌1 h至溶液呈橙色。将混合液转移到不锈钢高压反应釜中,密封后置于198 °C反应6 h。冷却至室温后将黑色反应产物用无水乙醇和超纯水反复清洗数次至上层溶液无色。将黑色反应产物烘干即得到氨基化磁珠。取1.5 mg氨基磁珠加入1.5 mL 5%的戊二醛溶液,于37 °C、200 r/min振荡2 h。磁分离后弃去戊二醛溶液,用PBS重悬后置于4 °C冰箱备用。向戊二醛活化的氨基磁珠中加入300 μL的肽溶液,于37 °C、150 r/min振荡1 h。磁分离,吸弃上清。用PBS清洗磁珠数遍,洗去未结合的肽。向偶联肽的磁珠加入1.5 mL 1%牛血清白蛋白溶液,37 °C、100 r/min振荡2 h,以封闭游离的醛基。磁分离后弃上清,用PBS清洗数遍并重悬,避光置于4 °C冰箱备用。将偶联肽的磁珠置于磁场,磁分离弃去PBS缓冲液后加入450 μL的大肠杆菌DNA片段溶液,混匀后将离心管于37 °C、100 r/min振荡孵育0.5 h。磁分离后吸去上清,用PBS缓冲液洗数遍后加入450 μL的TE缓冲液提取磁珠偶联肽结合的DNA。
根据He等[18]的修饰方法,采用磁珠交联肽对肽结合的DNA序列进行富集。以大肠杆菌DNA复制信号通路关键控制元件ssb (单链DNA结合蛋白)、dnaG (DNA引物酶)、dnaB (DNA解旋酶)、ligB (DNA连接酶)、dpoⅠ (DNA聚合酶Ⅰ)、rnaseH (核糖核酸酶H)、dpoⅢ β (DNA聚合酶Ⅲβ亚基)和dnaA (复制起始子)基因为特异性扩增目标,选取编码区序列为模板,用Primer 5软件设计引物(表 1),委托上海捷瑞生物工程有限公司合成。对假设的特异性序列进行PCR扩增,以分析肽特异结合大肠杆菌DNA复制相关的序列。PCR扩增结束后通过跑2%的琼脂糖凝胶电泳观察扩增结果,用凝胶成像系统记录。对于有特异性扩增条带的扩增体系用PCR纯化柱进行纯化,委托上海铂尚生物技术有限公司进行双向测序。
表 1. 本研究中使用的引物 Table 1. Primers used in this study
| Primers | Sequences (5′→3′) |
| ssb-F | ATGGCCAGCAGAGGCGTAAA |
| ssb-R | ACCACCCAGCATCTGCATGG |
| dnaG-F | ATACCCCCAAATACCTGAACTCG |
| dnaG-R | CTTCTTTTCGTACCAGCGTGTCA |
| dnaB-F | ATCTATATCGATGACTCCTCCGG |
| dnaB-R | TTATTCGTCGTCGTACTGCGG |
| ligB-F | TACGCAGTGGCAACGCTGCT |
| ligB-R | CTGCGTTAGAGTAAAACCTGCGG |
| dpoI-F | AACCATTCTCTTTGAAAAACAGGGC |
| dpoI-R | CTCATGCCATAAATCAGACCAAAGT |
| rnaseH-F | GTATGTCCGCCAGGGTATCAC |
| rnaseH-R | CCAGTTCATCACAGCGTTCGTT |
| dpoⅢ β-F | GTGCCACCATTTCCATCTC |
| dpoⅢ β-R | TCCTACGCTACCGATTCTC |
| dnaA-F | AGCAGTCCATTGATATTATTAAGG |
| dnaA-R | GATGAGTTACCAGCCACAG |
表选项
1.6 肽对DNA复制相关基因表达的影响 收集取对数期大肠杆菌细胞,用PBS清洗3遍后重悬为1.0×108 CFU/mL的菌悬液。加入肽溶液使其终浓度为最低抑菌浓度值,混匀后于37 °C、150 r/min振荡培养0.5 h。将菌液转入离心管内,5000 r/min离心2 min收集大肠杆菌细胞。用灭菌水洗3遍后向沉淀中加入50 μL的TE缓冲液和等体积的溶菌酶溶液,置于37 °C水浴孵育0.5 h。孵育结束后立即加入1 mL的Trizol,参照试剂盒方法提取RNA。提取的RNA,在随机引物和逆转录酶的作用下分两步逆转录成cDNA。根据Greenstar qPCR Master Mix试剂盒方法对大肠杆菌16S rRNA、DNA复制和SOS损伤修复基因进行实时荧光定量PCR分析。PCR扩增程序设置为:95 °C 5 min;95 °C 20 s,62 °C 30 s,72 °C 30 s,45个循环;95 °C 15 s,60 °C 15 s,95 °C 15 s。用??Ct法对基因进行定量,选取的基因的相对表达水平通过与管家基因16S rRNA的比例来计算。
1.7 肽对大肠杆菌DNA和RNA合成的影响 肽对大肠杆菌DNA和RNA合成的影响根据王海涛等方法稍做修饰[19]。收集取对数期大肠杆菌细胞,用PBS清洗2遍后重悬为1.0×106 CFU/mL的菌悬液。加入肽溶液使其终浓度为最低抑菌浓度,混匀后于37 °C、150 r/min振荡培养0.5 h。加入DAPI染色液(终浓度15 μg/mL),避光振荡10 min后用荧光分光光度计记录细菌DNA荧光强度(λ excitation=364 nm, λ emission=460 nm)和RNA荧光强度(λ excitation=400 nm, λ emission=460 nm)。
2 结果和分析 2.1 P7与EB竞争性结合DNA的荧光光谱 溴化乙锭EB是一种可以和DNA结合的荧光染料。它单独存在时荧光很弱,当与DNA静电结合时荧光不变,当它以嵌插作用与DNA结合嵌插入碱基对中时,荧光强度会提高20到30倍。若EB-DNA复合物体系中,EB的竞争物将结合在DNA上的EB竞争下来时,体系的荧光强度会降低,说明竞争物与EB一样以嵌插作用模式与DNA结合。故可根据EB-DNA复合物与竞争物作用的荧光光谱变化来判定竞争物是否也同EB一样通过嵌插方式与DNA结合。
结果如图 1所示,DNA-EB复合体系的荧光强度随着P7浓度的增加而降低,说明P7结合大肠杆菌基因组DNA并将嵌插于DNA碱基对的EB竞争下来,替代EB以嵌插的方式与DNA结合,游离的EB脱离DNA使体系的荧光强度减弱。
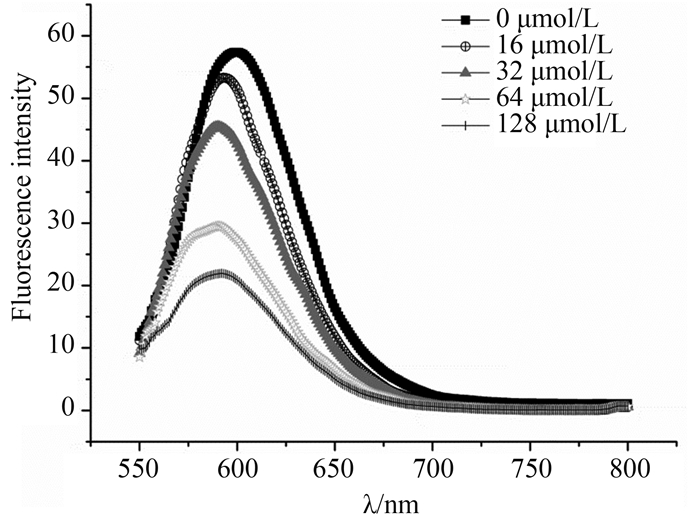 |
| 图 1. P7对DNA-EB复合物荧光强度的影响 Figure 1. Influence of P7 on the fluorescence intensity of DNA-EB complex. |
| 图选项 |
2.2 P7对大肠杆菌细胞周期的影响 在原核细胞中,细菌的细胞周期分为I、R和D 3个时期。从细胞分裂到的DNA开始复制的准备时期为I期,相当于真核细胞的G1期;而DNA复制的R期相当于真核生物的S期;R期一旦完成便直接进入细胞分裂的D期而没有DNA合成的后期G2期[20]。图 2显示正常大肠杆菌处于S期的细胞数为15.86%。P7作用后,进入S期的细胞数增加至22.61%。
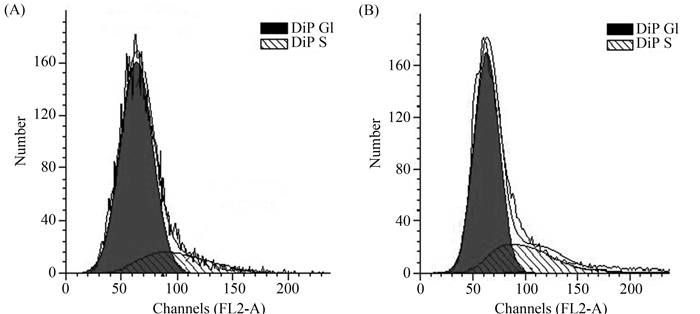 |
| 图 2. 肽对大肠杆菌细胞周期的影响 Figure 2. Effects of peptides on the cell cycle of E. coli cells. Cells were incubated with phosphate buffered saline (A) or P7 (B). |
| 图选项 |
2.3 P7特异性结合大肠杆菌复制相关DNA序列 将磁珠交联肽对肽结合的DNA序列进行富集, 以假设与P7结合的DNA序列引物对富集的DNA片段进行扩增,扩增结果如图 3所示。P7特异性结合rnhA (长度193 bp)序列。尽管还有许多非特异性结合序列未知,但本研究结果证实,P7特异结合大肠杆菌DNA复制的关键基因序列,抑制大肠杆菌的DNA复制。
 |
| 图 3. P7特异性结合的DNA序列 Figure 3. Specific DNA sequences that P7 bound. M: DNA ladder; lane 1: rnhA. |
| 图选项 |
2.4 P7对大肠杆菌DNA复制和DNA损伤修复相关基因表达的影响 基因是DNA分子中的功能片段,肽与基因的结合必然会影响DNA正常的生理功能,基因的表达也会出现变化。图 4-A显示在P7的作用下,选取的8个DNA复制相关基因中的ssb、dnaG、ligB和rnhA基因表达水平与对照组相比,出现不同程度的显著下调(P < 0.05),即P7影响大肠杆菌DNA复制相关的多个基因的表达。P7使rnhA的基因表达水平下调2.24倍。图 4B显示P7可以显著上调DNA损伤修复相关的recA和recN基因表达水平(P < 0.05)。P7对DNA复制和损伤修复基因表达影响的分析表明,P7与大肠杆菌DNA的作用,导致大肠杆菌DNA的损伤,DNA复制受到抑制。
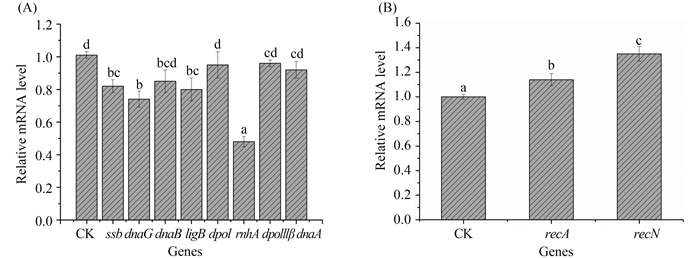 |
| 图 4. P7引起的大肠杆菌复制相关基因表达水平的变化 Figure 4. Change in expression level of replicated relative genes (A) and DNA damage repair relative genes (B) induced by P7. CK: control (sample without peptide treatment). Different lower case letters superscripts indicate significant difference (P < 0.05). |
| 图选项 |
2.5 P7对大肠杆菌DNA和RNA合成的影响 由图 5-A可知,P7与大肠杆菌作用不同时间后DNA含量均少于对照组,当P7与大肠杆菌作用3.5 h,荧光强度比对照组减少9.43%,说明大肠杆菌DNA的合成减少。图 5-B显示P7与大肠杆菌作用不同时间后RNA含量均少于对照组,P7与大肠杆菌作用3.5 h,RNA的荧光强度减少11.87%,说明大肠杆菌RNA在P7的干预下合成量减少,且P7对RNA合成的影响大于对DNA合成的影响。
 |
| 图 5. P7对大肠杆菌DNA合成的影响 Figure 5. Influence on the synthesis of DNA (A) and RNA (B) by P7. CK: control (sample without peptide treatment). All values are mean±standard deviation for triplicate experiments. |
| 图选项 |
3 讨论 外界因素导致的DNA结构变化会影响DNA信息的正常传递,细胞的基本生理功能必然受到影响。Park等[8]研究发现Buforin Ⅱ穿过大肠杆菌细胞膜后与胞内的DNA和RNA结合,从而抑制细胞功能,导致细胞快速死亡。P7与大肠杆菌基因组DNA的荧光分析显示,P7结合并插入大肠杆菌DNA双螺旋结构中,使得DNA碱基对分开并发生构象变化。进一步的流式细胞术分析P7对大肠杆菌细胞周期的影响。结果表明,P7的处理使更多的大肠杆菌细胞滞留在S期,说明P7对大肠杆菌的作用是在S期。而S期是DNA的复制期,即P7通过结合、插入大肠杆菌基因组DNA分子阻碍DNA遗传信息的正常表达。
大肠杆菌基因组DNA全长约为3000 kb,大量肽分子进入细胞内,不可能仅结合基因组DNA上的单一序列位点,所以肽分子结合的众多序列中,存在某些特异的DNA序列。肽与特异序列的结合,影响DNA遗传信息的传递功能,抑制大肠杆菌DNA的复制、细胞周期紊乱,最终死亡。Uyterhoeven等[21]运用计算机模拟和实验分析抗菌肽BuforinⅡ与DNA的相互作用,发现BuforinⅡ的抗菌活性与其结合DNA相关,BuforinⅡ与DNA的大沟结合不仅存在非特异性的静电吸引,同时肽的碱性侧链还以特异性方式与DNA强烈结合。本研究发现,P7通过特异性地结合大肠杆菌rnhA序列,影响大肠杆菌DNA的复制,从而发挥抑菌活性。
国内外对抗菌肽抑菌机制的研究主要集中在细胞结构变化和生长繁殖抑制。抗菌肽可通过抑制和影响病源微生物胞内信号传导及调控,改变细胞的生化代谢,杀伤病源菌。在细胞膜上形成孔洞破坏膜双分子层的抗菌肽Temporin L能显著上调S. aureus细胞壁调节子VraSR的转录水平[22]。破坏膜完整性的抗菌肽Cecropin A,使E. coli编码蛋白的多个基因发生显著变化,但这些基因的变化不同于E. coli在营养、热、渗透和氧化应激下基因转录水平上的响应[23]。实时荧光定量PCR分析P7对大肠杆菌DNA复制基因表达的影响显示,P7使rnhA基因表达水平显著下调2.24倍,同时参与大肠杆菌DNA复制相关的ssb、dnaG、dnaB和ligB基因表达水平显著下调(P < 0.05)。大肠杆菌在DNA受到严重损伤或者DNA复制系统受到抑制的情况下,为维持基因的完整性和提高存活率,会启动SOS修复。Subbalakshmi等研究发现,具有DNA结合活性的Indolicidin,抑制DNA、RNA和蛋白合成,阻止细胞分裂并激活DNA损伤的SOS修复信号通路[24]。P7穿入大肠杆菌细胞后与DNA作用造成DNA结构的变化和DNA复制功能的破坏,即引起DNA损伤。除了编码大肠杆菌DNA复制信号通路的多个关键控制元件的基因表达发生显著变化外,还引起大肠杆菌DNA损伤修复的recA和recN基因显著上调(P < 0.05)。非膜瓦解的细胞内活性抗菌肽Indolicidin[24]和Lactoferricin B[13],在它们干预下细菌DNA的合成量减少,即肽影响细菌DNA的合成。而我们的研究也证实以胞内DNA为靶标的抗菌肽P7降低大肠杆菌DNA和RNA的合成。
本研究通过对P7抑制大肠杆菌的分子机制的分析发现,P7穿过大肠杆菌细胞膜进入细胞内部与胞内DNA结合,嵌插入DNA双螺旋结构的疏水区域,改变DNA结构。P7与DNA序列的牢固结合使得DNA的正常生理功能受到影响,进而影响大肠杆菌正常的细胞周期。P7特异结合rnhA序列引起参与大肠杆菌DNA复制相关的基因的表达水平显著下调,DNA损伤修复基因显著上调,降低大肠杆菌DNA和RNA的合成。多重作用的结果导致大肠杆菌细胞最终死亡。
参考文献
| [1] | Jenssen H, Hamill P, Hancock REW. Peptide antimicrobial agents.Clinical Microbiology Reviews, 2006, 19(3): 491–511DOI:10.1128/CMR.00056-05. |
| [2] | Peters BM, Shirtliff ME, Jabra-Rizk MA. Antimicrobial peptides:primeval molecules or future drugs?.PLoS Pathogens, 2010, 6(10): e1001067DOI:10.1371/journal.ppat.1001067. |
| [3] | Eiríksdóttir E, Konate K, Langel ü, Divita G, Deshayes S. Secondary structure of cell-penetrating peptides controls membrane interaction and insertion.Biochimica et Biophysica Acta (BBA)-Biomembranes, 2010, 1798(6): 1119–1128DOI:10.1016/j.bbamem.2010.03.005. |
| [4] | Morris MC, Deshayes S, Heitz F, Divita G. Cell-penetrating peptides:from molecular mechanisms to therapeutics.Biology of the Cell, 2008, 100(4): 201–217DOI:10.1042/BC20070116. |
| [5] | Magzoub M, Gr?slund A. Cell-penetrating peptides:small from inception to application.Quarterly Reviews of Biophysics, 2004, 37(2): 147–195DOI:10.1017/S0033583505004014. |
| [6] | Madani F, Lindberg S, Langel ü, Futaki S, Gr?slund A. Mechanisms of cellular uptake of cell-penetrating peptides.Journal of Biophysics, 2011, 2011: 414729. |
| [7] | Li LR, Shi YH, Le GW. Antibacterial activity and mechanisms of a new peptide derived from cell-penetrating peptide.Acta Microbiologica Sinica, 2013, 53(9): 950–956(in Chinese).李莉蓉, 施用晖, 乐国伟. 来自穿膜肽的新肽的抗菌活性及抑菌机制.微生物学报, 2013, 53(9): 950–956. |
| [8] | Park CB, Kim HS, Kim SC. Mechanism of action of the antimicrobial peptide buforin Ⅱ:BuforinⅡ kills microorganisms by penetrating the cell membrane and inhibiting cellular functions.Biochemical and Biophysical Research Communications, 1998, 244(1): 253–257DOI:10.1006/bbrc.1998.8159. |
| [9] | Yonezawa A, Kuwahara J, Fujii N, Sugiura Y. Binding of tachyplesin i to DNA revealed by footprinting analysis:significant contribution of secondary structure to DNA binding and implication for biological action.Biochemistry, 1992, 31(11): 2998–3004DOI:10.1021/bi00126a022. |
| [10] | Kragol G, Lovas S, Varadi G, Condie BA, Hoffmann R, Otvos Jr L. The antibacterial peptide pyrrhocoricin inhibits the ATPase actions of Dnak and prevents chaperone-assisted protein folding.Biochemistry, 2001, 40(10): 3016–3026DOI:10.1021/bi002656a. |
| [11] | Nishikata M.Kanehira T, Oh H, Tani H, Tazaki M, Kuboki Y. Salivary histatin as an inhibitor of a protease produced by the oral bacterium Bacteroides gingivalis.Biochemical and Biophysical Research Communications, 1991, 174(2): 625–630DOI:10.1016/0006-291X(91)91463-M. |
| [12] | Friedrich CL, Rozek A, Patrzykat A, Hancock REW. Structure and mechanism of action of an indolicidin peptide derivative with improved activity against gram-positive bacteria.The Journal of Biological Chemistry, 2001, 276(26): 24015–24022DOI:10.1074/jbc.M009691200. |
| [13] | Ulvatne H, Samuelsen ?, Haukland HH, Kr?mer M, Vorland LH. Lactoferricin B inhibits bacterial macromolecular synthesis in Escherichia coli and Bacillus subtilis.FEMS Microbiology Letters, 2004, 237(2): 377–384. |
| [14] | Miao JY, Zhou JL, Liu G, Chen FL, Chen YJ, Gao XY, Dixon W, Song MY, Xiao H, Cao Y. Membrane disruption and DNA binding of Staphylococcus aureus cell induced by a novel antimicrobial peptide produced by Lactobacillus paracasei subsp.tolerans FX-6.Food Control, 2016, 59: 609–613DOI:10.1016/j.foodcont.2015.06.044. |
| [15] | Yi LH, Dang J, Zhang LH, Wu YB, Liu BF, Lü X. Purification, characterization and bactericidal mechanism of a broad spectrum bacteriocin with antimicrobial activity against multidrug-resistant strains produced by Lactobacillus coryniformis XN8.Food Control, 2016, 67: 53–62DOI:10.1016/j.foodcont.2016.02.008. |
| [16] | Li LR, Shi YH, Cheserek MJ, Su GF, Le GW. Antibacterial activity and dual mechanisms of peptide analog derived from cell-penetrating peptide against Salmonella typhimurium and Streptococcus pyogenes.Applied Microbiology and Biotechnology, 2013, 97(4): 1711–1723DOI:10.1007/s00253-012-4352-1. |
| [17] | Steen HB, Boye E. Bacterial growth studied by flow cytometry.Cytometry, 1980, 1(1): 32–36DOI:10.1002/(ISSN)1097-0320. |
| [18] | He JL, Furmanski P. Sequence specificity and transcriptional activation in the binding of lactoferrin to DNA.Nature, 1995, 373(6516): 721–724DOI:10.1038/373721a0. |
| [19] | Wang HT, Wang Q, Xie MJ. Anti-bacterial mechanism of soybean isoflavone on Staphylococcus aureus.Scientia Agricultura Sinica, 2009, 42(7): 2586–2591(in Chinese).王海涛, 王倩, 谢明杰. 大豆异黄酮对金黄色葡萄球菌的抑菌机制研究.中国农业科学, 2009, 42(7): 2586–2591. |
| [20] | Pan LZ, Na J, Xing Z, Fang HJ, Wang GL. Inhibiting effect of melittin on pathogens of crops.Chinese Science Bulletin, 2007, 52(5): 639–644DOI:10.1007/s11434-007-0117-0. |
| [21] | Uyterhoeven ET, Butler CH, Ko D, Elmore DE. Investigating the nucleic acid interactions and antimicrobial mechanism of buforin Ⅱ.FEBS Letters, 2008, 582(12): 1715–1718DOI:10.1016/j.febslet.2008.04.036. |
| [22] | Pieti?inen M, Fran?ois P, Hyyryl?inen HL, Tangomo M, Sass V, Sahl HG, Schrenzel J, Kontinen VP. Transcriptome analysis of the responses of Staphylococcus aureus to antimicrobial peptides and characterization of the roles of vraDE and vraSR in antimicrobial resistance.BMC Genomics, 2009, 10(1): 429DOI:10.1186/1471-2164-10-429. |
| [23] | Hong RW, Shchepetov M, Weiser JN, Axelsen PH. Transcriptional profile of the Escherichia coli response to the antimicrobial insect peptide cecropin A.Antimicrobial Agents and Chemotherapy, 2003, 47(1): 1–6DOI:10.1128/AAC.47.1.1-6.2003. |
| [24] | Subbalakshmi C, Sitaram N. Mechanism of antimicrobial action of indolicidin.FEMS Microbiology Letters, 1998, 160(1): 91–96DOI:10.1111/fml.1998.160.issue-1. |
