作为最基础的生命砌块,二十种天然氨基酸共同构筑了地球上缤纷多彩的生命体系。但天然氨基酸所携有的功能基团变化有限,限制了人工蛋白质设计和药物应用的发展。近年来,非天然氨基酸的引入拓展了传统分子设计的思维边界,其独特的结构赋予了蛋白质新的物理化学性质与生物功能,极大地增强了人类深入理解、精确调控甚至理性设计生命体的能力。非天然氨基酸对于药物开发也极为重要。据统计,美国食品药品监督管理局(FDA)批准上市的两百种最畅销药物中,具有非天然氨基酸单元的分子实体占比已经达到12%,充分展现该类结构单元对于生命活动调控的重要的功能。由于非天然氨基酸通常缺乏自然的合成体系,从微生物资源宝库中挖掘、理解并利用酶,进而发展非天然氨基酸的高效生物合成路径成为了这一领域的重大机遇与挑战。
在生物合成路径的设计领域,“生物逆向合成”是近年来被广泛应用的一种设计方法。该方法采用反向的逻辑思维方式:从剖析目标产物的化学结构入手,根据分子中各原子间连接方式的特征,综合考虑微生物催化元件的反应类型,选择合适的化学键进行切断,将目标分子分解为生物系统中易得且可被拼接或转化的结构单元。据此理念指导,非天然氨基酸可以被切割为羧酸与胺分子两个部分。而促成二者直接结合的氢胺化碳氮成键酶促反应,具备极高的原子经济性,被视为合成非天然氨基酸的最优途径。然而微生物体系中氢胺化酶极为稀缺,自上世纪三十年代以来,仅有寥寥数种氢胺化酶被发现。这些氢胺化酶在功能呈现出高度的专一性,极大限制了生物氢胺化反应的合成谱系,也使得酶分子进化举步维艰。这种功能高度专一的分子表型背后的决定构效机制是什么?氢胺化酶严格的选择性又是否具有调控空间?这是微生物酶学领域长久以来悬而未决的科学问题。
面对这些问题与挑战,中国科学院微生物研究所吴边团队于2021年5月在Nature Catalysis以封面文章报道了他们关于蛋白质大尺度计算重设计构筑微生物非天然氨基酸合成平台的突破性研究成果。该团队使用实验室建立的酶计算设计平台,以源自芽孢杆菌的高特异性氢胺化酶为研究对象,精确刻画出酶活性中心与底物之间形成的复杂氢键立体网络,在原子尺度阐明了该酶的反应机理与专一性机制。进而重构了完整的酶活性中心,打破了生物体系内氢胺化反应非天然底物无法兼容的瓶颈,成功创造出超广谱微生物氢胺化反应路径,为合成生物学所需的新型底层生命砌块创造了平台制备体系。
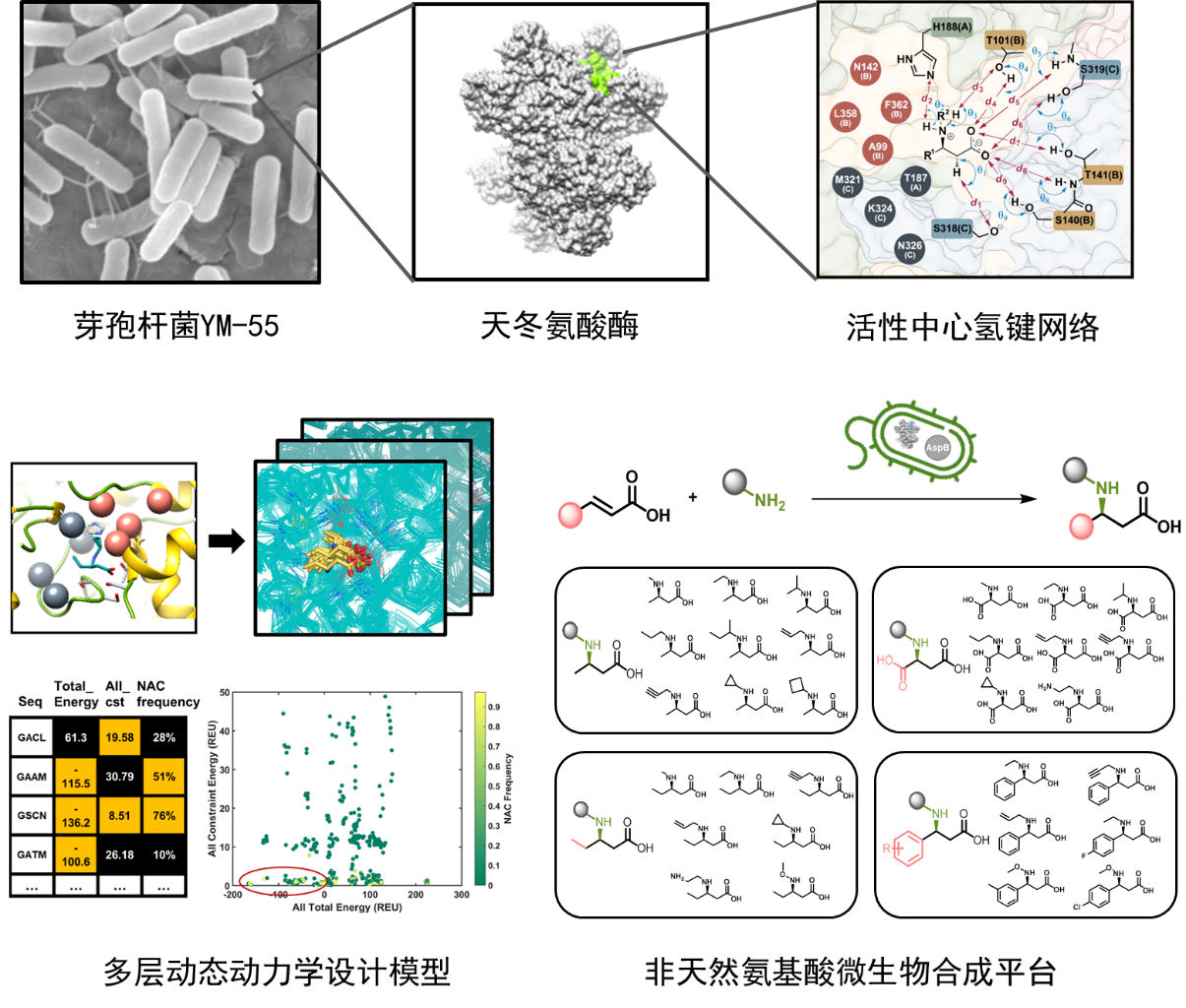
图1:微生物氢胺化酶的机制解析与计算重塑
在前期工作的基础上,吴边研究团队提出了针对氢胺化酶的设计原则。第一,需保证烯酸及胺分子的底物通道不受结构改造影响,并确保底物进入活性位点后能保持对映选择性的催化构象。其次,氢胺化酶活性位点具有纵横交错的氢键网络,对局部相互作用的调整需同时兼顾亲和性和特异性。最后,在紧凑的活性位点微环境内(活性位点平均体积仅为1072 ?3)进行大尺度改造,涉及到的突变组合路径极为庞大,还需要充分考虑多位点突变的协同效应。
在这些设计原则的引导下,该团队对天冬氨酸酶活性中心的氢键网络进行了分割处理,描绘了近似反应态几何尺度限定模型,通过蒙特卡洛随机序列空间扫描的计算方法对非催化依赖的氨基酸残基进行功能重设计。研究人员使用基于能量函数以及动力学模拟过程中近似反应态几何尺度约束频率的一致性评分结果对重设计蛋白进行虚拟筛选,进一步优化了计算设计文库。团队对通过虚拟筛选后的最终设计蛋白进行实验表达验证,成功获得了一系列能够催化交叉底物的人工非天然氨基酸合成酶。利用这些人工重构的微生物氢胺化反应元件,团队进一步构建出可用于生产的工程菌株,实现了数十种非天然氨基酸的绿色合成,底物浓度达到150 g/L,实现了99%转化率,99%区域选择性,99%立体选择性,时空产率达到131 g/L/h,相关指标达到了工业化生产的标准。
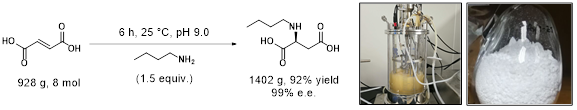
图2:微生物催化的非天然氨基酸合成
伴随着计算生物学、基因组学及人工智能的迅猛发展,蛋白质的计算解析与设计方向出现了诸多重大突破。新酶设计已突破传统理性设计方法仅对结构进行微小扰动的桎梏,逐步迈向活性位点大尺度协同突变的功能重塑,乃至全局序列空间搜索的从头设计。该项工作在微生物酶学领域率先实现了双底物耦合设计的突破性创新,展示了计算工具在解析生物复杂科学问题中所能发挥的巨大作用,以及前沿技术对于赋能传统微生物资源的重要意义。
目前安徽华恒生物科技股份有限公司依托该项技术,已经投产千吨级的非天然氨基酸微生物酶法生产线,并顺利运行至今。华恒生物作为合成生物学领域的代表企业,于2021年4月在科创板成功上市。随着算法成熟度的提高,数据驱动的微生物酶学研究将为微生物产业的发展提供更有力的支撑。
本文通讯作者吴边研究员自2018年获得国家优秀青年科学基金项目资助开始微生物碳氮成键酶的机制解析与功能重塑研究,现为微生物资源前期开发国家重点实验室副主任、国家重点研发计划项目首席科学家。中国科学院微生物研究所助理研究员崔颖璐博士、研究助理田文雅与新疆石河子大学研究生王颖慧为本文共同第一作者。该工作得到了国家优秀青年科学基金项目、国家重点研发计划合成生物学专项、中国科学院前沿科学研究计划“从0到1”原始创新项目的支持。
文章链接:https://doi.org/10.1038/s41929-021-00604-2
