2020年10月16日,中国科学院微生物研究所高福院士团队与澳门大学健康科学学院邓初夏教授团队合作,在EMBO Reports杂志发表了题为“N-glycosylation of PD-1 promotes binding of camrelizumab”的研究成果。研究发现PD-1分子N-糖基化修饰呈现多态性,不同表达系统的PD-1的蛋白稳定性评价结果表明糖修饰对PD-1分子的稳定性具有重要影响。研究者分别对camrelizumab与不同表达系统的PD-1的亲和力进行测定,发现camrelizumab与原核表达的PD-1分子的亲和力比与昆虫或哺乳动物细胞制备的PD-1亲和力低约200倍。研究者推测这种亲和力的差异很可能是由于PD-1分子在三种表达系统中的糖基化修饰不同造成的。
研究者进一步解析了camrelizumab-scFv/PD-1的复合物结构。结构分析发现camrelizumab的重链的三个CDR区均可以与PD-1结合,轻链的LCDR1和LCDR3参与PD-1的结合。Camrelizumab的轻链与PD-1的结合区对PD-L1的结合形成很强的空间位阻,可以有效的阻断PD-1与PD-L1的结合。更重要的是,结构分析显示PD-1的N58位点上的N-乙酰氨基葡萄糖和海藻糖残基直接参与camrelizumab的结合。结合实验表明, N58A突变后的PD-1以及用去糖基化酶PNGase消化后的哺乳动物细胞表达PD-1蛋白与camrelizumab的亲和力均显著降低。对PD-1/PD-L1作用的阻断效应是camrelizumab发挥T细胞活化和抗肿瘤作用的主要机制,而流式细胞分析发现,PD-1的N58位点突变后,camrelizumab阻断 PD-1与PD-L1结合效率显著下降。
本研究阐明了治疗性抗体camrelizumab与PD-1相互作用的分子机制,深入分析了PD-1的N58位点的糖基化修饰对抗体结合及其阻断活性的影响,为深入理解抗体药物的作用机制及指导药物开发提供了重要参考。
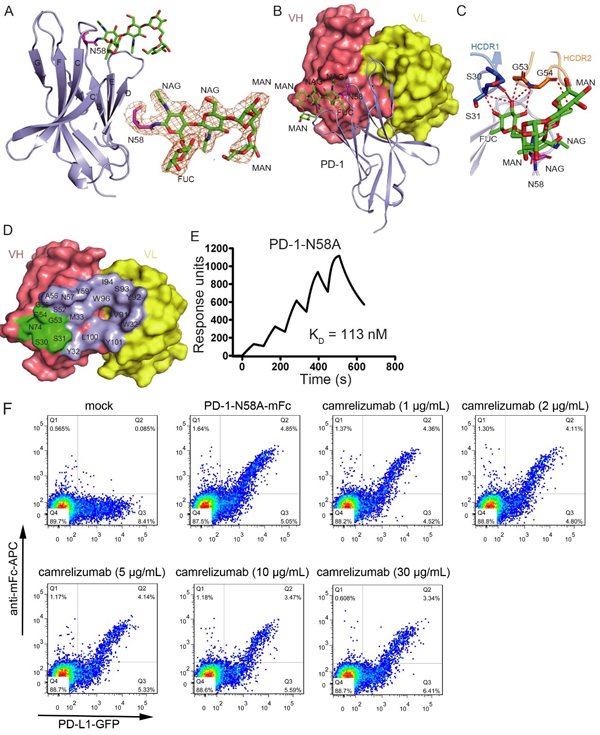
图1. PD-1的N58位点糖基化修饰对camrelizumab结合和阻断活性的影响
澳门大学与中国科学院大学联合培养博士生刘科芳,中科院微生物研究所副研究员谭曙光为共同第一作者。中国科学院微生物研究所高福院士、谭曙光副研究员,澳门大学健康科学学院邓初夏教授为共同通讯作者。本研究得到了西北大学王仲孚教授等的大力支持。该课题得到了国家自然基金,中国科学院先导专项和澳门大学讲席教授基金等的支持。
原文链接:https://www.embopress.org/doi/full/10.15252/embr.202051444
