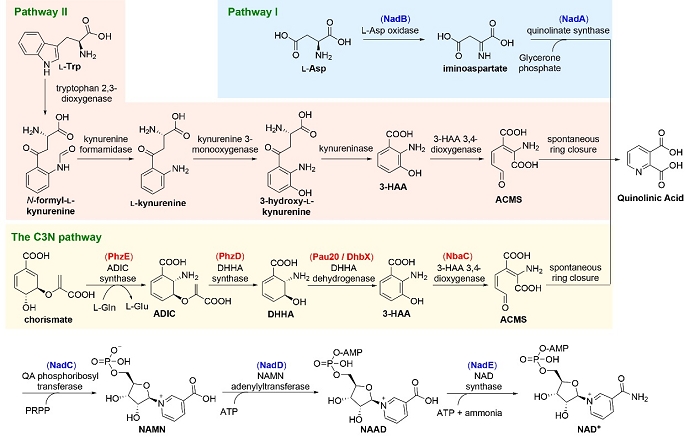
图1 NAD+的人工合成途径(C3N途径)与自然界中NAD+的从头合成途径
近日,中国科学院微生物研究所陈义华课题组在链霉菌次级代谢产物保罗霉素生物合成的启发下,设计创建了从分支酸到NAD+的人工合成途径—C3N途径。在C3N途径中,研究人员首先利用参与吩嗪类化合物(PhzE、PhzD)和保罗霉素(Pau20)生物合成的酶与芳香族化合物降解酶(NbaC)完成了从分支酸到喹啉酸的转化;进一步利用NAD+合成途径中的后三步反应,实现了NAD+分子的合成。为了验证这一途径,研究人员将C3N途径构建到NAD+从头合成缺陷的大肠杆菌中,证明了C3N途径可以独立地高效合成NAD+,保障大肠杆菌的正常生长。
人工设计的C3N途径突破了细胞固有的代谢网络调控限制,还解除了NAD+与蛋白质合成间的耦联。经过一系列优化后,在大肠杆菌中实现了极高水平的NAD(H)积累。随后,研究人员以重要的药物中间体2,5-二甲基吡嗪和手性胺的制备为例,证明了在高水平的NAD(H)底盘细胞中,NAD(H)依赖的氧化还原酶的反应效率得到了显著提升,C3N途径可以方便地应用于高值化合物的高效生产等领域。由于C3N途径的前体分支酸广泛分布于细菌、古菌、真菌和植物中,这一途径在理论上具有广泛的应用潜力。
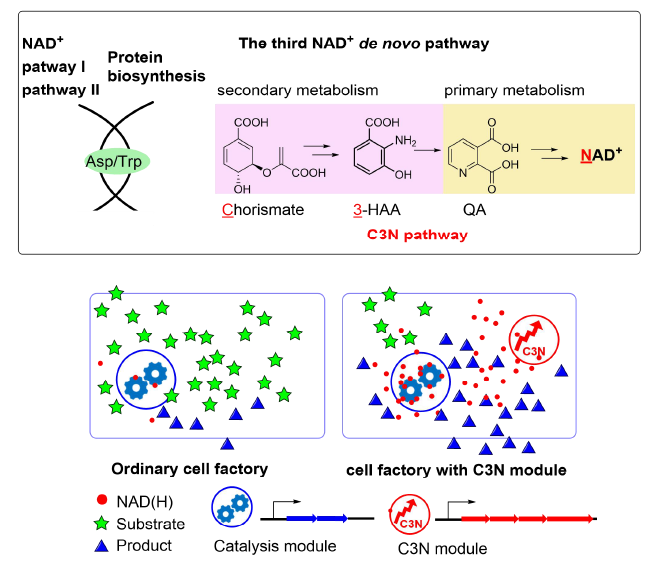
图2 基于C3N途径构建的高效NAD(H)依赖型细胞工厂示意图
人工设计的C3N途径是利用合成生物学手段探索NAD+从头合成问题的一个解答,不仅为研究NAD+这类重要分子合成的基础科学问题提供了新思路,还将有力促进涉及NAD(H)的应用研究。该研究以“Construction of an alternative NAD+ de novo biosynthesis pathway”为题,2021年3月2日在线发表于Advanced Science。中国科学院微生物研究所陈义华组博士生丁勇和李心利为论文并列第一作者,陈义华研究员为论文通讯作者。加拿大劳里埃大学Horsman教授;微生物研究所陶勇研究员、吴边研究员为该工作完成提供了重要的指导和帮助。研究工作得到了科技部重点研发计划、国家自然科学基金委****基金和面上项目的资助。
文章链接:https://doi.org/10.1002/advs.202004632
