 , 谢春生2, 谢莹莹3, 蔡海明1, 党志1, 黄伟林4, 易筱筠1, 卢桂宁1
, 谢春生2, 谢莹莹3, 蔡海明1, 党志1, 黄伟林4, 易筱筠1, 卢桂宁1

1. 华南理工大学环境与能源学院, 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
2. 肇庆学院, 环境与化学工程学院, 肇庆 526061;
3. 韩山师范学院化学与环境工程学院, 潮州 521041;
4. 罗格斯大学环境科学系, 新泽西 08901-8551
收稿日期: 2021-03-18; 修回日期: 2021-05-14; 录用日期: 2021-05-14
基金项目: 国家自然科学基金(No.41720104004,41931288);广东特支计划本土创新创业团队项目(No.2019BT02L218);广东省重点领域研发计划项目(No.2019B110207001)
作者简介: 温子宁(1996—), 男, E-mail: 978498544@qq.com
通讯作者(责任作者): 卢桂宁, E-mail: lutao@scut.edu.cn
摘要:施氏矿物是天然的砷吸附剂, 但其存在酸性条件下对As(Ⅲ)吸附性能较弱且无法对As(Ⅲ)氧化降毒的缺陷. 采用液相沉淀法成功制备出锰氧化物负载施氏矿物(MnOx@Sch), 研究锰负载量、初始pH值和共存离子对MnOx@Sch去除As(Ⅲ)的影响, 并采用吸附动力学结合XPS、FTIR及TEM等表征探究该过程的机理. 结果表明: 在初始pH=3、投加量为0.5 g·L-1、As(Ⅲ)初始浓度为1 mg·L-1的条件下, As(Ⅲ)与MnOx@Sch反应后的剩余浓度仅为2.42~3.38 μg·L-1.MnOx@Sch去除As(Ⅲ)受初始pH影响较小, H2PO4-共存时As(Ⅲ)去除存在明显的抑制作用. MnOx@Sch去除As(Ⅲ)的过程符合准二级动力学方程和颗粒内扩散方程. 液相化学组分和固相产物表征分析显示MnOx@Sch对As(Ⅲ)的去除机理可概括为As(Ⅲ)氧化、静电吸附和络合配位及配体交换. 研究结果可为施氏矿物及其改性材料应用于酸性矿山废水砷污染治理提供理论依据.
关键词:As(Ⅲ)施氏矿物锰氧化物去除机制酸性矿山废水
Removal performance and mechanism of As(Ⅲ) by manganese oxide coated schwertmannite from acid mine drainage
WEN Zining1
 , XIE Chunsheng2, XIE Yingying3, CAI Haiming1, DANG Zhi1, HUANG Weilin4, YI Xiaoyun1, LU Guining1
, XIE Chunsheng2, XIE Yingying3, CAI Haiming1, DANG Zhi1, HUANG Weilin4, YI Xiaoyun1, LU Guining1

1. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industrial Clusters, Ministry of Education, School of Environment and Energy, South China University of Technology, Guangzhou 510006;
2. School of Environmental and Chemical Engineering, Zhaoqing University, Zhaoqing 526061;
3. School of Chemistry and Environmental Engineering, Hanshan Normal University, Chaozhou 521041;
4. Department of Environmental Sciences, Rutgers University, New Jersey 08901-8551
Received 18 March 2021; received in revised from 14 May 2021; accepted 14 May 2021
Abstract: Schwertmannite is a natural adsorbent of As, but it application for As(Ⅲ) removal from acidic condition was restricted since the weak adsorption capacity and lack of oxidation ability. In this study, manganese oxide coated schwertmannite (MnOx@Sch) was successfully synthesized by using liquid-phase precipitation method and the effects of manganese concentration, initial pH and co-exist ion on As(Ⅲ) removal were studied. The adsorption kinetics combined with XPS, FTIR and TEM were used to investigate the mechanism of As(Ⅲ) removal by MnOx@Sch. The results show that when the initial pH was 3, the dosage was 0.5 g·L-1 and original As(Ⅲ) concentration was 1 mg·L-1, the residual As concentration was only 2.42~3.38 μg·L-1 after reaction. The effect of initial pH on the removal of As(Ⅲ) by MnOx@Sch was slight and was significantly inhibited in the presence of H2PO4-. The process of As(Ⅲ) removal by MnOx@Sch well fits the pseudo-second order kinetic and intraparticle diffusion model. Results of the chemical components analysis in liquid and solid phase reveal that the removal mechanism of As(Ⅲ) by MnOx@Sch includes As(Ⅲ) oxidation, electrostatic adsorption, complexation and ligand-exchange. The results could provide theoretical basis for the application of schertmananite in the treatment of arsenic pollution in acid mine drainage.
Keywords: As(Ⅲ)schwertmananitemanganese oxideremoval mechanismacid mine drainage
1 引言(Introduction)酸性矿山废水具有高酸度, 高铁高硫酸根含量的特点, 且常伴随大量Cu、Pb、As、Cr等重(类)金属, 对矿区周边生态环境和人体健康造成极大的威胁(Wang et al., 2019). As是首类致癌物质, 长期接触或摄入砷可导致呼吸系统, 消化系统, 心血管系统和神经系统的不可逆损伤, 最终引发各类癌症(Luo et al., 2012; Singh et al., 2015). 酸性矿山废水中含有As(Ⅲ)和As(Ⅴ)(Luo et al., 2020), 其中As(Ⅲ)毒性是As(Ⅴ)的25~60倍且以中性形式H3AsO3存在(pKa1=9.2)(Cheng et al., 2009, 唐苑君等, 2020), 难以吸附于土壤颗粒和沉积物表面, 因而具有更强的迁移性. 而As(Ⅴ)通常以阴离子的形式存在(pKa1=2.3, pKa2=6.8)(Burton et al., 2009), 易于通过吸附和沉淀的方式去除. 目前酸性矿山废水重金属的治理方式以石灰调酸沉淀法为主(周立祥, 2017; Wang et al., 2019), 并不能有效去除As(Ⅲ), 而吸附法和氧化法相结合的方式可明显提高As(Ⅲ)的去除效率.
铁锰二元氧化物/氢氧化物作为新兴的环境材料, 已广泛应用于As(Ⅲ)污染水体的治理之中. 铁锰二元氧化物/氢氧化物可将As(Ⅲ)氧化为带负电的As(Ⅴ), 并通过静电吸附或形成Fe(Ⅲ)-As(Ⅴ)络合物从而实现As(Ⅲ)的去除(Zhang et al., 2014). Zhang等(2007)通过共沉淀法制备出表面积为265 m2·g-1的非晶态铁锰二元氧化物, 对As(Ⅲ)的吸附容量达到132.75 mg·g-1;Shih等在针铁矿表面负载软锰矿, 使材料对As(Ⅲ)的吸附容量从8.03 mg·g-1提升至34.36mg·g-1(Shih et al., 2015).
施氏矿物(Fe8O8(OH)x(SO4)y; x = 8-2y, 1 < y < 1.75)是在酸性矿山废水中的沉积物中发现的弱晶型羟基铁硫酸盐矿物(Bigham et al., 1996; Regenspurg et al., 2004). 前期研究发现施氏矿物可通过静电吸附, 配体交换, 表面络合的方式富集水中的砷, 是天然的砷吸附剂(Lee et al., 2005; 李旭伟等, 2020). 然而施氏矿物对As(Ⅲ)的最佳吸附pH为6~12(王威等, 2020). Burton等研究发现施氏矿物在pH=3时对As(Ⅲ)的吸附容量仅为pH=9时的54%(Burton et al., 2009). Song等通过过氧化氢氧化硫酸亚铁制备得到的施氏矿物在酸性条件下(pH=3)As(Ⅴ)的吸附容量可达182.86 mg·g-1, 但As(Ⅲ)的吸附容量仅有45.50 mg·g-1(Song et al., 2014).
酸性环境不利于施氏矿物对As(Ⅲ)的吸附, 且施氏矿物难以氧化酸性矿山废水中的As(Ⅲ)(Paikaray et al., 2011). 迄今为止, 鲜少关于施氏矿物改性材料氧化去除As(Ⅲ)的报道. 因而本研究尝试采用MnSO4溶液与KMnO4溶液共沉淀的方式, 在施氏矿物表面负载锰氧化物以制备改性矿物吸附剂, 探究吸附影响因素, 并通过吸附动力学实验对比施氏矿物和锰氧化物负载施氏矿物对As(Ⅲ)的去除性能, 推测锰氧化物负载施氏矿物氧化吸附As(Ⅲ)的作用机理, 为施氏矿物及其改性材料有效应用于酸性矿山废水的砷污染去除提供参考.
2 材料与方法(Materials and methods)2.1 实验试剂与材料实验用七水硫酸亚铁、过氧化氢、二水磷酸二氢钠购于天津大茂化学试剂厂, 硫酸钠、一水硫酸锰、氢氧化钠、二水氯化钙、六水氯化镁购买于上海泰坦科技股份有限公司, 高锰酸钾、硝酸钠、硝酸购于广州化学试剂厂, 亚砷酸钠购于上海安谱实验科技有限公司. 以上试剂均为分析纯. 实验用水为去离子水.
2.2 实验方法2.2.1 MnOx@Sch的制备施氏矿物(Sch)的合成方法参照(李浙英, 2011; Zhang et al., 2019). 在988 mL去离子水中加入22.24 g FeSO4·7H2O, 待搅拌至固体完全溶解后, 用蠕动泵缓慢滴加12 mL的30% H2O2并持续搅拌12 h. 静置24 h后沉淀先用酸化(pH=2)去离子水洗涤3次, 再用去离子水洗涤4次以上直至上清液pH值不再改变. 所得固体冷冻干燥24 h, 研磨后过200目筛, 在干燥器中保存待用.
MnOx@Sch的合成方法参照(Chen et al., 2019). 取1 g施氏矿物于200 mL去离子水中搅拌分散, 按Mn2+/MnO4-物质的量的比为1.5的比例称取适量MnSO4·H2O和KMnO4分别溶于100 mL水中. 先将MnSO4溶液加入Sch混合液并继续搅拌4 h使Mn2+与施氏矿物充分接触, 再缓慢加入KMnO4溶液, 反应2 h. 反应所得沉淀静置12 h后用去离子水充分洗涤4次, 倾倒上清液后将沉淀离心分离, 冷冻干燥24 h, 研磨后过200目筛, 在干燥器中保存待用. 由上述方法合成得到的不同锰氧化物负载量的材料, 分别命名为MnOx@Sch-1、MnOx@Sch-2和MnOx@Sch-3.
MnO2的制备按Mn2+/MnO4-物质的量的比为1.5的比例称取适量MnSO4·H2O和KMnO4分别溶于水中. KMnO4溶液缓慢加入MnSO4溶液中反应2 h, 后续静置干燥储存方式同上.
2.3 As(Ⅲ)的吸附去除试验2.3.1 As(Ⅲ)去除影响因素试验锰负载量对As(Ⅲ)去除的影响:配制不同初始As(Ⅲ)质量浓度(1、5、10、15和20 mg·L-1)且含有0.01 mmol·L-1 NaNO3的混合溶液, 取30 mL上述溶液加入50 mL离心管中. 分别准确称量0.015 g Sch, MnOx@Sch-1、MnOx@Sch-2、MnOx@Sch-3和MnO2加入离心管中. 用HNO3和NaOH调节混合液pH至3后置于转速200 r·min-1, 温度25 ℃的摇床中振荡4 d. 反应结束后取混合液过0.22 μm滤膜, 滤液测定As的质量浓度. 每组设置3个平行处理.
初始pH对As(Ⅲ)去除的影响:向50 mL离心管加入30 mL配置的0.01 mmol·L-1 NaNO3, 5 mg·L-1 As(Ⅲ)的混合溶液, 然后分别准确称量0.015 g Sch和MnOx@Sch-2加入离心管中. 用HNO3和NaOH调节混合液pH至2、3、4、5、6、7、8后置于转速200 r·min-1, 温度25 ℃的摇床中振荡4 d. 反应结束后取混合液过0.22 μm滤膜, 滤液测定As的质量浓度. 每组设置3个平行处理.
共存离子对As(Ⅲ)去除的影响:分别配置含5 mg·L-1 As(Ⅲ)及10、100和1000 mg·L-1的Ca2+、Mg2+、Cl-、SO42-和H2PO4-的混合储备液, 加入30 mL至50mL离心管中. 准确称量0.015 g MnOx@Sch-2加入离心管中, 用HNO3和NaOH调节pH至3后置于转速200 r·min-1, 温度25 ℃的摇床中振荡4 d. 反应结束后取混合液过0.22 μm滤膜, 滤液测定As的质量浓度. 每组设置3个平行处理.
2.3.2 吸附动力学试验将配置好的200 mL 0.01 mmol·L-1 NaNO3, 15 mg·L-1 As(Ⅲ)溶液加入250 mL锥形瓶中, 依据Sch、MnOx@Sch-2和MnO2的化学组成, 将Sch、MnOx@Sch-2和MnO2的投加量设定为0.5、0.548和0.072 g·L-1, 以分别对比相同铁含量及相同锰含量的Sch、MnOx@Sch-2和MnO2与As(Ⅲ)反应后的各元素的反应行为. 用HNO3和NaOH调节混合液pH至3, 于温度25 ℃、转速200 r·min-1的条件下反应. 在设置的一系列时间点取混合液样品, 过0.22 μm滤膜后滤液置于4 ℃冰箱储存. 反应结束后下层固体经冷冻干燥后密封储存以备后续固相分析. 每组设置3个平行处理.
本研究中材料对As吸附量的计算公式见式(1).
 | (1) |
吸附动力学采用准一级动力学模型, 准二级动力学模型和颗粒内扩散模型对反应过程进行拟合. 拟合公式见式(1)~(3).
准一级动力学模型:
 | (2) |
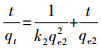 | (3) |
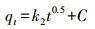 | (4) |
2.4 分析方法本研究采用原子荧光光谱仪(AFS-9130, Jitan)测定反应前后上清液总As含量, As(Ⅴ)采用砷锑钼蓝分光光度法测定(Dhar et al., 2004; Huang et al., 2015), 波长为880 nm(UV-160A, Shimadzu, Japan), 锰平均氧化度Mn(AOS)采用草酸-高锰酸钾返滴定法测定(Kijima et al., 2001). 反应释放于液相的SO42-和Mn2+分别采用离子色谱仪(Dionex ICS-90, USA)和火焰原子吸收仪(PerkinElmer 900T, USA)分析检测.
准确称取0.05 g不同锰氧化物负载量的施氏矿物溶于6 mol·L-1 HCl, 室温下消解6 h后适当稀释, 采用ICP-OES(PerkinElmer Optima 7300V, USA)测定固相中的Fe、S和Mn的元素含量. 采用扫描电子显微镜(Zeiss Merlin, Germany)分析负载锰氧化物前后材料表面形貌;采用X射线衍射仪(XRD, D8 ADVANCE, Bruker)分析材料晶相结构;采用X射线光电子能谱(XPS, Axis Ulra DLD, Krotos)对固相表面反应前后Mn和As元素的价态分布和成键状态进行探究;利用傅里叶红外光谱(FTIR, VERTEX 33, Bruker)分析矿物材料表面官能团组成和变化特征;采用透射电子显微镜(JEM-2100F, Japan)分析反应后As元素在材料中的赋存状态.
3 结果与讨论(Results and discussion)3.1 材料表征本研究合成了不同锰氧化物负载量的施氏矿物, 其化学组成如表 1所示. 图 1为扫描电子显微镜对锰氧化物负载前后的施氏矿物的表面形貌. 纯施氏矿物(图 1a)呈不规则球状, 表面有“触手”状的突起, 与文献报道中类似(Song et al., 2014), 而锰氧化物负载后的改性施氏矿物(图 1b)表面有片状结构的堆叠, 为典型锰氧化物的表面形貌(Chen et al., 2019), 同时可以从部分剖面发现核壳结构的特征, 表明锰氧化物成功负载在施氏矿物的表面.
表 1(Table 1)
| 表 1 Sch和MnOx@Sch的化学组成 Table 1 Components of Sch and MnOx@Sch | ||||||||||||||||||||||||||||||||||||
表 1 Sch和MnOx@Sch的化学组成 Table 1 Components of Sch and MnOx@Sch
| ||||||||||||||||||||||||||||||||||||
图 1(Fig. 1)
 |
| 图 1 Sch(a) 与MnOx@Sch-2(b) 的SEM图 Fig. 1SEM image of Sch(a) and MnOx@Sch-2(b) |
二氧化锰及锰氧化物负载前后的施氏矿物的XRD谱图如图 2所示. 纯施氏矿物在18.2°、26.3°、35.2°、39.5°、46.5°、55.3°、61.3°和63.7°有特征衍射峰, 与施氏矿物标准JCPDS 47-1775相匹配. 而负载锰氧化物后, 部分施氏矿物特征峰强度有轻微减弱, 在37°出现ε-MnO2的微弱特征衍射峰(JCPDS 30-0820), 表明负载后施氏矿物矿相未发生明显变化, 且锰氧化物主要以不定型态负载在施氏矿物表面. 该现象与文献报道的铁锰氧化物材料的的XRD衍射图谱的结果相近(Hou et al., 2017).
图 2(Fig. 2)
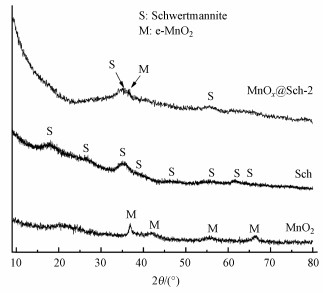 |
| 图 2 MnO2、Sch与MnOx@Sch-2的XRD图谱 Fig. 2XRD patterns of MnO2, Sch and MnOx@Sch-2 |
3.2 锰氧化物负载施氏矿物去除As(Ⅲ)的影响因素3.2.1 锰氧化物负载量对去除As(Ⅲ)的影响图 3为施氏矿物、二氧化锰和不同锰氧化物负载量的施氏矿物在投加量为0.5 g·L-1、初始pH值为3条件下, As(Ⅲ)去除率随初始浓度的变化规律. 结果表明负载锰氧化物后, 材料去除As(Ⅲ)效率对比单独采用纯施氏矿物或纯二氧化锰有着明显提升, 初始As(Ⅲ)浓度为1 mg·L-1时, MnOx@Sch-1、MnOx@Sch-2和MnOx@Sch-3组的As剩余浓度分别为3.38、2.42和2.71 μg·L-1, 低于As的世界卫生组织饮用水质量控制标准(10 μg·L-1)(Luo et al., 2012). MnOx@Sch-2在1~20 mg·L-1初始污染物浓度条件下对As(Ⅲ)的去除效率均最高, 且20 mg·L-1初始As(Ⅲ)浓度时去除率为MnOx@Sch-3的1.96倍, 表明不同锰氧化物负载量对As(Ⅲ)去除率影响较大. Ma等(2020)发现铁锰氧化物在去除As(Ⅲ)过程中, 锰铁比高时有利于As(Ⅲ)的氧化, 但可能抑制As的吸附, 该现象与本研究相近. 此外, 较高的负载量会导致更厚的锰氧化物壳层, 不利于As的颗粒内传质和与活性位点的接触. 由此后续试验以MnOx@Sch-2为代表做进一步研究.
图 3(Fig. 3)
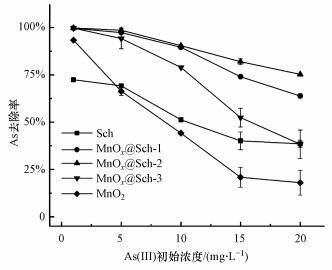 |
| 图 3 锰氧化物负载量对MnOx@Sch去除As(Ⅲ)的影响 (吸附剂投加量0.5 g·L-1, pH=3, 反应时间4 d) Fig. 3Effect of manganese oxide content on As(Ⅲ) removal by MnOx@Sch (adsorbent dosage: 0.5 g·L-1, pH=3, contact time: 4 d) |
3.2.2 初始pH对去除As(Ⅲ)的影响图 4为不同初始pH对Sch和MnOx@Sch-2的As(Ⅲ)去除效率的影响. 由图可知, MnOx@Sch-2在酸性和中性环境中对As(Ⅲ)的去除效果均优于Sch. Sch在酸性环境中对As(Ⅲ)的去除率较低, 其中初始pH=2时仅为32.64%. 而负载锰氧化物后, 矿物材料在酸性和中性环境下对As(Ⅲ)去除率均高于97%, 这是由于电中性的As(Ⅲ)接触材料表面的锰氧化物后氧化形成带负电的As(Ⅴ)(Shan et al., 2013). 由Zeta电位分析测试可知MnOx@Sch-2的等电点为5.64, 在酸性环境中材料表面带正电. 因此锰氧化物氧化As(Ⅲ)促进材料对As的静电吸附. 当pH高于MnOx@Sch-2等电点时, 材料保持良好的As去除效果, 可能由于高pH促进了反应释放的Mn2+的再吸附过程, 形成了更多的As吸附活性位点(Ren et al., 2013).
图 4(Fig. 4)
 |
| 图 4 pH对Sch和MnOx@Sch去除As(Ⅲ)的影响 (吸附剂投加量0.5 g·L-1, As(Ⅲ)浓度5 mg·L-1, 反应时间4 d) Fig. 4Effect of pH on As(Ⅲ) removal by Sch and MnOx@Sch (adsorbent dosage: 0.5 g·L-1, As(Ⅲ) concentration: 5 mg·L-1, contact time: 4 d) |
3.2.3 共存离子对去除As(Ⅲ)的影响本研究选取了5种酸性矿山废水中常见的阴阳离子作为背景, 分析共存离子对As(Ⅲ)去除效率的影响, 结果如图 5所示. Ca2+、Mg2+、Cl-对As(Ⅲ)去除无明显影响, As(Ⅲ)去除率均大于99.93%. 随着SO42-和H2PO4-浓度的提高, MnOx@Sch-2对As(Ⅲ)的去除率逐渐降低. 其中H2PO4-的抑制效应最为明显, 浓度为1000 mg·L-1时, As(Ⅲ)的去除率仅为28.3%, 其原因在于H2PO4-与H3AsO3和H2AsO4-结构相近, 均可以与固体表面的羟基官能团内圈络合, 因此吸附过程中存在竞争效应(Zhang et al., 2010).
图 5(Fig. 5)
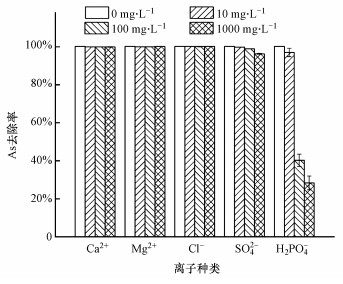 |
| 图 5 共存离子对MnOx@Sch-2去除As(Ⅲ)的影响 (吸附剂投加量0.5 g·L-1, pH: 3, As(Ⅲ)浓度5 mg·L-1, 反应时间4 d) Fig. 5Effect of co-exist ion on the As(Ⅲ) removal by MnOx@Sch-2 (adsorbent dosage: 0.5 g·L-1, pH: 3, As(Ⅲ) concentration: 5 mg·L-1, contact time: 4 d) |
3.3 锰氧化物负载施氏矿物去除As(Ⅲ)过程中液相组分的变化3.3.1 As(Ⅲ)的氧化和吸附图 6a反映液相总As浓度的变化规律. 溶液中的As在前3 h内迅速吸附于MnOx@Sch-2表面, 随着反应的进行逐渐达到平衡. 对比相同Fe含量的Sch, MnOx@Sch-2吸附As的速率更大, 到达平衡的时间更短. 在该反应条件下, 相较于Sch的As(Ⅲ)平衡吸附量(17.62 mg·g-1), MnOx@Sch-2(28.72 mg·g-1)提高了63.0%, 其原因一方面由于As(Ⅲ)氧化反应形成As(Ⅴ)后以阴离子形式存在, 从而促进材料对As的静电吸附, 另一方面锰氧化物包裹在施氏矿物表面形成了含锰官能团和吸附活性位点. 相同Mn含量的MnO2对照组中总砷去除率较低, 说明Mn在MnOx@Sch-2中并不提供主要的As吸附位点(Zhou et al., 2020).
图 6(Fig. 6)
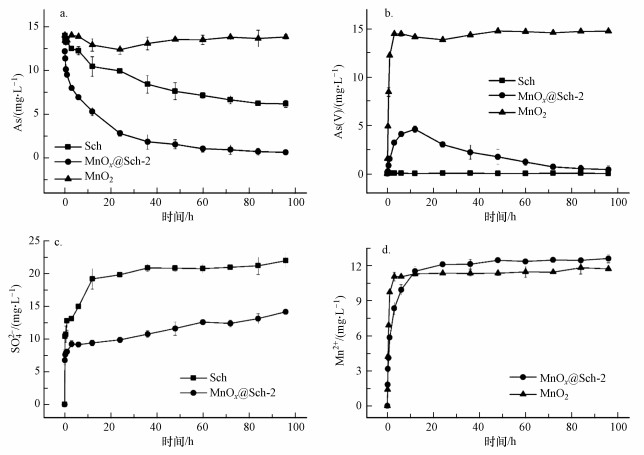 |
| 图 6 不同材料去除As(Ⅲ)过程液相组分的浓度变化 (a.总As;b. As(Ⅴ);c. SO42-;d. Mn2+)(pH: 3, As(Ⅲ)浓度15 mg·L-1) Fig. 6Changes in aqueous concentrations of total As(a), As(Ⅴ)(b), SO42- (c) and Mn2+(d) during the removal of As(Ⅲ) by Different materials (pH: 3, As(Ⅲ) concentration: 15 mg·L-1) |
图 6b反映溶液中As(Ⅴ)浓度的变化趋势. MnO2组中As(Ⅲ)在3 h内完全氧化, 体现出良好且高效的氧化性能. As(Ⅲ)与相同锰含量的MnOx@Sch-2反应后, 溶液中的As(Ⅴ)浓度上升, 在6 h时后生成的As(Ⅴ)达到峰值浓度4.60 mg·L-1, 表明氧化反应速率大于吸附速率, 在反应初期起主要作用. 随着反应进行, As(Ⅴ)成为溶液中As的主要形态. 生成的As(Ⅴ)吸附于材料表面, 平衡去除率达到95.74%.
3.3.2 SO42-和Mn2+的释放前期研究发现, 施氏矿物内部孔道结构中的SO42-可与As(Ⅲ)发生配体交换(Liao et al., 2011; 王威等, 2020). 本研究分析MnOx@Sch-2和Sch去除As(Ⅲ)过程中溶液SO42-的浓度变化(图 6c)发现Sch释放的SO42-的量是相同铁含量MnOx@Sch-2的1.55倍, 一方面说明MnOx@Sch-2的施氏矿物内核中的孔道结构内SO4与As(Ⅲ)存在配体交换作用, 另一方面锰氧化物提供了As吸附活性位点(Hou et al., 2017), 削弱了配体交换机制的作用. 对比相同Mn含量的MnO2与MnOx@Sch-2的反应过程, 发现两者与As(Ⅲ)反应后的还原产物Mn2+释放总量相近(图 6d), 与MnO2组中As(Ⅴ)的生成趋势一致. 但反应前期MnOx@Sch-2的Mn2+释放速率较慢, 可能由于MnOx@Sch-2施氏矿物内核的吸持作用. 本研究中并未出现反应后期Mn2+浓度下降的现象(Cuong et al., 2021), 可能由于低pH条件下固相表面带正电荷, 抑制了Mn2+的再吸附.
3.4 锰氧化物负载施氏矿物去除As(Ⅲ)动力学为探究锰氧化物负载施氏矿物对As(Ⅲ)的去除机理, 本研究采用动力学方程对反应过程进行拟合, 结果如表 2和表 3所示. Sch以及MnOx@Sch-2去除As(Ⅲ)动力学过程更符合准二级动力学模型, 相关系数分别为0.9264和0.8766, 表明吸附过程主要为化学吸附. 颗粒内扩散方程可以分析反应过程中的限速步骤(Ociński et al., 2016; 陈丽红等, 2019). 对Sch反应过程进行单直线拟合发现相关系数达到0.9846, 表明As(Ⅲ)在施氏矿物颗粒内扩散是吸附过程的限制因素. 而MnOx@Sch-2与多直线拟合结果相符, 可能是由于As在锰氧化物壳层与施氏矿物内核的扩散速率不同.
表 2(Table 2)
| 表 2 Sch和MnOx@Sch-2去除As(Ⅲ)的准一级动力学和准二级动力学拟合参数 Table 2 Fitting parameters of pseudo-first-order kinetic and pseudo-second-order kinetic for As(Ⅲ) removal by Sch and MnOx@Sch-2 | |||||||||||||||||||||||||||||
表 2 Sch和MnOx@Sch-2去除As(Ⅲ)的准一级动力学和准二级动力学拟合参数 Table 2 Fitting parameters of pseudo-first-order kinetic and pseudo-second-order kinetic for As(Ⅲ) removal by Sch and MnOx@Sch-2
| |||||||||||||||||||||||||||||
表 3(Table 3)
| 表 3 Sch和MnOx@Sch-2去除As(Ⅲ)的颗粒内扩散方程拟合参数 Table 3 Fitting parameters of intraparticle diffusion model for As(Ⅲ) removal by Sch and MnOx@Sch-2 | ||||||||||||||||||
表 3 Sch和MnOx@Sch-2去除As(Ⅲ)的颗粒内扩散方程拟合参数 Table 3 Fitting parameters of intraparticle diffusion model for As(Ⅲ) removal by Sch and MnOx@Sch-2
| ||||||||||||||||||
3.5 产物的表征3.5.1 XPS分析采用XPS探讨吸附As(Ⅲ)前后Sch@MnOx-2表面各元素的赋存价态. 其中反应前后固体样品的Mn 2p和反应后As 3d轨道的谱图信息经XPSPEAK41软件分峰拟合, 谱图结果如图 7所示. 反应前(图 7a)Mn 2p3/2峰位于642.6 eV, 拟合谱图由Mn(Ⅲ)、Mn(Ⅳ)以及卫星峰所组成, 分别对应于641.6、642.6、644.3 eV(Zhang-Steenwinkel et al., 2002; He et al., 2019), 其中Mn(Ⅳ)/Mn(Ⅲ)为6.44. 反应(图 7b)材料表面新增加了Mn(Ⅱ)的特征峰(640.9 eV), 表明锰氧化物负载层中Mn(Ⅳ)在反应中被As(Ⅲ)还原消耗, 向Mn(Ⅲ)和Mn(Ⅱ)转变. 反应后材料Mn 2p谱图峰强度相比反应前明显下降, 可能一方面由于反应生成的Mn2+部分脱离固相, 另一方面部分吸附于材料表面的As与Mn相互络合(Hou et al., 2017). 反应后As 3d的拟合谱图(图 7c)中位于45.6 eV的As(Ⅴ)特征峰占全峰面积的85.09%(Han et al., 2011), 说明反应后As(Ⅲ)得到充分的氧化.
图 7(Fig. 7)
 |
| 图 7 MnOx@Sch-2的XPS窄轨道谱图的 (a.反应前Mn 2p;b.反应后Mn 2p;c.反应后As 3d) Fig. 7XPS spectra of Mn 2p (a. before reaction, b. after reaction) and As 3d(c) after reaction for MnOx@Sch-2 |
3.5.2 FTIR分析Sch以及MnOx@Sch-2的FTIR谱图如图 8所示. 1631 cm-1弯曲振动峰代表矿物表面的结合水羟基官能团(Xie et al., 2017; Zhang et al., 2018). 位于1120 cm-1的ν3(SO4)伸缩振动宽峰和609 cm-1的ν4(SO4)三重简并弯曲振动峰体现施氏矿物隧道结构内硫酸根的分子内振动. 981cm-1的ν1(SO4)吸收峰对应矿物外圈络合的硫酸根, 702 cm-1代表Fe—O伸缩振动吸收峰, 这与过往研究相吻合(李君菲等, 2018). 负载锰氧化物后新生成了位于513、468 cm-1的锰氧化物Mn—O伸缩振动峰(Luo et al., 2017; Ma et al., 2020). 谱图表明锰氧化物负载后矿物材料既保留了施氏矿物结构中丰富的羟基以及独特的隧道空隙结构作为吸附去除As(Ⅲ)的官能团, 还在材料表面增加了Mn—O官能团作为氧化和吸附As的活性位点.
图 8(Fig. 8)
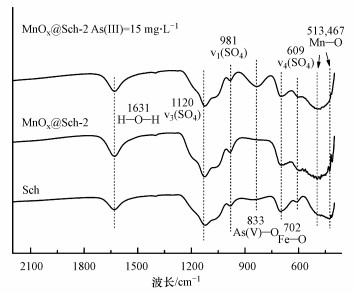 |
| 图 8 MnOx@Sch-2反应前后FTIR谱图 Fig. 8FTIR spectra of MnOx@Sch-2 before and after reaction |
反应后谱图中出现位于833 cm-1的As(Ⅴ)—O吸收峰, 同时Fe—O、Mn—O伸缩振动吸收峰强度减弱, 说明As(Ⅲ)氧化后与材料中的Fe—OH络合(Ren et al., 2018), 且Mn—O官能团参与反应(Ma et al., 2020), 与XPS谱图结果相符. 谱图中SO4官能团峰强及峰位变化并不明显, 并未出现(Cao et al., 2021)报道中施氏矿物吸附As(Ⅲ)后SO4峰强度明显减弱的现象, 与反应后硫酸根释放结果相一致, 可能是由于吸附过程中部分As与材料表面锰羟基结合, 从而抑制了硫酸根与砷酸根的配体交换过程.
3.6 锰氧化物负载施氏矿物去除As(Ⅲ)机理预测锰氧化物负载施氏矿物在酸性环境下去除水中As(Ⅲ)分为3个阶段:首先, As(Ⅲ)接触材料表面锰氧化物壳层后, 迅速氧化转变为As(Ⅴ). 壳层中高价态的Mn(Ⅵ)部分还原溶解生成Mn2+的释放于液相中, 产生了更多As吸附位点的同时壳层部分剥落(图 9a). 其次, As(Ⅴ)受静电吸附作用再吸附于材料上, 少量As(Ⅴ)截留于壳层之中, 与Mn—OH官能团表面络合(Cuong et al., 2021). 最后, 由于Mn对As的亲和性较弱(Shih et al., 2015), 大部分As(Ⅴ)通过扩散的方式穿过壳层到达施氏矿物内核. As(Ⅴ)与施氏矿物形成As—O—Fe络合(Ren et al., 2018), 并通过配体交换替代施氏矿物孔道内的硫酸根配体, 使得As富集于Fe和Mn含量接近的壳层和内核交界处(图 9b).
图 9(Fig. 9)
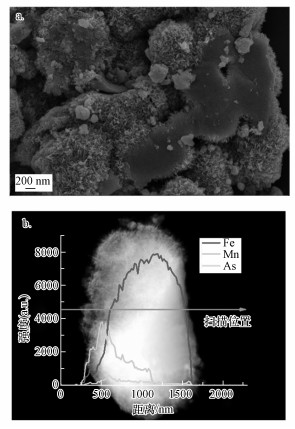 |
| 图 9 MnOx@Sch-2的反应后SEM图(a)和TEM线扫剖面图(b) Fig. 9SEM image(a) and TEM line scan profiles image(b) of MnOx@Sch-2 after reaction |
4 结论(Conclusions)1) 以实验室合成的施氏矿物为基础, 一水硫酸锰和高锰酸钾为锰源, 采用液相沉淀法成功制备出锰氧化物负载施氏矿物(MnOx@Sch).
2) 铁锰比为4.57, 初始pH=3, 投加量为0.5 g·L-1, As(Ⅲ)初始浓度为1 mg·L-1条件下As(Ⅲ)与MnOx@Sch反应的平衡剩余浓度为2.42 μg·L-1, 去除率为99.76%.
3) MnOx@Sch对As(Ⅲ)的去除率随锰负载量的增加先上升后下降. pH和共存Ca2+、Mg2+、Cl-对MnOx@Sch去除As(Ⅲ)无显著影响. 吸附过程符合准二级动力学及颗粒内扩散过程, 伴随SO42-和Mn2+的释放.
4) 结合XPS、FTIR及TEM等表征分析, MnOx@Sch对As(Ⅲ)主要的去除机理为先将As(Ⅲ)氧化为As(Ⅴ)从而促进As的静电吸附, 再通过配体交换和络合配位的作用去除. As富集于材料内核与壳层之间的区域.
参考文献
| Bigham J M, Schwertmann U, Traina S J, et al. 1996. Schwertmannite and the chemical modeling of iron in acid sulfate waters[J]. Geochimica et Cosmochimica Acta, 60: 2111-2121. DOI:10.1016/0016-7037(96)00091-9 |
| Burton E D, Bush R T, Johnston S G, et al. 2009. Sorption of arsenic(Ⅴ) and arsenic(Ⅲ) to schwertmannite[J]. Environmental Science & Technology, 43: 9202-9207. |
| Cao Q, Chen C, Li K, et al. 2021. Arsenic(Ⅴ) removal behavior of schwertmannite synthesized by KMnO4 rapid oxidation with high adsorption capacity and Fe utilization[J]. Chemosphere, 264: 128398. DOI:10.1016/j.chemosphere.2020.128398 |
| 陈丽红, 张翔凌, 何春艳, 等. 2019. Zn-LDHs覆膜改性麦饭石对Cd(Ⅱ)吸附性能及其作用机理研究[J]. 环境科学学报, 39(12): 4004-4014. |
| Chen M, Wu P, Li S, et al. 2019. The effects of interaction between vermiculite and manganese dioxide on the environmental geochemical process of thallium[J]. Science of the Total Environment, 669: 903-910. DOI:10.1016/j.scitotenv.2019.03.079 |
| Cheng H, Hu Y, Luo J, et al. 2009. Geochemical processes controlling fate and transport of arsenic in acid mine drainage (AMD) and natural systems[J]. Journal of Hazardous Materials, 165: 13-26. DOI:10.1016/j.jhazmat.2008.10.070 |
| Cuong D V, Wu P C, Chen L I, et al. 2021. Active MnO2/biochar composite for efficient As(Ⅲ) removal: Insight into the mechanisms of redox transformation and adsorption[J]. Water Research, 188: 116495. DOI:10.1016/j.watres.2020.116495 |
| Dhar R K, Zheng Y, Rubenstone J, et al. 2004. A rapid colorimetric method for measuring arsenic concentrations in groundwater[J]. Analytica Chimica Acta, 526: 203-209. DOI:10.1016/j.aca.2004.09.045 |
| Han X, Li Y L, Gu J D. 2011. Oxidation of As(Ⅲ) by MnO2 in the absence and presence of Fe(Ⅱ) under acidic conditions[J]. Geochimica et Cosmochimica Acta, 75: 368-379. DOI:10.1016/j.gca.2010.10.010 |
| He Z, Zhang Q, Wei Z, et al. 2019. Multiple-pathway arsenic oxidation and removal from wastewater by a novel manganese-oxidizing aerobic granular sludge[J]. Water Research, 157: 83-93. DOI:10.1016/j.watres.2019.03.064 |
| Hou J, Luo J, Song S, et al. 2017. The remarkable effect of the coexisting arsenite and arsenate species ratios on arsenic removal by manganese oxide[J]. Chemical Engineering Journal, 315: 159-166. DOI:10.1016/j.cej.2016.12.115 |
| Huang F G, Jua S Y, Liu Y, et al. 2015. Reductive dissolution of ferrihydrite with the release of As(Ⅴ) in the presence of dissolved S(-Ⅱ)[J]. Journal of Hazardous Materials, 286: 291-297. DOI:10.1016/j.jhazmat.2014.12.035 |
| Kijima N, Yasuda H, Sato T, et al. 2001. Preparation and characterization of open tunnel oxide α-MnO2 precipitated by ozone oxidation[J]. Journal of Solid State Chemistry, 159: 94-102. DOI:10.1006/jssc.2001.9136 |
| Lee J S, Chon H T. 2005. Hydrogeochemical characteristics of acid mine drainage in the vicinity of an abandoned mine, Daduk Creek, Korea[J]. Journal of Geochemical Exploration, 88: 37-40. |
| 李君菲, 谢莹莹, 党志, 等. 2018. 酸性矿山废水中铜在含铬施氏矿物上的吸附及其对矿物溶解与相转变的影响[J]. 环境科学学报, 38(8): 3138-3145. |
| 李旭伟, 贺静, 张健, 等. 2020. 透析对施氏矿物微观结构及其砷吸附能力的影响[J]. 环境科学学报, 40(2): 546-553. |
| 李浙英, 梁剑茹, 佰双友, 等. 2011. 生物成因与化学成因施氏矿物的合成、表征及其对As(Ⅲ)的吸附[J]. 环境科学学报, 31(3): 460-467. |
| Liao Y, Liang J, Zhou L. 2011. Adsorptive removal of As(Ⅲ) by biogenic schwertmannite from simulated As-contaminated groundwater[J]. Chemosphere, 83: 295-301. DOI:10.1016/j.chemosphere.2010.12.060 |
| Luo C, Routh J, Dario M, et al. 2020. Distribution and mobilization of heavy metals at an acid mine drainage affected region in South China, a post-remediation study[J]. Science of the Total Environment, 724: 138122. DOI:10.1016/j.scitotenv.2020.138122 |
| Luo X, Wang C, Luo S, et al. 2012. Adsorption of As (Ⅲ) and As (Ⅴ) from water using magnetite Fe3O4-reduced graphite oxide-MnO2 nanocomposites[J]. Chemical Engineering Journal, 187: 45-52. DOI:10.1016/j.cej.2012.01.073 |
| Luo Y, Ding J, Shen Y, et al. 2017. Interaction mechanism and kinetics of ferrous sulfide and manganese oxides in aqueous system[J]. Journal of Soils and Sediments, 18: 564-575. |
| Ma L, Cai D, Tu S. 2020. Arsenite simultaneous sorption and oxidation by natural ferruginous manganese ores with various ratios of Mn/Fe[J]. Chemical Engineering Journal, 382: 123040. DOI:10.1016/j.cej.2019.123040 |
| Ociński D, Jacukowicz-SobalaI, Mazur P, et al. 2016. Water treatment residuals containing iron and manganese oxides for arsenic removal from water-Characterization of physicochemical properties and adsorption studies[J]. Chemical Engineering Journal, 294: 210-221. DOI:10.1016/j.cej.2016.02.111 |
| Paikaray S, G?ttlicher J, Peiffer S. 2011. Removal of As(Ⅲ) from acidic waters using schwertmannite: Surface speciation and effect of synthesis pathway[J]. Chemical Geology, 283: 134-142. DOI:10.1016/j.chemgeo.2010.08.011 |
| Regenspurg S, Brand A, Peiffer S. 2004. Formation and stability of schwertmannite in acidic mining lakes 11Associate editor: C. M. Eggleston[J]. Geochimica et Cosmochimica Acta, 68: 1185-1197. DOI:10.1016/j.gca.2003.07.015 |
| Ren H T, Ji Z Y, Wu S H, et al. 2018. Photoreductive dissolution of schwertmannite induced by oxalate and the mobilization of adsorbed As(Ⅴ)[J]. Chemosphere, 208: 294-302. DOI:10.1016/j.chemosphere.2018.05.187 |
| Ren H T, Jia S Y, Wu S H, et al. 2013. Abiotic oxidation of Mn(Ⅱ) induced oxidation and mobilization of As(Ⅲ) in the presence of magnetite and hematite[J]. Journal of Hazardous Materials, 254-255: 89-97. DOI:10.1016/j.jhazmat.2013.03.022 |
| Shan C, Tong M. 2013. Efficient removal of trace arsenite through oxidation and adsorption by magnetic nanoparticles modified with Fe-Mn binary oxide[J]. Water Research, 47: 3411-3421. DOI:10.1016/j.watres.2013.03.035 |
| Shih Y J, Huang R L, Huang Y H. 2015. Adsorptive removal of arsenic using a novel akhtenskite coated waste goethite[J]. Journal of Cleaner Production, 87: 897-905. DOI:10.1016/j.jclepro.2014.10.065 |
| Singh R, Singh S, Parihar P, et al. 2015. Arsenic contamination, consequences and remediation techniques: A review[J]. Ecotoxicology and Environmental Safety, 112: 247-270. DOI:10.1016/j.ecoenv.2014.10.009 |
| Song J, Jia S Y, Ren H T, et al. 2014. Application of a high-surface-area schwertmannite in the removal of arsenate and arsenite[J]. International Journal of Environmental Science and Technology, 12: 1559-1568. |
| 唐苑君, 谢莹莹, 叶翰, 等. 2020. 草酸盐介导下含As(Ⅴ)黄钾铁矾的相转化过程与As(Ⅴ)的再分配行为[J]. 环境科学学报, 40(7): 2458-2467. |
| 王威, 冯坤, 王晓萌, 等. 2020. 施氏矿物和水铁矿对砷(Ⅲ)吸附性能的比较研究[J]. 南京农业大学学报, 43(6): 1116-1123. |
| Wang X, Jiang H, Fanf D, et al. 2019. A novel approach to rapidly purify acid mine drainage through chemically forming schwertmannite followed by lime neutralization[J]. Water Research, 151: 515-522. DOI:10.1016/j.watres.2018.12.052 |
| Xie Y, Lu G, Ye H, et al. 2017. Fulvic acid induced the liberation of chromium from CrO42--substituted schwertmannite[J]. Chemical Geology, 475: 52-61. DOI:10.1016/j.chemgeo.2017.10.031 |
| Zhang-Steenwinkel Y, Beckers J, Bliek A. 2002. Surface properties and catalytic performance in CO oxidation of cerium substituted lanthanum-manganese oxides[J]. Applied Catalysis A: General, 235: 79-92. DOI:10.1016/S0926-860X(02)00241-7 |
| Zhang G S, Qu J H, Liu H J, et al. 2007. Removal mechanism of As(Ⅲ) by a novel Fe-Mn binary oxide adsorbent: Oxidation and sorption[J]. Environmental Science & Technology, 41: 4613-4619. |
| Zhang G, Liu F, Liu H, et al. 2014. Respective role of Fe and Mn oxide contents for arsenic sorption in iron and manganese binary oxide: An X-ray absorption spectroscopy investigation[J]. Environmental Science & Technology, 48: 10316-10322. |
| Zhang S, Chen S, Liu F, et al. 2018. Effects of Mn average oxidation state on the oxidation behaviors of As(Ⅲ) and Cr(Ⅲ) by vernadite[J]. Applied Geochemistry, 94: 35-45. DOI:10.1016/j.apgeochem.2018.05.002 |
| Zhang S, Niu H, Cai Y, et al. 2010. Arsenite and arsenate adsorption on coprecipitated bimetal oxide magnetic nanomaterials: MnFe2O4 and CoFe2O4[J]. Chemical Engineering Journal, 158: 599-607. DOI:10.1016/j.cej.2010.02.013 |
| Zhang Z, Guo G, Li X, et al. 2019. Effects of hydrogen-peroxide supply rate on schwertmannite microstructure and chromium(Ⅵ) adsorption performance[J]. Journal of Hazardous Materials, 367: 520-528. DOI:10.1016/j.jhazmat.2018.12.116 |
| Zhou J, Zhou X, Yang K, et al. 2020. Adsorption behavior and mechanism of arsenic on mesoporous silica modified by iron-manganese binary oxide (FeMnOx/SBA-15) from aqueous systems[J]. Journal of Hazardous Materials, 384: 121229. DOI:10.1016/j.jhazmat.2019.121229 |
| 周立祥. 2017. 生物矿化: 构建酸性矿山废水新型被动处理系统的新方法[J]. 化学学报, 75(6): 552-559. |
