 , 章乾, 陈瑾惠, 袁俊莉, 王艺瑾, 齐鲁
, 章乾, 陈瑾惠, 袁俊莉, 王艺瑾, 齐鲁
 , 王洪臣
, 王洪臣中国人民大学环境学院低碳水环境技术中心, 北京 100872
收稿日期: 2021-03-20; 修回日期: 2021-04-14; 录用日期: 2021-04-14
基金项目: 中国人民大学科学研究基金项目(No.2020030257)
作者简介: 刘国华(1976—), 男, E-mail: lgh@ruc.edu.cn
通讯作者(责任作者): 齐鲁, E-mail: qilu@ruc.edu.cn
摘要:考察了叶酸对厌氧氨氧化细菌对污水脱氮性能的影响,并从胞外聚合物(EPS)、血红素及细胞合成等方面进行了机理分析.结果表明,在叶酸添加量分别为0.5、1.0和1.5 mg·L-1时,均可提高厌氧氨氧化细菌的污水脱氮性能,且当叶酸浓度为1.5 mg·L-1时,脱氮性能最好.与对照组相比,在1.5 mg·L-1的叶酸添加量时,总氮去除率(TNRR)提高到45.3 mg·g-1·d-1,增加了32.1%;总EPS提高到175.9 mg·g-1,增加了66.6%;血红素含量提高到2.35 mg·g-1,增加了26.4%;厌氧氨氧化细菌功能基因总拷贝数提高到(2.87×108±1.79×107)copies·g-1,增加了11.1%.经叶酸刺激培养后,污泥系统中的浮霉菌门相对丰度增加了3.5%,系统中占主导地位的厌氧氨氧化细菌为Candidatus Brocadia.
关键词:叶酸厌氧氨氧化脱氮活性促进机理
Effects of folic acid on nitrogen removal by anammox
LIU Guohua
 , ZHANG Qian, CHEN Jinhui, YUAN Junli, WANG Yijing, QI Lu
, ZHANG Qian, CHEN Jinhui, YUAN Junli, WANG Yijing, QI Lu
 , WANG Hongchen
, WANG HongchenLow-Carbon Water Environmental Technology Center, School of Environment, Renmin University of China, Beijing 100872
Received 20 March 2021; received in revised from 14 April 2021; accepted 14 April 2021
Abstract: The impact of folic acid on nitrogen removal by anammox bacteria was evaluated in shortterm batch experiments. Results show that total nitrogen removal rate (TNRR) could be improved when the additional amount of folic acid was 0.5 mg·L-1, 1.0 mg·L-1, and 1.5 mg·L-1, and the highest TNRR was observed at a folic acid concentration of 1.5 mg·L-1. Compared with the control group, the NRR, total extracellular polymeric substance (EPS), heme production, and anammox bacterial gene copy number at the folic acid concentration of 1.5 mg·L-1 reached 45.32 mg·g-1·d-1, 175.9 mg·g-1, 2.35 mg·g-1, and (2.87×108±1.79×107) copies·g-1, with an increase of 32.1%, 66.6%, 26.4%, and 11.1%, respectively. Moreover, the relative abundance of Planctomycetes in the sludge system increased by 3.5%, and the prevalent anammox bacteria were identified as Candidatus Brocadia.
Keywords: folic acidanammoxnitrogen removalactive enhancementmechanism
1 引言(Introduction)传统的生物硝化-反硝化污水脱氮技术具有能耗、药耗高、污泥产量大等缺点.厌氧氨氧化(Anammox)作为一种具有高效益且对环境友好的废水脱氮技术受到了广泛关注.在厌氧氨氧化反应中, 厌氧氨氧化细菌以NO2-为电子受体, 将NH4+直接氧化为N2(Van de Graaf et al., 1996).其优点是无需额外添加有机碳源, 不用曝气, 剩余污泥产率低, 已在世界范围内得到广泛应用, 并逐渐成为废水生物反硝化工艺的研究热点(Lackner et al., 2014;安芳娇等, 2018).然而, 厌氧氨氧化菌的生长周期长, 对环境条件要求苛刻等因素限制了厌氧氨氧化工艺的进一步应用(Strous et al., 1998;Jin et al., 2012;Zekker et al., 2015).因此, 为了提高反应器中厌氧氨氧化细菌的生物量和活性, 研究人员通过各种外加手段刺激厌氧氨氧化细菌的生长和活性, 并取得了一定的效果(Duan et al., 2011;Wang et al., 2013;Chen et al., 2015;Xu et al., 2018;Xu et al., 2020).
维生素B是促进细菌细胞内糖类、脂肪和蛋白质进行代谢必不可少的物质, 并且与生物活性密切相关, 常被用作生物细胞分裂与生长的促进剂.作为维生素B9的别名, 叶酸在自然界中以多种形式存在, 其母体化合物是由蝶啶、对氨基苯甲酸和谷氨酸3种成分结合而成.随着叶酸绿色合成工艺的发展, 将其广泛运用于促进微生物增殖成为可能(王维, 2016).
Schouten等(2004)通过同位素示踪法和酶活法研究获知, 厌氧氨氧化细菌通过乙酰-CoA途径还原固定CO2从而进行细胞内物质的合成.乙酰-CoA途径包括(Ragsdale et al., 2008):①1分子CO2还原成甲基后与四氢叶酸(THF)形成甲基四氢叶酸, 然后甲基通过甲基转移酶(CH3Tr)传递给类咕啉/铁硫蛋白(C/Fe-S), 最后传递给CO脱氢酶(CODH), 从而将甲基提供给乙酰-CoA;②另1分子CO2还原成CO, 然后转移至CODH, 将羰基提供给乙酰-CoA;③CoA通过CODH二硫化物还原酶(S-SRd-CODH)将CoAS-转移给CODH, 为乙酰-CoA提供CoAS-基团.
叶酸是厌氧氨氧化细菌CO2固定中大多数化合物的必要亚基, 包括10-甲氧基四氢叶酸、5, 10-甲基四氢叶酸和5, 10-亚甲基四氢叶酸等叶酸的次级代谢物.这些次级代谢物对厌氧氨氧化细菌的生长和活性至关重要, 因为它们会影响CO2固定或乙酰辅酶A的生成(Wang et al., 2016).然而, 厌氧氨氧化细菌缺乏叶酸的生物合成途径, 需要从外界获取叶酸.目前, 有关叶酸对厌氧氨氧化细菌活性的影响作用还未见报道.因此, 本研究通过在短时间内(一个世代周期内)考察叶酸对厌氧氨氧化细菌脱氮性能的影响, 并从叶酸促进厌氧氨氧化细菌细胞代谢的角度分析其机理, 以期为厌氧氨氧化工艺的启动和稳定运行提供技术支撑.
2 材料与方法(Materials and methods)2.1 试验装置与工作条件在血清瓶(500 mL, 液相体积450 mL)中进行厌氧氨氧化反应, 将厌氧氨氧化颗粒污泥和3种不同浓度(0.5、1.0、1.5 mg·L-1)的叶酸分别加入血清瓶中, 考察叶酸对厌氧氨氧化细菌脱氮性能的影响.对照组为含厌氧氨氧化污泥但不添加叶酸的血清瓶.用铝箔包裹血清瓶外部, 以防止光对厌氧氨氧化细菌的抑制.往反应系统中通入20 min氮气确保厌氧状态后, 将血清瓶置于恒温气浴振荡器(中国, 常州)中, 调节温度为(35±1) ℃, 转速控制在140 r·min-1左右进行培养.
2.2 接种污泥和配水组成所用厌氧氨氧化污泥取自本课题组实验室规模的SBR反应器培养系统, 污泥浓度约为4500 mg·L-1.用磷酸缓冲液(140 mg·L-1 KH2PO4, 750 mg·L-1 KH2PO4, pH=7.0±0.5)洗涤, 以消除氮背景值的影响.厌氧氨氧化优势菌种为Candidatus Jettenia.
实验污水采用人工配水, 以NH4Cl和NaNO2作为进水中氨氮和亚硝态氮的主要来源, NH4Cl和NaNO2浓度分别为95.13 mg·L-1和68.84 mg·L-1.进水中其它基质的浓度分别为:NaHCO3 1.00 g·L-1、KH2PO4 0.018 g·L-1、CaCl2·2H2O 0.18 g·L-1、MgSO4·7H2 O 0.27 g·L-1、FeSO4·7H2O 0.02 g·L-1、EDTA-2Na 0.018 g·L-1.此外, 每次配水加入1 mL微量元素, 微量元素根据Van de Graaf等(1996)报道所配.
2.3 水质分析方法氨氮(NH4+-N)的测定采用纳氏试剂光度法, 亚硝酸盐(NO2--N)的测定采用N-(1-萘基)-乙二胺光度法, 硝酸盐(NO3--N)的测定采用氨基磺酸紫外分光光度法.溶解氧和氧化还原电位均采用在线测定仪实时监测.
2.4 污泥生物活性分析2.4.1 胞外聚合物(EPS)提取和测定具体提取步骤如下(Murthy et al., 1999):取约100 mL均匀混合的污泥样品, 以6000 r·min-1转速离心10 min.用滤纸过滤后, 将所得溶液存放于烧杯内, 离心后的沉淀物用磷酸盐缓冲液(0.142% Na2HPO4、0.024% KH2PO4、0.790% NaCl、0.020% KCl)稀释到原来的体积, 在(60±1) ℃恒温水浴锅中水浴加热振荡60 min, 然后以6000 r·min-1转速离心15 min, 用滤纸过滤收集的上清液, 倒入上述烧杯内, 混合后的溶液置于4 ℃冰箱中备用.
EPS中蛋白质(PN)的测定采用LOWRY法(Lowery et al., 1951), 多糖(PS)含量的测定采用蒽酮-硫酸比色法测定(Gerhardt et al., 1994).
2.4.2 血红素测定采用荧光光谱法对样品血红素进行测定, 具体操作步骤如下:①原位取1 g污泥样品置于50 mL离心管中, 将其在4 ℃、8000 g离心力条件下作用20 min, 弃去上清液得到无杂质污泥;②将步骤①中所得无杂质污泥与10 mmol·L-1磷酸盐缓冲溶液(pH=7.5)等体积混合并振荡均匀, 继续在4 ℃、8000 g离心力条件下作用20 min后弃去上清液, 重复操作, 直至所得上清液为无色后, 弃去上清液得到菌体;③取1 g步骤②中所得菌体置于50 mL烧杯中, 加入25 mL 10 mmol·L-1磷酸盐缓冲溶液(pH=7.5), 封口以防菌体溅出;放入超声破碎仪, 使细胞在1000 W功率下进行超声破碎30 min(工作/间歇时间为5 s/6 s), 然后在4 ℃、12500 g离心力条件下离心20 min, 过滤后得到的悬浮液体即为亚铁血红素溶液;④取步骤③得到的亚铁血红素溶液0.5 mL, 加入饱和草酸溶液(2 mol·L-1)5 mL, 混合均匀;将得到的混合溶液在100 ℃下加热30 min, 冷却备用;采用荧光光谱仪测定激发波长为240~500 nm及发射波长为500~700 nm处的荧光强度;⑤将测得的荧光强度代入标准曲线, 计算出亚铁血红素浓度.
2.4.3 污泥的电子传递体系(TTC-ETS)活性测定参考文献(尹军等, 2005)方法, 在10 mL离心管中加入0.8 mL污泥混合液、0.5 mL 3.6 g·L-1的Na2SO3溶液及0.3 mL 4 g·L-1的TTC溶液, 将制备好的样品放在(25±l) ℃水浴振荡器内振荡培养30~60 min, 并记录培养时间;向离心管中加入1 mL 37%甲醛以终止酶反应, 以上操作均在暗处进行;将样品在4000 r·min-1下离心5 min, 弃去上清液后小心加入5 mL丙酮, 轻轻混合均匀, 继续在黑暗避光处(37±l) ℃水浴振荡器内振荡萃取10 min;待样品萃取完毕后, 再在4000 r·min-1转速下离心5 min, 使上清液和污泥沉淀尽量完全分离;用紫外分光光度计在485 nm波长处读取萃取液的吸光度.离心剩下的沉淀污泥在(105±l) ℃下烘干l h, 并测得干重.污泥的TTC-ETS活性的计算公式如下:
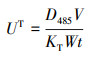 | (1) |
2.4.4 污泥表观活性分析采用扫描电镜(SEM)进行分析, 具体操作步骤如下:①样品漂洗:取适量污泥混合液置于2 mL离心管中, 用PBS缓冲液漂洗, 5000 r·min-1离心10 min, 用吸管将上清液从离心管去除;②样品的固定:将4%戊二醛加入到洗净的污泥样品内固定, 置于4 ℃冰箱中保存1.5 h;③冲洗:用PBS缓冲液轻轻振荡摇匀后, 以4000 r·min-1的速度离心5 min, 弃去上清液后, 再次注入PBS缓冲液离心, 重复操作3次;④脱水:分别用浓度为50%、70%、80%、90%、100%的乙醇进行脱水, 每次10 min;⑤干燥:样品放置于真空冷冻干燥机中干燥;⑥粘样和镀膜:样品观察面朝上, 用导电胶贴于扫描电镜样品台上, 用离子溅射镀膜仪在样品表面镀金1 min;⑦照相:将处理好的样品在扫描显微镜下观察污泥样品的形态, 选取目标区域, 调整放大倍数拍照.
2.5 分子生物学检测项目与方法2.5.1 活性污泥总DNA的提取及纯化本研究采用FastDNA? SPIN Kit for Soil试剂盒(MP, 美国)对污泥样品DNA进行提取和纯化.
2.5.2 Anammox细菌基因定量分析(qPCR)以含有厌氧氨氧化细菌的相关功能基因片段的质粒作为定量标准品.将扩增的目的基因片段与pEASY-Blunt克隆载体(北京全式金生物技术有限公司)连接, 并克隆到Trans1-T1感受态细胞(北京全式金生物技术有限公司)中.用通用引物(AMX809f, GCCGTAAACGATGGGCAC; AMX1066r, AACGTCT CACGACACGAGCTG)进行PCR扩增, 所得片段经琼脂糖凝胶电泳鉴定, 将正确的阳性DNA片段送往深圳华大基因科技有限公司进行测序, 测序结果通过GenBank BLAST软件进行同源分析.重组质粒用EasyPure Plasmid MiniPrep Kit质粒提取试剂盒(北京全式金生物技术有限公司)提取并测定其浓度.然后根据吸光度和片断长度的关系计算基因拷贝数.质粒DNA用灭菌水稀释10倍, 得到连续稀释度模板, 作为qPCR的标准品.标准曲线的R2大于0.99, 扩增效率最好在90%~105%;溶解曲线的溶解温度应大于85 ℃(范强, 2016).
利用ABIPRISM7000系统对样品的脱氮功能菌及功能基因进行定量.扩增反应总体积为20 μL, 包含SYBR GreenⅠ混合液(北京全式金生物技术有限公司) 10 μL、DNA模板(样品)1 μL、10 μmol·L-1引物各0.4 μL, ddH2O补足至20 μL.反应程序为:95 ℃预变性5 min;95 ℃变性15 s, 55 ℃退火45 s, 72 ℃延伸30 s, 40个循环.定量PCR所用引物和上述PCR所用引物相同.
2.5.3 细菌群落结构分析将提取的DNA样品送往生物公司(诺禾致源, 北京)完成高通量测序文库的构建, 并基于Illumina MiSeq PE250平台进行双端测序.将双端测序得到的正、反向序列进行两两组装连接, 保留长度大于200 bp的序列.对嵌合序列进行质量过滤, 去除嵌合体序列, 利用得到的序列进行OTU分析, 用VSEARCH软件进行序列聚类(序列相似性大于97%), 并将16S rRNA与Silva 119数据库进行比对.接着利用RDP(Ribosomal Database Program)分类器的贝叶斯算法对OTU的代表性序列进行物种分类分析, 在不同的物种分类水平上统计每个样本的群落组成.
3 结果与讨论(Results and discussion)3.1 叶酸对厌氧氨氧化细菌脱氮性能的影响加入厌氧氨氧化系统的叶酸浓度分别为0(对照组)、0.5、1.0、1.5 mg·L-1, 其对厌氧氨氧化细菌脱氮性能的影响如图 1所示.可以看出, 在加入不同浓度的叶酸后, 厌氧氨氧化细菌的脱氮效果均有不同程度的增加.反应96 h后, 对照组(未加叶酸)中NH4+-N和NO2--N浓度分别从95.13 mg·L-1和68.84 mg·L-1下降到9.03 mg·L-1和30.19 mg·L-1, NO3--N浓度上升到16.29 mg·L-1, 总氮去除率(TNRR)为34.3 mg·g-1·d-1.随着叶酸添加浓度的增加(从0.5 mg·L-1增至1.5 mg·L-1), 系统TNRR逐渐增强, 且在叶酸添加浓度为1.5 mg·L-1的实验组里, TNRR提高最多, 即NH4+-N和NO2--N浓度分别从92.16 mg·L-1和70.30 mg·L-1下降到1.90 mg·L-1和0.02 mg·L-1, NO3--N浓度上升到17.82 mg·L-1, TNRR为45.3 mg·g-1·d-1, 较对照组提高了32.1%.与其他研究结果对比发现, 本研究用叶酸刺激反应系统中的厌氧氨氧化细菌后TNRR提高更多(Yin et al., 2015; Wang et al., 2016), 说明叶酸可以有效增强厌氧氨氧化细菌的生物活性, 强化厌氧氨氧化细菌的脱氮性能.另外, 通过计算发现, 本研究厌氧氨氧化系统中NO3--N生成量低于理论计算值, 推测系统出现了反硝化细菌.叶酸浓度的监测结果表明, 实验体系反应过程中叶酸几乎被完全利用(表 1).因此, 需要进一步分析污泥中的微生物种群结构及不同微生物之间的相互关系, 考虑异养菌利用叶酸后与厌氧氨氧化细菌产生了协同脱氮作用.
图 1(Fig. 1)
 |
| 图 1 叶酸对厌氧氨氧化细菌脱氮性能的影响 Fig. 1Effect of folic acid on nitrogen removal |
表 1(Table 1)
| 表 1 反应体系中叶酸的浓度变化 Table 1 Change in folic acid concentration during the experiment | |||||||||||||||||
表 1 反应体系中叶酸的浓度变化 Table 1 Change in folic acid concentration during the experiment
| |||||||||||||||||
3.2 叶酸对厌氧氨氧化细菌生长活性的影响3.2.1 表观活性为了考察叶酸的添加对厌氧氨氧化细菌颗粒粒径的影响, 从不同叶酸添加量的血清瓶中取厌氧氨氧化污泥进行扫描电子显微镜(SEM)拍照, 结果如图 3所示.从图中可以发现, 反应系统的厌氧氨氧化颗粒污泥的粒径随叶酸添加量的升高而增加.添加1.5 mg·L-1叶酸后形成的颗粒污泥粒径最大, 相比未添加叶酸的颗粒污泥粒径明显增加, 说明叶酸对厌氧氨氧化颗粒污泥的形成有一定的促进作用, 可以形成更大粒径的污泥.研究表明(Kindaichi et al., 2007; Bhunia et al., 2007), 厌氧氨氧化颗粒污泥粒径越大厌氧氨氧化活性越高, 这主要是因为厌氧氨氧化颗粒污泥的活性主要集中在颗粒污泥表面1 mm的范围内, 0.2~0.3 mm厚的生物膜是厌氧氨氧化反应活性最主要的部分.粒径越大的颗粒污泥, 内部保持着更丰富的生物量, 可以产生更多的厌氧氨氧化中间产物, 因此, 可以保持更高的生物活性(冒盛鑫, 2016).
图 3(Fig. 3)
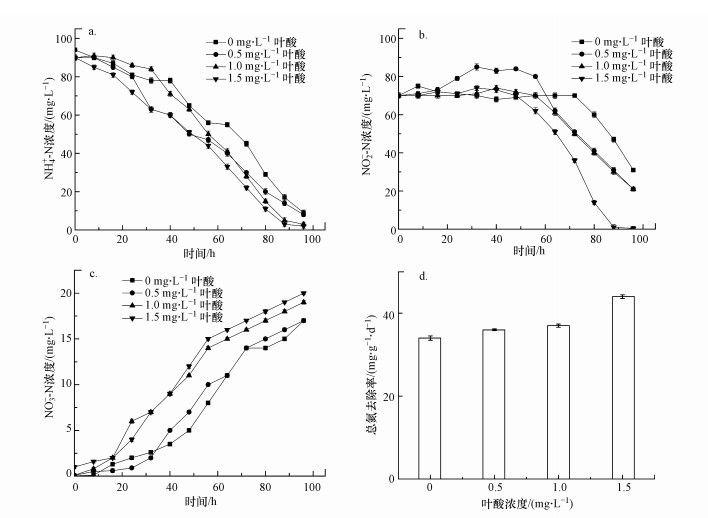
 |
| 图 3 叶酸对厌氧氨氧化污泥EPS分泌(a)及PN/PS(b)的影响 Fig. 3Effect of folic acid on EPS content (a) and PN/PS (b) of anammox sludge |
3.2.2 胞外聚合物(EPS)通过检测EPS浓度的变化来研究叶酸对厌氧氨氧化细菌活性的影响, 结果如图 3所示.由图 3a可知, 污泥中初始PN、PS和总EPS的含量分别为57.8、29.8和87.6 mg·g-1.在不添加叶酸的情况下(对照组), 经过96 h的反应, EPS总量增加了15.6%, 含量达到94.8 mg·g-1(PN:64.1 mg·g-1, PS:30.8 mg·g-1).当叶酸浓度分别为0.5、1.0和1.5 mg·L-1时, EPS总量均有明显的升高, 比对照组分别提高了46.7%、59.0%和66.6%.当叶酸浓度为1.5 mg·L-1时, PN、PS和EPS的含量最高, 分别为95.8、40.9和175.95 mg·g-1.由图 3b可知, 随着叶酸添加量的增加, PN/PS值也逐渐增加, 当叶酸浓度为1.5 mg·L-1时, PN/PS值比对照组提高了11.1%.以上结果表明, 随着叶酸剂量的增加(从0.5 mg·L-1增加到1.5 mg·L-1), 厌氧氨氧化细菌产生的EPS总量也随之增加, 叶酸添加剂量为1.5 mg·L-1时对厌氧氨氧化细菌EPS的分泌促进作用最强.
研究表明, EPS和微生物聚合物的理化特性(絮凝性、吸附性和稳定性等)有很大相关性, 对厌氧氨氧化污泥的生物活性具有重要影响(Hou et al., 2015;Bhunia et al., 2019).EPS是聚集积累在细菌细胞表面的代谢物, 可以作为保护细胞免受外部环境伤害的保护层(Wang et al., 2020).EPS可以通过改变细菌表面的负电荷并起到促进微生物细胞聚集的物理架桥作用, 还可以参与污泥多孔结构的形成(Jia et al., 2017).污泥颗粒化会提高系统的稳定性和厌氧氨氧化细菌的活性(Zhang et al., 2020), 且厌氧氨氧化污泥颗粒的粒径与EPS含量呈正相关(冒盛鑫, 2016).结合本研究厌氧氨氧化污泥的表观活性结果(图 2)和EPS分泌结果可以得出, 随着叶酸添加量的增加, 厌氧氨氧化污泥的活性得以提高.
图 2(Fig. 2)
 |
| 图 2 不同叶酸添加量下厌氧氨氧化污泥SEM图像 (a.0 mg·L-1, b.0.5 mg·L-1, c.1.0 mg·L-1, d.1.5 mg·L-1) Fig. 2SEM images of anammox sludge at different dosages of folic acid |
3.2.3 电子传递体系(ETC)活性氯化三苯基四氮唑(TTC)是经常被用作检测ETS活性的人工电子受体, 由TTC作为人工电子受体检测出的ETS活性被称为TTC-ETS活性(Ryssov-Nielsen, 1975).叶酸对厌氧氨氧化污泥TTC-ETS活性的影响如图 4所示.由图可知, 在血清瓶内底物消耗完全之前, TTC-ETS活性同样随底物的减少而逐渐降低.当叶酸浓度分别为0.5、1.0、1.5 mg·L-1时, TTC-ETS活性出现突降, 其中, 1.5 mg·L-1实验组降幅最大, 说明该组微生物呼吸速度最快, 底物消耗最快, 系统内厌氧氨氧化污泥的生物活性最高.这与Wang等(2013)和Yang等(2015)的研究结果一致, 他们报道了底物(NH4+-N)的去除与污泥的TTC-ETS活性呈正相关.而叶酸添加量为0 mg·L-1组的TTC-ETS活性在反应时间内尚未达到最低值, 仍有继续下降的趋势, 这是由于该组厌氧氨氧化污泥生物活性较低, 底物反应不完全, 依然有电子传递过程进行.
图 4(Fig. 4)
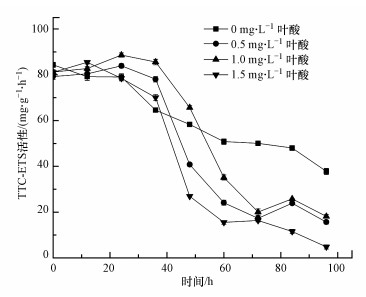 |
| 图 4 叶酸对厌氧氨氧化污泥TTC-ETS活性的影响 Fig. 4Effect of folic acid on TTC-ETS activity of anammox sludge |
污泥的TTC-ETS活性是衡量污泥中细菌在一定条件下降低人工电子受体(氧化还原电位低于天然最终电子受体)能力的指标(尹军等, 2005), 通过测定污泥微生物呼吸链上电子的传递速率, 间接表征了污泥微生物的生物活性(Trevors et al., 1982).单位时间内经过氧化呼吸链传递给最终电子受体的氢(电子)越多, 说明污泥微生物的呼吸速率越快, 污泥的生物活性越高.
3.2.4 血红素亚铁血红素浓度与厌氧氨氧化污泥的脱氮性能呈正相关关系, 能直接反映厌氧氨氧化污泥的活性(Ma et al., 2019).本研究采用荧光光谱仪测定激发波长为405 nm、发射波长为500~700 nm处的荧光强度, 在601.4 nm及655 nm处检测出亚铁血红素的特征峰荧光强度, 由标准曲线可以计算出厌氧氨氧化污泥中亚铁血红素的含量.
由表 2可以看出, 随着叶酸浓度的增加, 亚铁血红素的含量也在升高.叶酸添加剂量为1.5 mg·L-1组测得的亚铁血红素含量最高(2.3478 mg·g-1), 比初始含量(1.8580 mg·g-1)增加了26.4%, 说明在该叶酸浓度下的厌氧氨氧化污泥生物活性最高, 与脱氮性能表现出的生物活性一致.Ma等(2019)和Zhang等(2015)报道的血红素c浓度表明, 在35 ℃温度条件下, 血红素c浓度与NRR呈明显的正相关.本研究实验结果与报道中的规律一致.
表 2(Table 2)
| 表 2 不同叶酸添加实验组的亚铁血红素含量 Table 2 Concentration of heme in exerimental group with different dosage of folic acid | |||||||||||||||||||||||||||
表 2 不同叶酸添加实验组的亚铁血红素含量 Table 2 Concentration of heme in exerimental group with different dosage of folic acid
| |||||||||||||||||||||||||||
3.3 叶酸对厌氧氨氧化细菌生长量的影响图 5为添加叶酸前后厌氧氨氧化细菌功能基因拷贝数检测结果.由图可知, 随着叶酸浓度的增加, 厌氧氨氧化细菌基因拷贝数也逐渐升高, 添加1.5 mg·L-1叶酸组厌氧氨氧化细菌功能基因拷贝数增长最多, 由初始值(2.584×108±1.301×107) copies·g-1增加至(2.870×108±1.793×107) copies·g-1, 增加了11.1%.结果表明, 在本研究的叶酸浓度范围内(0.5~1.5 mg·L-1), 叶酸对厌氧氨氧化细菌的生长有一定的促进作用.
图 5(Fig. 5)
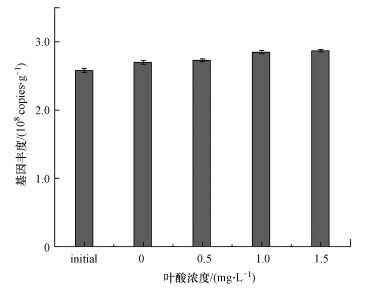 |
| 图 5 添加叶酸前后厌氧氨氧化细菌基因丰度的变化 Fig. 5Change in gene abundance of anammox bacteria before and after adding folic acid |
3.4 叶酸对厌氧氨氧化细菌微生物群落结构的影响为了考察叶酸对厌氧氨氧化系统微生物群落结构的影响, 将血清瓶中的厌氧氨氧化污泥取样进行了高通量测序.由图 6a可知, 添加不同浓度叶酸后, 浮霉菌门(Planctomycetes)相对丰度受叶酸刺激后均呈现出一定程度增多的趋势, 特别在叶酸添加量为1.5 mg·L-1时增加幅度较大, 说明在一定范围内更高浓度的叶酸对浮霉菌门细菌的生长繁殖有积极作用.
图 6(Fig. 6)
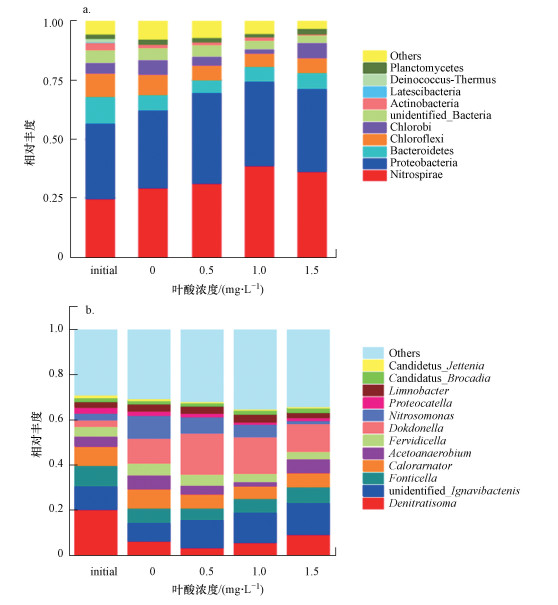 |
| 图 6 各样本在门(a)和属(b)分类水平下Top10的物种分布柱状图 Fig. 6Histogram of top10 species distribution of each sample at the phylum (a) and genus (b) classification levels |
在浮霉菌门中共检测出3种主要属(图 6b), 属于厌氧氨氧化细菌属种类包括Candidatus Brocadia属和Candidatus Jettenia属.在原始接种污泥中, Candidatus Brocadia属和Candidatus Jettenia属的占比分别为1.6%和1.1%.添加叶酸(1.5 mg·L-1)进行培养后, Candidatus Brocadia属的比例增加到1.9%, 而Candidatus Jettenia属的比例减少为0.5%, 说明添加叶酸后的反应体系内厌氧氨氧化细菌的优势属为Candidatus Brocadia属.有研究报道, Candidatus Jettenia属只能在低氮负荷环境中增殖, 而Candidatus Brocadia属在高氮负荷条件下有较高的增殖速率(Schouten et al., 2004).氮负荷的变化可能是导致厌氧氨氧化细菌优势属种改变的原因.
4 结论(Conclusions)1) 在0.5~1.5 mg·L-1的浓度范围内, 叶酸的添加可提高厌氧氨氧化污水脱氮性能.当添加1.5 mg·L-1叶酸时, 厌氧氨氧化污泥生物活性强化效果最明显, TNRR提高到45.32 mg·g-1·d-1, 增加了32.1%;总EPS含量提高到175.95 mg·g-1, 增加了66.6%;血红素含量提高到2.3478 mg·g-1, 增加了26.4%;厌氧氨氧化细菌功能基因总拷贝数提高到(2.870×108±1.793×107) copies·g-1, 增加了11.1%.
2) 经叶酸刺激培养后, 浮霉菌门(Planctomycetes)相对丰度呈现出一定程度增多的趋势, 特别在叶酸添加量为1.5 mg·L-1时增加幅度较大.在浮霉菌门中共检测出3种主要属, 属于厌氧氨氧化细菌的为Candidatus Brocadia和Candidatus Jettenia, 且反应体系内厌氧氨氧化细菌的优势属为Candidatus Brocadia.
参考文献
| 安芳娇, 彭永臻, 张永辉, 等. 2018. 基质比对厌氧氨氧化脱氮性能的影响[J]. 环境科学学报, 38(3): 1010-1015. |
| Bhunia P, Ghangrekar M M. 2007. Required minimum granule size in UASB reactor and characteristics variation with size[J]. Bioresource Technology, 98(5): 994-999. DOI:10.1016/j.biortech.2006.04.019 |
| Chen H, Yu J, Jia X, et al. 2014. Enhancement of anammox performance by Cu(Ⅱ), Ni(Ⅱ) and Fe(Ⅲ) supplementation[J]. Chemosphere, 117: 610-616. DOI:10.1016/j.chemosphere.2014.09.047 |
| Duan X, Zhou J, Qiao S, et al. 2011. Application of low intensity ultrasound to enhance the activity of anammox microbial consortium for nitrogen removal[J]. Bioresource Technology, 102: 4290-4293. DOI:10.1016/j.biortech.2010.12.050 |
| 范强. 2016. AOB-ANAMMOX一体式颗粒污泥脱氮系统的构建及ANAMMOX活性提高的研究[D]. 北京: 中国人民大学 |
| Gerhardt P, Murray R G E, Wood W A, et al. 1994. Methods for General and Molecular Bacteriology[M]. Washington D.C: American Society for Microbiology. |
| Hou X, Liu S, Zhang Z. 2015. Role of extracellular polymeric substance in determining the high aggregation ability of anammox sludge[J]. Water Research, 75(15): 51-62. |
| Jia F, Yang Q, Liu X, et al. 2017. Stratification of extracellular polymeric substances (EPS) for aggregated anammox microorganisms[J]. Environmental Science & Technology, 51(6): 3260-3268. |
| Jin R, Yang G, Yu J, et al. 2012. The inhibition of the Anammox process: A review[J]. Chemical Engineering Journal, 197: 67-79. DOI:10.1016/j.cej.2012.05.014 |
| Kindaichi T, Tsushima I, Ogasawara Y, et al. 2007. In situ activity and spatial organization of anaerobic ammonium-oxidizing (anammox) bacteria in biofilms[J]. Applied and Environmental Microbiology, 73(15): 4931-4939. DOI:10.1128/AEM.00156-07 |
| Lackner S, Gilbert E M, Vlaeminck S E, et al. 2014. Full-scale partial nitritation/anammox experiencese an application survey[J]. Water Research, 55(15): 292-303. |
| Lowery O H, Rosebrough N J, Farr A L. 1951. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 193(1): 265-275. DOI:10.1016/S0021-9258(19)52451-6 |
| Ma H, Zhang Y, Xue Y, et al. 2019. Relationship of heme, nitrogen loading capacity and temperature in anammox reactor[J]. Science of the Total Environment, 659: 568-577. DOI:10.1016/j.scitotenv.2018.12.377 |
| 冒盛鑫. 2016. 不同粒径厌氧氨氧化颗粒污泥脱氮效能及污泥菌群特性的研究[D]. 北京: 中国矿业大学 |
| Murthy S N, Novak J T. 1999. Factors affecting floc properties during aerobic digestion: implications for dewatering[J]. Water Environment Research, 71(2): 197-202. DOI:10.2175/106143098X121879 |
| Peters S H, Van Niftrik L. 2019. Trending topics and open questions in anaerobic ammonium oxidation[J]. Current Opinion in Chemical Biology, 49: 45-52. DOI:10.1016/j.cbpa.2018.09.022 |
| Ragsdale S W, Wood H G. 2008. Enzymology of the Acetyl-CoA pathway of CO2 fixation[J]. Critical Reviews in Biochemistry & Molecular Biology, 26(3/4): 261-300. |
| Ryssov-Nielsen H. 1975. Measurement of the inhibition of respiration in activated sludge by a modified determination of the ttcdehydrogenase activity[J]. Water Research, 9: 1179-1185. DOI:10.1016/0043-1354(75)90118-9 |
| Schouten S, Strous M, Kuypers Marcel M M, et al. 2004. Stable carbon isotopic fractionations associated with inorganic carbon fixation by anaerobic ammonium-oxidizing bacteria[J]. Applied & Environmental Microbiology, 70(6): 3785-3788. |
| Strous M, Heijnen J J, Kuenen J G, et al. 1998. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 50: 589-596. DOI:10.1007/s002530051340 |
| Trevors J, Mayfield C, Inniss W. 1982. Measurement of electron transport system (ETS) activity in soil[J]. Microbial Ecology, 8: 163-168. DOI:10.1007/BF02010449 |
| Van de Graaf A A, Bruijn P, Robertson L A, et al. 1996. Autotrophic growth of anaerobic, ammonium-oxidising microorganisms in a fluidized bed reactor[J]. Microbiology, 142(8): 2187-2196. DOI:10.1099/13500872-142-8-2187 |
| Wang D, Wang G, Zhang G, et al. 2013. Using graphene oxide to enhance the activity of anammox bacteria for nitrogen removal[J]. Bioresource Technology, 131: 527-530. DOI:10.1016/j.biortech.2013.01.099 |
| Wang T, Zhang H, Yang F. 2016. Performance of Anammox process and low-oxygen adaptability of Anammox biofilms in a FBR with small ring non-woven carriers[J]. Ecological Engineering, 86: 126-134. DOI:10.1016/j.ecoleng.2015.11.025 |
| Wang W, Li X Wang P, et al. 2013. Long-term effects of Ni(Ⅱ) on the performance and activity of activated sludge processes[J]. Ecotoxicology & Environmental Safety, 92: 144-149. |
| Wang W, Yan Y, Zhao Y, et al. 2020. Characterization of stratified EPS and their role in the initial adhesion of anammox consortia[J]. Water Research, 169: 115-223. |
| Wang Y, Hu X, Jiang B, et al. 2016. Symbiotic relationship analysis of predominant bacteria in a lab-scale anammox UASB bioreactor[J]. Environmental Science and Pollution Research, 23(8): 7615-7626. DOI:10.1007/s11356-015-6016-z |
| 王维. 2016. 叶酸的绿色合成工艺研究[D]. 南京: 东南大学 |
| Xu X, Liu G H, Fan Q, et al. 2018. Effects of gibberellin on the activity of anammox bacteria[J]. Journal of Environmental Management, 225: 104-111. |
| Xu X, Liu G H, Zhao D, et al. 2020. Enhancement of anammox bacterial activity by sodium glutamate[J]. Chemosphere, 244: 125570. DOI:10.1016/j.chemosphere.2019.125570 |
| Yang S, Guo W, Chen Y, et al. 2015. Economical evaluation of sludge reduction and characterization of effluent organic matter in an alternating aeration activated sludge system combining ozone/ultrasound pretreatment[J]. Bioresource Technology, 177: 194-203. DOI:10.1016/j.biortech.2014.11.009 |
| 尹军, 谭学军, 任南琪. 2005. 用TTC与INT-电子传递体系活性表征重金属对污泥活性的影响[J]. 环境科学, 26(1): 56-62. |
| Yin X, Qiao S, Zhou J. 2015. Using electric field to enhance the activity of anammox bacteria[J]. Applied Microbiology and Biotechnology, 99(16): 6921-6930. DOI:10.1007/s00253-015-6631-0 |
| Zekker I, Rikmann E, Tenno T, et al. 2015. Nitric oxide for anammox recovery in a nitrite-inhibited deammonification system[J]. Environmental Science & Technology Letters, 36: 2477-2487. |
| Zhang J, Miao Y, Zhang Q, et al. 2020. Mechanism of stable sewage nitrogen removal in a partial nitrification-anammox biofilm system at low temperatures: microbial community and EPS analysis[J]. Bioresource Technology, 297: 122459. DOI:10.1016/j.biortech.2019.122459 |
| Zhang Z Z, Cheng Y F, Zhou Y H, et al. 2015. A novel strategy for accelerating the recovery of an anammox reactor inhibited by copper(Ⅱ): EDTA washing combined with biostimulation via low-intensity ultrasound[J]. Chemical Engineering Journal, 279: 912-920. DOI:10.1016/j.cej.2015.05.081 |
