 , 关傲梅1,3, 齐维晓2
, 关傲梅1,3, 齐维晓2
 , 曲久辉1,2,3
, 曲久辉1,2,31. 中国科学院生态环境研究中心, 中国科学院饮用水科学与技术重点实验室, 北京 100085;
2. 清华大学环境学院, 清华大学水质与水生态研究中心, 北京 100084;
3. 中国科学院大学, 北京 100049
收稿日期: 2021-04-06; 修回日期: 2021-05-07; 录用日期: 2021-05-07
基金项目: “一带一路”国际科学组织联盟资助项目(No.ANSO-CR-KP-2020-05);国家自然科学基金面上项目(No.51778608)
作者简介: 彭强(1996—), 男, E-mail: qiangpeng_st@rcees.ac.cn
通讯作者(责任作者): 齐维晓, E-mail: wxqi@mail.tsinghua.edu.cn
摘要:沉积物氮还原功能对于调控和管理河流氮负荷具有重要作用.本研究选取潮白河不同区域河段表层沉积物作为研究对象,采用15N同位素示踪技术、16S rRNA扩增子测序和实时荧光定量PCR(qPCR)技术,研究了潮白河沉积物中氮还原过程(反硝化、厌氧氨氧化(anaerobic ammonia oxidation,anammox)和DNRA过程(dissimilatory nitrate reduction to ammonium,异化硝酸盐还原为铵))速率特征、相关功能基因丰度和微生物群落结构特征.结果表明:潮白河沉积物潜在反硝化、anammox、DNRA和N2O释放速率分别为(25.82±0.98)~(142.32±17.06)、(0.58±0.10)~(4.51±0.78)、(2.91±0.46)~(19.59±4.15)和(-1.09±0.17)~(3.30±0.57)nmol·g-1·h-1(以N计,下同).沉积物氮还原以反硝化过程为主(贡献率71.86%~91.65%),DNRA也有较高的贡献率(7.03%~25.32%),anammox过程贡献较小.相关分析表明,氮还原相关功能基因丰度与潮白河沉积物氮还原过程速率存在显著正相关关系,微生物群落中α-变形菌纲、硝基螺旋菌纲、疣微菌纲、脱硫杆菌门、硬壁菌门丰度与沉积物氮还原过程速率存在显著的相关关系.
关键词:氮还原过程潜在速率功能基因微生物群落组成15N同位素示踪
The characteristics of nitrogen reduction process in sediments of Chaobai River based on isotope tracer approach and molecular biology technology
PENG Qiang1,3
 , GUAN Aomei1,3, QI Weixiao2
, GUAN Aomei1,3, QI Weixiao2
 , QU Jiuhui1,2,3
, QU Jiuhui1,2,31. Key Laboratory of Drinking Water Science and Technology, Research Center for Eco-Environment Sciences, Chinese Academy of Sciences, Beijing 100085;
2. Center for Water and Ecology, School of Environment, Tsinghua University, Beijing 100084;
3. University of Chinese Academy of Sciences, Beijing 100049
Received 6 April 2021; received in revised from 7 May 2021; accepted 7 May 2021
Abstract: The nitrogen reduction function of sediments plays an important role in regulating and managing the nitrogen load of rivers. In this study,we selected the surface sediments of different sections of Chaobai River and used 15N isotope tracer approach,16S rRNA amplicon sequencing and real-time fluorescence quantitative PCR technology (qPCR) to study the characteristics of the rates of nitrogen reduction process (denitrification,anaerobic ammonia oxidation (anammox) and dissimilatory nitrate reduction to ammonium process (DNRA)),related functional gene abundances and microbial community structure in sediments of Chaobai River. Results showed that the potential rates of denitrification,anammox,DNRA and release rate of N2O in sediments were (25.82±0.98)~(142.32±17.06),(0.58±0.10)~(4.51±0.78),(2.91±0.46)~(19.59±4.15) and (-1.09±0.17)~(3.30±0.57) nmol·g-1·h-1,respectively. Nitrogen reduction process in sediments of Chaobai River was dominated by denitrification (contribution rate: 71.86%~91.65%). In addition,DNRA also had a relative high contribution rate (7.03%~25.32%) with the least contribution of anammox. Further,correlation analysis showed that the abundance of nitrogen-reduction-related functional genes had a significant positive correlation with the rates of nitrogen reduction process in sediments of Chaobai River. Moreover,the abundance of α-Proteobacteria,Nitrospiria,Verrucomicrobiae,Firmicutes and Desulfobacterota notably correlated with the rates of nitrogen reduction process.
Keywords: nitrogen reduction processpotential ratefunctional genemicrobial community composition15N isotope tracer approach
1 引言(Introduction)人类活动产生了大量活性氮排入水体, 破坏了水域生态系统原有氮平衡, 导致了一系列严重的氮素污染问题(Canfield et al., 2010).水中活性氮会通过沉降、吸附等过程进入水体沉积物, 并经过氨氧化、反硝化、anammox等过程发生价态上的转化(Kuypers et al., 2018).活性氮从水环境中去除, 主要通过微生物驱动的氮还原过程完成.早前的研究认为, 异养反硝化作用是水环境中最主要的NO3-还原去除过程(Burgin et al., 2007).然而, anammox过程的发现打破了这一传统认识, 由自养细菌驱动的anammox过程能直接以NO2-为电子受体氧化NH4+产生N2, 该过程中不会释放温室气体N2O(Mulder et al., 1995; Wang et al., 2019).与反硝化和anammox过程不同, 异化硝酸盐还原为铵(DNRA)将NO2-还原为更利于生物利用的NH4+, 促进了氮素的内循环, 但这也可能增加水环境的富营养化风险(Peng et al., 2016).因此, 了解沉积物中这3种氮还原途径的速率特征和影响因素对于预测、调控和管理水环境的氮负荷至关重要.目前, 关于沉积物氮转化功能的研究, 主要集中于海洋、湖泊、河口沉积物和水陆交错带, 与人类关系密切的城市圈河流沉积物氮转化功能的相关定量研究仍较少(高娟, 2019; Li et al., 2021).河流作为面源氮素污染的汇和主要的输送路径, 对河流沉积物氮转化功能的研究, 尤其是受人类活动干扰严重的重点城市圈河流沉积物氮转化功能的定量研究, 对于调控河流氮负荷、改善城市水环境具有重要意义.
潮白河作为流经京津冀城市圈最重要的河流, 具有重要的生态区位(Xi et al., 2021).潮白河发源于燕山北部, 首先流经受人类活动影响较小的山区(5530 km2), 然后流经城区(695 km2)和下游农业区(4624 km2)后, 最终在天津汇入渤海(Liao et al., 2018).Liao等研究表明, 潮白河流域山区、城区和农业区分别受到不同种类和程度的人类活动的干扰, 污水处理排放是城区河段的主要污染源, 而农药和化肥使用是农业区河段最主要的污染源(Liao et al., 2018; Liao et al., 2019).不同区域上覆水TP、DOC和NH4+-N等水质理化性质指标也存在显著差异, 农业区上覆水TP、NH4+-N含量显著高于山区和城区, 而城区DOC含量则显著高于山区和农业区(Liao et al., 2018).
基于Liao等的研究结果, 本研究选取潮白河不同区域的河段进行采样, 以不同区域样点沉积物作为研究对象, 采用15N同位素示踪法、16S rRNA高通量测序和qPCR技术, 研究潮白河不同区域沉积物中氮还原过程的速率、相关功能基因丰度和微生物群落结构特征, 并应用统计分析方法探讨相关功能基因和微生物群落组成与沉积物氮还原过程速率的相关关系.
2 材料和方法(Materials and methods)2.1 样品采集和保存本研究采集潮白河不同区域河段表层沉积物(0~10 cm)样品共4个, 采样时间为2018年11月.样品位于潮白河干流不同区段(图 1):上游山区(A)、中游城区(B)、下游农业区(C)及潮白河入海口(D).采样时于每个样点随机取3个表层沉积物样品, 去除植物残体和动物残骸等杂质后充分混匀.混匀后样品装入无菌自封袋, 放入装有冰盒的保温箱带回实验室.运回实验室的样品于4 ℃冰箱存储, 并尽快进行沉积物的潜在反硝化、anammox、DNRA和N2O释放速率的测定, 同时取少量样品存于-80 ℃冰箱用于冷冻干燥后提取DNA进行分子生物学分析.
图 1(Fig. 1)
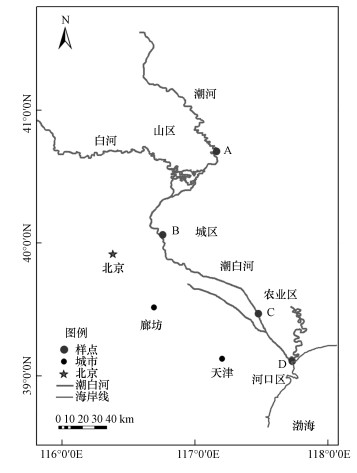 |
| 图 1 潮白河采样点分布图 Fig. 1Location of Chaibai River and sampling sites |
2.2 沉积物潜在反硝化、anammox、DNRA和N2O释放速率测定采用泥浆培养法结合15N同位素示踪技术测定沉积物潜在反硝化、anammox、DNRA速率(Risgaard Petersen et al., 2003; Song et al., 2016).取3.4 g新鲜沉积物及等质量的去离子水于12 mL Labco瓶(Exetainer, Labco, UK)中, 搅拌混匀;利用定制厌氧装置进行交替抽换气, 保证管内为厌氧状态;在原位温度条件下, 避光旋转预培养24 h;按照实验分组分别加入100 μL 15N标记或未标记溶液(15N终浓度为100 μmol·L-1), 于暗处进行旋转培养, 其中, 阴性对照:(15NH4)2SO4;阳性对照:(15NH4)2SO4+Na14NO3;实验组:Na15NO3 +(14NH4)2SO4.分别在0、3、6、9、12、24 h时加入200 μL终止剂(7 mol·L-1 ZnCl2)终止反应, 每个时间点设2~3个平行.培养结束后用6 mL Ar取代泥水混合物.采用IRMS(MAT253 Plus and Gasbench II, Thermofisher Scientific, Germany)测定29N2和30N2.测定结束后取回Labco小瓶, 加入5 mL 0.01 mol·L-1 CaCl2浸提2 h, 静置后取上清液3 mL, 加入新Labco瓶中, 交替抽换气以去除瓶内29N2和30N2;加入3 mL 0.1 mol·L-1 NaBrO旋转培养12 h以上, 将15NH4+充分氧化为30N2;倒置Labco瓶, 采用IRMS测定30N2, 依据测定结果计算潜在DNRA速率.
潜在N2O释放速率测定方法与上述方法类似, 预培养结束后取16个Labco瓶加入(14NH4)2SO4和14NO3Na溶液(最终添加的14NH4+和14NO3-浓度为100 μmol·L-1), 在设定好的培养时间(0、3、6、9、12、24 h)加入200 μL终止剂(7 mol·L-1 ZnCl2)终止反应.培养结束后通入6 mL高纯Ar气置换泥水混合物, 平压后将Labco顶空瓶置于旋转培养仪上高速剧烈摇晃1 h, 使Labco瓶内气液相达到平衡, 用针式取样器抽取2 mL气体转移至新的真空Labco瓶中, 再加入18 mL高纯Ar气.N2O采用自动进样技术使用气相色谱仪(Gas Chromatograph, 安捷伦7890A, 美国)进行检测.
沉积物潜在反硝化、anammox、DNRA、N2O释放速率计算公式如下:
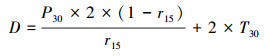 | (1) |
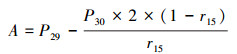 | (2) |
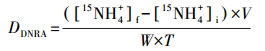 | (3) |
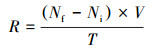 | (4) |
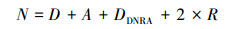 | (5) |
2.3 DNA提取及高通量测序取0.25 g已冻干土样, 按照试剂盒(DNeasy Power Soil Kit, QIAGEN, Hilden, North Rhine-Westphalia, Germany)说明书对样品进行总DNA提取.每个样点提取3个样品用于后续实验.提取后的DNA质量采用浓度为1%的琼脂糖凝胶进行凝胶电泳检查, 如出现明亮而清晰的条带, 说明该样品DNA提取成功.所有DNA样品被送至上海美吉生物科技有限公司(Shanghai Majorbio Bio-Pharm Technology Co., Ltd, China), 使用通用引物515F和806R对16S rRNA基因的V4区进行扩增(Caporaso et al., 2012), 基于Illumina MiSeq测序平台(Illumina, Inc., San Diego, CA, USA)进行双末端测序.测序所得原始下机数据已上传NCBI Sequence Read Archive, 项目登录号为PRJNA718976.
2.4 实时荧光定量PCR实时荧光定量PCR采用SYBR Green Ⅰ染料法, 所用试剂为SYBR Premix Ex Taq TM试剂盒(天根, 北京), 基因定量使用Roche Real-Time PCR扩增仪.qPCR反应体系为20 μL体系:SYBR Green染料10 μL, DNA 2 μL, 前引物和后引物各0.4 μL(最终浓度为0.2 μmol·L-1), 双蒸水7.2 μL;每个样品设置3个平行, 采用Roche配套软件进行数据处理.实验标准品扩增效率介于90%~110%, 标准曲线相关性大于0.98, 扩增溶解曲线均为单一峰.
表 1(Table 1)
| 表 1 引物及相应qPCR反应程序 Table 1 Primers and correspondent qPCR reaction profiles | ||||||||||||||||||||||||||||||
表 1 引物及相应qPCR反应程序 Table 1 Primers and correspondent qPCR reaction profiles
| ||||||||||||||||||||||||||||||
2.5 数据分析测序完成后的下机数据经去杂、去引物和去接头得到clean data, 使用QIIME2官方pipeline中的Dada2合并双端数据并去除嵌合体和冗余序列(Bolyen et al., 2019), 生成扩增子序列变异(amplicon sequence variants, ASVs), 基于Silva数据库进行物种注释(Quast et al., 2012;Yilmaz et al., 2014), 使用QIIME2中的qiime diversity core-metrics-phylogenetic脚本分析样品微生物多样性.R中使用psych包(Revelle, 2020)计算沉积物氮转化过程速率与相关功能基因丰度和微生物组成的相关关系(显著性水平α<0.05), 分析结果采用pheatmap包(Kolde, 2019) 绘图.其余绘图主要使用Origin9.1完成.
3 结果(Results)3.1 潮白河沉积物中氮还原速率特征潮白河沉积物中各氮还原过程速率表现出空间异质性, 不同样点速率存在较大差异(图 2).沉积物潜在反硝化速率为(25.82±0.98)~(142.32±17.06) nmol·g-1·h-1, 农业区样点(C)速率最高而城区样点(B)速率最低.沉积物潜在anammox速率为(0.58±0.10)~(4.51±0.78) nmol·g-1·h-1, 其中, 速率最高的是农业区样点(C), 速率最低样点则位于山区(A). 潮白河沉积物潜在反硝化和anammox速率与Li等(2021)使用同样方法监测所得闽江沉积物中潜在反硝化和anammox速率范围相当, 但比Chen等(2019)测得长江沉积物中反硝化和anammox速率高1~2个数量级.沉积物潜在DNRA速率为(2.91±0.46)~(19.59±4.15) nmol·g-1·h-1, 与潜在反硝化和anammox速率一致, 农业区样点(C)DNRA速率最高, 而最低速率则位于河口样点(D).与Wei等(2020)测得上海城区河网沉积物潜在DNRA速率相比, 潮白河沉积物潜在DNAR速率较高.潮白河沉积物潜在N2O释放速率为(-1.09±0.17)~(3.30±0.57) nmol·g-1·h-1, 山区样点(A)潜在N2O释放速率最大, 而河口区样点(D)潜在N2O释放速率最小.目前潮白河沉积物氮还原速率从上游到下游分别为50.52、37.13、164.61、29.47 nmol·g-1·h-1, 不同区域样点沉积物氮还原速率差异较大.与之前的研究相比, 潮白河沉积物山区样点(A)和城区样点(B)存在较高的N2O释放潜势, 在当前减缓气候变化的时代背景下, 潮白河山区和城区河段潜在N2O释放风险值得进一步重视(Zhao et al., 2018; 高娟, 2019).
图 2(Fig. 2)
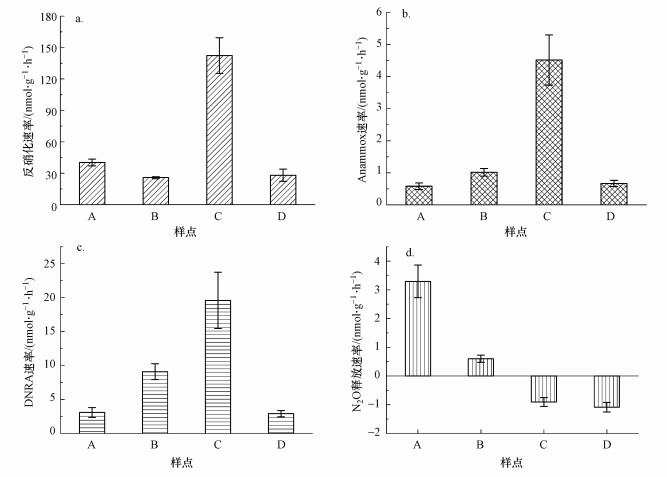 |
| 图 2 潮白河沉积物中潜在氮还原过程和N2O释放速率 Fig. 2Potential nitrogen reduction and N2O release rates in sediments of Chaobai River |
3.2 潮白河沉积物氮还原过程贡献率如图 3所示, 潮白河沉积物中反硝化、anammox、DNRA过程对沉积物中NO3--N还原的贡献率在不同样点存在较大差异, 但各个样点均以反硝化作用为主.反硝化作用对潮白河沉积物中NO3--N还原贡献率达到71.86%~91.65%, 贡献率最高在山区样点(A), 而贡献率最低在城区样点(B).DNRA过程对潮白河沉积物中NO3--N还原也存在较大贡献, 贡献率为7.03%~25.32%, 在城区样点(B)DNRA过程贡献率最高, 而在山区样点(A)贡献率最低.Anammox过程对潮白河沉积物中NO3-N还原贡献率较低, 最高贡献率仅为2.83%(城区样点(B)), 最低贡献率则出现在山区样点(A).
图 3(Fig. 3)
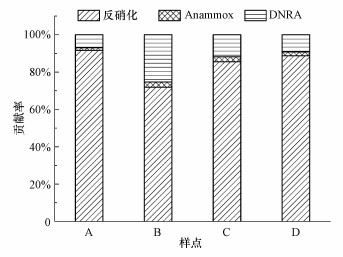 |
| 图 3 潮白河沉积物中氮还原过程对NO3--N还原的贡献率 Fig. 3Contribution of each nitrogen reduction process to NO3--N reduction in sediments of Chaobai River |
3.3 沉积物氮还原功能基因丰度潮白河沉积物中与氮还原过程相关的功能基因丰度在不同区域采样点间存在较大差异(图 4).沉积物中narG基因丰度为(1.04±0.05)×104~(4.00±0.31)×105 copies·g-1, 农业区样点(C)基因丰度最高而河口区样点(D)基因丰度最低.沉积物中nirS基因丰度为(2.95±0.08)×103~(2.35±0.13)×106 copies·g-1, 基因丰度在山区样点(A)最高而在河口区样点(D)最低.沉积物nosZ基因丰度为(1.81±0.03)×105~(4.50±0.68)×106 copies·g-1, 农业区样点(C)基因丰度最高而山区样点(A)基因丰度最低, nosZ在各样点基因丰度差异相比narG和nirS差异较小.沉积物中hzsB基因丰度为(5.16±1.23)×103~(4.57±0.21)×105 copies·g-1, 基因丰度在农业区样点(C)最高而在城区样点(B)最低.沉积物中nrfA基因丰度为(2.95±0.14)×103~(1.50±0.15)×104 copies·g-1, 其基因丰度在农业区样点(C)最高而在山区样点(A)最低.
图 4(Fig. 4)
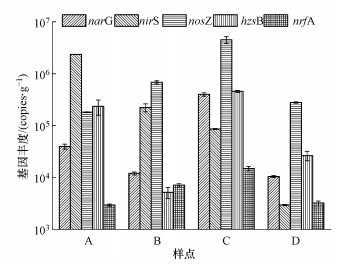 |
| 图 4 潮白河沉积物中氮还原过程相关功能基因丰度 Fig. 4Abundance of functional genes related to nitrogen reduction process in sediments of Chaobai River |
3.4 沉积物的潜在氮还原速率与相关功能基因丰度的相关关系采用Pearson相关性分析探讨潮白河沉积物中氮还原过程速率与相关功能基因丰度的相关关系.如图 5所示, 潮白河沉积物的潜在反硝化速率与narG基因丰度存在显著的正相关关系(r=0.999, p < 0.01), 与nosZ基因丰度也存在显著正相关关系(r=0.979, p < 0.05), 与nrfA和hzsB基因丰度则并不存在显著的相关关系(p>0.05).沉积物的潜在anammox速率与narG、nosZ和nrfA基因丰度均存在显著的正相关关系(r=0.988, p < 0.05; r=1.000, p < 0.01; r=0.969, p < 0.05), 与直接控制anammox过程相关酶合成的hzsB基因丰度不存在显著的正相关关系(p>0.05).沉积物潜在DNRA速率与nrfA和nosZ基因丰度存在显著的正相关关系(r=0.999, p < 0.01; r=0.962, p < 0.05), 与narG、nirS和hzsB基因丰度存则并不存在显著的相关关系(p>0.05).沉积物的潜在N2O释放速率与nirS基因丰度则存在显著的正相关关系(r=0.953, p < 0.05), 与nrfA、nosZ和narG基因丰度的相关关系则并不显著(p>0.05).
图 5(Fig. 5)
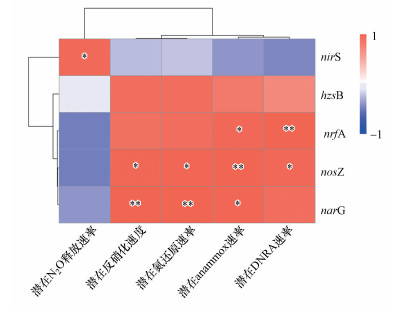 |
| 图 5 沉积物氮还原过程速率与相关功能基因丰度的Pearson相关关系(相关系数r介于-1~1之间, *表示显著性检验p < 0.05, **表示显著性检验p < 0.01, n=4) Fig. 5Pearson correlation between nitrogen reduction rates and the abundance of related functional genes in sediments(The correlation coefficient r is between -1 and 1, * means significant test p < 0.05, ** means significant test p < 0.01, n=4) |
3.5 潮白河沉积物中微生物群落结构本研究选用Faith_pd指数(系统发育多样性)、Shannon指数(物种多样性指数)、Obseved features(物种多样性指数)、Pielous指数(物种均匀度指数)评估潮白河沉积物中微生物多样性(王鹏等, 2021).如表 2所示, 潮白河沉积物中微生物α多样性差异较小, Faith_pd指数在河口区样点(D)最高, 在农业区样点(C)最低;Shannon指数在山区样点(A)最高, 在农业区样点(C)最低;群落Observed features在山区样点(A)最高, 在农业区样点(C)最低;物种均匀度Pielous指数在山区样点(A)和城区样点(B)最高, 在河口区样点(D)最低.
表 2(Table 2)
| 表 2 潮白河沉积物中微生物α多样性 Table 2 Alpha diversity of microbiome in sediments of Chaobai River | |||||||||||||||||||||||||
表 2 潮白河沉积物中微生物α多样性 Table 2 Alpha diversity of microbiome in sediments of Chaobai River
| |||||||||||||||||||||||||
对16S rRNA测序数据经Qiime2质控去噪得到ASVs, 基于SILVA数据库(SSU 138)在99%相似度水平上进行物种注释(Bokulich et al., 2018), 不同采样区样点微生物相对丰度取平均值, 绘图在Origin Pro9.1中完成(图 6).所有样品ASVs经注释共得到62个门类(phylum), 选取相对丰度前10的门类进行分析(图 6a), 潮白河沉积物中各采样区样点微生物群落结构存在一定差异.山区样点(A)中变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、拟杆菌门(Bacteroidota)占主导地位, 平均丰度分别为40.8%、7.8%、10.6%、10.2%和12.9%.城区样点(B)变形菌门(17.1%)和拟杆菌门(6.2%)相对丰度较山区样点低, 但绿弯菌门(22.5%)、放线菌门(18.4%)、酸杆菌门(16.3%)相对丰度更高.农业区样点(C)群落结构与城区样点B较相似, 以变形菌门(16.3%)、绿弯菌门(26.7%)、放线菌门(14.5%)、硬壁菌门(Firmicutes, 7.6%)占据主导地位.河口区样点(D)微生物群落组成则与A、B、C样点差异较大, 群落中变形菌门(21.7%)、绿弯菌门(13.0%)、拟杆菌门(7.3%)相对丰度仍较高, 但在其他样点中相对丰度较低的弯曲杆菌门(Campilobacterota, 15.9%)、脱硫菌门(Desulfobacterota, 7.7%)相对丰度则较高.
图 6(Fig. 6)
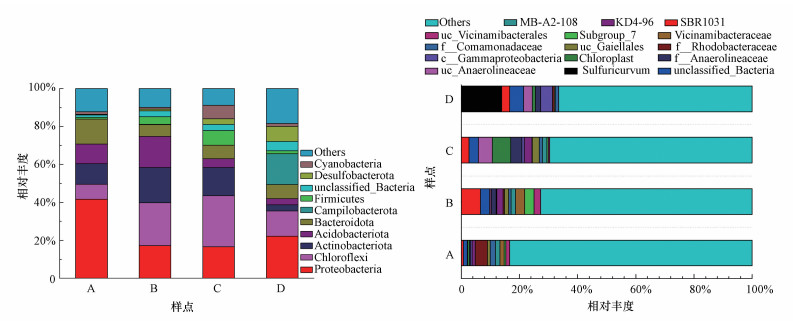 |
| 图 6 潮白河沉积物微生物群落组成 (a.门水平, b.平均相对丰度大于1%的ASVs)(uc:未培养的) Fig. 6Composition of microbial community in sediments of Chaobai River(a.phylum level, b.ASVs with an average relative abundance greater than 1%)(uc: uncultured) |
基于对ASVs的注释结果, 选取所有样点中平均相对丰度大于1%的ASVs进行分析, 得到15种优势ASVs(图 6b).从注释结果来看, 各优势ASVs相对丰度在各样点中均较低, 平均相对丰度超过1%的ASVs的丰度总和在各样点中均未超过40%.河口样点(D)中相对丰度最高的硫氧化菌属(Sulfuricurvum, 13.9%)在样点A、B中均未检出, 在样点C中丰度也极低(0.02%), 这可能与河口沉积物受到海洋潮汐的影响有关(Li et al., 2021).在城区样点(B)中, SBR1031相对丰度最高, 农业区样点(C)中未分类的厌氧绳菌科(uc_ Anaerolineaceae, 4.8%)相对丰度最高, 在山区样点(A)中则是红杆菌科(f__Rhodobacteraceae)具有最高的相对丰度.
4 讨论(Discussion)4.1 潮白河沉积物中功能基因丰度与氮还原过程速率的相关关系自然界中发生的氮循环过程主要由微生物驱动完成, 控制不同形态氮素发生转化的酶受到相关基因的调控(Kuypers et al., 2018; Li et al., 2021).在硝态氮还原过程中, NO3-还原为NO2-需要被硝酸盐还原酶(NAR)催化, 该过程主要受narG调控(Schwarz et al., 2009;Glass et al., 2012).反硝化过程中, NO2-进一步还原为NO需要分别被nirS和nirK基因编码的亚铁血红素(cd1)和铜辅助亚硝酸盐还原酶(NIR)催化完成(Einsle et al., 1999), 催化NO进一步还原为N2O主要由norB编码调控的一氧化氮还原酶(NOR)完成(Shiro et al., 2012), 最终N2O被还原为N2释放到大气中也需nosZ编码调控的一氧化二氮还原酶参与(Kuypers et al., 2018).DNRA过程中, NO2-被异化还原为NH4+主要受到nrfA编码的细胞色素c亚硝酸盐还原酶(ccNIR)调控(Li et al., 2021), 而anammox过程中, 厌氧条件下NO2-氧化NH4+生成N2H4主要受到hzsB基因编码的HZS酶调控(Lam et al., 2011).
本研究中, 如图 5所示, 潮白河沉积物中多个氮还原过程与相关功能基因丰度存在显著的正相关关系.沉积物潜在氮还原、反硝化、anammox和DNRA速率均与narG基因丰度存在极强的正相关关系(r>0.9), 且潜在反硝化和anammox速率与之呈显著正相关, 表明潮白河沉积物中发生的氮还原过程所需的底物NO2-可能主要由NO3-还原提供.沉积物潜在DNRA和anammox速率与nrfA存在显著的正相关关系(r>0.95, p < 0.05), 表明沉积物中发生的DNRA过程主要受nrfA基因丰度的控制, 而DNRA过程的产物可能为沉积物中发生的anammox过程提供了底物NH4+(Wang et al., 2020).沉积物潜在氮还原和反硝化速率与nosZ基因丰度存在显著的正相关关系, 主要是由于潮白河沉积物氮还原过程以反硝化作用占据主导, 而反硝化产生N2的速率直接受到nosZ编码的一氧化二氮还原酶催化.沉积物潜在anammox和DNRA速率与nosZ基因丰度亦存在显著正相关关系, 表明参与这几个过程的菌群间可能存在协同作用(Wang et al., 2020).沉积物中潜在N2O释放速率与nirS基因丰度存在显著的正相关关系, 表明nirS基因编码的亚硝酸盐还原酶(NIR)对N2O释放的控制, NIR催化NO2-还原生成NO, 而NO为N2O生成的前驱物.
4.2 微生物群落组成与潮白河沉积物中氮还原速率的相关关系自然界中参与氮还原过程的微生物具有极高的多样性, 而不同种微生物对于生长都有不同的需求, 在环境差异极大的自然条件下, 单种微生物往往不能高效地完成氮转化过程(Kuypers et al., 2018).因此, 环境中发生的氮还原过程一般都是由多种微生物组成的微生物群落完成, 主要包括反硝化作用、anammox和DNRA过程(Zhu et al., 2018).目前, 能够催化反硝化作用的类群在细菌、古菌、真菌和原生动物中都有发现(Li et al., 2021), 很多属的细菌(主要是变形菌门和硬壁菌门)能够在厌氧条件下催化反硝化过程(Guo et al., 2018; Zou et al., 2018), 在极端环境中也发现了多种存在反硝化代谢途径的古菌和真菌(Torregrosa-Crespo et al., 2019).如图 7所示, 潮白河沉积物潜在N2O释放速率与疣微菌纲(Verrucomicrobiae)相对丰度存在显著的正相关关系, 与脱硫杆菌门(Desulfobacterota)相对丰度存在显著的负相关关系.Ward等(2020)研究表明, 脱硫杆菌门的部分菌属能够在厌氧条件下将硫酸盐还原, 该过程会与NO2-竞争电子供体, 会抑制沉积物中NO2-还原产生N2O的过程.已知的参与anammox过程的细菌均属于浮霉菌门(Planctomycetes), 主要包括Ca. Brocadia、Ca. Jettenia、Ca. Scalindua、Ca. Kuenenia和Ca. Anammxoglobus(Wang et al., 2020), 但本研究中沉积物潜在anammox速率和浮霉菌门相对丰度的相关关系并不显著, 这可能是因为相关菌群丰度并不是潮白河沉积物anammox过程的限制因素.沉积物潜在anammox速率与硬壁菌门和绿弯菌门相对丰度存在显著的正相关关系, 与α-变形菌纲存在显著的负相关关系, 这可能是因为硬壁菌门的部分菌群能够还原NO3-, 而绿弯菌门的部分菌群能够氧化沉积物中的NH4+, 这两个过程均能为anammox提供底物NO2-, 而α-变形菌纲中的反硝化菌属会与anammox菌群竞争反应底物(Wyman et al., 2013;Vilar-Sanz et al., 2018).DNRA过程可由大多数细菌谱系的成员完成, 比如γ-变形菌纲、甲烷氧化古菌、硅藻和真菌等(Kuypers et al., 2018).本研究中沉积物潜在DNRA速率与硝基螺旋菌纲(Nitrospiria)相对丰度存在显著的负相关关系, 已有研究表明硝基螺旋菌纲主要生存在富氧环境, 而催化完成DNRA过程的相关菌群主要生活在厌氧和缺氧环境(Jiang et al., 2020).此外, 硝基螺旋菌纲的相关菌属主要参与完成环境中NO2-氧化和完全氨氧化过程, 该过程会与DNRA过程竞争反应底物(Daims et al., 2015;Anantharaman et al., 2018).
图 7(Fig. 7)
 |
| 图 7 潮白河沉积物中氮还原过程与微生物群落组成的Spearman相关关系(n=4) Fig. 7Spearman correlation between nitrogen reduction rates and microbial community composition in sediments of Chaobai River(n=4) |
已有研究表明, 沉积物中有机质含量、无机氮(NO3-、NO2-、NH4+)含量也对氮转化速率存在较大影响(Mulder et al., 1995; Wang et al., 2019).潮白河不同区段沉积物氮还原速率存在较大差异, 除氮转化功能基因丰度和微生物群落组成外, 不同区段理化性质差异对沉积物氮还原速率也存在一定影响.依据Liao等对潮白河的研究结果, 农业区(C)氮还原速率最高可能是由于农业区河段具有更高的TP、NH4+-N含量, 而城区样点(B)DNRA对氮还原过程的高贡献率可能是因为该河段DOC含量显著高于山区和农业区, 而高C/N比有利于DNRA菌群的生长(Liao et al., 2018; Pan et al., 2020).
5 结论(Conclusions)1) 潮白河不同区段沉积物氮还原过程速率存在显著差异, 沉积物潜在反硝化、anammox、DNRA和N2O释放速率分别为(25.82±0.98)~(142.32±17.06)、(0.58±0.10)~(4.51±0.78)、(2.91±0.46)~(19.59±4.15)和(-1.09±0.17)~(3.30±0.57) nmol·g-1·h-1.沉积物氮还原过程以反硝化作用为主(贡献率71.86%~91.65%), DNRA也有较高的贡献率(7.03%~25.32%), anammox过程贡献则较小.
2) 相关分析结果表明, 沉积物氮循环功能基因丰度与沉积物中多个氮还原过程的速率存在显著的相关关系, 微生物群落中α-变形菌纲、硝基螺旋菌纲、疣微菌纲、脱硫杆菌门、硬壁菌门菌群丰度与沉积物中氮还原速率也存在显著的相关关系.
参考文献
| Anantharaman K, Hausmann B, Jungbluth S P, et al. 2018. Expanded diversity of microbial groups that shape the dissimilatory sulfur cycle[J]. The ISME Journal, 12(7): 1715-1728. DOI:10.1038/s41396-018-0078-0 |
| Bokulich N A, Kaehler B D, Rideout J R, et al. 2018. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2's q2-feature-classifier plugin[J]. Microbiome, 6(1), https://doi.org/10.1186/s40168-018-0470-z |
| Bolyen E, Rideout J R, Dillon M R, et al. 2019. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology, 37(8): 852-857. DOI:10.1038/s41587-019-0209-9 |
| Burgin A J, Hamilton S K. 2007. Have we overemphasized the role of denitrification in aquatic ecosystems? A review of nitrate removal pathways[J]. Frontiers in Ecology and the Environment, 5(2): 89-96. DOI:10.1890/1540-9295(2007)5[89:HWOTRO]2.0.CO;2 |
| Canfield D E, Glazer A N, Falkowski P G. 2010. The evolution and future of Earth's nitrogen cycle[J]. Science, 330(6001): 192-196. DOI:10.1126/science.1186120 |
| Caporaso J G, Lauber C L, Walters W A, et al. 2012. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. ISME Journal, 6(8): 1621-1624. DOI:10.1038/ismej.2012.8 |
| Chen L, Liu S, Chen Q, et al. 2019. Anammox response to natural and anthropogenic impacts over the Yangtze River[J]. Science of the Total Environment, 665: 171-180. DOI:10.1016/j.scitotenv.2019.02.096 |
| Daims H, Lebedeva E V, Pjevac P, et al. 2015. Complete nitrification by Nitrospira bacteria[J]. Nature, 528(7583): 504-509. DOI:10.1038/nature16461 |
| Einsle O, Messerschmidt A, Stach P, et al. 1999. Structure of cytochrome c nitrite reductase[J]. Nature, 400(6743): 476-480. DOI:10.1038/22802 |
| Glass J B, Orphan V J. 2012. Trace metal requirements for microbial enzymes involved in the production and consumption of methane and nitrous oxide[J]. Frontiers in Microbiology, 3: 61. |
| Guo Q, Li N, Bing Y, et al. 2018. Denitrifier communities impacted by heavy metal contamination in freshwater sediment[J]. Environmental Pollution, 242(Pt A): 426-432. |
| 高娟. 2019. 河口潮滩湿地沉积物反硝化过程及其功能微生物菌群动态研究[D]. 上海: 华东师范大学 |
| Jiang X, Gao G, Zhang L, et al. 2020. Denitrification and dissimilatory nitrate reduction to ammonium in freshwater lakes of the Eastern Plain, China: Influences of organic carbon and algal bloom[J]. Science of the Total Environment, 710: 136303. DOI:10.1016/j.scitotenv.2019.136303 |
| Kolde R. 2019. pheatmap: Pretty Heatmaps[Z]. R package |
| Kuypers M M M, Marchant H K, Kartal B. 2018. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| Lam P, Kuypers M M. 2011. Microbial nitrogen cycling processes in oxygen minimum zones[J]. Ann Rev Mar Sci, 3: 317-345. DOI:10.1146/annurev-marine-120709-142814 |
| Lam P, Lavik G, Jensen M M, et al. 2009. Revising the nitrogen cycle in the peruvian oxygen minimum zone[J]. Proceedings of the National Academy of Sciences-PNAS, 106(12): 4752-4757. DOI:10.1073/pnas.0812444106 |
| Li W, Shi C, Yu Y, et al. 2021. Interrelationships between tetracyclines and nitrogen cycling processes mediated by microorganisms: A review[J]. Bioresour Technol, 319: 124036. DOI:10.1016/j.biortech.2020.124036 |
| Li X, Gao D, Hou L, et al. 2021. Nitrogen loads alter the N2 production between denitrification and anammox in Min River Estuary, a highly impacted estuary in southeast China[J]. Environmental Pollution, 277: 116757. DOI:10.1016/j.envpol.2021.116757 |
| Liao K, Bai Y, Huo Y, et al. 2018. Integrating microbial biomass, composition and function to discern the level of anthropogenic activity in a river ecosystem[J]. Environment International, 116: 147-155. DOI:10.1016/j.envint.2018.04.003 |
| Liao K, Bai Y, Huo Y, et al. 2019. Use of convertible flow cells to simulate the impacts of anthropogenic activities on river biofilm bacterial communities[J]. Science of the Total Environment, 653: 148-156. DOI:10.1016/j.scitotenv.2018.10.363 |
| López-Gutiérrez J C, Henry S, Hallet S, et al. 2004. Quantification of a novel group of nitrate-reducing bacteria in the environment by real-time PCR[J]. Journal of Microbiological Methods, 57(3): 399-407. DOI:10.1016/j.mimet.2004.02.009 |
| Mulder A, Graaf A A V D, Robertson L A, et al. 1995. Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed reactor[J]. Fems Microbiology Ecology, 16(3), https://doi.org/10.1111/j.1574-6941.1995.tb00281.x |
| Pan H, Qin Y, Wang Y, et al. 2020. Dissimilatory nitrate/nitrite reduction to ammonium(DNRA) pathway dominates nitrate reduction processes in rhizosphere and non-rhizosphere of four fertilized farmland soil[J]. Environmental Research, 186: 109612. DOI:10.1016/j.envres.2020.109612 |
| Peng X, Ji Q, Angell J H, et al. 2016. Long-term fertilization alters the relative importance of nitrate reduction pathways in salt marsh sediments[J]. Journal of Geophysical Research: Biogeosciences, 121(8): 2082-2095. DOI:10.1002/2016JG003484 |
| Quast C, Pruesse E, Yilmaz P, et al. 2012. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 41(D1): D590-D596. DOI:10.1093/nar/gks1219 |
| Revelle W. 2020. psych: Procedures for Personality and Psychological Research[Z]. R package |
| Risgaard Petersen N, Nielsen L P, Rysgaard S, et al. 2003. Application of the isotope pairing technique in sediments where anammox and denitrification coexist[J]. Limnology & Oceanography Methods, 1(1): 63-73. |
| Schwarz G, Mendel R R, Ribbe M W. 2009. Molybdenum cofactors, enzymes and pathways[J]. Nature, 460(7257): 839-847. DOI:10.1038/nature08302 |
| Shiro Y, Sugimoto H, Tosha T, et al. 2012. Structural basis for nitrous oxide generation by bacterial nitric oxide reductases[J]. Philos Trans R Soc Lond B Biol Sci, 367(1593): 1195-1203. DOI:10.1098/rstb.2011.0310 |
| Song G D, Liu S M, Kuypers M M M, et al. 2016. Application of the isotope pairing technique in sediments where anammox, denitrification, and dissimilatory nitrate reduction to ammonium coexist[J]. Limnology and Oceanography: Methods, https://doi.org/10.1002/lom3.10127 |
| Throb? Ck I N, Enwall K, Jarvis ? S, et al. 2004. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. Fems Microbiology Ecology, 49(3): 401-417. DOI:10.1016/j.femsec.2004.04.011 |
| Torregrosa-Crespo J, Pire C, Martinez-Espinosa R M, et al. 2019. Denitrifying haloarchaea within the genus Haloferax display divergent respiratory phenotypes, with implications for their release of nitrogenous gases[J]. Environmental Microbiology, 21(1): 427-436. |
| Vilar-Sanz A, Pous N, Puig S, et al. 2018. Denitrifying nirK-containing alphaproteobacteria exhibit different electrode driven nitrite reduction capacities[J]. Bioelectrochemistry, 121: 74-83. DOI:10.1016/j.bioelechem.2018.01.007 |
| Wang S Y, Pi Y X, Song Y P, et al. 2020. Hotspot of dissimilatory nitrate reduction to ammonium(DNRA) process in freshwater sediments of riparian zones[J]. Water Research, 173: 11. |
| Wang S Y, Wang W D, Zhao S Y, et al. 2019. Anammox and denitrification separately dominate microbial N-loss in water saturated and unsaturated soils horizons of riparian zones[J]. Water Research, 162: 139-150. DOI:10.1016/j.watres.2019.06.052 |
| Wang S, Wang Y, Feng X, et al. 2011. Quantitative analyses of ammonia-oxidizing Archaea and bacteria in the sediments of four nitrogen-rich wetlands in China[J]. Applied Microbiology and Biotechnology, 90(2): 779-787. DOI:10.1007/s00253-011-3090-0 |
| Wang S, Zhu G, Zhuang L, et al. 2020. Anaerobic ammonium oxidation is a major N-sink in aquifer systems around the world[J]. ISME Journal, 14(1): 151-163. DOI:10.1038/s41396-019-0513-x |
| Ward L M, Bertran E, Johnston D T, et al. 2020. Draft genome sequence of Desulfovibrio sulfodismutans ThAc01, a heterotrophic sulfur-disproportionating member of the Desulfobacterota[J]. Microbiology resource announcements, 9(13). |
| Wei H, Gao D, Liu Y, et al. 2020. Sediment nitrate reduction processes in response to environmental gradients along an urban river-estuary-sea continuum[J]. Science of the Total Environment, 718: 137185. DOI:10.1016/j.scitotenv.2020.137185 |
| Wyman M, Hodgson S, Bird C. 2013. Denitrifying alphaproteobacteria from the arabian sea that express nosZ, the gene encoding nitrous oxide reductase, in oxic and suboxic waters[J]. Applied and Environmental Microbiology, 79(8): 2670-2681. DOI:10.1128/AEM.03705-12 |
| 王鹏, 柏耀辉, 毛冠男, 等. 2021. 膜组合工艺对地下水中铀的去除及其微生物群落特征[J]. 环境科学学报, 41(2): 469-476. |
| Xi B, Yu H, Li Y, et al. 2021. Insights into the effects of heavy metal pressure driven by long-term treated wastewater irrigation on bacterial communities and nitrogen-transforming genes along vertical soil profiles[J]. Journal of Hazardous Materials, 403: 123853. DOI:10.1016/j.jhazmat.2020.123853 |
| Yilmaz P, Parfrey L W, Yarza P, et al. 2014. The SILVA and "All-species Living Tree Project(LTP)" taxonomic frameworks[J]. Nucleic Acids Research, 42(Database issue): D643-D648. |
| Zhao S, Wang Q, Zhou J, et al. 2018. Linking abundance and community of microbial N2O-producers and N2O-reducers with enzymatic N2O production potential in a riparian zone[J]. Science of the Total Environment, 642: 1090-1099. DOI:10.1016/j.scitotenv.2018.06.110 |
| Zhu G, Wang S, Li Y, et al. 2018. Microbial pathways for nitrogen loss in an upland soil[J]. Environmental Microbiology, 20(5): 1723-1738. DOI:10.1111/1462-2920.14098 |
| Zou Y, Lin M, Xiong W, et al. 2018. Metagenomic insights into the effect of oxytetracycline on microbial structures, functions and functional genes in sediment denitrification[J]. Ecotoxicology Environment Safe, 161: 85-91. DOI:10.1016/j.ecoenv.2018.05.045 |
