 , 黄超1,2
, 黄超1,2
 , 王平1,2
, 王平1,2
 , 曾峤婧1,2, 沈璐1, 杨雄1,2, 郑小雨1,2
, 曾峤婧1,2, 沈璐1, 杨雄1,2, 郑小雨1,21. 中南林业科技大学环境科学与工程学院, 长沙 410004;
2. 稻米品质安全控制湖南省工程实验室, 长沙 410004
收稿日期: 2021-03-22; 修回日期: 2021-04-30; 录用日期: 2021-04-30
基金项目: 国家自然科学基金(No.51809293);国家重点研发计划(No.2016YFD0800805-4);湖南省自然科学基金(No.2019JJ50989,2018JJ3886);湖南省重点研发计划(No.2020SK2039);中国博士后基金面上资助项目(No.2018M633004);湖南省教育厅优秀青年基金(No.19B588)
作者简介: 谭媛(1995-), 女, E-mail: 1072810865@qq.com
通讯作者(责任作者): 黄超(1986—), 男, 讲师, 硕士生导师, 主要从事水体与土壤重金属污染修复技术研究.E-mail: huangchao@csuft.edu.cn. 黄超, E-mail: huangchao@csuft.edu.cn
王平(1964—), 男, 教授, 博士生导师, 主要从事土水污染控制与环境生物技术研究.E-mail: csfuwp@163.com. 王平, E-mail: csfuwp@163.com
摘要:基于老化对纳米零价铁(NZVI)去除水中Cr(Ⅵ)的不利影响,本研究考察了接种嗜水气单胞菌(Aeromonas hydrophila)强化老化NZVI对水中Cr(Ⅵ)的去除,并分析了溶解氧、温度、pH、Cr(Ⅵ)初始浓度对其去除Cr(Ⅵ)的影响,同时利用扫描电镜(SEM)、X射线光电子能谱(XPS)等分析了反应前后材料的形貌特征及Cr的价态变化.结果表明,接种嗜水气单胞菌能显著提高无氧条件下老化NZVI对Cr(Ⅵ)的去除效果,且在酸性条件和30~40 ℃条件下去除效果较好,可能是因为该条件下更有利于老化NZVI的腐蚀和微生物的生长,此外,Cr(Ⅵ)去除效率随Cr(Ⅵ)初始浓度升高而降低.在pH=6,温度为30 ℃,老化nZVI投加量为0.1 g·L-1,Cr(Ⅵ)初始浓度为50 mg·L-1的条件下反应24 h后,Cr(Ⅵ)的去除率可达到100%.XPS分析表明,反应后NZVI表面沉积的Cr主要以Cr(Ⅲ)的形式存在,可能为Cr(OH)3沉淀或FexCr1-x(OH)3共沉淀物.动力学研究发现,Cr(Ⅵ)去除过程符合准二级动力学,去除机制为Cr(Ⅵ)的吸附、还原与共沉淀,其中以还原作用为主.
关键词:纳米零价铁老化嗜水气单胞菌Cr(Ⅵ)
Activation of aged nano zero-valent iron by Aeromonas hydrophila to enhance the removal of Cr(Ⅵ) from aqueous solution
TAN Yuan1,2
 , HUANG Chao1,2
, HUANG Chao1,2
 , WANG Ping1,2
, WANG Ping1,2
 , ZENG Qiaojing1,2, SHEN Lu1, YANG Xiong1,2, ZHENG Xiaoyu1,2
, ZENG Qiaojing1,2, SHEN Lu1, YANG Xiong1,2, ZHENG Xiaoyu1,21. College of Environmental Science and Engineering, Central South University of Forestry and Technology, Changsha 410004;
2. Hunan Engineering Laboratory for Control of Rice Quality and Safety, Changsha 410004
Received 22 March 2021; received in revised from 30 April 2021; accepted 30 April 2021
Abstract: Based on the aging effects of nano zero-valent iron (NZVI) on Cr(Ⅵ) removal from aqueous solution, this study investigated the activation of aged nano zero-valent iron by Aeromonas hydrophila to enhance the removal of Cr(Ⅵ) from aqueous solution, and examined the effects of dissolved oxygen, temperature, pH, initial Cr(Ⅵ) concentration on Cr(Ⅵ) removal, and analyzed the morphological characteristics of the material as well as the valence change of the Cr before and after the reaction by scanning electron microscopy (SEM) and X-ray photoelectron spectroscopy (XPS). The results showed that inoculation of Aeromonas hydrophila significantly improved the performance of aged NZVI on Cr(Ⅵ) removal under anaerobic conditions, and the removal efficiency was significantly enhanced under acidic conditions and the temperature of 30 to 40 ℃, possibly because these conditions were more conducive for the corrosion of aged NZVI and the growth of the microorganism, and the removal efficiency of Cr(Ⅵ) decreased with the initial concentration of Cr(Ⅵ). The removal efficiency of 50 mg·L-1 Cr(Ⅵ) after 24 h reached 100% at the conditions of pH 6, aged NZVI dosage of 0.1 g·L-1 and 30 ℃. XPS analysis shows that Cr(Ⅲ) was the main form deposited on the surface of NZVI after the reaction, which may be Cr(OH)3 or FexCr1-x(OH)3. The Cr(Ⅵ) removal process was found to follow the pseudo second-order kinetic model, and the removal mechanism involved adsorption, reduction and co-precipitation, which was dominated by reduction.
Keywords: nano zero-valent ironagingAeromonas hydrophilaCr(Ⅵ)
1 引言(Introduction)铬及其化合物是冶金、电镀、印染、陶瓷、木材防腐及皮革制造等行业的一种重要原料(汤洁等, 2013), 其广泛使用使得大量含铬废水排入到水环境中, 从而造成水体铬污染, 进而威胁到生态环境安全和人类健康(Wang et al., 2009).在自然环境中, 铬(Cr)主要以六价铬(Cr(Ⅵ))和三价铬(Cr(Ⅲ))的形式存在(Srivastava et al., 2007; Liu et al., 2012).铬的毒性与价态有关, 且不同价态的化合物之间可以相互转化, 其中, Cr(Ⅲ)毒性低, 容易与有机物形成不溶性复合物, 而Cr(Ⅵ)具有可溶性、致癌、高毒性(Madamwar et al., 2006; Nickens et al., 2010; 李靖等, 2019).因此, 有必要开展水体中Cr(Ⅵ)的去除研究.
目前国内外对水体中Cr(Ⅵ)的去除方法主要包括吸附法、氧化还原法、电解法及微生物法等.纳米零价铁(NZVI)作为一种环境友好纳米材料, 具有反应速率快、还原能力强及成本低廉等优势, 近年来已被广泛应用在重金属污染修复研究中.目前许多****对NZVI去除Cr(Ⅵ)的动力学、影响因素及其机制等进行了深入研究(王吟等, 2010), 发现NZVI是一种有效的去除水体中Cr(Ⅵ)的绿色纳米材料, 但NZVI去除水体中Cr(Ⅵ)的过程中, 随着反应的进行, NZVI颗粒表面逐渐被腐蚀氧化形成铁氧化膜, 使反应位点随之减少, 从而导致长期使用过程中反应活性降低, 不能得到充分利用(Dutta et al., 2011).因此, 促进NZVI颗粒表面铁氧化物的还原是提高其反应活性的可行方法.
异化铁还原菌是自然界中被证实能有效将Fe(Ⅲ)还原为Fe(Ⅱ)的一类微生物, 包括嗜水气单胞菌(Aeromonas hydrophila)、希瓦氏菌(Shewanella putrefaciens)、热棒菌(Pyrobaculum)和地杆菌(Goebacter)(Gerlach et al., 2000; Chun et al., 2003; Li et al., 2010)等.其还原Fe(Ⅲ)的主要机理在于异化铁还原菌通过吸附在铁基体上与铁矿物直接接触并产生电子转移或者通过产生铁螯合剂增加Fe(Ⅲ)氧化物的溶解度(Li et al., 2010).已有研究表明, 异化铁还原菌可促进铁氧化物α-FeOOH对DDT的去除(Ravikumar et al., 2016), 因此, 可以考虑将异化铁还原菌和NZVI联合应用于环境污染修复中.然而, NZVI可能对微生物细胞的生长和代谢活动具有抑制和毒性作用(Gerlach et al., 2000; Keenan et al., 2009; Sacca et al., 2014).研究还发现, 异化铁还原菌Shewanella alga BrY和Shewanella putrefaciens虽然能将NZVI表面的Fe(Ⅲ)还原为Fe(Ⅱ), 但Shewanella alga BrY仅黏附于老化的零价铁上, 不能与活性NZVI共存(Nevin et al., 2002).因此, 关于异化铁还原菌和NZVI的相互作用及联合修复方法有待进一步深入研究.
目前关于异化铁还原菌和NZVI联合修复水体重金属污染的研究较少, 其去除性能及机理尚不清晰.因此, 本研究拟采用嗜水气单胞菌联合NZVI及老化NZVI去除水体中Cr(Ⅵ), 研究嗜水气单胞菌-NZVI/老化NZVI体系对水体中Cr(Ⅵ)的去除能力与影响因素, 并探讨嗜水气单胞菌提升NZVI反应活性的作用机制.
2 材料与方法(Materials and methods)2.1 实验试剂实验用到的主要试剂有氯化铁(FeCl3)、硼氢化钠(NaBH4)、重铬酸钾(K2Cr2O7)、牛肉膏、蛋白胨、葡萄糖、氯化钠(NaCl)、磷酸二氢钠(NaH2PO4)、氯化铵(NH4Cl)、氯化钾(KCl)、碳酸氢钠(NaHCO3)、磷酸氢二钠(Na2HPO4)、柠檬酸等, 以上试剂均为分析纯, 购自国药化学试剂有限公司和阿拉丁试剂(中国)有限公司.
2.2 材料准备2.2.1 嗜水气单胞菌的培养嗜水气单胞菌(Aeromonas hydrophila BNCC 336453)购自北京北纳创联生物技术研究院.经活化后, 置于恒温摇床于30 ℃、150 r·min-1条件下培养12 h, 然后配制菌悬液(OD600为1, 浓度约为1×108 CFU·mL-1), 备用.
固体培养基(g·L-1): 牛肉膏3.0、蛋白胨10.0、NaCl 5.0、琼脂15.0.肉汁培养基(g·L-1): 牛肉膏3.0、蛋白胨10.0、NaCl 5.0.微量元素液: NaH2PO4 0.68 g·L-1、NH4Cl 0.25 g·L-1、KCl 0.1 g·L-1、NaHCO3 2.5 g·L-1, 葡萄糖5 mmol·L-1, 用pH缓冲液调节pH至6.0左右.pH缓冲溶液由Na2HPO4(0.2 mol·L-1)与柠檬酸(0.1 mol·L-1)按比例配置而成.
2.2.2 NZVI的制备和老化采用液相还原的方法制备NZVI(李钰婷等, 2012), 即在氮气保护及机械搅拌的条件下, 将硼氢化钠溶液匀速逐滴滴入三氯化铁溶液中(3 mL·min-1), 滴定完成后继续搅拌30 min使反应彻底, 然后进行固液分离, 再经无氧超纯水和无水乙醇清洗后置于真空干燥箱烘干得到NZVI. NZVI的老化方法采用自然老化法, 即将上述制得的NZVI置于去离子水中, 放置2周后用无水乙醇清洗, 真空干燥, 得到老化NZVI.
2.3 实验方法配制由肉汁培养基、微量元素和Cr(Ⅵ)组成的微生物培养液, 用缓冲液调节pH后加入到100 mL血清瓶中, 通N2除氧, 随后接种微生物调节OD600值为0.1(菌浓度约为1×107 CFU·mL-1), 并加入NZVI, 最后用橡胶塞密封, 放入恒温摇床中于30 ℃、180 r·min-1条件下培养.每隔一段时间从厌氧瓶中取出等量样品, 经8000 r·min-1离心3 min后, 所得上清液用0.22 μm滤膜过滤, 留待分析.
实验主要考察温度(10、20、30、40 ℃)、pH(3、4、5、6、7、8)、Cr(Ⅵ)初始浓度(25、50、75、100 mg·L-1)、溶解氧(通N2、自然条件)对Cr(Ⅵ)去除效率的影响, 每组实验不同条件均使用同一批微生物及同一批NZVI材料进行实验, 默认条件: 温度为30 ℃, pH为6.0, NZVI添加量为0.1 g·L-1, Cr(Ⅵ)浓度为50 mg·L-1, 通N2.
2.4 分析测试方法Cr(Ⅵ)含量采用二苯碳酰二肼分光光度法于540 nm波长下进行测定, 总Cr含量采用原子吸收光谱法测定, Cr(Ⅲ)含量为总Cr含量减去Cr(Ⅵ)含量.Fe(Ⅱ)含量采用邻菲罗啉分光光度法于510 nm波长下测定, 总溶解性Fe含量的测定方法为先用盐酸羟胺将样品中Fe(Ⅲ)还原为Fe(Ⅱ)后, 再用相同方法测定.
采用扫描电子显微镜(SEM)分析反应前后材料的形貌特征, 采用X射线光电子能谱(XPS)分析反应前后NZVI的元素组成及价态特征, XPS采用ESCALAB Xi+光电子能谱仪(美国Thermo Fischer公司)测定, 采用Al Ka(hv=1486.6 eV)作为射线源.
2.5 数据分析采用准一级动力学模型(Lagergren, 1898)(式(1))和准二级动力学模型(Ho et al., 1998)(式(2))对动力学实验数据进行拟合.
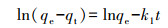 | (1) |
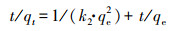 | (2) |
所有实验组均设置3个平行实验, 取其数据的平均值±标准偏差作为实验结果, 采用Microsoft Excel 2013对试验数据进行整理, 采用SPSS Statistics 18.0对数据进行单因素方差分析, 显著性水平为p < 0.05.
3 结果与讨论(Results and discussion)3.1 老化对NZVI去除Cr(Ⅵ)效果的影响为了研究老化对NZVI反应活性的影响, 本实验将NZVI放置于去离子水中进行2周的自然老化, 并考察通入氮气(N2)和自然条件(Air)下NZVI和老化NZVI去除Cr(Ⅵ)的效果.由图 1可知, NZVI和老化NZVI对Cr(Ⅵ)的去除率随反应时间延长逐渐升高, 老化对NZVI去除Cr(Ⅵ)的效果有显著影响(p < 0.05).反应72 h后NZVI对Cr(Ⅵ)的去除率达到95.0%, 而相同条件下老化NZVI对Cr(Ⅵ)的去除率仅为41.9%.无氧条件下NZVI和老化NZVI对Cr(Ⅵ)的去除率相比有氧条件下分别下降了41.7%和7.6%.NZVI对Cr(Ⅵ)的去除主要是发生在NZVI表面的氧化还原反应, NZVI接触水相中的水分子和氧发生氧化反应形成Fe(Ⅱ), 当水中Cr(Ⅵ)吸附到NZVI表面时与Fe(Ⅱ)接触发生氧化还原反应, 因此, 投加NZVI的实验组具有较好的Cr(Ⅵ)去除效果.而老化NZVI表面因氧化形成的铁氧化膜的存在阻碍了NZVI与污染物的接触, 减少了其表面活性位点, 限制了NZVI与污染物的充分反应, 使得其对Cr(Ⅵ)的还原去除能力明显下降, 因此, 有必要开展相关研究提高老化NZVI的反应活性, 延长NZVI的使用寿命.
图 1(Fig. 1)
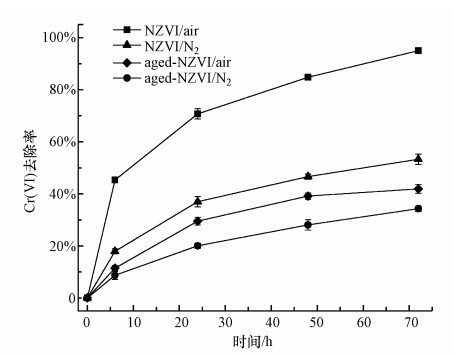 |
| 图 1 老化对NZVI去除Cr(Ⅵ)的影响 Fig. 1Effect of aging on Cr(Ⅵ) removal by NZVI |
3.2 嗜水气单胞菌强化老化NZVI对Cr(Ⅵ)的去除嗜水气单胞菌强化老化NZVI去除Cr(Ⅵ)的实验在30 ℃、180 r·min-1的恒温摇床中进行, 反应容器放置在自然条件下或通氮气0.5 h后密封, 溶液初始pH值用磷酸氢二钠-柠檬酸缓冲液调节至6.0.由图 2可知, 单独的嗜水气单胞菌对Cr(Ⅵ)的去除效果不明显, 在无氧条件下嗜水气单胞菌协同老化NZVI对Cr(Ⅵ)的去除效果相比单独的老化NZVI有显著提升(p < 0.05), 反应72 h后Cr(Ⅵ)去除率由34.3%提升到89.3%.而在有氧条件下, 接种嗜水气单胞菌后, 老化NZVI对Cr(Ⅵ)的去除率反而有所下降, 从41.9%降为24.5%.分析认为, 这可能是因为嗜水气单胞菌的加入促进了NZVI表面氧化的Fe(Ⅲ)还原为Fe(Ⅱ), 使其恢复还原活性, 而嗜水气单胞菌本身属兼性厌氧细菌, 在厌氧条件下才具备较高的铁还原活性, 使老化NZVI表面的铁氧化膜溶解还原(Shi et al., 2019), 从而一定程度上活化老化NZVI并提升其对Cr(Ⅵ)的还原去除能力.
图 2(Fig. 2)
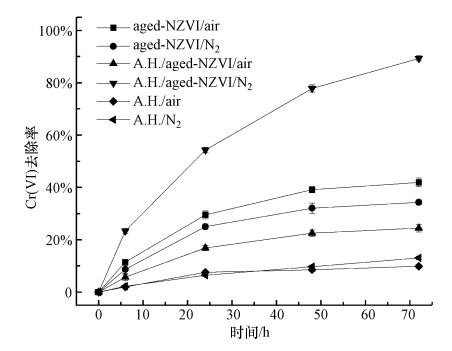 |
| 图 2 嗜水气单胞菌对老化NZVI去除Cr(Ⅵ)的影响 Fig. 2Effect of Aeromonas hydrophila (A.H.) on Cr(Ⅵ) removal by aged-NZVI |
3.3 嗜水气单胞菌强化老化NZVI去除Cr(Ⅵ)的影响因素3.3.1 温度和pH对Cr(Ⅵ)去除的影响温度和pH是影响微生物生长和活性的重要因素, 不同微生物生长的适宜温度和pH有所不同, 同时pH又是影响铁形态的重要因子, 因此, 本研究考察了温度和pH对嗜水气单胞菌强化老化NZVI去除Cr(Ⅵ)的影响.嗜水气单胞菌生长的适宜温度为25 ~ 37 ℃(潘吉脉等, 2019).由图 3a可知, 在一定范围内升高温度有助于Cr(Ⅵ)的去除, 当达到嗜水气单胞菌生长的适宜温度附近时(30 ℃和40 ℃), Cr(Ⅵ)的去除率在反应10 h后可达到90%以上, 24 h内Cr(Ⅵ)即可完全去除.研究发现, 温度从30 ℃升高至40 ℃时, Cr(Ⅵ)去除效率变化不明显, 由此可认为嗜水气单胞菌强化老化NZVI去除Cr(Ⅵ)的适宜温度为30~40 ℃.在前2 h内, 各个温度实验组下的Cr(Ⅵ)去除率差异并不明显, 说明反应前期嗜水气单胞菌尚处在调整适应阶段, 对老化NZVI的还原作用不强, Cr(Ⅵ)的去除主要归因于老化NZVI本身对Cr(Ⅵ)的吸附和还原作用, 随着反应时间延长, 微生物在适宜温度下经过适应及铁还原反应促进了对Cr(Ⅵ)的去除.
图 3(Fig. 3)
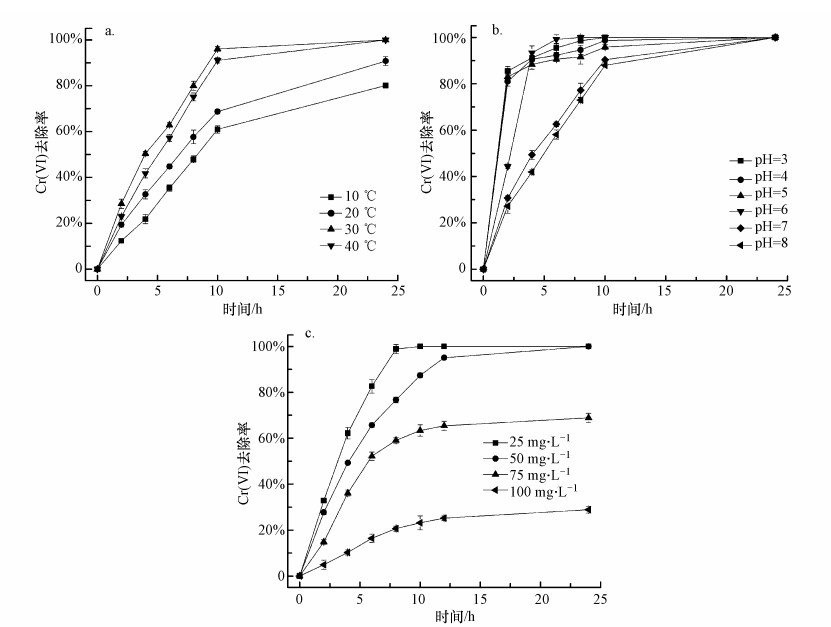 |
| 图 3 温度(a)、pH(b)和Cr(Ⅵ)初始浓度(c)对Cr(Ⅵ)去除的影响 Fig. 3Effect of temperature(a), pH(b) and Cr(Ⅵ) initial concentration(c) on Cr(Ⅵ) removal |
pH对铁还原菌协同老化NZVI去除Cr(Ⅵ)的影响如图 3b所示.可以看出, 嗜水气单胞菌协同老化NZVI在酸性条件下对Cr(Ⅵ)的去除效果较好, 去除速度较快;在中性和弱碱性条件下相对较差, 完全去除Cr(Ⅵ)的时间较长, 其去除Cr(Ⅵ)的最适pH为6, pH为6时, Cr(Ⅵ)在8 h内即可完全被去除.微生物的生长和活性受pH的影响较大, 有研究表明嗜水气单胞菌的生长适宜pH为6~7(潘吉脉等, 2019), NZVI去除Cr(Ⅵ)在酸性条件下效率较高(张永祥等, 2018).因此, 本研究中嗜水气单胞菌强化老化NZVI去除Cr(Ⅵ)的实验在pH=6条件下进行.
3.3.2 Cr(Ⅵ)初始浓度对Cr(Ⅵ)去除的影响Cr(Ⅵ)初始浓度会影响嗜水气单胞菌的生长和活性, 从而影响其活化NZVI对Cr(Ⅵ)的去除.本实验考察了Cr(Ⅵ)初始浓度为25~100 mg·L-1时Cr(Ⅵ)去除率随时间的变化.由图 3c可知, Cr(Ⅵ)的去除效率随Cr(Ⅵ)初始浓度的增大而显著降低.当初始浓度为25 mg·L-1时, Cr(Ⅵ)去除率在6 h内达到82.7%, 在10 h内即可达到100%;初始浓度为50 mg·L-1时, 反应6 h后Cr(Ⅵ)去除效率仅为70.7%, 完全去除需要12 h;当初始浓度为75 mg·L-1和100 mg·L-1时, 24 h后反应基本达到平衡, Cr(Ⅵ)去除效率分别仅为68.9%和28.9%.结果表明, Cr(Ⅵ)初始浓度对嗜水气单胞菌-老化NZVI联合体系去除Cr(Ⅵ)的影响较大, Cr(Ⅵ)初始浓度在50 mg·L-1及以下时, 该体系能高效且快速地去除溶液中的Cr(Ⅵ), 而当Cr(Ⅵ)初始浓度达到100 mg·L-1时, 该体系对Cr(Ⅵ)的去除十分缓慢且去除能力有限.分析认为, 随Cr(Ⅵ)初始浓度的增加, 过高浓度的Cr(Ⅵ)超出了嗜水气单胞菌与老化NZVI联合体系的处理能力, 同时, 高浓度Cr(Ⅵ)可能对嗜水气单胞菌的生长和活性造成了一定程度的影响, 从而使其还原能力降低, 最终导致体系对Cr(Ⅵ)去除率的下降.
3.4 嗜水气单胞菌强化老化NZVI对Cr(Ⅵ)的去除机制分析3.4.1 材料形貌分析反应前后NZVI和老化NZVI的扫描电镜图如图 4所示.从图 4a可以看出, 本实验合成的NZVI颗粒呈现球形或椭球形状, 粒径大约在30~70 nm, 由于比表面积较大且颗粒之间相互吸引(Jabeen et al., 2011), 整体形态呈链条状. 从图中还可以看到材料颗粒表面较为光滑, 颗粒之间有轻微团聚现象.图 4b显示, 相对于NZVI, 老化NZVI表面较为粗糙, 体积也较NZVI明显增大, 但形态基本还保持为链条状, 团聚现象相对NZVI更为明显, 比表面积明显降低, 原因在于其表面氧化生成的钝化膜.从图 4c与图 4d可以看到, 反应后NZVI与老化NZVI表面附着了其他物质, 体积增大, 团聚明显.
图 4(Fig. 4)
 |
| 图 4 反应前后NZVI(a.反应前, c.反应后)和老化NZVI(b.反应前, d.反应后)的SEM图 Fig. 4SEM images of NZVI(a, c), aged-NZVI(b, d) before and after reaction |
3.4.2 反应产物分析为了探究Cr(Ⅵ)的去除机制, 本研究采用光电子能谱仪对反应前后老化NZVI进行检测, 以分析老化NZVI表面元素组成与价态变化.由图 5a可以发现, 老化NZVI反应前Fe主要以Fe0(706.5 eV)、Fe(Ⅱ)—O(710.2 eV与723.6 eV)(Lv et al., 2018)和Fe(Ⅲ)—O(712.5 eV与726.2 eV)(Li et al., 2018)的形式存在, 且Fe0的特征峰较弱, 说明老化过程中Fe0逐渐被氧化为Fe(Ⅱ)和Fe(Ⅲ), 以Fe(Ⅱ)—O和Fe(Ⅲ)—O的形式存在于材料表面.反应后Fe0特征峰消失, Fe以Fe(Ⅱ)—O(710.2 eV与723.6 eV)和Fe(Ⅲ)—O(712.5 eV与726.2 eV)的铁氧化合物形式存在, 说明反应过程中Fe0被氧化生成了Fe(Ⅱ)与Fe(Ⅲ)并吸附在材料表面.
由图 5b可看出, 在577.1 eV和587.8 eV处的峰为Cr(Ⅲ)特征峰(曾淦宁等, 2015; Liu et al., 2019), 在581.8 eV和590.5 eV处的峰为Cr(Ⅵ)特征峰(徐海玉等, 2019).由此可知, 反应后的老化NZVI颗粒表面有含Cr的化合物沉积, 且存在Cr(Ⅲ)和Cr(Ⅵ)两种价态, 通过峰面积大小可推断老化NZVI表面Cr主要以Cr(Ⅲ)形式存在.据文献报道, 零价铁及表面氧化生成的Fe(Ⅱ)能与吸附在零价铁表面的Cr(Ⅵ)发生氧化还原反应, 生成Cr(OH)3沉淀或FexCr1-x(OH)3共沉淀物(式(3)~(5))(汤洁等, 2013).因此, 嗜水气单胞菌强化老化NZVI对Cr(Ⅵ)的去除主要以还原作用为主, 直接吸附作用占比不大.
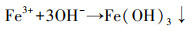 | (3) |
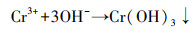 | (4) |
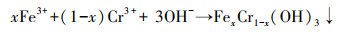 | (5) |
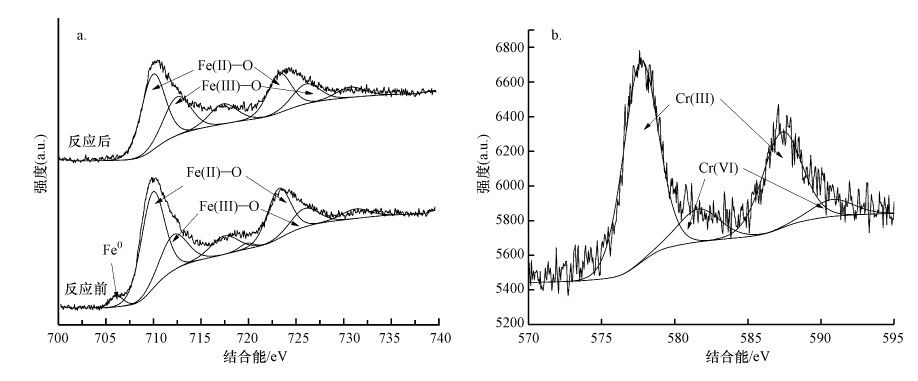 |
| 图 5 老化NZVI反应前后的Fe 2p(a)及反应后Cr 2p(b)窄轨道谱图 Fig. 5Fe 2p of aged-NZVI before and after reaction(a) and Cr 2p of aged-NZVI after reaction(b) |
为了进一步证实Cr(Ⅵ)的还原, 本研究考察了溶液中Cr(Ⅵ)和Cr(Ⅲ)随时间的变化规律, 结果如图 6a所示.由图 6a可知, 随着反应的进行, 溶液中Cr(Ⅵ)浓度逐渐降低, 而Cr(Ⅲ)浓度逐渐升高, 说明溶液中的Cr(Ⅵ)在嗜水气单胞菌与老化NZVI的联合作用下被还原转化为毒性较低的Cr(Ⅲ).但反应过程中溶液中Cr(Ⅲ)和Cr(Ⅵ)浓度之和低于Cr(Ⅵ)初始浓度, 结合XPS表征结果中老化NZVI材料表面Cr主要存在形式为Cr(Ⅲ), 可推测被还原生成的Cr(Ⅲ)大部分以吸附或共沉淀作用(式(3)~(5))附着在材料表面(莫慧敏等, 2020), 从而从溶液中被去除.
图 6(Fig. 6)
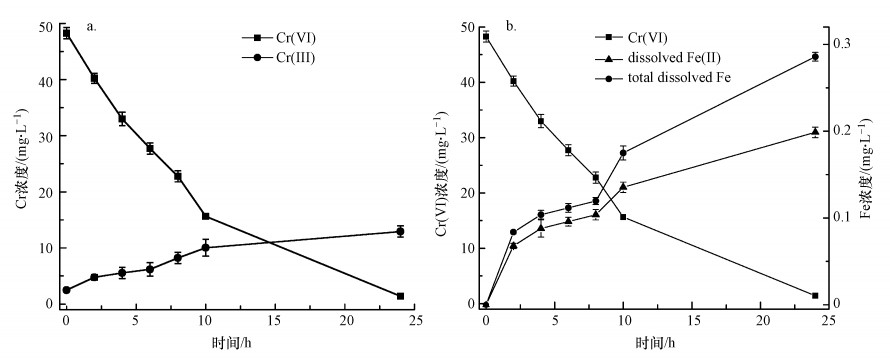 |
| 图 6 Cr浓度(a)与Fe浓度(b)随时间的变化 Fig. 6The variation of Cr(Ⅵ) and Cr(Ⅲ) concentration (a), and total dissolved Fe and Fe(Ⅱ) concentration (b) |
图 6b是溶液中总溶解性Fe和Fe(Ⅱ)浓度随时间的变化情况, 可以看出, 反应前期总溶解性Fe和Fe(Ⅱ)浓度均较低, 随着反应进行, Cr(Ⅵ)逐渐被去除, 总溶解性Fe和Fe(Ⅱ)浓度逐渐增加.分析认为, Fe0在水中会逐渐老化, 表面被氧化生成Fe(Ⅱ)(式(6)和(7)), 生成的Fe(Ⅱ)可与Cr(Ⅵ)反应生成Fe(Ⅲ)和Cr(Ⅲ)(式(8)).嗜水气单胞菌可将Fe(Ⅲ)还原为Fe(Ⅱ), 从而促进反应体系中Fe(Ⅲ)与Fe(Ⅱ)之间的循环, 提高溶液中总溶解性Fe和Fe(Ⅱ)浓度, 同时强化其对Cr(Ⅵ)的还原去除.
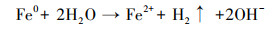 | (6) |
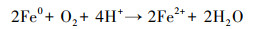 | (7) |
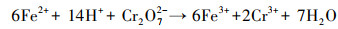 | (8) |
图 7(Fig. 7)
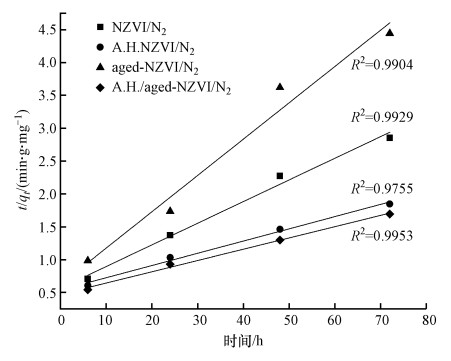 |
| 图 7 不同体系对Cr(Ⅵ)去除的准二级动力学拟合结果 Fig. 7The pseudo-second-order kinetics for Cr(Ⅵ) removal under different treatments |
4 结论(Conclusions)1) 通过接种嗜水气单胞菌, 能显著提高无氧条件下老化NZVI对Cr(Ⅵ)的去除效率, 证实联合铁还原菌是一种有效的恢复和提升NZVI反应活性的方法.
2) 影响因素实验表明, 嗜水气单胞菌强化老化NZVI对Cr(Ⅵ)的去除率在无氧、pH值为酸性和温度为30~40 ℃条件下较高, 随Cr(Ⅵ)初始浓度升高而降低.在温度为30 ℃, pH=6, 老化NZVI投加量为0.1 g·L-1, Cr(Ⅵ)初始浓度为50 mg·L-1的条件下反应24 h后, 体系对Cr(Ⅵ)的去除率可达到100%.
3) 嗜水气单胞菌强化老化NZVI对溶液中Cr(Ⅵ)的去除过程符合准二级动力学.XPS分析证实反应后沉积在老化NZVI表面的Cr以Cr(Ⅲ)为主, 可能为Cr(OH)3沉淀或FexCr1-x(OH)3共沉淀物, 结果表明其去除Cr(Ⅵ)的机制包含吸附、还原与共沉淀, 其中以还原作用为主.
参考文献
| Chatterjee A, Schiewer S. 2014. Multi-resistance kinetic models for biosorption of Cd by raw and immobilized citrus peels in batch and packed-bed columns[J]. Chemical Engineering Journal, 244: 105-116. DOI:10.1016/j.cej.2013.12.017 |
| Cuong A P, Sung J J, Nguyet T P, et al. 2003. A novel electrochemically active and Fe(Ⅲ)-reducing bacterium phylogenetically related to Aeromonas hydrophila, isolated from a microbial fuel cell[J]. FEMS Microbiology Reviews, 223(1): 129-134. DOI:10.1016/S0378-1097(03)00354-9 |
| Gerlach R, Cunningham, A B, Caccavo F. 2000. Dissimilatory iron-reducing bacteria can influence the reduction of carbon tetrachloride by iron metal[J]. Environmental Science & Technology, 34(12): 2461-2464. |
| Ho Y S, Mckay G. 1998. A comparison of chemisorption kinetic models applied to pollutant removal on various sorbents[J]. Process Safety and Environmental Protection, 76(4): 332-340. DOI:10.1205/095758298529696 |
| Jabeen H, Chandra V, Jung S, et al. 2011. Enhanced Cr(Ⅵ) removal using iron nanoparticle decorated graphene[J]. Nanoscale, 3(9): 3583-3585. DOI:10.1039/c1nr10549c |
| Keenan C R, Goth-Goldsten R, Lucas D, et al. 2009. Oxidative stress induced by zero-valent iron nanoparticles and Fe(Ⅱ) in human bronchial epithelial cells[J]. Environmental Science & Technology, 43(12): 4555-4560. |
| Lagergren S. 1898. Zur theorie der sogenannten adsorption geloster stoffe[J]. Kungliga Svenska Vetenskapsakad Handl, 24: 1-39. |
| Li F B, Li X M, Zhou S G, et al. 2010. Enhanced reductive dechlorination of DDT in an anaerobic system of dissimilatory iron-reducing bacteria and iron oxide[J]. Environ Pollut, 158(5): 1733-1740. DOI:10.1016/j.envpol.2009.11.020 |
| Li J, Xu M, Yao G, et al. 2018. Enhancement of the degradation of atrazine through CoFe2O4 activated peroxymonosulfate (PMS) process: Kinetic, degradation intermediates, and toxicity evaluation[J]. Chemical Engineering Journal, 348: 1012-1024. DOI:10.1016/j.cej.2018.05.032 |
| 李靖, 范明杰, 刘翔, 等. 2019. 双表面活性剂修饰下纳米零价铁对水中Cr(Ⅵ)污染去除研究[J]. 环境科学学报, 39(10): 3402-3409. |
| Liu H, Guo L, Liao S, et al. 2012. Reutilization of immobilized fungus Rhizopus sp. LG04 to reduce toxic chromate[J]. Journal Applied Microbiology, 112(4): 651-659. DOI:10.1111/j.1365-2672.2012.05257.x |
| Liu Y Y, Sochi S P, Liu S Y, et al. 2019. Adsorption and reductive degradation of Cr(Ⅵ) and TCE by a simply synthesized zero valent iron magnetic biochar[J]. Journal Environment Management, 235: 276-281. |
| Lv D, Zhou X, Zhou J, et al. 2018. Design and characterization of sulfide-modified nanoscale zerovalent iron for cadmium(Ⅱ) removal from aqueous solutions[J]. Applied Surface Science, 442: 114-123. DOI:10.1016/j.apsusc.2018.02.085 |
| 李钰婷, 张亚雷, 代朝猛, 等. 2012. 纳米零价铁颗粒去除水中重金属的研究进展[J]. 环境化学, 31(9): 1349-1354. |
| Mitra P, Sakar D, Chakrabarti S, et al. 2011. Reduction of hexa-valent chromium with zero-valent iron: Batch kinetic studies and rate model[J]. Chemical Engineering Journal, 171(1): 54-60. DOI:10.1016/j.cej.2011.03.037 |
| 莫慧敏, 秦兴姿, 毛珺, 等. 2020. 海藻酸钠改性纳米零价铁还原土壤中Cr(Ⅵ)[J]. 环境科学学报, 40(5): 1821-1827. |
| Nevin K P, Lovley D R. 2002. Mechanisms for accessing insoluble Fe(Ⅲ) oxide during dissimilatory Fe(Ⅲ) reduction by Geothrix fermentans[J]. Applied Environment Microbiology, 68(5): 2294-2299. DOI:10.1128/AEM.68.5.2294-2299.2002 |
| Nickens K P, Patierno S R, Ceryak S. 2010. Chromium genotoxicity: A double-edged sword[J]. Chemistry Biology Interact, 188(2): 276-288. DOI:10.1016/j.cbi.2010.04.018 |
| 潘吉脉, 吴良涛, 杨霞, 等. 2019. 温度、pH、盐度和碳氮源对嗜水气单胞菌GZ1株生长的影响[J]. 水产学杂志, 32(4): 63-67. DOI:10.3969/j.issn.1005-3832.2019.04.010 |
| Ravikumar K V G, Kumar D, Rajeshwari A, et al. 2016. A comparative study with biologically and chemically synthesized nZVI: applications in Cr(Ⅵ) removal and ecotoxicity assessment using indigenous microorganisms from chromium-contaminated site[J]. Environmental Science and Pollution Research, 23(3): 2613-2627. DOI:10.1007/s11356-015-5382-x |
| Rudinski W, Plazinski W. 2007. Theoretical description of the kinetics of solute adsorption at heterogeneous solid/solution interfaces[J]. Applied Surface Science, 253(13): 5827-5840. DOI:10.1016/j.apsusc.2006.12.038 |
| Sacca M L, Fajardo C, Martinez-Gomariz M, et al. 2014. Molecular stress responses to nano-sized zero-valent iron (nZVI) particles in the soil bacterium Pseudomonas stutzeri[J]. PLoS One, 9(2): e89677. DOI:10.1371/journal.pone.0089677 |
| Shi Z J, Shen W J, Yang K, et al. 2019. Hexavalent chromium removal by a new composite system of dissimilatory iron reduction bacteria Aeromonas hydrophila and nanoscale zero-valent iron[J]. Chemical Engineering Journal, 362: 63-70. DOI:10.1016/j.cej.2019.01.030 |
| Simonin J P. 2016. On the comparison of pseudo-first order and pseudo-second order rate laws in the modeling of adsorption kinetics[J]. Chemical Engineering Journal, 300: 254-263. DOI:10.1016/j.cej.2016.04.079 |
| Srivastava S, Shekhar I. 2007. Evaluation of biosorption potency of Acinetobacter sp. for removal of hexavalent chromium from tannery effluent[J]. Biodegradation, 18(5): 637-646. DOI:10.1007/s10532-006-9096-0 |
| Tancker U, Parikh R, Shouche Y, et al. 2006. Hexavalent chromium reduction by Providencia sp[J]. Process Biochemistry, 41(6): 1332-1337. DOI:10.1016/j.procbio.2006.01.006 |
| 汤洁, 王卓行, 徐新华. 2013. 铁屑-微生物协同还原去除水体中Cr(Ⅵ)研究[J]. 环境科学, 34(7): 2650-2657. |
| 王吟, 赵建夫, 王学江, 等. 2010. 零价铁修复铬污染水体研究进展[J]. 安徽农业科学, 38(6): 3117-3119. DOI:10.3969/j.issn.0517-6611.2010.06.126 |
| 徐海玉, 张明青, 陈翌昱. 2019. 有机凹凸棒石负载纳米零价铁去除水中六价铬[J]. 中国环境科学, 39(12): 5079-5084. |
| Yang J X, He M Y, Wang G J. 2009. Removal of toxic chromate using free and immobilized Cr(Ⅵ)-reducing bacterial cells of Intrasporangium sp. Q5-1[J]. World Journal of Microbiology and Biotechnology, 25(9): 1579-1587. DOI:10.1007/s11274-009-0047-x |
| 曾淦宁, 武晓, 郑林, 等. 2015. 负载纳米零价铁铜藻基活性炭的制备及其去除水中Cr(Ⅵ)的研究[J]. 环境科学, 36(2): 530-536. |
| 张永祥, 马晓敏. 2018. 纳米零价铁去除水中六价铬的研究[J]. 应用化工, 47(8): 1569-1573. DOI:10.3969/j.issn.1671-3206.2018.08.003 |
