
 , 王莹2, 孟富臣1, 李宛伦1, 尤宏1
, 王莹2, 孟富臣1, 李宛伦1, 尤宏11. 哈尔滨工业大学, 城市水资源与水环境国家重点实验室, 哈尔滨 150090;
2. 北京高能时代环境技术股份有限公司, 北京 100095
收稿日期: 2020-09-09; 修回日期: 2020-09-11; 录用日期: 2020-09-11
基金项目: 黑龙江省自然科学基金(No.LH2020D010);城市水资源与水环境国家重实验室基金项目(No.ESK202004)
作者简介: 王树涛(1975-), 男, 副教授(博士), E-mail:wshutao@hit.edu.cn
通讯作者(责任作者): 王树涛(1975—), 男, 副教授, 硕士生导师, 主要研究方向为臭氧催化氧化深度处理难降解污水、有毒污染物的环境毒理学等, E-mail: wshutao@hit.edu.cn
摘要:制备了纳米MnO2,并以Al2O3为载体制备了掺杂型MnO2/Al2O3颗粒催化剂.催化剂焙烧温度和时间分别为500℃和4 h、MnO2质量分数为8%时,催化剂具有最高的臭氧催化氧化活性.SEM分析表明,纳米MnO2均匀分布于Al2O3载体表面.MnO2/Al2O3催化剂的比表面积(BET)为183.22 m2·g-1,平均孔容为0.27 cm3·g-1,平均孔径为4.87 nm.建立了MnO2/Al2O3催化剂-微气泡臭氧催化反应体系,研究了该体系对喹啉的降解去除效果及其机理.臭氧微气泡的平均粒径为61.7 μm.微气泡臭氧投量为30 mg·L-1时,反应60 min后喹啉去除率能达到95%以上;反应20 min后,MnO2/Al2O3催化剂-微气泡臭氧体系对实际煤化工废水二级出水的TOC去除率可达到55%以上.以叔丁醇作为分子探针,证明了羟基自由基(·OH)氧化作用在臭氧微气泡催化氧化体系中对喹啉的降解起到主导作用.
关键词:MnO2/Al2O3催化剂喹啉煤化工废水臭氧催化氧化臭氧微气泡
Degradation of quinoline and its mechanism by catalytic ozonation with MnO2/Al2O3 catalyst
WANG Shutao1

 , WANG Ying2, MENG Fuchen1, LI Wanlun1, YOU Hong1
, WANG Ying2, MENG Fuchen1, LI Wanlun1, YOU Hong11. State Key Laboratory of Urban Water Resources and Environment, Harbin Institute of Technology, Harbin 150090;
2. Beijing GeoEnviron Engineering&Technology, lnc., Beijing 100095
Received 9 September 2020; received in revised from 11 September 2020; accepted 11 September 2020
Abstract: A doped catalyst MnO2/Al2O3 was prepared by using Al2O3 as the support. The catalyst exhibit the highest activity when the calcination temperature and duration was 500 ℃ and 4 h,respectively,and the mass percent of MnO2 was 8%. The nano-sized MnO2 was distributed on the surface of the Al2O3 support according to the scanning electron scope (SEM) analysis. The specific surface area (BET),average pore volume and pore diameter of the catalyst reached 183.22 m2·g-1,0.27 cm3·g-1 and 4.87 nm,respectively. A catalyst ozonation system was established with MnO2/Al2O3 and microbubble ozone. The removal rate of quinoline reached >95% at the ozone dose of 30 mg·L-1 and the reaction time of 60 min. The TOC removal rate for the secondary effluent of the real coal chemical wastewater achieved 55% after 20 min reaction at the ozone dose of 180 mg·L-1·h-1. In addition,it is proved that ·OH dominated the removal of quinoline in the catalytic ozonation reaction with MnO2/Al2O3 catalyst by using tertiary butanol (TBA) as molecular probe.
Keywords: MnO2/Al2O3 catalystquinolinecoal chemical wastewatercatalytic ozonationmicrobubble ozone
1 引言(Introduction)煤化工废水经过生化处理后, 二级出水中仍含有多种难降解污染物, 无法达标排放, 仍需进行深度处理.高级氧化法(AOPs)在难降解工业废水处理中具有独特优势, 如氧化去除污染物能力强、反应速率快、矿化度高等(王俊洁等, 2010).臭氧的氧化还原电位为2.07 mV, 是仅次于氟的强氧化剂, 氧化性极强.臭氧催化氧化技术由于高效、低耗等优点成为工业废水深度处理的研究热点(Zhao et al., 2003;Kolosov et al., 2018).Zhai等(2010)制备了纳米ZnO粉末催化剂, 将其用于氧化降解饮用水中的二氯乙酸.与臭氧单独氧化相比, 催化剂ZnO的加入对二氯乙酸的降解性能提升了32.4%.Lan等(2013)以水中对氯苯甲酸(pCBA)为目标物, 以分子筛负载Fe制成负载型催化剂, 60 min矿化程度达到91.3%.Ahmadi等(2017)以PAC@FeIIFe2IIIO4为催化剂, 臭氧催化氧化对难降解有机物也具有良好的效果.
金属氧化物类催化剂常见的有MnO2、CeO2、TiO2、FexOy和γ-Al2O3等.其中由于Mn在环境中存量较多, 且Mn氧化物的制备相对容易, 成本较低, 故经常被作为水处理催化剂(Rosal et al., 2011).温舒涵等(2018)使用MnO2负载陶粒制备催化剂, 反应30 min后臭氧催化氧化对草酸的去除率达67%.此外, 由于Al2O3具有合适的孔结构, 较大的比表面积, 一定的抗压能力和良好的热稳定性, 能够在一定程度上节约活性组分用量, 故经常被用作催化剂的载体(Wu et al, 2018).Vittenet等(2015)曾直接以γ-Al2O3为催化剂在臭氧催化氧化条件下处理2, 4-DMP, 对COD和TOC的去除率分别达到56%和75%.
水中臭氧微小气泡(10~50 μm)具有更大的比表面积, 能够提供更大的气液接触面积, 进而增加臭氧分子与催化剂活性点位和污染物分子的接触几率, 并且有助于· OH的产生(Takahashi, 2005;Takahashi et al, 2007a;2007b).与普通曝气法相比, 臭氧微气泡能够大大提高臭氧利用率和污染物净化效果(Zhang et al, 2018).Liu等(2012)采用臭氧微气泡处理焦化废水时发现其对吡啶的去除率比普通曝气法提高了3.5倍.
本研究采用掺杂法制备出二氧化锰负载氧化铝催化剂(MnO2/Al2O3), 采用连续流反应器研究了微气泡臭氧催化氧化降解煤化工废水中典型污染物喹啉的去除效果以及喹啉的降解机理, 并研究了体系对实际煤化工废水二级出水的处理效果.
2 材料与方法(Materials and methods)2.1 化学试剂氢氧化铝(Al(OH)3)、硝酸(HNO3)、碘化钾(KI)、重铬酸钾(K2Cr2O7)、硫代硫酸钠(Na2S2O3)都购置于津基准有限公司, 硝酸锰(MnNO3)购置于天津市巴斯夫化工有限公司, 浓硫酸(H2SO4)、铝溶胶(Al2O3·nH2O)、聚合氯化铝均购置于天津光复化工研究所, 高锰酸钾(KMnO4)购置于天津东陵精细化学厂, 硫酸银(AgSO4)和硫酸汞(HgSO4)均购置于上海试剂一厂,香豆素购于中国医药公司, 7-羟基香豆素购于德国Augsburg公司, 叔丁醇(TBA)购于美国Sigma-Aldrich公司.上述试剂除浓硫酸、铝溶胶、香豆素(化学纯)外, 均为分析纯.
2.2 MnO2/Al2O3催化剂的制备活性组分MnO2的制备:恒温(60 ℃)磁力搅拌条件下, 将100 mL Na2S2O3溶液(0.376 mol·L-1)用滴定管缓慢滴加到500 mL KMnO4溶液(0.2 mol·L-1)中, 滴加完成后体系pH为6.0, 用0.1 mol·L-1的硝酸调节pH至5.0;将所得的沉淀物在60 ℃水浴中陈化2 h, 然后过滤;再用60 ℃去离子水洗涤至滤液呈中性后, 再过滤, 并于110 ℃条件下干燥12 h;最后, 用玛瑙研钵充分研磨干燥后的沉淀, 并过60目筛, 得到MnO2黑褐色粉末.
催化剂的制备:将自制的MnO2以8%的质量分数与粉末Al(OH)3混合, 以铝溶胶为胶溶剂制备出直径为(5±1) mm的球形催化剂.颗粒采用小型颗粒机制成.室温下将球形催化剂风干6 h后置于烘箱中在105 ℃下烘干12 h;最后置于马弗炉中焙烧.以2 ℃·min-1的升温速度升至500 ℃, 500 ℃条件下焙烧4 h.最后以2 ℃·min-1的降温速度降至室温, 即制成掺杂型MnO2/Al2O3催化剂.
2.3 废水水质实验用废水为配置的喹啉废水和煤化工废水的生化二级出水, 后者取自黑龙江省七台河某大型煤化工企业, 该企业生化处理段采用A2/O法, 出水B/C低下、可生化性差、色度高、呈黄色.水质特性如表 1所示.
表 1(Table 1)
| 表 1 煤化工废水的生化二级出水的水质特征 Table 1 Characteristics of the experimental water | ||||||||||||||||||||||||
表 1 煤化工废水的生化二级出水的水质特征 Table 1 Characteristics of the experimental water
| ||||||||||||||||||||||||
2.4 实验仪器与分析方法实验仪器:比表面积分析仪(ASAP-2020, Micromeritics, USA), 电子扫描显微镜(S-4700, Hitachi, Japan), X射线衍射仪(D8 advance, bruker, Germany), 电子拉力试验机(AG-X 50 kN, Shimadu, Japan), X-射线光电子能谱仪(PHI 5700 ESCA, USA), 激光粒度仪(Mastersizer 2000, Malvern, UK).
分析方法:喹啉浓度采用高效液相色谱仪(2695型, Waters, USA)分析, 色谱柱为C-18-AR-II, 检测器为紫外检测器(313 nm), 流动相采用V(甲醇):V (水)=1:1;TOC采用TOC分析仪(Shimadu, Japan)分析;CODCr采用重铬酸钾法测定;气相臭氧浓度检测采用臭氧气相浓度分析仪测定;液相臭氧浓度采用碘量法测定;羟基自由基采用香豆素荧光探测技术测定.
2.5 实验装置催化氧化系统的核心是内循环反应器, 反应器为圆柱体, 内径为50 mm, 有效容积为1.5 L, 设计水位高度为700 mm, 氧气由制氧机发生作为臭氧发生器气源.实验前, 将催化剂加至反应器中, 臭氧和实验用水经过微气泡发生器后一同进入到反应器中, 以保证催化剂、臭氧和水充分接触.臭氧发生器压力控制在0.1 MPa, 微气泡机处压降控制在0.2~0.3 MPa.进水端设有臭氧浓度检测仪, 尾气中剩余的臭氧经KI溶液吸收后排出室外.实验装置具体路线如图 1所示.
图 1(Fig. 1)
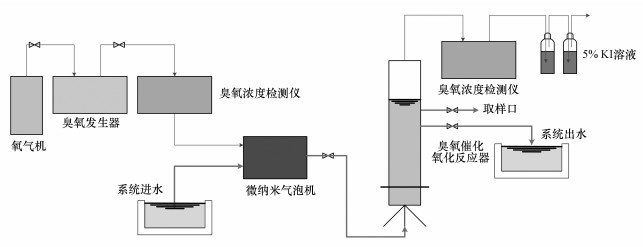 |
| 图 1 实验装置流程图 Fig. 1Experimental setup |
3 结果与讨论(Results and discussion)3.1 MnO2/Al2O3形貌及性质表征利用扫描显微镜(SEM)对纳米MnO2和MnO2/Al2O3催化剂颗粒表面进行微观形貌分析, 结果如图 2所示.由图 2a可见, 当焙烧温度为400 ℃时, 纳米MnO2直径约为50 nm左右, 可见到纳米球与球相连, 连接长度为200~300 nm;图 2b为放大10000×的MnO2/Al2O3催化剂表面形貌.可看到MnO2均匀地附着于Al2O3载体表面.分析发现MnO2/Al2O3催化剂中存在Al、Mn、O、C、K 5种元素, 其重量百分比含量分别为:30.00%、36.55%、22.30%、9.11%、2.04%(表 2).
图 2(Fig. 2)
 |
| 图 2 纳米MnO2(a)和MnO2/Al2O3 (b)催化剂表面微观形貌 Fig. 2Microstructure of MnO2 (a) and surface of MnO2/Al2O3 (b) catalyst |
表 2(Table 2)
| 表 2 MnO2/Al2O3催化剂X-射线光电子能谱结果 Table 2 X-ray photoelectron spectroscopy results of MnO2/Al2O3 catalyst | ||||||||||||||||||
表 2 MnO2/Al2O3催化剂X-射线光电子能谱结果 Table 2 X-ray photoelectron spectroscopy results of MnO2/Al2O3 catalyst
| ||||||||||||||||||
对MnO2/Al2O3催化剂进行X-射线衍射分析(XRD), 结果如图 3所示.由图 3可知, 衍射峰的位置(2θ=18.469、31.027、37.281、42.612、47.034)与标准图谱JCPDS#13-0373一致, 表明有Al2O3的存在, 衍射峰的位置2θ=12.784、18.108、25.712、28.842、49.865、52.857、56.929、72.714、78.590与标准图谱JCPDS#44-0141一致, 为典型的α-MnO2.
图 3(Fig. 3)
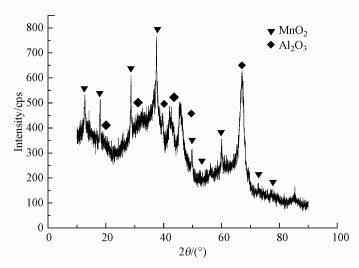 |
| 图 3 掺杂型纳米MnO2/Al2O3催化剂的XRD图谱 Fig. 3XRD pattern of doped MnO2/Al2O3 catalyst |
3.2 催化剂的表面特性催化剂的比表面积和孔结构对催化剂的催化活性、热稳定性和机械强度等方面具有重要影响.对反应前后的MnO2/Al2O3催化剂进行比表面积(BET)、孔分布及吸附性能分析发现, 臭氧催化反应前MnO2/Al2O3催化剂的比表面积为183.22 m2·g-1, 平均孔容为0.27 cm3·g-1, 平均孔径为4.87 nm;催化反应后比表面积为175.07 m2·g-1, 平均孔容为0.25 cm3·g-1, 平均孔径为5.75 nm.反应后, 催化剂比表面积和孔容略有下降, 但催化剂仍保持较大的比表面积.
对质量分数为8%的MnO2/Al2O3催化剂进行了反应前后的吸附脱附等温线分析.结果发现, MnO2/Al2O3吸附等温线属于IV型(中孔毛细凝聚型).在相对压力为0.4~1.0范围内有回滞环, 属于H3型, 相对压力在0.4左右时, 吸附质发生毛细管凝聚现象, 等温线随之上升.等温线在相对压力为0.4~1.0范围内不一致, 脱附等温线位于吸附等温线上方(称为吸附滞后).由于中孔内吸附高压时已结束, 曲线比较平稳, 此时吸附现象从外表面积上开始.在相对压力趋于1时, 吸附发生在孔径较大的位置, 曲线表现为上升趋势.反应前MnO2/Al2O3催化剂的低温氮气吸附-脱附等温线线型属于典型不可逆等温线, 两者说明催化剂表面存在介孔结构(Grunert, 1997).
3.3 臭氧微气泡表征臭氧氧化污染物的过程是传质与化学反应同时进行的复杂过程, 反应与传质之间相互影响、相互制约.臭氧在水中的传质效率与液体的紊流程度、臭氧气泡直径大小、分解动力学等因素有关.当气体流量相同时, 气泡尺寸越小, 液相边界面积越大, 臭氧和水的接触面积越大, 此时臭氧利用率越大.水中臭氧气泡的尺寸和比表面积是影响臭氧利用率和羟基自由基产生的重要因素, 影响臭氧的气液传质速率.采用激光粒度仪对微气泡粒度进行了测试, 结果表明, 臭氧微气泡的平均粒径为61.67 μm, 气泡粒径小于50 μm的气泡占28.93%.这是因为微气泡表面具有较高的ζ电位(魏婕等, 2018), ζ电位会对气泡的合并和收缩的过程产生重要影响, 随着ζ电位的升高, 静电排斥力越大, 气泡越不容易发生聚集, 导致微气泡粒径越小, 臭氧利用率增大.
Takahashi(2007)通过电子自旋共振谱证实直径 < 50 μm的微纳米气泡破裂会产生大量的· OH, · OH具有较高的氧化还原电位, 可以氧化降解一般情况下较难降解的有机污染物(初理冰等, 2007).
3.4 MnO2/Al2O3臭氧催化降解喹啉效果建立了微气泡臭氧催化反应体系, 考察了MnO2/Al2O3催化剂臭氧催化降解喹啉效果, 结果如图 4所示.MnO2/Al2O3催化剂对于喹啉的最大吸附去除率为30%, 反应60 min后, 单独臭氧微气泡氧化对喹啉的去除率为45%, 而臭氧催化氧化的去除率可达85%, 说明MnO2/Al2O3催化剂具有较高的催化活性.继续延长反应时间到90 min时, 催化氧化对喹啉的去除率达到95%.
图 4(Fig. 4)
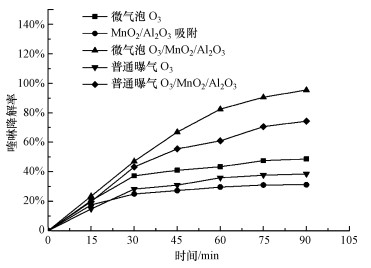 |
| 图 4 MnO2/Al2O3催化剂臭氧催化降喹啉的效果([喹啉]0=60 mg·L-1, [O3]=30 mg·L-1, [催化剂]=70 g·L-1) Fig. 4Degradation of quinoline by catalystic ozonation with MnO2/Al2O3 catalyst |
此外, 单独臭氧氧化时, 微气泡臭氧对喹啉的去除率有明显的提升作用, 这是由于臭氧微气泡不仅在水中溶解度更高, 也会促使产生更多的· OH, 有利于喹啉的降解, 且微气泡表现出更高的界面电动势(Liu et al., 2012), 有利于电子传递, 提升催化效率.此外, 相同催化剂的条件下, 臭氧微气泡催化氧化对喹啉的去除率比微孔曝气臭氧催化氧化高出20%, 这是由于臭氧溶解性更高, 在催化剂表面被激发出更多的· OH, 喹啉与催化剂表面的· OH高效接触, 从而提高了降解去除效率.
3.5 MnO2/Al2O3催化剂臭氧催化降解喹啉机理探讨对于臭氧发生链式分解反应, O2-是生成· OH的重要引发物质.TBA作为一种结构稳定的三级醇, 与臭氧分子反应速率常数为3×10-3 M-1·s-1, 远低于与· OH反应速率常数(6×108 M-1·s-1), TBA与· OH反应会导致自由基链式反应的终止(Nagarkatti, 1991;Potapenko et al., 2012;Mostrou et al., 2019).在臭氧氧化相关研究中, 一般选择TBA作为· OH的探针分子, 来探讨反应是否遵循· OH机理.本研究以TBA作为· OH的探针分子, 考察· OH在催化臭氧化降解有机物过程中的作用, 结果如图 5所示.
图 5(Fig. 5)
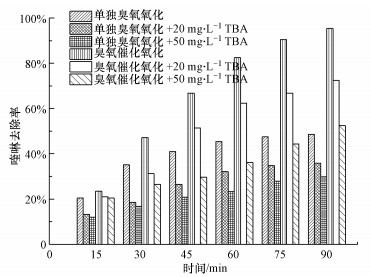 |
| 图 5 TBA对喹啉氧化去除效果的影响([喹啉]0=60 mg·L-1, [O3]=30 mg·L-1, [催化剂]=70 g·L-1) Fig. 5Effect of tert-butanol (TBA) on quinoline removal |
如图 5所示, 向反应体系中分别加入20 mg·L-1和50 mg·L-1的TBA后明显抑制了喹啉的降解过程, 单独臭氧微气泡氧化体系分别加入20 mg·L-1和50 mg·L-1的TBA, 反应90 min喹啉的去除率分别降低了12.8%和18.8%.而在其他实验条件不变的情况下, 向臭氧微气泡催化氧化体系中分别加入20 mg·L-1和50 mg·L-1的TBA后, 反应90 min后, 喹啉的去除率分别降低了23%和43%, 证明了· OH在微气泡催化臭氧化喹啉中起着重要作用.在臭氧氧化过程中, 除了占有主导氧化降解作用的· OH外, 还有臭氧直接氧化作用.TBA抑制了· OH的产生, 但不能抑制臭氧分子对有机物的氧化, 喹啉在一定程度上仍能被降解.然而, TBA作为探针分子, 仅能间接从对· OH强抑制作用角度推断出在臭氧微气泡催化氧化体系中· OH起主导作用, 反应过程中产生的· OH还需要进行进一步检测.
3.6 MnO2/Al2O3臭氧催化处理煤化工废水效果考察了不同臭氧投量对实际煤化工废水二级出水(进水水质见表 1)的TOC去除效果, 结果如图 6所示.由图 6可知, 随着臭氧投量的增加, 出水的TOC降解效果增幅显著, 不同投量下, 出水稳定后的TOC去除率分别为35%、39%、46%、54%、59%和60%.当臭氧投量较大时, 水中的臭氧达到溶解平衡, 并且与有机物快速反应, 对TOC的降解效果显著增加.但当进一步增加臭氧的投量时, 系统对TOC的去除效率不再增加, 说明参与污染物或生成的中间产物难以进一步矿化.
图 6(Fig. 6)
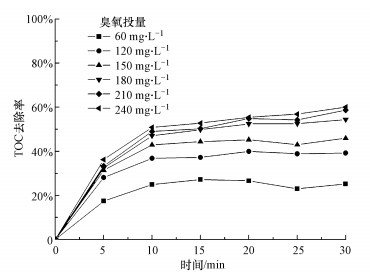 |
| 图 6 MnO2/Al2O3催化剂微气泡臭氧催化对TOC去除([COD]0=100~130 mg·L-1;[TOC]0=40~50 mg·L-1; pH=6.5~7.5) Fig. 6Removal of TOC by catalytic ozonation with MnO2/Al2O3 |
3.7 反应过程中·OH浓度的变化臭氧氧化过程中能分解生成具有强氧化性和无选择性的· OH, 能有效降解水中有机物, 是臭氧催化氧化过程中的主要活性物质.为明确降解有机物过程中的主要降解机制, 有必要检测· OH在水中的浓度变化.
香豆素荧光探测技术是目前常用的能在臭氧催化氧化过程中更加直接的检测出· OH.7-羟基香豆素具有强荧光特性, 故采用荧光光谱仪对实验中生成的7-羟基香豆素进行全扫描.本研究中考察了3种体系氧化过程中体系中的· OH浓度随时间的变化, 3种体系分别是:普通曝气臭氧氧化、臭氧微气泡氧化和臭氧微气泡催化氧化, 结果如图 7所示.
图 7(Fig. 7)
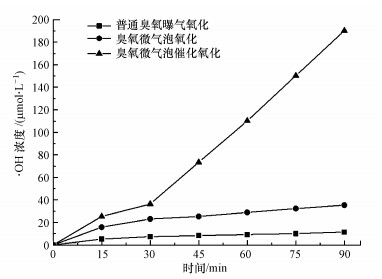 |
| 图 7 不同臭氧反应体系中· OH的浓度变化规律 Fig. 7· OH concentration change in the ozone reaction system |
由图 7可知, 3种体系中的· OH的浓度大小顺序为:普通臭氧曝气氧化<臭氧微气泡氧化<臭氧微气泡催化氧化, 在30~90 min内, · OH的浓度随时间的变化呈正相关, 臭氧微气泡催化氧化体系· OH的平均产生速率达到了60.96 μmol·L-1·min-1, 单独臭氧微气泡体系平均平均产生速率为19.05 μmol·L-1·min-1, 而普通臭氧曝气氧化体系平均平均产生速率仅有6.69 μmol·L-1·min-1.可见, 臭氧微气泡催化氧化过程中· OH的产生速率远高于臭氧微气泡氧化.这说明臭氧微气泡要比普通臭氧曝气产生· OH的能力更强, 催化剂与臭氧结合对体系中· OH的生成也有很大的促进效果, 可使得喹啉的降解速度提升.这一结果与图 5不同体系下喹啉的降解效果的趋势吻合, 这证明了单独的臭氧氧化和臭氧微气泡催化氧化对有机污染物的降解均是· OH氧化起到主导作用.
4 结论(Conclusions)1) 制备了纳米MnO2, 并以Al2O3为载体制备了掺杂型α-MnO2/Al2O3颗粒催化剂.采用SEM、BET等手段对纳米MnO2和MnO2/Al2O3进行了表征.纳米MnO2的平均粒径为50 nm, 晶型为α-MnO2;BET表征结果表明球形催化剂比表面积可达到183.22 m2·g-1, 平均孔容为0.27 cm3·g-1, 平均孔径为4.87 nm, 具有均匀的介孔结构.
2) 臭氧微气泡的平均粒径为61.67 μm.MnO2活性组分含量为8%时, 微气泡臭氧投量为30 mg·L-1时, 反应60 min后喹啉去除率能达到95%以上;反应20 min后, MnO2/Al2O3催化剂-微气泡臭氧体系对实际煤化工废水的TOC去除率可达到55%以上.
3) 在臭氧微气泡催化氧化体系中· OH的产量最高, 该体系下· OH对有机污染物的降解起到主导作用, 其平均产生速率达到60.96 μmol·L-1·min-1, 是单独臭氧微气泡体系的3倍, 是普通臭氧曝气体系的近10倍.
参考文献
| Ahmadi M, Kakavandi B, Jaafarzadeh N, et al. 2017. Catalytic ozonation of high saline petrochemical wastewater using PAC@FeⅡFe2ⅢO4; Optimization, mechanisms and biodegradability studies[J]. Separation and Purification Technology, 177: 293-303. DOI:10.1016/j.seppur.2017.01.008 |
| 初理冰, 邢新会, 等. 2007. 微米气泡强化臭氧氧化的作用机理研究[J]. 环境化学, 26(5): 622-625. |
| Grunert W. 1997. Handbook of heterogeneous catalysis[J]. Wiley-VCH: 290-291. DOI:10.1524/zpch.1999.208.Part_1_2.274 |
| Kolosov P, Yargeau V. 2018. Impact of catalyst load, chemical oxygen demand and nitrite on disinfection and removal of contaminants during catalytic ozonation of wastewater[J]. Science of the Total Environment, 651(PT.2): 2139-2147. |
| Liu S, Wang Q. 2012. The effect of different types of micro-bubbles on the performance of the coagulation flotation process for coke waste-water[J]. Journal of Chemical Technology and Biotechnology, 87(2): 206-215. DOI:10.1002/jctb.2698 |
| Lan B, Huang R, Li L, et al. 2013. Catalytic ozonation of p-chlorobenzoic acid in aqueous solution using Fe-MCM-41 as catalyst[J]. Chemical Engineering Journal, 219: 346-354. DOI:10.1016/j.cej.2012.12.083 |
| Mostrou S, Nagl A, Ranocchiari M, et al. 2019.The catalytic and radical mechanism for ethanol oxidation to acetic acid[J]. Chemical Communications, 55 |
| Nagarkatti M. 1991. Ozone in water treatment:Application and engineering[J]. Journal of Environmental Quality, 20(4): 881. |
| Potapenko E V, Andreev P Y. 2012. Catalytic oxidation of alkylbenzenes with ozone in acetic acid in the presence of strong acids[J]. Petroleum Chemistry, 52(2): 113-118. DOI:10.1134/S0965544112020120 |
| Rosal R, Gonzalo S, Santiago J, et al. 2011. Kinetics and mechanism of catalytic ozonation of aqueous pollutants on metal oxide catalysts[J]. Ozone:Science & Engineering, 33(6): 434-440. |
| Takahashi M, Chiba K, Li P. 2007a. Free-radical generation from collapsing microbubbles in the absence of a dynamic stimulus[J]. Journal of Physical Chemistry B, 111(6): 1343. DOI:10.1021/jp0669254 |
| Takahashi M. 2005. ζ potential of microbubbles in aqueous solutions:Electrical properties of the gas-water interface[J]. The Journal of Physical Chemistry B, 109(46): 21858-21864. DOI:10.1021/jp0445270 |
| Takahashi M, Chiba K, Li P. 2007b. Formation of hydroxyl radicals by collapsing ozone microbubbles under strongly acidic conditions[J]. The Journal of Physical Chemistry B, 111(39): 11443-11446. DOI:10.1021/jp074727m |
| Vittenet J, Aboussaoud W, Mendret J, et al. 2015. Catalytic ozonation with γ-Al2O3 to enhance the degradation of refractory organics in water[J]. Applied Catalysis A General: 519-532. DOI:10.1016/j.apcata.2014.10.037 |
| 王俊洁, 刁伟明. 2010. 高效混凝沉淀技术在煤化工废水处理中的应用[J]. 辽宁化工, 39(7): 714-715. |
| 温舒涵, 姚沁坪, 李炜琦, 等. 2018. MnO2陶粒臭氧氧化催化剂的制备及其性能研究[J]. 化工环保, (2): 157-163. DOI:10.3969/j.issn.1006-1878.2018.02.006 |
| 魏婕, 蒋毓婷, 李军, 等. 2018. 微纳米气泡特征及其在环境治理中的应用[J]. 环境工程, 36(10): 75-79. |
| Wu Z, Zhang G, Zhang R, et al. 2018. Insights into mechanism of catalytic ozonation over practicable mesoporous Mn-CeOx/γ-Al2O3 catalysts[J]. Industrial & Engineering Chemistry Research, acs.iecr.7b04516 |
| Zhang J, Huang G Q, Liu C, et al. 2018.Synergistic effect of microbubbles and activated carbon on the ozonation treatment of synthetic dyeing wastewater[J]. Separation & Purification Technology, 201 |
| Zhai X, Chen Z, Zhao S, et al. 2010. Enhanced ozonation of dichloroacetic acid in aqueous solution using nanometer ZnO powders[J]. Journal of Environmental Sciences, 22(10): 1527-1533. DOI:10.1016/S1001-0742(09)60284-9 |
| Zhao W, Shi H. 2003. Degradation mechanism of cationic red X-GRL by ozonation[J]. Chinese Chemical Letters, 4(12): 1309-1312. |
