 , 陈桂香1, 刘旭阳1, 金强1, 王晓彤2, 曾从盛1,3, 王维奇1,3
, 陈桂香1, 刘旭阳1, 金强1, 王晓彤2, 曾从盛1,3, 王维奇1,3

1. 福建师范大学地理研究所, 福州 350007;
2. 福建师范大学生命科学学院, 福州 350117;
3. 福建师范大学湿润亚热带生态地理过程教育部重点实验室, 福州 350007
收稿日期: 2020-02-17; 修回日期: 2020-04-18; 录用日期: 2020-04-18
基金项目: 国家自然科学基金(No.41571287);福建省高校****科研人才培育计划2017
作者简介: 林少颖(1996-), 男, E-mail:lsy1881438@163.com
通讯作者(责任作者): 王维奇, E-mail:wangweiqi@finu.edu.cn
摘要:本研究以闽江口秋茄湿地、漳江口白骨壤湿地和闽江口芦苇湿地为研究地点,采集土壤样品并通过高通量测序分析了土壤细菌的群落结构及其多样性,以此探讨互花米草入侵对河口湿地土壤细菌群落结构的影响.结果表明:①互花米草入侵河口湿地后,改变了湿地土壤细菌种类的相对丰度,且入侵不同的湿地群落,细菌优势菌属及相对丰度具有差异;②互花米草入侵秋茄和芦苇湿地后使土壤细菌多样性升高,互花米草入侵白骨壤湿地后使土壤细菌多样性降低;③互花米草入侵并未明显改变细菌门水平的群落组成,湿地土壤主要的细菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes);④互花米草入侵改变了湿地土壤细菌的优势菌属,使白骨壤湿地土壤Ruminococcus_2、Faecalibacterium的相对丰度降低,同时白骨壤湿地土壤出现了Thiohalophilus、Hallea等优势菌属;⑤环境因子和活性碳组分能够影响湿地土壤中细菌的相对丰度,细菌Thiohalophilus的相对丰度与湿地土壤盐度呈显著正相关(p < 0.05),Sideroxydans的相对丰度与湿地土壤pH呈显著负相关(p < 0.01),Ruminococcus_2的相对丰度与土壤易分解有机碳(LOC)呈显著负相关(p < 0.01);Blautia、Bacteroidess的相对丰度与土壤可溶性有机碳(DOC)呈显著正相关(p < 0.01).本研究可为深入研究互花米草入侵机制及生态影响提供重要科学依据.
关键词:互花米草入侵河口湿地细菌多样性群落结构
Effects of Spartina alterniflora invasion on soil bacterial community structure and diversity in estuarine wetland
LIN Shaoying1
 , CHEN Guixiang1, LIU Xuyang1, JIN Qiang1, WANG Xiaotong2, ZENG Congsheng1,3, WANG Weiqi1,3
, CHEN Guixiang1, LIU Xuyang1, JIN Qiang1, WANG Xiaotong2, ZENG Congsheng1,3, WANG Weiqi1,3

1. Institute of Geography, Fujian Normal University, Fuzhou 350007;
2. College of Life Science, Fujian Normal University, Fuzhou 350117;
3. Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fujian Normal University, Fuzhou 350007
Received 17 February 2020; received in revised from 18 April 2020; accepted 18 April 2020
Abstract: In this study, we collected soil samples from three sites (i.e., Kandelia candel wetland in Minjiang River Estuary, the Avicennia marina wetland in Zhangjiang River Estuary, and the Phragmites australis wetland in Minjiang River Estuary), and soil bacterial community structure and diversity was measured by high-throughput sequencing in the native and Spartina alterniflora invasion sites. The results showed: ① The relative abundance of soil bacterial groups were changed after Spartina alterniflora invasion in estuarine wetland. Besides, the relative abundance of dominant bacterial genera was also different in various wetland. ② Soil bacterial diversity was increased by Spartina alterniflora invasion in the Kandelia candel and Phragmites australis wetland, while soil bacterial diversity was increased in the Avicennia marina wetland. ③ Bacteria community composition was not significantly changed by Spartina alterniflora invasion at phylum level. Bacterial phyla were Proteobacteria, Firmicutes, Chloroflexi, Acidobacteria and Bacteroidetes in these wetland soils. ④ Bacterial community composition was altered by Spartina alterniflora invasion at genus level, and the relative abundance of Ruminococcus_2 and Faecalibacterium was decreased, however, dominant genera such as Thiohalophilus and Hallea was increased in Avicennia marina wetland. ⑤ The relative abundance of bacteria was influenced by the environmental factors and active carbon component in wetland soils. The relative abundance of Thiohalophilus was significantly and positively correlated with the soil salinity (p < 0.05), and the relative abundance of Sideroxydans was significantly and negatively correlated with soil pH (p < 0.01). There was a significant and negative correlation between the relative abundance of Ruminococcus_2 and labile organic carbon (p < 0.01). The relative abundance of Blautia and Bacteroides were significantly and positively correlated with soil dissolved organic carbon (p < 0.01). The study could provide important scientific basis for further study of Spartina alterniflora invasion mechanism and the related ecological impact.
Keywords: Spartina alterniflora invasionestuarine wetlandbacteriadiversitycommunity structure
1 引言(Introduction)土壤微生物在河口湿地生态系统的形成、演化、稳定及生态功能等过程扮演着重要的角色, 与河口湿地环境和元素生物地球化学循环之间的关系十分密切(Boyle et al., 2008; Zhang et al., 2017).外来植物通过根系分泌物、脱落物等释放的化感物质, 引起土壤理化性质变化, 对土壤微生物群落结构选择塑造, 使得土壤营养元素循环和能量流动发生改变, 从而影响植物生长发育过程.因此, 深入开展外来植物入侵对土壤微生物的影响是十分必要的(Callaway et al., 2004; Gao et al., 2019).
互花米草是一种多年生耐盐草本植物, 作为外来入侵物种(Feng et al., 2014; Zhang et al., 2017), 其生态适应能力和繁殖能力强, 引入后在中国沿海湿地大面积扩散生长, 侵占本地物种生态位(郑洁等, 2017), 影响入侵地的生长环境, 并形成单一的优势群落(Nie et al., 2009; Subudhi et al., 2011), 降低了当地生物多样性, 破坏了原生态系统的结构和功能.近年来, 随着研究的深入, 从土壤生物多样性的角度探讨互花米草入侵影响的研究越来越广泛, 如Quan等(2016)在长江口盐沼地区研究了互花米草入侵对微生境和底栖生物群落的影响;Liu等(2017)研究发现互花米草入侵强烈改变了九龙江口红树林湿地的土壤微生物群落结构和组成;Zheng等(2018)进一步探讨了互花米草入侵对红树林根际细菌群落的影响并探究土壤功能的控制因子;此外, 左平等(2014)利用BIOLOG ECOPLATE技术探讨了原生滨海湿地土壤中的微生物群落功能多样性;郑洁等(2017)采用PLFA法探讨了互花米草对闽江河口湿地红树林土壤微生物群落结构的影响.而借助高通量测序技术研究互花米草对入侵对典型的河口湿地类型包括秋茄、白骨壤和芦苇湿地土壤细菌群落丰度及多样性的影响尚鲜见报道.
河口湿地是受海陆交互作用的独特生态系统, 在维持生物多样性、涵养水源和提高动植物资源等方面发挥着重要作用(Bianch et al., 2013; He et al., 2020), 同时也是对全球变化响应最为敏感的区域(Yu et al., 2015), 目前已成为相关研究的热点.闽江口和漳江口湿地是我国东南沿海区域重要的河口湿地, 位于福建省.由于福建省是我国最早引种互花米草的地区, 使得该区域受互花米草入侵较为严重, 土著植物退化迅速(Wang et al., 2015;李家兵等, 2016;金宝石等, 2016a;2016b).以往的相关研究主要集中互花米草入侵机制及其对土著生态系统生物量、元素循环的影响和治理措施等方面(Wang et al., 2014; Yu et al., 2014; Quan et al., 2018), 而对植物入侵后地下土壤系统中生物特征的变化研究鲜见报道.随着新技术的发展, 尤其是高通量等分子生物学技术的出现为研究土壤微生物群落结构与多样性提供了有利条件, 但目前从较大的区域尺度上分析互花米草入侵对不同土著植物群落下土壤微生物特征的影响研究尚未见报道.实际上, 这一方面的研究是科学评价互花米草入侵对河口湿地土壤功能影响的重要方面, 开展相关研究将弥补河口湿地土壤生物学研究领域的不足.为此, 本研究选取秋茄、白骨壤、芦苇3种典型植被、互花米草入侵区域土壤作为研究对象, 借助Illumina高通量测序技术探索互花米草入侵对河口湿地土壤细菌群落组成及多样性的影响, 以期为红树林、芦苇、互花米草土壤微生物之间的耦合作用研究提供理论依据, 同时也为外来植物入侵的湿地生态系统的保护与恢复提供科学依据.
2 研究区与研究方法(Study area and methods)2.1 研究区和采样点研究区位于福建闽江口国家级湿地自然保护区和福建漳江口红树林国家级自然保护区.闽江口湿地(26°00′36″~26°03′42″N, 119°34′12″~119°40′40″E)地处福建省长乐市闽江入海口, 属亚热带海洋性季风气候, 区内气候暖热湿润, 降水丰沛, 年均气温为19.6 ℃, 年均降水量为1346 mm, 主要植被类型包括土著种芦苇(Phragmites australis)、秋茄(Kandelia candel)和外来入侵种互花米草(Spartina alterniflora)(胡伟芳等, 2015;陈桂香等, 2017).漳江口湿地位于福建省漳州市云霄县竹塔村(24°23′33″~24°27′38″N, 117°23′~117°32′E), 该区属亚热带海洋性季风气候, 气候温暖湿润, 年均气温为21.2 ℃, 年平均降雨量为1714 mm(陈志杰等, 2016;陈桂香等, 2017), 保护区内的植被群落以秋茄和白骨壤(Avicennia marina)等为主.随着互花米草的不断入侵, 闽江口和漳江口的土著种出现不同程度的退化, 该研究区也成为研究互花米草入侵河口湿地的典型区域.因此, 选取闽江口互花米草入侵秋茄湿地、互花米草入侵芦苇湿地, 以及漳江口互花米草入侵白骨壤湿地作为3个试验区, 每个试验区设置2个采样点, 即闽江口秋茄湿地(MQ1)、闽江口互花米草湿地(MM1, 入侵前为秋茄);漳江口白骨壤湿地(ZB2)、漳江口互花米草湿地(ZM2, 入侵前为白骨壤);闽江口芦苇湿地(ML3)、闽江口互花米草湿地(MM3, 入侵前为芦苇).图 1为采样点分布及概念模型图.
图 1(Fig. 1)
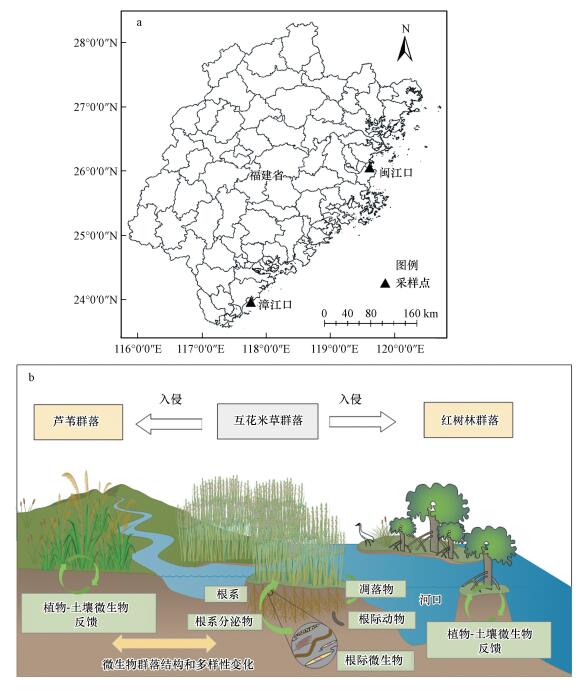 |
| 图 1 试验区采样点(a)和概念模型(b) Fig. 1Distribution of sampling plots(a) and conceptual model(b) |
2.2 样品采集和处理遵循样地布设和样品采集的典型性和代表性原则, 本试验于2015年6—8月, 在涨潮前, 在闽江口秋茄湿地(MQ1)、闽江口互花米草湿地(MM1)、漳江口白骨壤湿地(ZB2)、漳江口互花米草湿地(ZM2)、闽江口芦苇湿地(ML3)、闽江口互花米草湿地(MM3)中分别设置1个大样区.每个样区内随机设置3个采样点, 在每个采样点去除表面植被和枯枝落叶后用采土器采集0~10 cm土层的土壤, 装入已灭菌的自封袋中, 并用便携式保温箱密封保存, 带回实验室, 挑去植物残体根系后, 采集的每份土样分为两部分, 一部分风干后过筛并置于4 ℃冰柜保藏, 用于土壤理化性质和活性碳组分指标测定, 另一部分置于-20 ℃冰柜保存用于后续DNA的提取及细菌测定.
2.3 土壤细菌群落结构分析—高通量测序技术2.3.1 基因组DNA的提取和PCR扩增采用CTAB方法对土壤样品的基因组DNA进行提取(刘璐等, 2015;丁新景等, 2018), 之后用琼脂糖凝胶电泳检测DNA的纯度和浓度, 取适量的DNA提取液于离心管中, 用无菌水稀释至1 ng·μL-1.以稀释后的基因组DNA为模板, 根据测序区域的选择, 使用带Barcode的特异引物、New England Biolabs公司的Phusion? High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR, 确保扩增效率和准确性.其中, 16S V3~V4区扩增引物及序列为341F(CCTAYGGGRBGCASCAG)和806R(GGACTACNNGGGTATCTAAT).PCR扩增程序为:95 ℃预变性5 min, 接着进行25个循环, 包括94 ℃变性1 min, 57 ℃退火45 s, 72 ℃延伸1 min;循环结束后72 ℃延伸10 min, 16 ℃延伸5 min.扩增体系为30 μL, 2×Taq PCR mix 4 μL, Prime F(10 μmol·L-1)1 μL, Prime R(10 μmol·L-1)1 μL, 模板DNA 2.5 μL, 超纯水(ddH2O)2.5 μL.
2.3.2 PCR产物的混样和纯化PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测40 min, 根据PCR产物浓度进行等量混样, 充分混匀后使用1×TAE浓度2%的琼脂糖凝胶电泳纯化PCR产物, 剪切回收目标条带.产物纯化试剂盒使用的是Thermo Scientific公司GeneJET胶回收试剂盒回收产物.
2.3.3 文库构建和上机测序使用Thermofisher公司的Ion Plus Fragment Library Kit 48rxns建库试剂盒进行文库的构建, 构建好的文库经过Qubit定量和文库检测合格后, 使用Thermofisher的Life Ion S5TM进行上机测序.
2.4 土壤理化性质的测定土壤含水量采用烘干法测定(鲁如坤, 1999);土壤容重采用环刀法测定(鲁如坤, 1999);土壤pH值和盐度(以电导率表征盐度)的测定:采用水土质量比为5:1, 于250 r·min-1速度振荡30 min, 静置30 min后分别用pH计(Starter 300, 美国)和电导仪(2265FS, 美国)测定.
2.5 土壤活性碳组分的测定土壤有机碳(SOC)采用土壤碳氮元素分析仪(Elementar Vario MAX CN, 德国)测定;土壤易分解有机碳(LOC)使用333 mmol·L-1高锰酸钾氧化法(Blair et al., 1995)提取之后, 采用紫外分光光度计(Shimadzu UV-2450, 日本)测定;土壤可溶性有机碳(DOC)使用0.5 mol·L-1硫酸钾浸提;土壤微生物生物量碳(MBC)经过氯仿熏蒸-K2SO4浸提(Murphy et al., 2000).
2.6 数据处理和分析应用Excel2016及SPSS23.0统计分析软件对结果数据进行整理, 为了研究不同处理的物种组成多样性, 利用Mothur(V.1.36.1)对原始DNA序列进行过滤处理, 去除嵌合体, 得到优化序列;采用Uparse软件聚类分析所有处理Effective Tags序列, 以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units), 构建OTUs时选取代表性序列(OTUs中出现频次最高的序列);对比SILVA(http://www.arb-silva.de)SSUrRNA数据库, 采用Mothur方法对OTUs的代表序列进行物种注释分析;结合物种组成信息得到土壤样品中细菌物种丰度.利用QIIME软件(Version 1.7.0)计算土壤样品的细菌多样性:物种数、Shannon指数、Chao1指数、ACE指数和覆盖度(Coverage).使用R软件(Version 2.15.3)绘制PCA图, 分析各土壤样品OTUs相似性.细菌丰度与环境影响因子、活性碳组分的关系采用Spearman相关性分析.
3 结果与分析(Results and analysis)3.1 互花米草入侵后湿地土壤理化性质和碳组分的变化3.1.1 互花米草入侵后湿地土壤理化性质的变化互花米草入侵河口湿地后土壤理化性质的变化具体见尹晓雷等(2020)的研究.总体表现为:互花米草入侵红树林(秋茄和白骨壤)后, 土壤含量有所增加, 而土壤容重有所降低, 尤其是互花米草入侵白骨壤后差异达到显著水平(p < 0.05);闽江口的秋茄湿地在互花米草入侵后pH值和盐度均无显著变化(p>0.05);而漳江口的白骨壤湿地和互花米草湿地土壤pH值变化与土壤盐度相反, 其中显著提高了土壤盐度(p < 0.05), 提高比例为35%.互花米草入侵闽江河口的芦苇湿地后, 土壤pH值和盐度分别提高了3.8%和2.9%.
3.1.2 互花米草入侵后湿地土壤碳组分的变化互花米草的入侵对河口湿地土壤产生了不同的影响.如表 1所示, 互花米草入侵红树林(秋茄、白骨壤)湿地后, 一定程度上降低了土壤SOC含量, 增加了土壤LOC含量, 特别是在闽江口秋茄湿地, 差异显著(p < 0.05);土壤DOC和MBC含量均显著降低(p < 0.05).互花米草入侵白骨壤湿地后, 土壤SOC含量变化与LOC含量变化正好相反, SOC含量显著增加;土壤DOC含量略有增加, MBC含量显著增加(p < 0.05).
表 1(Table 1)
| 表 1 互花米草入侵湿地后土壤碳组分的变化 Table 1 Changes of soil organic carbon fractions in wetland after the invasion of Spartina alterniflora | |||||||||||||||||||||||||||||||||||||||||||||
表 1 互花米草入侵湿地后土壤碳组分的变化 Table 1 Changes of soil organic carbon fractions in wetland after the invasion of Spartina alterniflora
| |||||||||||||||||||||||||||||||||||||||||||||
3.2 互花米草入侵后湿地土壤细菌的多样性分析经过高通量测序以97%的相似度划分, 闽江口秋茄湿地和互花米草湿地得到的有效OTUs数目分别为3901、4235个;漳江口白骨壤湿地和互花米草湿地得到的有效OTUs数目分别为4715、4590个;闽江芦苇湿地和互花米草湿地得到的有效OTUs数目分别为3831、4320个.如表 2所示, 各样品文库的覆盖度(Coverage)为99.2%~99.5%, 说明样品土壤中基因序列被检出的概率较高, 本次测序结果能够反映湿地土壤中细菌群落的真实情况.Shannon指数是用来估算样品中微生物多样性的指数之一, Shannon值越大, 说明微生物群落的多样性越高.由表 2可知, 互花米草入侵闽江口秋茄湿地和芦苇湿地后, 明显提高了土壤细菌群落的多样性, 而互花米草入侵白骨壤湿地后, 土壤细菌群落的多样性则略微降低, 说明其群落结构的稳定性较强;Shannon值的变动与OTUs数量的变化规律一致.Chao1指数和ACE指数是估算群落中OTUs数目的指数, 可用来评估样品中微生物群落的丰富度.从Chao1指数和ACE指数来看, 互花米草入侵秋茄和芦苇湿地后, 土壤中微生物群落的丰富度均提高, 而入侵白骨壤湿地则降低了土壤细菌群落的丰富度.
表 2(Table 2)
| 表 2 互花米草入侵后湿地土壤细菌的多样性指数 Table 2 Diversity index of soil bacteria in wetland after the invasion of Spartina alterniflora | ||||||||||||||||||||||||||||||||||||||||||||||
表 2 互花米草入侵后湿地土壤细菌的多样性指数 Table 2 Diversity index of soil bacteria in wetland after the invasion of Spartina alterniflora
| ||||||||||||||||||||||||||||||||||||||||||||||
3.3 互花米草入侵后湿地土壤细菌OTUs分布分别对互花米草入侵湿地土壤中细菌OTUs绘制韦恩图(图 2).韦恩图可用来分析多个样品中所共有的和特有的OTUS数目, 能够较为直观地表现不同样品的OTUs组成相似性及重叠情况.图 2显示, 闽江口秋茄湿地和互花米草湿地特有的OTUs分别为971、1305个;漳江口白骨壤湿地和互花米草湿地特有的OTUs分别为1272、1147个;闽江口芦苇湿地和互花米草湿地特有的OTUs分别为954、1443个.由此可见, 互花米草入侵秋茄、白骨壤和芦苇湿地后, 较大程度地改变了土壤细菌的群落组成.
图 2(Fig. 2)
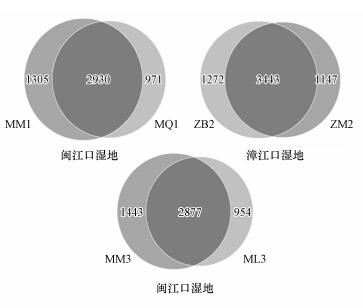 |
| 图 2 互花米草入侵后湿地土壤细菌OTUs韦恩分布 Fig. 2Venn of soil bacteria OTUs distribution in wetland after the invasion of Spartina alterniflora |
3.4 互花米草入侵后湿地土壤细菌群落组成结构3.4.1 门(Phylum)水平的细菌群落组成结构根据物种注释结果, 选取每个样品在门水平上最大丰度排名前10的物种, 生成的门水平组成结构如图 3a所示.由图可知, 秋茄、白骨壤、芦苇湿地及互花米草入侵湿地土壤样品中相对丰度较高的门分别为:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)、绿菌门(Chlorobi)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes), 其中, 变形菌门、厚壁菌门、绿弯菌门、酸杆菌门、拟杆菌门、硝化螺旋菌门6个门的占比之和高达80%, 表明互花米草的入侵并未明显改变细菌门水平的群落组成.但互花米草入侵不同的湿地类型, 对土壤细菌群落结构的影响并不一致, 主要表现在变形菌门和厚壁菌门相对丰度的改变.如互花米草入侵秋茄湿地后, 变形菌门和厚壁菌门的相对丰度均有所降低, 而入侵芦苇湿地后相对丰度则有所升高;漳江口白骨壤湿地在互花米草入侵后, 变形菌门的相对丰度有显著升高, 而厚壁菌门则显著降低.
图 3(Fig. 3)
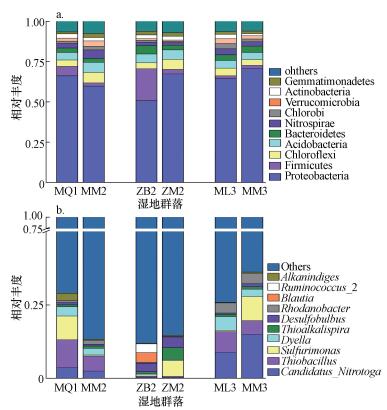 |
| 图 3 互花米草入侵后湿地土壤细菌门(a)和属(b)水平群落组成 Fig. 3Community composition of soil bacteria at phylum(a) and genus(b) level in wetland after the invasion of Spartina alterniflora |
3.4.2 属(Genus)水平的细菌群落组成结构互花米草入侵秋茄、白骨壤、芦苇湿地后土壤细菌属水平群落组成如图 3b所示.本研究检测到相对丰度较高的细菌属有:硝基念珠菌属(Candidatus_Nitrotoga)、硫杆菌属(Thiobacillus)、硫尿单胞菌属(Sulfurimonas)、Dyella、硫碱螺旋菌属(Thioalkalispira)、脱硫弧菌属(Desulfobulbus)、罗丹诺菌属(Rhodanobacter)、布劳特氏菌属(Blautia)、瘤胃球菌属_2(Ruminococcus_2)、Alkanindiges.在属水平群落组成上, 互花米草入侵秋茄湿地后, 硫杆菌属和硫尿单胞菌属的相对丰度明显降低;而芦苇湿地受到互花米草入侵后, 这2种菌属的相对丰度明显升高, 表明互花米草入侵不同的湿地群落, 对土壤细菌属水平的群落组成有较大的影响.互花米草入侵白骨壤湿地后, 硫尿单胞菌属的相对丰度有所增加, 瘤胃球菌属_2的相对丰度明显降低, 且未检测出布劳特氏菌属, 表明互花米草的入侵不仅改变了土壤细菌的相对丰度和群落组成, 也改变了土壤中细菌的多样性.
3.5 互花米草入侵后湿地土壤细菌属差异分析为了进一步探究互花米草入侵前后湿地土壤中细菌优势菌属的差异, 选取相对丰度较高的前35位的菌属, 根据其在每个样品中的丰度信息, 从物种和样品两个层面进行聚类, 绘制成热图.如图 4所示, 闽江口秋茄湿地的优势菌属为Cellulomonas、Alkanindiges、Clostridium_sensu_stricto_13;互花米草入侵秋茄湿地后的优势菌属为Anaeromyxobacter.漳江口白骨壤湿地的优势菌属为Marinobacterium、Ruminnococcus、Bacteroides等;互花米草入侵白骨壤湿地后的优势菌属为Thioalkalispira、Thiohalophilus、Sulfurovum.闽江口芦苇湿地的优势菌属为Candidatus_Planktophila;互花米草入侵芦苇湿地后的优势菌属为Desulfurivibrio、Desulfocapsa.可以看出, 不同细菌属在不同样品中的相对丰度具有一定的差异, 各个样品的优势菌属并不相同, 表明互花米草的入侵改变了土壤微生物的生存环境, 从而使得土壤中的优势菌属也有所改变.
图 4(Fig. 4)
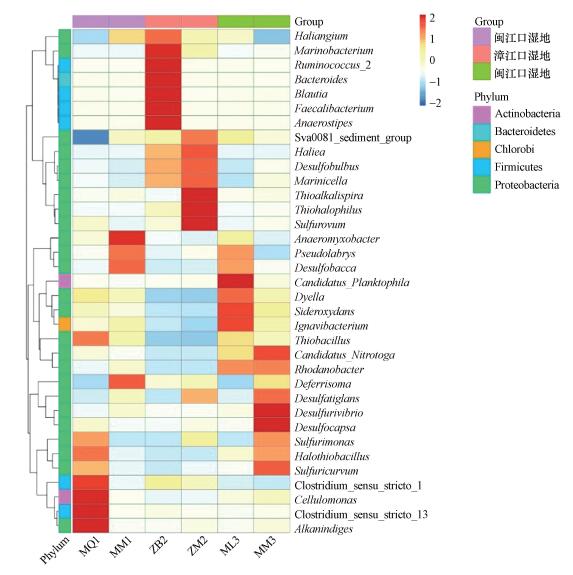 |
| 图 4 互花米草入侵后湿地土壤细菌相对丰度聚类热图 Fig. 4Species relative abundance cluster heatmap of soil bacteria in wetland after the invasion of Spartina alterniflora |
3.6 互花米草入侵后湿地土壤细菌群落组成的主成分分析为了能够更加直观地揭示互花米草入侵对土壤细菌群落组成结构的影响, 绘制了PCA分析图.如图 5所示, 提取的前2个主成分的方差累计贡献率为54.47%, 说明这2个主成分是影响互花米草入侵前后土壤细菌群落差异的主要贡献者.图中各个点代表不同的湿地群落, 点距离越远, 表示细菌群落结构差异越显著.从图中可知, 互花米草入侵闽江口的秋茄湿地和芦苇湿地前后的土壤在主成分1轴上有一定的距离, 而漳江口白骨壤湿地和互花米草入侵白骨壤湿地的土壤在主成分1轴和2轴均距离较远.PCA分析结果说明, 互花米草入侵白骨壤湿地前后土壤细菌群落结构的变化受到这两个主成分的作用较大, 对其细菌群落组成有较为显著的影响, 而对秋茄湿地和芦苇湿地影响较小.
图 5(Fig. 5)
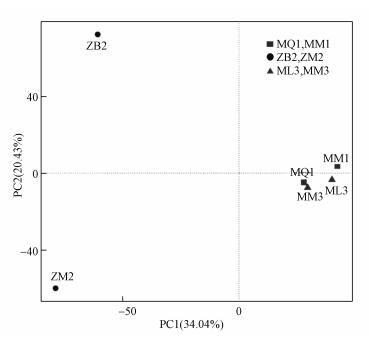 |
| 图 5 互花米草入侵后湿地土壤细菌群落结构PCA分析 Fig. 5PCA analysis of soil bacterial community structure in wetland after the invasion of Spartina alterniflora |
3.7 湿地土壤细菌物种多样性与环境因子及活性碳组分相关性分析3.7.1 湿地土壤细菌物种多样性与环境因子相关性分析为了解环境因子对细菌群落多样性的影响, 本研究对细菌多样性与环境因子之间进行Spearman相关性分析(图 6).从图中可以看出, 湿地土壤细菌丰富度与土壤盐度、pH、含水量及容重之间均存在相关性.Thiohalophilus、Hallea细菌的相对丰度与湿地土壤盐度呈显著正相关(p < 0.05);Sideroxydans细菌的相对丰度与湿地土壤pH呈显著负相关(p < 0.01), 且有较多细菌的相对丰度与土壤pH值呈显著负相关(p < 0.05), 如细菌Ignavibacterium、Rhodanobacter、Dyella、Candidatus_Nitrotoga;Rhodanobacter细菌的相对丰度与土壤含水量呈显著负相关(p < 0.05).此外, 通过绘制CCA图(图 7)可知, 互花米草入侵秋茄湿地及芦苇湿地的土壤细菌群落与土壤容重、易分解有机碳含量呈正相关.
图 6(Fig. 6)
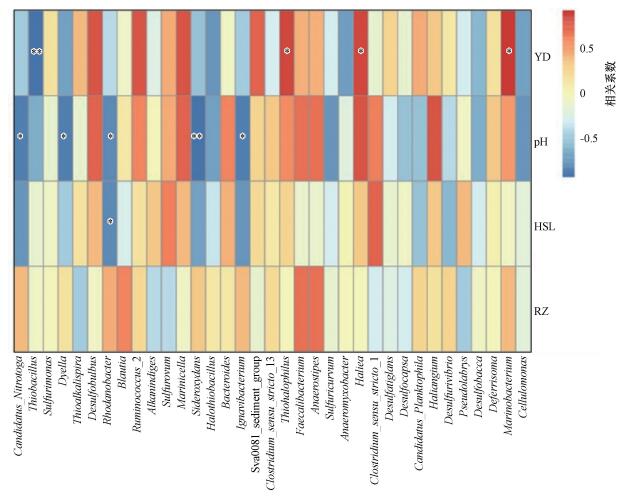 |
| 图 6 湿地土壤细菌物种多样性与环境因子相关性(纵向为环境因子信息, 横向为物种信息, 中间热图对应的值为Spearman相关系数r, 介于-1~1之间, r < 0为负相关, r>0为正相关, 标*表示显著性检验p < 0.05;YD:盐度;HSL:含水量;RZ:容重;下同) Fig. 6Correlation between soil bacterial species diversity and environmental factors in wetland |
图 7(Fig. 7)
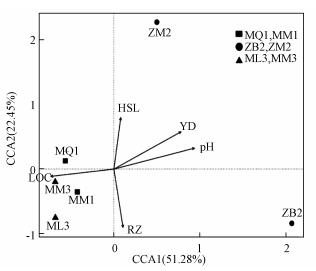 |
| 图 7 湿地土壤细菌群落结构与环境因子CCA分析 Fig. 7CCA analysis of soil bacterial community structure and environmental factors in wetland |
3.7.2 湿地土壤细菌物种多样性与活性碳组分相关性分析湿地土壤细菌的相对丰度同样受到活性碳组分的影响, 如图 8所示, 湿地土壤细菌丰富度与土壤有机碳(SOC)、易分解有机碳(LOC)、可溶性有机碳(DOC)及微生物生物量碳(MBC)之间均存在相关性.土壤SOC与Halothiobacillus的相对丰度呈显著正相关(p < 0.01), 与Sulfuricurvum的相对丰度呈显著负相关(p < 0.05);土壤LOC与Ruminococcus_2细菌的相对丰度呈显著负相关(p < 0.01), 与Marinobacterium细菌的相对丰度呈显著负相关(p < 0.05), 与Cellulomonas细菌的相对丰度呈显著正相关(p < 0.05);土壤DOC与Blautia、Ruminococcus_2、Bacteroides、Faecalibacterium及Anaerostipes呈显著正相关(p < 0.01);土壤MBC与Desulfobulbus、Marinicella的相对丰度呈显著正相关(p < 0.01).
图 8(Fig. 8)
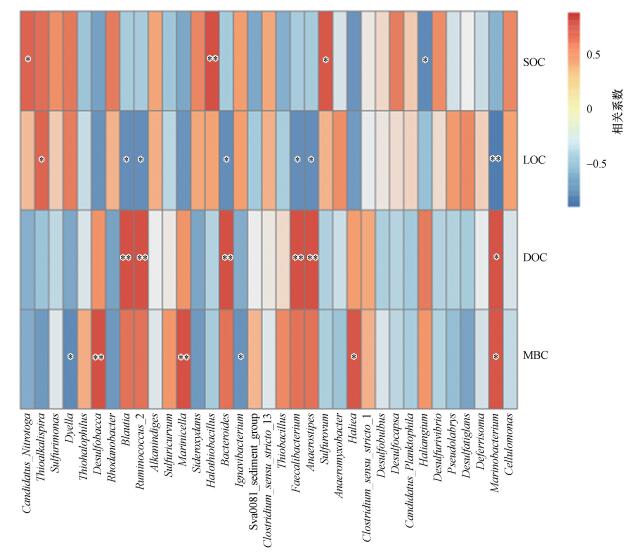 |
| 图 8 湿地土壤细菌物种多样性与活性碳组分相关性 Fig. 8Correlation between soil bacterial species diversity and activated carbon component in wetland |
4 讨论(Discussion)4.1 互花米草入侵对河口湿地土壤细菌多样性及群落结构的影响外来植物入侵将改变原生群落和生态系统的植物种类和群落结构(Vilà et al., 2011), 而植被与土壤乃至土壤微生物之间存在明显的反馈机制, 从而影响根际土壤微生物群落结构和多样性(陈桂香等, 2017;郑洁等, 2017).已有研究发现, 植被类型、植物根系分泌物和凋落物等对细菌群落组成和结构变化有显著影响(Doornbos et al., 2012; Jiang et al., 2013).此外, 土壤细菌群落的生长又受控于土壤环境因子, 对土壤环境的变化极为敏感(Lin et al., 2004).本研究发现, 互花米草入侵不同的河口湿地群落, 对土壤细菌多样性的影响效应不同.互花米草入侵闽江口秋茄湿地后, 土壤细菌群落的多样性和丰富度均明显提高, 这与郑洁等(2017)、廖丹等(2018)的研究结果一致, 这可能是由于秋茄湿地在互花米草入侵后土壤含水量有所增加, 容重有所降低, 适宜的土壤水分条件可为细菌的生长繁殖创造良好的条件(丁新景等, 2018).有研究发现, 相比于红树林, 互花米草入侵后有较高的含水量可能是因为互花米草地下根系十分密集及有较多的螃蟹洞穴(陈桂香等, 2017), 而且互花米草具有较强的促淤能力, 使得新淤积的土壤结构较为松疏, 含水量较高(Craft, 2007);此外, 米草根系的生长还能疏松土壤, 一定程度上能改善土壤的供气状况, 稳定土壤pH值(杭子清等, 2014), 从而创造土壤内丰富多样的微环境.漳江口的白骨壤湿地在受到互花米草入侵后, 细菌群落的多样性和丰富度降低, 这是由于互花米草的入侵显著增加了土壤盐度(p < 0.05), 造成土壤中细菌渗透胁迫, 抑制细菌的代谢活动, 降低了细菌多样性(刘方春等, 2014);另外, 盐胁迫抑制了植物根系的生长并减少根系分泌物, 作为细菌营养物质的主要来源, 根系分泌物的减少则会促使细菌群落的种类及数量降低(路海玲等, 2011).互花米草入侵闽江口芦苇湿地后, 增加了土壤细菌群落的多样性和丰富度, 这是由于相比芦苇, 互花米草作为C4植物, 具有较高的净光合速率和细根生物量, 生长季较长, 生命活力较强, 植被对土壤的反馈也促使微生物活动同样活跃(Nyman et al., 2006);此外, 互花米草有较为发达的通气组织, 提高了土壤的通气性, 使得根系周围土壤的溶氧度得到改善(金宝石等, 2016a;2016b), 有利于好氧菌的繁殖生长.
4.2 互花米草入侵对河口湿地土壤优势细菌菌群的影响互花米草的入侵改变了土壤原有的微环境, 从而影响了土壤中细菌群落的多样性、丰富度及优势菌群(白静等, 2017;王晓彤等, 2019).本研究结果显示, 互花米草入侵红树林湿地和芦苇湿地后, 土壤主要的细菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes), 这与廖丹等(2018)、李虎等(2014)的研究结果基本一致, 表明互花米草入侵并未明显改变细菌门水平的群落组成, 特别是芦苇湿地与互花米草入侵芦苇湿地, 这是由于这2个群落的植被生长相似, 且同属禾本科(左平等, 2014), 因此, 在门水平上发育了相似的细菌群落.但细菌优势菌属却有所不同, 互花米草的入侵使得芦苇湿地优势菌属Candidatus_Planktophila的相对丰度降低, 而使Desulfurivibrio、Desulfocapsa等成为优势菌属.这是由于脱硫弧菌属(Desulfurivibrio)这类硫酸盐还原菌常存在于大型植物如互花米草(廖丹等, 2017), 一方面, 硫酸盐还原菌在厌氧条件下, 利用有机质作为电子供体, 硫酸盐作为电子受体, 产生硫化氢(H2S), 产生的H2S会随着潮汐的影响而被释放至周围区域, 因此, 将直接或间接地危害互花米草入侵区域的其他植被;另一方面, 硫酸盐还原菌还原硫酸盐产生硫化物与铁共存, 形成植物不可利用的硫化铁, 降低了生态环境中植被可利用铁, 使植物的生长受到影响, 与外来物种互花米草的竞争力则会下降, 因此, 互花米草根际土壤中的优势菌属—硫酸盐还原菌从某种程度上为互花米草入侵提供了条件(李虎等, 2014).这也从侧面论证了互花米草入侵在一定程度上会改变部分有利于自身生长的、与土壤环境相关的微生物类群丰度, 竞争有利的生存条件, 迅速扩张实现入侵(曾艳等, 2011;郑洁等, 2017).这与众多****的研究结论一致, 如Li等(2007)等研究发现薇甘菊(Mikania micrantha)的入侵显著改变了入侵地土壤微生物群落组成;Zou等(2006)研究发现乌柏成功入侵的原因可能是改变了入侵地土壤细菌的丰富度和群落多样性;也有部分****研究入侵中国的植物紫茎泽兰(Ageratina adenophora), 发现该植物入侵区的土壤氨氧化细菌、真菌和自生固氮菌的数量均显著高于未入侵区, 这在一定程度上加速了其入侵(牛红榜等, 2007).综上分析, 微生物是土壤生态系统的重要组成部分, 直接参与凋落物的分解、根系养分吸收等植物-土壤的生态系统过程, 其群落组成和多样性的改变对生态系统的功能和稳定性有着重要的影响.
4.3 湿地土壤微生物与环境因子的关系及其对活性碳组分的影响土壤中所包含的菌群由于在不同的土壤理化性质及活性碳组分的影响下, 微生物的活跃程度不同, 对环境的适应性也不一致.此外, 诸如气候条件、地理位置甚至人为因素等都是影响土壤中微生物多样性和丰富度的变量因子(王晓彤等, 2019).在本研究中, 通过Spearman相关性分析发现, 湿地土壤细菌丰富度与环境因子(含水量、容重、pH、盐度)及碳组分(SOC、LOC、DOC、MBC)之间存在相关性, 不同的环境因子及碳组分作用于特定的细菌, 使其与之存在某种正相关或是负相关关系.如根据图 5、图 7和图 8的结果可知, 互花米草入侵白骨壤湿地后, 原始的优势菌属如Blautia、Ruminococcus_2、Bacteroides、Faecalibacterium、Marinobacterium等相对丰度明显降低, 而Thiohalophilus、Hallea等菌属的相对丰度明显增加, 由相关性分析可知土壤DOC与Blautia、Ruminococcus_2、Bacteroides、Faecalibacterium的相对丰度呈显著正相关, 土壤盐度与Thiohalophilus、Hallea呈显著正相关, 因此, 白骨壤湿地受到互花米草入侵后土壤细菌优势菌属的改变与土壤DOC及盐度含量的变化有密切的关系.这可能是由于土壤DOC作为能够直接被微生物利用的的碳源, 主要来源于表层有机质的淋溶、近期光合作用产物的分解, 易溶于水(Jagadamma et al., 2014), 而红树林相比于互花米草, 具有较高的生物量, 且红树林凋落物的分解速率比互花米草快, 其可为微生物的活动提供大量的可利用碳源(陈桂香等, 2017);此外, 有研究表明, Blautia、Ruminococcus_2、Bacteroides等菌属具有分解有机物作为碳源的能力(Moore et al., 2006), 因此, 互花米草入侵白骨壤湿地后使得土壤DOC、SOC和MBC均显著下降, Blautia、Ruminococcus_2、Bacteroides等菌属的相对丰度也明显下降.相反, 互花米草入侵白骨壤湿地后使得土壤盐度显著提高, Thiohalophilus、Hallea等耐盐菌属的相对丰度也明显增加.值得注意的是, 互花米草入侵闽江口秋茄湿地后, 土壤环境因子及碳组分对其细菌群落的优势菌属影响较小, 这是因为受到采样点各种因素的共同影响, 使各部分的因素交织作用达到平衡.综上所述, 通过研究环境因子、活性碳组分等因子对土壤微生物物种多样性的影响, 可为我们从微生物角度探索互花米草的入侵机制提供一种思路, 但由于这一过程十分复杂, 在今后仍需进一步开展相关研究予以揭示.
5 结论(Conclusions)1) 互花米草入侵河口湿地后, 改变了湿地土壤细菌的相对丰度、多样性及群落组成, 且入侵不同类型的湿地群落, 细菌优势菌属及相对丰度不同.
2) 互花米草入侵秋茄和芦苇湿地后使土壤细菌多样性升高, 入侵白骨壤湿地后使土壤细菌多样性降低.
3) 互花米草入侵并未明显改变细菌门水平的群落组成, 湿地土壤主要的细菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes).
4) 互花米草的入侵改变了湿地土壤细菌的优势菌属, 使白骨壤湿地土壤Ruminococcus_2、Faecalibacterium的相对丰度降低, 同时出现了Thiohalophilus、Hallea等优势菌属.
5) 环境因子和活性碳组分能够影响湿地土壤中细菌的相对丰度, 细菌Thiohalophilus的相对丰度与湿地土壤盐度呈显著正相关(p < 0.05), Sideroxydans的相对丰度与湿地土壤pH呈显著负相关(p < 0.01), Ruminococcus_2的相对丰度与土壤易分解有机碳(LOC)呈显著负相关(p < 0.01);Blautia、Bacteroidess的相对丰度与土壤可溶性有机碳(DOC)呈显著正相关(p < 0.01).
参考文献
| Bianchi T S, Allison M A, Zhao J, et al. 2013. Historical reconstruction of mangrove expansion in the Gulf of Mexico:Linking climate change with carbon sequestration in coastal wetlands[J]. Estuarine Coastal and Shelf Science, 119(119): 7-16. |
| Blair G J. 1995. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems[J]. Australian Journal of Agricultural Research, 46(7): 393-406. |
| Boyle S A, Yarwood R R, Bottomley P J, et al. 2008. Bacterial and fungal contributions to soil nitrogen cycling under Douglas fir and red alder at two sites in Oregon[J]. Soil Biology and Biochemistry, 40(2): 443-451. DOI:10.1016/j.soilbio.2007.09.007 |
| 白静, 严锦钰, 何东进, 等. 2017. 互花米草入侵对闽东滨海湿地红树林土壤理化性质和酶活性的影响[J]. 北京林业大学学报, 39(1): 70-77. |
| Callaway R M, Thelen G C, Rodriguez A, et al. 2004. Soil biota and exotic plant invasion[J]. Nature, 427(6976): 731-733. DOI:10.1038/nature02322 |
| Craft C. 2007. Freshwater input structures soil properties, vertical accretion, and nutrient accumulation of Georgia and U.S.tidal marshes[J]. Limnlogy and Oceanography, 52(3): 1220-1230. DOI:10.4319/lo.2007.52.3.1220 |
| 陈桂香, 高灯州, 陈刚, 等. 2017. 互花米草入侵对我国红树林湿地土壤碳组分的影响[J]. 水土保持学报, 31(6): 249-256. |
| 陈志杰, 韩士杰, 张军辉. 2016. 土地利用变化对漳江口红树林土壤有机碳组分的影响[J]. 生态学杂志, 36(9): 2379-2385. |
| Doornbos R F, Loon L C V, Bakker P A H M. 2012. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere.A review[J]. Agronomy for Sustainable Development, 32(1): 227-243. DOI:10.1007/s13593-011-0028-y |
| 丁新景, 敬如岩, 黄雅丽, 等. 2018. 基于高通量测序的4种不同树种人工林根际土壤细菌结构及多样性[J]. 林业科学, 54(1): 81-89. |
| Feng J, Guo J, Huang Q, et al. 2014. Changes in the community structure and diet of benthic macrofauna in invasive Spartina alterniflora wetlands following restoration with native mangroves[J]. Wetlands, 34(4): 673-683. DOI:10.1007/s13157-014-0533-2 |
| Gao G F, Li P F, Zhong J X, et al. 2019. Spartina alterniflora invasion alters soil bacterial communities and enhances soil N2O emissions by stimulating soil denitrification in mangrove wetland[J]. Science of the Total Environment, 653: 231-240. DOI:10.1016/j.scitotenv.2018.10.277 |
| He T, Sun Z, Hu X, et al. 2020. Effects of Spartina alterniflora invasion on spatial and temporal variations of total sulfur and inorganic sulfur fractions in sediments of salt marsh in the Min River estuary, Southeast China[J]. Ecological Indicators, 113: 106253. DOI:10.1016/j.ecolind.2020.106253 |
| 杭子清, 王国祥, 刘金娥, 等. 2014. 互花米草盐沼土壤有机碳库组分及结构特征[J]. 生态学报, 34(15): 4175-4182. |
| 胡伟芳, 曾从盛, 高君颖, 等. 2015. 闽江口鳝鱼滩芦苇湿地沉积物甲烷产生与氧化潜力对外源物质输入的响应[J]. 环境科学学报, 35(4): 185-193. |
| Jagadamma S, Mayes M A, Steinweg J M, et al. 2014. Substrate quality alters the microbial mineralization of added substrate and soil organic carbon[J]. Biogeosciences, 11(17): 4665-4678. DOI:10.5194/bg-11-4665-2014 |
| Jiang X T, Peng X, Deng G H, et al. 2013. Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J]. Microbial Ecology, 66(1): 96-104. DOI:10.1007/s00248-013-0238-8 |
| 金宝石, 高灯州, 杨平, 等. 2016. 闽江河口区互花米草入侵不同年限下湿地土壤有机碳变化[J]. 自然资源学报, 31(4): 608-619. |
| 金宝石, 闫鸿远, 张林海, 等. 2016. 中国滨海互花米草湿地土壤有机碳时空变化及其影响因素[J]. 生态环境学报, 25(12): 2021-2027. |
| Li W H, Zhang C B, Jiang H B, et al. 2007. Changes in soil microbial community associated with invasion of the exotic weed, Mikania micrantha H.B.K[J]. Plant and Soil, 281(6): 309-324. |
| 李虎, 廖丹, 苏建强, 等. 2014. 外来种互花米草根内细菌多样性及功能[J]. 应用与环境生物学报, 20(5): 856-862. |
| 李家兵, 张秋婷, 张丽烟, 等. 2016. 闽江河口春季互花米草入侵过程对短叶茳芏沼泽土壤碳氮分布特征的影响[J]. 生态学报, 36(12): 3628-3638. |
| 廖丹, 黄华斌, 庄峙厦, 等. 2018. 互花米草入侵对红树秋茄根际与根内细菌群落结构与多样性的影响[J]. 应用与环境生物学报, 24(2): 269-275. |
| Lin X G, Yin R, Zhang H Y, et al. 2004. Changes of soil microbiological properties caused by land use changing from rice-wheat rotation to vegetable cultivation[J]. Environmental Geochemistry and Health, 26(2): 119-128. DOI:10.1023/B:EGAH.0000039574.99651.65 |
| 刘方春, 邢尚军, 马海林, 等. 2014. 持续干旱对樱桃根际土壤细菌数量及结构多样性影响[J]. 生态学报, 34(3): 642-649. |
| 刘璐, 何寻阳, 谢强, 等. 2015. 桂西北喀什特常见豆科植物根瘤菌的遗传多样性[J]. 应用生态学报, 26(12): 3663-3669. |
| Liu M, Yu Z, Yu X Q, et al. 2017. Invasion by cordgrass increases microbial diversity and alters community composition in a mangrove nature reserve[J]. Frontiers in Microbiology, 8: 1-12. DOI:10.3389/fmicb.2017.02503 |
| 鲁如坤. 1999. 土壤化学农业分析方法[M]. 北京: 中国农业科技出版社. |
| 路海玲, 孟亚利, 周玲玲, 等. 2011. 盐胁迫对棉田土壤微生物量和土壤养分的影响[J]. 水土保持学报, 25(1): 197-201. |
| Moore F P, Barac T, Borremans B, et al. 2006. Endophytic bacterial diversity in poplar trees growing on a BTEX-contaminated site:The characterisation of isolates with potential to enhance phytoremediation[J]. Systematic and Applied Microbiology, 29(7): 539-556. DOI:10.1016/j.syapm.2005.11.012 |
| Murphy D V, Macdonald A J, Stockdale E A, et al. 2000. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 30(5): 374-387. DOI:10.1007/s003740050018 |
| Nie M, Wang M, Li B. 2009. Effects of salt marsh invasion by Spartina alterniflora on sulfate-reducing bacteria in the Yangtze River estuary, China[J]. Ecological Engineering, 35(12): 1804-1808. DOI:10.1016/j.ecoleng.2009.08.002 |
| 牛红榜, 刘万学, 万方浩. 2007. 紫茎泽兰(Ageratina adenophora)入侵对土壤微生物群落和理化性质的影响[J]. 生态学报, 27(7): 3051-3060. DOI:10.3321/j.issn:1000-0933.2007.07.047 |
| Nyman J A, DeLaune R D. 1991. CO2 emission and soil Eh responses to different hydrological conditions in fresh, brackish, and saline marsh soils[J]. Limnology and Oceanography, 36(7): 1406-1414. DOI:10.4319/lo.1991.36.7.1406 |
| Quan C, Qian Z, Pimao C, et al. 2018. Effect of exotic cordgrass, Spartina alterniflora, on the eco-exergy based thermodynamic health of the macrobenthic faunal community in mangrove wetlands[J]. Ecological Modelling, 385: 106-113. DOI:10.1016/j.ecolmodel.2018.07.015 |
| Quan W, Zhang H, Wu Z, et al. 2016. Does invasion of Spartina alterniflora alter microhabitats and benthic communities of salt marshes in Yangtze River estuary?[J]. Ecological Engineering, 88(3): 153-164. |
| Subudhi P K, Baisakh N. 2011. Spartina alterniflora Loisel.a halophyte grass model to dissect salt stress tolerance[J]. In Vitro Cellular and Developmental Biology-Plant, 47(4): 441-457. DOI:10.1007/s11627-011-9361-8 |
| Vilà M, Espinar J L, Hejda M, et al. 2011. Ecological impacts of invasive alien plants:a meta-analysis of their effects on species, communities and ecosystems[J]. Ecology Letters, 14(7): 702-708. DOI:10.1111/j.1461-0248.2011.01628.x |
| Wang M, Gao X, Wang W. 2014. Differences in burrow morphology of crabs between Spartina alterniflora marsh and mangrove habitats[J]. Ecological Engineering, 69(3): 213-219. |
| Wang W Q, Wang C, Sardans J, et al. 2015. Plant invasive success associated with higher N-use efficiency and stoichiometric shifts in the soil-plant system in the Minjiang River tidal estuarine wetlands of China[J]. Wetlands Ecology and Management, 23(5): 865-880. DOI:10.1007/s11273-015-9425-3 |
| 王晓彤, 蓝兴福, 安婉丽, 等. 2019. 模拟酸雨对福州平原稻田土壤细菌丰度及多样性的影响[J]. 中国环境科学, 39(3): 1237-1244. DOI:10.3969/j.issn.1000-6923.2019.03.041 |
| Yu X, Yang J, Liu L, et al. 2015. Effects of Spartina alterniflora invasion on biogenic elements in a subtropical coastal mangrove wetland[J]. Environmental Science and Pollution Research, 22(4): 3107-3115. DOI:10.1007/s11356-014-3568-2 |
| 尹晓雷, 陈桂香, 王纯, 等. 2020. 互花米草入侵对河口湿地土壤真菌群落结构及多样性影响[J]. 环境科学学报, 40(6): 2186-2194. |
| 曾艳, 田广红, 陈蕾伊, 等. 2011. 互花米草入侵对土壤生态系统的影响[J]. 生态学杂志, 30(9): 2080-2087. |
| Zhang D, Hu Y, Liu M, et al. 2017. Introduction and spread of an exotic plant, Spartina alterniflora, along coastal marshes of China[J]. Wetland, 37: 1181-1193. DOI:10.1007/s13157-017-0950-0 |
| Zhang P, Nie M, Li B, et al. 2017. The transfer and allocation of newly fixed C by invasive Spartina alterniflora and native Phragmites australis to soil microbiota[J]. Soil Biology and Biochemistry, 113: 231-239. DOI:10.1016/j.soilbio.2017.06.003 |
| Zheng J, Li J, Lan Y, et al. 2018. Effects of Spartina alterniflora invasion on Kandelia candel rhizospheric bacterial community as determined by high-throughput sequencing analysis[J]. Journal of Soils and Sediments, 19(4): 332-344. |
| 郑洁, 刘金福, 吴则焰, 等. 2017. 闽江河口红树林土壤微生物群落对互花米草入侵的响应[J]. 生态学报, 37(21): 7293-7303. |
| Zou J, Rogers W, DeWalt S, et al. 2006. The effect of Chinese tallow tree (Sapium sebiferum) ecotype on soil-plant system carbon and nitrogen processes[J]. Oecologia, 150(2): 272-281. DOI:10.1007/s00442-006-0512-2 |
| 左平, 欧志吉, 姜启吴. 2014. 江苏盐城原生滨海湿地土壤中的微生物群落功能多样性分析[J]. 南京大学学报(自然科学), 50(5): 715-722. |
