 , 张雅庆1, 李家轩1, 焦一滢2, 赵丽娅1, 许峰1, 宋娜3,4
, 张雅庆1, 李家轩1, 焦一滢2, 赵丽娅1, 许峰1, 宋娜3,4

1. 区域开发与环境响应湖北省重点实验室, 湖北大学资源环境学院, 武汉 430062;
2. 河湖生态修复及藻类利用湖北省重点实验室, 湖北工业大学土木建筑与环境学院, 武汉 430068;
3. 中国科学院南京地理与湖泊研究所, 南京 210008;
4. 湖泊与环境国家重点实验室, 南京 210008
收稿日期: 2019-07-07; 修回日期: 2019-10-10; 录用日期: 2019-10-10
基金项目: 国家自然科学基金项目(No.41807452);湖北省自然科学基金项目(No.2018CFB311);湖泊与环境国家重点实验室开放基金资助项目(No.2018SKL011)
作者简介: 陈默(1984-), 男, E-mail:chenmoccnu@163.com
通讯作者(责任作者): 宋娜, E-mail:nsong@niglas.ac.cn
摘要:淡水湖泊水生植物残体的腐烂分解过程为沉积物中的异养微生物提供了重要的碳源,但是目前关于温度对沉水植物残体有机质分解的影响研究还不够深入.本研究通过室内微宇宙模拟实验,研究了4℃和25℃时马来眼子菜残体在沉积物中厌氧分解特征及其主要的微生物代谢途径.结果表明,温度对马来眼子菜残体的分解影响显著,25℃实验组沉积物中总有机碳(TOC)和纤维素去除率显著高于4℃实验组.25℃实验组沉积物初始腐殖质占TOC比例为18.23%±1.47%,90 d后达到约46%,这说明微生物对马来眼子菜残体的分解促进了沉积物腐质化.此外,温度升高促进了纤维素降解细菌(如拟杆菌门,Bacteroidetes)的生长繁殖,且硫酸盐还原细菌(如GOUTA19、脱硫球菌属(Desulfocuccus)、LCP-6、HB118)和铁还原细菌(如地杆菌属,Geobacter)是沉积物中主要的优势菌种.在25℃条件下,微生物硫酸盐还原、铁还原和产甲烷作用占马来眼子菜残体厌氧代谢的比例分别达到37.3%、27.8%和10.3%.综上所述,本研究表明温度升高促进了沉积物中马来眼子菜残体的厌氧分解,且微生物硫酸盐还原、铁还原和产甲烷过程在其厌氧分解过程中发挥了重要作用.
关键词:温度淡水湖泊水生植物硫酸盐还原铁还原
The effects of temperature differences on anaerobic degradation of submerged macrophytes litter in lake sediments
CHEN Mo1
 , ZHANG Yaqing1, LI Jiaxuan1, JIAO Yiying2, ZHAO Liya1, XU Feng1, SONG Na3,4
, ZHANG Yaqing1, LI Jiaxuan1, JIAO Yiying2, ZHAO Liya1, XU Feng1, SONG Na3,4

1. Hubei Province Key Laboratory of Regional Development and Environment Response, School of Resources and Environmental Science, Hubei University, Wuhan 430062;
2. Key Laboratory of Ecological Remediation of Lakes and Rivers and Algal Utilization of Hubei Province, School of Civil Engineering, Architecture and Environment, Hubei University of Technology, Wuhan 430068;
3. Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008;
4. State Key Laboratory of Lake Science and Environment, Nanjing 210008
Received 7 July 2019; received in revised from 10 October 2019; accepted 10 October 2019
Abstract: Anaerobic degradation of macrophytes litter in freshwater lakes provides important carbon source for heterotrophs in the sediments, however, the effects of temperature differences on decomposition of organic matter derived from macrophytes litters in sediments have not been well studied. In this study, microcosm experiments were conducted to study the characteristics of decomposition of Potamogeton malaianus (PM) litter and the main anaerobic microbial metabolic pathways for PM litter in sediments at 4℃and 25 ℃, respectively. Results indicated that temperature significantly influenced the degradation of PM litters, and the removal efficiencies of TOC and cellulose were significantly higher at 4 ℃ than 25 ℃. The initial ratio of humic matter to TOC in sediments was 18.23%±1.47% at 25 ℃, and the ration reached ca. 46% after 90 days, which indicated that microbial-mediated degradation of PM litters stimulated humification in the sediments. In addition, it was observed that increases in temperature promoted the growth of cellulolytic bacterium (like Bacteroidetes) in the sediments, and sulfate-reducing bacteria (like GOUTA19、Desulfocuccus、LCP-6 and HB118) and iron-reducing bacteria (like Geobacter) were the dominant bacteria. It was calculated that sulfate reduction, iron reduction and methanogenesis were responsible for 37.3%, 27.8% and 10.3% of total anaerobic respiration of PM litters in sediments. This study indicated that increases in temperature promoted anaerobic mineralization of PM litters in the sediments, and sulfate reduction, iron reduction and methanogenesis played an important role of the anaerobic mineralization of PM litter.
Keywords: temperaturefreshwater lakesmacrophytessulfate reductioniron reduction
1 引言(Introduction)马来眼子菜(Potamogeton malaianus)是太湖乃至长江中下游湖泊水生植被中极为重要的优势种之一(刘伟龙等, 2013), 水生植物的腐烂分解对湖泊的富营养化进程有重要的影响(潘慧云等, 2008;邢鹏等, 2008).有研究表明, 马来眼子菜残体分解的前期能通过无机营养盐的溶出向水体释放出其体内的氮磷营养盐, 且磷优于氮释放(韩红娟等, 2010).随着时间推移, 马来眼子菜向水体释放的磷大部分沉积到底泥中, 而氮则部分沉积到底泥中、部分以气体形式(N2和N2O)逸出水体(王博等, 2014).此外, 马来眼子菜的分解导致水体中pH和溶解氧(DO)的迅速下降(曹勋等, 2015).目前关于马来眼子菜分解的研究多关注于对湖泊营养盐循环以及水质的影响, 而对其草源有机质分解特征方面的研究较少, 且相关的微生物群落结构也不清楚.
水生植物死亡后, 其残体沉积于湖底, 湖泊沉积物成为草源有机质代谢的重要场所(Song et al., 2015;Zhang et al., 2018).在富含有机物的沉积物中, 氧气会在表层沉积物几毫米深度内被快速消耗(Furukawa et al., 2004), 导致沉积物中有机物代谢主要在厌氧条件下进行(Aller et al., 1994).沉积物中的厌氧微生物代谢途径主要包括反硝化、(锰)铁还原、硫酸盐还原和产甲烷等, 各种代谢途径相互影响、相互制约(Roden et al., 1996;朱维琴等, 2002).由于温度影响微生物的代谢速率, 改变微生物群落的结构以及元素的生物地球化学循环(Chen et al., 2014), 因此温度是影响沉积物中有机物厌氧代谢的重要因素之一(Gudasz et al., 2010).有研究表明, 温度升高能够促进沉积物中草源有机质的分解(Chen et al., 2016a).此外, 温度变化对沉积物中有机物厌氧代谢途径也有显著的影响.夏季沉积物中硫酸盐还原速率是冬季的7倍(Al-Raei et al., 2009), 25 ℃沉积物中铁还原速率约是15 ℃沉积物的1.5倍(Chen et al., 2014).目前有关温度对沉积物中有机质代谢影响的研究较多(Weston et al., 2005;Al-Raei et al., 2009;Gudasz et al., 2010;Song et al., 2013), 但对不同温度条件下沉积物中水生植物残体的微生物代谢途径还有待进一步研究.
太湖是我国第三大淡水湖泊, 水面面积为2338 km2, 平均水深约1.9 m, 最大水深近4.0 m.太湖水生植物主要分布于东太湖, 其中马来眼子菜为目前太湖沉水植物的优势种(刘伟龙等, 2007).依据上述特点, 本文选择水生植物丰富的东太湖作为研究区域, 采用室内微宇宙模拟实验, 结合16S rRNA高通量测序技术, 比较了4 ℃和25 ℃条件下马来眼子菜残体在沉积物中的分解特征及主要厌氧代谢途径, 旨在揭示温度对马来眼子菜残体厌氧分解的影响及其主要的微生物代谢途径.
2 材料与方法(Materials and methods)2.1 样品采集与处理2015年1月和8月, 用彼得森抓泥斗在东太湖区域采集冬季(水温4.3 ℃)和夏季表层沉积物样品(水温27.8 ℃)(图 1), 并用若干25 L有盖塑料桶采集湖水, 几小时内运回实验室, 随后将样品置于4 ℃保存.马来眼子菜采集于2015年8月东太湖区域, 将其用清水洗净, 吸水纸擦干后, 置于室温下自然风干至恒重, 然后磨成粉状.
图 1(Fig. 1)
 |
| 图 1 太湖采样位点(31°00.271′N, 120°23.262′E) Fig. 1The sampling site in Lake Taihu in this study |
为了研究马来眼子菜残体的分解特征, 取300 g冬季和夏季沉积物分别装入1 L高脚烧杯中, 随后各加入9 g马来眼子菜残体, 混匀, 然后将400 mL湖水沿烧杯壁缓慢倒入烧杯中, 待水-沉积物界面稳定后, 用铝箔纸进行避光处理.冬季和夏季沉积物实验组分别置于4 ℃和25 ℃条件下运行3个月, 本实验设置3个重复.实验开始和结束时测定沉积物中如下指标:纤维素含量、总有机碳(TOC)含量、易降解有机质(LP)含量、难降解有机质(RP)含量和腐殖质(HM)含量;测定间隙水中Fe(II)浓度、Fe(III)浓度、SO42-浓度和NO3-浓度.
为了研究马来眼子菜残体的厌氧分解途径, 在充满N2的厌氧手套箱中, 分别将10 mL冬季和夏季沉积物样品装于100 mL血清瓶中, 加入3 g马来眼子菜残体和100 mL无氧、灭菌的去离子水, 然后用橡胶塞塞紧, 铝盖密封.将装有冬季和夏季沉积物样品的血清瓶分别置于4 ℃和25 ℃, 黑暗条件下培养7 d, 本实验设置3个重复.培养期间定期取出少量样品测量Fe(II)和SO42-浓度, 根据浓度随时间的变化, 通过线性拟合分别换算出沉积物铁还原速率和硫酸盐还原速率, 取血清瓶顶空中气体样品, 测定CO2和CH4含量随时间的变化, 计算出产CO2和CH4速率.由于在微生物铁还原过程中, 消耗1 mol有机物需要4 mol铁氧化物, 最终生成1 mol CO2和4 mol Fe(II), 因此确定铁还原占有机物厌氧代谢的比例时, 按照CO2:Fe(II) = 1:4换算;消耗1 mol有机物需要1 mol SO42-, 最终生成2 mol CO2和1 mol硫化物, 因此确定硫酸盐还原占有机物厌氧代谢的比例时, 按照CO2: SO42- = 2:1, CO2: CH4 = 1:1来换算.
2.2 样品理化指标测定方法沉积物中纤维素含量采用铜铵溶液取法测定(Wissel et al., 2008), TOC含量采用重铬酸钾-油浴法测定(Chen et al., 2016a).采用菲咯嗪比色法测定沉积物中Fe(II)和总铁含量, 总铁与Fe(II)浓度的差值为Fe(III)浓度(Stookey et al., 1970).取一定量的沉积物装满离心管中, 5000 r·min-1离心5 min, 倒出上清液, 过0.45 μm滤膜除去悬浮物, 通过离子色谱测定间隙水中NO3-和SO42-浓度.
沉积物中易降解有机质(LP)和难降解有机质(RP)的测定方法参考(Rovira et al., 2002), 具体如下:
① 易降解有机质Ⅰ(LPⅠ, 主要为非纤维素多糖类物质):称取0.5 g风干过筛的沉积物样品放入50 mL离心管中, 加入20 mL 2.5 mol·L-1 H2SO4, 105 ℃静置30 min, 4000 r·min-1离心15 min, 上清液倒出保存, 残留物用20 mL蒸馏水清洗, 离心.合并2次离心得到的上清液, 采用元素分析仪测定碳含量.
② 易降解有机质Ⅱ(LPⅡ, 主要为纤维素类物质):在①中的残留物中加入2 mL 13 mol·L-1 H2SO4室温过夜, 持续振荡水解, 然后用蒸馏水稀释酸度至1 mol·L-1, 105 ℃水解3 h, 每隔0.5 h摇晃1次.4000 r·min-1离心15 min, 上清液倒出保存, 残留物用20 mL蒸馏水清洗, 离心.合并2次离心得到的上清液, 采用元素分析仪测定碳含量.
③ 难降解有机质(RP):将②中的残留物用蒸馏水清洗2次, 60 ℃烘干, 采用元素分析仪测定有机碳含量.本试验将LPⅠ和LPⅡ统称为易降解有机质(LP).
本实验主要测定腐殖质(HM)中的胡敏酸(HA)和富里酸(FA)两种组分(HM = HA+FA), 测定方法参照腐殖质协会(IHSS)的标准方法(Hong et al., 2010), 具体测定如下:称取风干过筛的沉积物样品2.5 g, 加入1 mol·L-1 HCl使pH达到1~2, 再加入0.1 mol·L-1 HCl至液体体积为25 mL, 室温下振荡1 h, 离心, 上清液分出FA(a).在残留物中加入1 mol·L-1 NaOH 25 mL, 在氮气下混合、振荡4 h, 静置过夜, 离心, 除去残渣, 用6 mol·L-1 HCl将提取液pH调到1.0, 静置12 h, 离心, 上清液分出FA(b).在氮气下将沉淀出来的HA用尽量少的0.1 mol·L-1 KOH重新溶解, 高速离心, 加6 mol·L-1 HCl调节pH至1.0, 沉淀12~16 h, 离心, 弃去上清液, 残留的HA用0.1 mol·L-1 HCl+0.3 mol·L-1 HF混合液, 室温下振荡过夜, 离心, 反复用HCl+HF处理, 使HA残余小于1.0%.再通过透析膜或透析管, 直至AgNO3检测不出Cl-, 冷冻干燥, 用元素分析仪测定有机碳含量.合并(a)、(b)两份FA溶液, 用XAD-8树脂吸附FA, 弃去残留液, 依次用0.1 mol·L-1 NaOH和水洗脱, 流出液立即用6 mol·L-1 HCl调节pH至1.0, 使FA仍留在溶液中.然后将溶液通过H+饱和的离子交换树脂, 冷冻干燥得H+饱和的FA, 用元素分析仪测定有机碳含量.
2.3 微生物群落结构分析本研究选择原位采集的冬季和夏季表层沉积物进行DNA提取.采用土壤基因组试剂盒(PowerSoil? DNA, MOBIO)提取样品中基因组总DNA, DNA的浓度采用超微量分光光度计(Nanodrop 2000, Wilmington, USA)进行测定.DNA样品送illumina测序公司进行高通量测序, illumina测序平台产生的初始数据采用开放的软件包QIIME(http://qiime.org/)进行分析(Chen et al., 2016b).
2.4 数据分析与处理运用SPSS11.0进行数据统计分析, p>0.05表示未达到显著检验水平;p < 0.05为显著水平.
3 结果(Results)3.1 沉积物中纤维素、TOC、LPI、LPII和腐殖质含量的变化从图 2a可知, 在4 ℃条件下沉积物中纤维素和TOC没有显著降解, 而在25 ℃实验组沉积物中马来眼子菜残体的分解导致纤维素去除率和TOC去除率不断升高.实验第5 d时, 25 ℃实验组沉积物中纤维素和TOC去除率分别为4.52%±2.54%和2.01%±1.05%, 实验结束时沉积物中纤维素几乎完全分解, TOC去除率达到43.47%±2.84%(图 2a).实验结束时, 4 ℃实验组沉积物中易降解有机组分如LPI和LPII占TOC的比例略有降低, 而25 ℃实验组中LPI和LPII的比例显著降低, 25 ℃实验组沉积物中RP比例则从约33%(0 d)升高到47%(90 d)(图 2b).腐殖质含量变化反映了沉积物的腐质化程度, 4 ℃实验组的腐殖质占TOC比例在实验过程中没有显著变化(p>0.05), 而25 ℃实验组沉积物的腐质化程度在实验开始阶段较低, 占TOC比例为18.23%±1.47%, 实验结束时腐殖质含量占TOC比例达到约46%(图 2b).
图 2(Fig. 2)
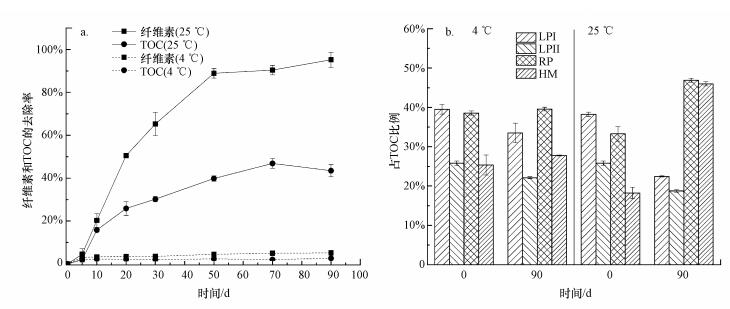 |
| 图 2 纤维素和TOC去除率随时间的变化(a)和实验初始(0 d)和结束时(90 d)沉积物中LPI, LPII, RP和HM占TOC的比例(b) Fig. 2Temporal dynamics of removal efficiencies of cellulose and TOC during the incubation(a) and The ratios of LPI, LPII, RP and HM to TOC on 0 d and 90 d, respectively(b) |
3.2 沉积物间隙水中NO3-、Fe(III)和SO42-浓度的变化由图 3可知, 沉积物中初始NO3-浓度比Fe(III)和SO42-浓度低一个数量级, 4 ℃和25 ℃实验组中NO3-浓度均没有显著变化(p>0.05), 25 ℃实验组中Fe(III)和SO42-浓度在实验过程中显著降低, Fe(III)从实验开始时的(12.62±1.50) μmol·cm-3下降到第90 d时的(6.25±1.22) μmol·cm-3, SO42-浓度从(4.88±0.78)μmol·cm-3下降到(0.94±0.18) μmol·cm-3(图 3).
图 3(Fig. 3)
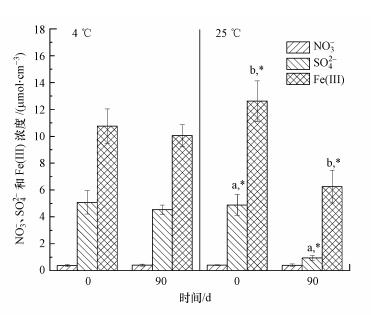 |
| 图 3 实验初始(0 d)和结束时(90 d)沉积物间隙水中NO3-、SO42-和Fe(III)浓度变化(注:同一小写字母表示实验初始(0 d)和结束时(90 d)时浓度差异显著(p < 0.05).) Fig. 3Concentrations dynamics of NO3-, SO42- and Fe(III) in the porewater on day 0 and day 90, respectively |
3.3 铁还原速率、硫酸盐还原速率、产CO2速率和产CH4速率从图 4a可知, 25 ℃实验组沉积物中Fe(II)浓度在实验过程中持续升高, 实验开始时Fe(II)浓度为(51.19±0.74) μmol·cm-3, 84 h后达到(60.49±5.52) μmol·cm-3.沉积物中SO42-浓度变化趋势与Fe(II)相反, 实验开始时SO42-浓度为(4.07±0.24) μmol·cm-3, 84 h后下降到(2.12±0.49) μmol·cm-3.数据拟合表明, 25 ℃实验组沉积物中铁还原速率为2.93 μmol·cm-3·d-1 (R2=0.996), 硫酸盐还原速率为0.49 μmol·cm-3· d-1 (R2=0.984).此外, 根据图 4b的数据计算出25 ℃条件下产CO2速率为2.36 μmol·cm-3·d-1 (R2=0.976), 产CH4速率为0.27 μmol·cm-3·d-1 (R2=0.976).计算表明, 25 ℃实验组沉积物中铁还原占马来眼子菜残体厌氧代谢的比例为27.8%, 硫酸盐还原为37.3%, 产甲烷为10.3%.
图 4(Fig. 4)
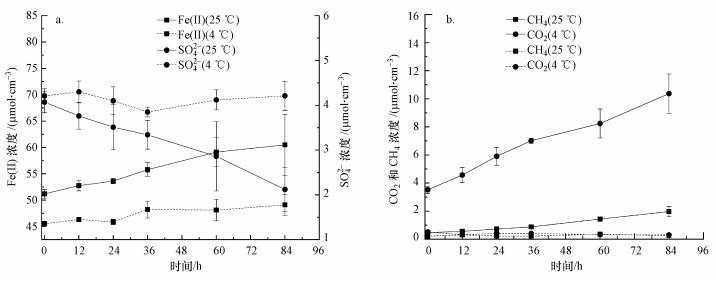 |
| 图 4 沉积物中Fe(II)和SO42-浓度随时间的变化(a)及CO2和CH4浓度随时间的变化(b) Fig. 4Temporal dynamics of concentrations of Fe(II) and SO42- in the sediments during the incubation(a) and the production of CO2 and CH4 during the incubation(b) |
3.4 不同温度条件下沉积物中微生物群落结构变化在门水平上, 拟杆菌门(Bacteroidetes)细菌在25 ℃实验组沉积物中相对丰度(15.7%)明显高于4 ℃实验组沉积物(6.93%)(图 5a).放线菌门(Actinobacteria)细菌和硝化螺旋菌门(Nitrospirae)细菌相对丰度在4 ℃实验组更高.如图 5b所示, 在属水平上, 东太湖沉积物主要的硫还原细菌包括GOUTA19、脱硫球菌属(Desulfocuccus)、LCP-6和HB118, 其中LCP-6属和HB118属细菌在25 ℃实验组沉积物中相对丰度分别为18.85%和15.28%, 明显高于4 ℃实验组沉积物中的6.09%和7.22%(图 5b);铁还原细菌如地杆菌属(Geobacter)在4 ℃实验组和25 ℃实验组沉积物中相对丰度分别为2.06%和2.68%;硫氧化细菌如硫化细菌(Thiobacillus)也是沉积物中优势种群之一, 在4 ℃实验组和25 ℃实验组沉积物中相对丰度分别达到12.32%和14.33%(图 5b)
图 5(Fig. 5)
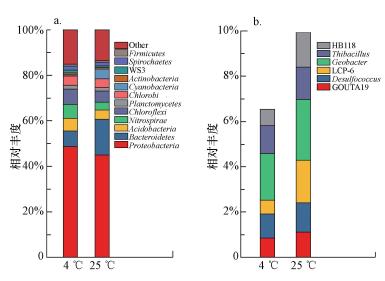 |
| 图 5 4 ℃和25 ℃沉积物中细菌门的相对丰度(a)及在属水平上主要的硫还原细菌、铁还原细菌和硫氧化细菌的相对丰度(b) Fig. 5Relative abundances of microbial phylum in the sediments at 4 ℃ and 25 ℃, respectively(a) and relative abundances of the main bacteria of sulfate-reduction、iron reduction and sulfur oxidation at the genus level, respectively(b) |
4 讨论(Discussion)温度差异对淡水湖泊沉积物中马来眼子菜残体的分解影响显著, 本研究发现, 25 ℃时马来眼子菜残体的分解速率显著高于4 ℃时, 且微生物对马来眼子菜残体的分解促进了沉积物中腐质化过程.另外, 硫酸盐还原和铁还原微生物是东太湖沉积物中主要的优势菌种, 且在25 ℃沉积物中相对丰度明显高于4 ℃.马来眼子菜残体厌氧代谢途径与沉积物中微生物群落结构变化高度吻合, 硫酸盐还原、铁还原和产甲烷过程是马来眼子菜残体厌氧分解的主要途径.
4.1 温度对草源有机质分解的影响本研究发现, 温度升高促进了沉积物中马来眼子菜残体纤维素和TOC的去除(图 2a).以往的研究表明在一定温度范围内, 马来眼子菜残体分解过程中纤维素降解细菌的生物量、代谢活性与温度成正比(Song et al., 2013).本研究进一步表明拟杆菌门细菌(Bacteroidetes)等纤维素降解细菌是沉积物中优势菌种之一(图 5a) (杨腾腾等, 2015), 其相对丰度在25 ℃时显著高于4 ℃(图 5a), 这说明拟杆菌门细菌在马来眼子菜残体分解过程中发挥了重要的作用, 且温度升高促进了拟杆菌门细菌对马来眼子菜残体有机质的分解.
异养微生物对马来眼子菜残体的分解导致沉积物腐质化程度升高(图 2b).湖泊中微生物对易降解有机质和难降解有机质的分解速率差异明显, 温度升高对易降解有机物的去除效果更加明显(Song et al., 2013), 从而导致实验结束时25 ℃实验组沉积物中难降解有机质占TOC比例更高(图 2b).从图 2可知, 实验结束时沉积物中腐殖质类物质(HM)占TOC比例显著提高, 有研究表明有机质在沉积物分解过程中, 部分有机质组分能够通过微生物的作用会转化为HM(Jiao et al., 2010).HM由于其化学结构复杂难以被微生物利用, 其形成过程通常被认为是沉积物储碳的重要机制之一(Prescott et al., 2010).此外, 有研究表明草型湖泊沉积物中植物残体的堆积, 腐殖质的不断增加, 制约了有机氮的分解和向水中释放氮素(孙惠民等, 2006), 因此, 对于东太湖这类草型湖湾而言, 马来眼子菜残体厌氧分解导致的腐质化程度高(图 2b), 可能降低了营养元素循环速率, 进一步抑制藻类利用水体营养盐.
4.2 马来眼子菜残体的厌氧代谢途径在25 ℃条件下, 硫酸盐还原是沉积物中马来眼子菜残体厌氧代谢的最主要途径, 其次是铁还原和产甲烷过程(图 4).按照热力学原理, 铁还原细菌应先于硫酸盐还原细菌代谢有机碳源, 但在富含有机质的沉积物中铁还原和硫酸盐还原能够同时发生, 甚至硫酸盐还原会先于铁还原(Roden et al., 1996).当前太湖水体中硫酸根浓度显著高于其他典型淡水湖泊, 达到约1 mmol·L-1(Tao et al., 2013);另外, 东太湖沉积物中有机质含量相对于太湖其他湖湾更高, 能够为异养微生物提供充足的碳源(Chen et al., 2016a).因此, 充足的有机质来源和高浓度的硫酸根缓解了铁还原对硫酸盐还原的竞争性抑制, 促进了东太湖沉积物中硫酸盐还原和铁还原细菌的生长繁殖(图 5b), 导致微生物硫酸盐还原和铁还原成为东太湖沉积物中马来眼子菜残体厌氧代谢的主要途径(图 4a).另外, 东太湖沉积物中还发现了硫氧化细菌如硫化细菌(Thiobacillus), 硫氧化细菌能够将硫酸盐还原产生硫化物最终氧化为硫酸根.因此, 本研究中通过测定硫化物浓度变化换算出的硫酸盐还原速率比实际情况偏低, 硫酸盐还原作用占马来眼子菜残体厌氧代谢的比例很可能更高.
硫酸盐还原产生的硫化氢对水生动植物和环境造成严重的危害, 东太湖中强烈的铁还原作用产生的Fe(II)(图 4a)可与硫化物形成沉淀抑制硫化氢的产生(Chen et al., 2016a).另外, CH4全球变暖潜力值是CO2的25倍, 并且CH4是第二大温室气体排放源, 对全球气候变化有重要的影响(Bridgham et al., 2013).本研究中发现25 ℃实验组时东太湖沉积物中产甲烷作用显著强于4 ℃实验组(图 4b), 且超过15%的马来眼子菜残体是通过产甲烷途径完成厌氧代谢.研究表明, 沉水植物通过根系泌氧将沉积物中的Fe(II)氧化为Fe(III), 实现促进铁还原作用而抑制产甲烷过程(Laanbroek et al., 2009).因此, 在今后东太湖生态环境管理过程中, 如能增加根系泌氧能力强的水生植物生物量, 并且对植物残体进行有效收割收集, 可能对东太湖区域温室气体排放起到一定的抑制效果.
5 结论(Conclusions)1) 温度升高促进了沉积物中马来眼子菜残体的厌氧分解, 导致25 ℃实验组沉积物中TOC和纤维素去除率显著高于4 ℃实验组, 且微生物对马来眼子菜残体的分解促进了沉积物的腐质化过程.
2) 温度升高促进了纤维素降解细菌(如拟杆菌门, Bacteroidetes)的生长繁殖, 且硫酸盐还原和铁还原细菌是沉积物中主要的优势菌种.
3) 在25 ℃条件下, 硫酸盐还原、铁还原和产甲烷在马来眼子菜残体的厌氧分解过程中发挥了重要作用, 以上3种微生物代谢途径占沉积物中有机质厌氧代谢的比例分别达到37.3%、27.8%和10.3%.
参考文献
| Aller R C. 1994. Bioturbation and remineralization of sedimentary organic matter:effects of redox oscillation[J]. Chemical Geology, 114(3/4): 331-345. |
| Al-Raei A M, Bosselmann K, B?ttcher M E, et al. 2009. Seasonal dynamics of microbial sulfate reduction in temperate intertidal surface sediments:controls by temperature and organic matter[J]. Ocean Dynamics, 59(2): 351-370. DOI:10.1007/s10236-009-0186-5 |
| Bridgham S D, Cadillo-Quiroz H, Keller J K, et al. 2013. Methane emissions from wetlands:biogeochemical, microbial, and modeling perspectives from local to global scales[J]. Global Change Biology, 19(5): 1325-1346. DOI:10.1111/gcb.12131 |
| 曹勋, 韩睿明, 章婷曦, 等. 2015. 冬季水生植物分解过程及其对水质的影响研究[J]. 农业环境科学学报, 34(2): 361-369. |
| Chen M, Jiang H L. 2016a. Relative contribution of iron reduction to sediments organic matter mineralization in contrasting habitats of a shallow eutrophic freshwater lake[J]. Environmental Pollution, 213: 904-912. DOI:10.1016/j.envpol.2016.03.061 |
| Chen M, Li X H, He Y H, et al. 2016b. Increasing sulfate concentrations result in higher sulfide production and phosphorous mobilization in a shallow eutrophic freshwater lake[J]. Water Research, 96: 94-104. |
| Chen M, Ye T R, Krumholz L R, et al. 2014. Temperature and cyanobacterial bloom biomass influence phosphorous cycling in eutrophic lake sediments[J]. PloS One, 9(3): e93130. DOI:10.1371/journal.pone.0093130 |
| Furukawa Y, Smith A C, Kostka J E, et al. 2004. Quantification of macrobenthic effects on diagenesis using a multicomponent inverse model in salt marsh sediments[J]. Limnology and Oceanography, 49(6): 2058-2072. DOI:10.4319/lo.2004.49.6.2058 |
| Gudasz C, Bastviken D, Steger K, et al. 2010. Temperature-controlled organic carbon mineralization in lake sediments[J]. Nature, 466(7305): 478. DOI:10.1038/nature09186 |
| 韩红娟, 翟水晶, 胡维平. 2010. 马来眼子菜腐烂分解氮磷转化模型研究[J]. 环境科学, 31(6): 1483-1488. |
| Hong S W, Kim H S, Chung T H. 2010. Alteration of sediment organic matter in sediment microbial fuel cells[J]. Environmental Pollution, 158(1): 185-191. |
| Jiao N, Herndl G J, Hansell D A, et al. 2010. Microbial production of recalcitrant dissolved organic matter:long-term carbon storage in the global ocean[J]. Nature Reviews Microbiology, 8(8): 593-599. DOI:10.1038/nrmicro2386 |
| Laanbroek H J. 2009. Methane emission from natural wetlands:interplay between emergent macrophytes and soil microbial processes. A mini-review[J]. Annals of Botany, 105(1): 141-153. DOI:10.1093/aob/mcp201 |
| 刘伟龙, 胡维平, 陈永根, 等. 2013. 西太湖水生植物时空变化[J]. 生态学报, 27(1): 159-170. |
| 刘伟龙, 胡维平, 谷孝鸿. 2007. 太湖马来眼子菜(Potamogeton malaianus)生物量变化及影响因素[J]. 生态学报, 27(8): 3324-3333. DOI:10.3321/j.issn:1000-0933.2007.08.027 |
| 潘慧云, 徐小花, 高士祥. 2008. 沉水植物衰亡过程中营养盐的释放过程及规律[J]. 环境科学研究, 21(1): 64-68. |
| Prescott C E. 2010. Litter decomposition:what controls it and how can we alter it to sequester more carbon in forest soils?[J]. Biogeochemistry, 101(1/3): 133-149. DOI:10.1007/s10533-010-9439-0 |
| Roden E E, Wetzel R G. 1996. Organic carbon oxidation and suppression of methane production by microbial Fe (Ⅲ) oxide reduction in vegetated and unvegetated freshwater wetland sediments[J]. Limnology and Oceanography, 41(8): 1733-1748. DOI:10.4319/lo.1996.41.8.1733 |
| Rovira P, Vallejo V R. 2002. Labile and recalcitrant pools of carbon and nitrogen in organic matter decomposing at different depths in soil:an acid hydrolysis approach[J]. Geoderma, 107(1/2): 109-141. |
| Song N, Jiang H L, Cai H Y, et al. 2015. Beyond enhancement of macrophyte litter decomposition in sediments from a terrestrializated shallow lake through bioanode employment[J]. Chemical Engineering Journal, 279: 433-441. DOI:10.1016/j.cej.2015.05.041 |
| Song N, Yan Z S, Cai H Y, et al. 2013. Effect of temperature on submerged macrophyte litter decomposition within sediments from a large shallow and subtropical freshwater lake[J]. Hydrobiologia, 714(1): 131-144. DOI:10.1007/s10750-013-1529-2 |
| Stookey L L. 1970. Ferrozine——a new spectrophotometric reagent for iron[J]. Analytical Chemistry, 42(7): 779-781. DOI:10.1021/ac60289a016 |
| 孙惠民, 何江, 吕昌伟, 等. 2006. 乌梁素海氮污染及其空间分布格局[J]. 地理研究, 25(6): 1003-1012. DOI:10.3321/j.issn:1000-0585.2006.06.007 |
| Tao Y, Yuan Z, Fengchang W, et al. 2013. Six-decade change in water chemistry of large freshwater Lake Taihu, China[J]. Environmental Science & Technology, 47(16): 9093-9101. |
| 王博, 李法云, 范志平. 2014. 初春马来眼子菜分解对水体和底泥碳、氮和磷积累及释放的影响[J]. 植物资源与环境学报, 23(2): 80-86. DOI:10.3969/j.issn.1674-7895.2014.02.12 |
| Weston N B, Joye S B. 2005. Temperature-driven decoupling of key phases of organic matter degradation in marine sediments[J]. Proceedings of the National Academy of Sciences, 102(47): 17036-17040. DOI:10.1073/pnas.0508798102 |
| Wissel H, Mayr C, Lücke A. 2008. A new approach for the isolation of cellulose from aquatic plant tissue and freshwater sediments for stable isotope analysis[J]. Organic Geochemistry, 39(11): 1545-1561. DOI:10.1016/j.orggeochem.2008.07.014 |
| 邢鹏, 孔繁翔, 陈开宁, 等. 2008. 生态修复水生植物根际氨氧化细菌的研究[J]. 环境科学, 29(8): 2154-2159. DOI:10.3321/j.issn:0250-3301.2008.08.012 |
| 杨腾腾, 周宏, 王霞, 等. 2015. 微生物降解纤维素的新机制[J]. 微生物学通报, 42(5): 928-935. |
| Zhang W Q, Jin X, Meng X, et al. 2018. Phosphorus transformations at the sediment-water interface in shallow freshwater ecosystems caused by decomposition of plant debris[J]. Chemosphere, 201: 328-334. DOI:10.1016/j.chemosphere.2018.03.006 |
| 朱维琴, 林咸永, 章永松. 2002. 铁、锰等金属元素的微生物还原及其在环境生物修复中的意义[J]. 应用生态学报, 13(3): 369-372. DOI:10.3321/j.issn:1001-9332.2002.03.027 |
