 , 楼菊青
, 楼菊青

浙江工商大学环境科学与工程学院, 杭州 310012
收稿日期: 2019-12-26; 修回日期: 2020-03-04; 录用日期: 2020-03-04
基金项目: 中央支持地方高校财政专项(No.S1701)
作者简介: 李佳萍(1995-), 女, E-mail:ljp02080603@163.com
通讯作者(责任作者): 楼菊青, E-mail:ljq7393@163.com
摘要:反硝化型甲烷厌氧氧化(Nitrate-/nitrite-denitrifying methane anaerobic oxidation,N-DAMO)技术是一种新型的同步脱氮除甲烷技术.我国环境水体和污水中普遍存在硫酸盐,为探明不同浓度硫酸盐对N-DAMO过程的影响,本研究通过短期和长期试验考察了硫酸盐对Nitrate-DAMO系统生物反应过程的影响,并分析了该过程的动力学及化学计量学特性的影响规律.结果表明,不同浓度梯度的硫酸盐(0~3.96 mmol·L-1)对Nitrate-DAMO系统的短期影响呈先促进后抑制趋势,在浓度为0.42 mmol·L-1时促进作用最明显;当浓度达到0.83 mmol·L-1时,开始有明显的抑制作用,且长期和短期试验过程中均未出现硫酸盐消耗现象.0~0.42 mmol·L-1和0.42~0.83 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学过程分别符合非底物抑制方程和Haldane方程,通过拟合得出硫酸盐对Nitrate-DAMO系统的初始抑制浓度和令Nitrate-DAMO系统完全失去脱氮性能的硫酸盐浓度分别为0.81和4.06 mmol·L-1.硫酸盐对Nitrate-DAMO系统甲烷氧化速率影响的动力学过程符合非底物抑制方程,实际的甲烷氧化速率与脱氮速率之比(5.03:8)符合理论值(5:8).同时,硫酸盐还会影响N-DAMO微生物的生长周期.
关键词:硫酸盐反硝化型甲烷厌氧氧化脱氮性能动力学
The performance and kinetic characteristics of nitrate-denitrifying anaerobic methane oxidation process under different sulfate concentration
LI Jiaping
 , LOU Juqing
, LOU Juqing

School of Environmental Science and Engineering, Zhejiang Gongshang University, Hangzhou 310012
Received 26 December 2019; received in revised from 4 March 2020; accepted 4 March 2020
Abstract: N-DAMO (nitrate-/nitrite-denitrifying methane anaerobic oxidation) technology can achieve nitrogen removal and methane reduction simultaneously. Short- and long-term experiments were carried out to find out the effect of sulfate on N-DAMO process, and the dynamics and stoichiometry of the process were also analyzed. Experimental results indicated that the performance of the Nitrate-DAMO system was promoted firstly then inhibited with the increase of SO42- concentration within 3.96 mmol·L-1, and the denitrification rate was highest at 0.42 mmol·L-1. There was no sulfate consumed during the whole experiment. The denitrification kinetics conformed to non-substrate inhibition equation and Haldane equation. The initial inhibitory and completely inhibited concentration of sulfate on the Nitrate-DAMO system was 0.81 and 4.06 mmol·L-1, respectively. The sulfate effect on methane oxidation rate in the Nitrate-DAMO system was consistent with the non-substrate inhibition equation, and the ratio of the actual methane oxidation rate to the nitrogen removal rate (5.03:8) is in line with the theoretical value (5:8). In addition, sulfate can influence the growth cycle of N-DAMO microorganisms in the Nitrate-DAMO system.
Keywords: sulfatenitrate-denitrifying anaerobic methane oxidationnitrogen removalkinetics
1 引言(Introduction)反硝化型甲烷厌氧氧化(Nitrate-/nitrite-denitrifying methane anaerobic oxidation, N-DAMO)过程可以通过氧化甲烷为厌氧条件下的反硝化提供电子, 这意味着N-DAMO过程能为废水中氮的去除提供新途径(Lu et al., 2017).在全球碳氮循环中, N-DAMO过程发挥着重要作用.目前, 我国自然环境水体和待处理污水中普遍存在硫酸盐, 且各类水体中的硫酸盐浓度差异较大.我国普通城镇污水中的硫酸盐浓度为0.26 mmol·L-1左右(魏华等, 2005), 矿山、冶金、食品及医药等行业污水中的硫酸盐浓度普遍高于2.60 mmol·L-1(王凯, 2018);此外, 我国受硫酸盐污染的地下水中硫酸盐浓度高达13.81 mmol·L-1(张珍珍, 2019).在污水处理过程中, 硫酸盐的存在会产生多种不良影响, 如硫酸根会被硫酸盐还原菌利用并转化为更高毒性的硫化氢(H2S);而在厌氧反应器中, 未离解的H2S浓度与环境pH值相关, 当游离的H2S比例较大时, 不仅会引起水体酸化, 还会影响其他功能微生物的正常生长, 如细菌细胞膜上的酶会与氢离子结合, 降低酶活性.目前已知的N-DAMO微生物广泛分布于含0.21~2.71 mmol·L-1硫酸盐的水稻田(Hu et al., 2016)及含0.06~0.10 mol·L-1硫酸盐的湖泊(Yang et al., 2012)等自然生态环境中;此外, 以含0~0.81 mmol·L-1硫酸盐的不同污水处理厂的厌氧活性污泥为接种物, 研究人员均成功富集培养出了N-DAMO微生物(Wang et al., 2012; Zhou et al., 2014; 杨东叶, 2015; Hu et al., 2016).但目前有关硫酸盐对N-DAMO过程影响的研究还未见报道, 且由于硫酸盐可以耦合甲烷厌氧氧化过程被还原(SAMO), 因此, 探明硫酸盐对Nitrate-DAMO反应过程的影响显得更有意义.本文拟采用以Nitrite-DAMO细菌和Nitrate-DAMO古菌为优势菌种的Nitrate-DAMO反应器为研究对象, 研究不同浓度梯度硫酸盐(0~3.96 mmol·L-1)对Nitrate-DAMO过程的影响, 并通过动力学模型获得反应器协同脱氮除碳系统对硫酸盐的耐受程度, 以期为协同脱氮除碳体系的建立提供理论基础.
2 试验材料与方法(Materials and methods)2.1 材料与方法2.1.1 试验系统以Nitrite-DAMO细菌和Nitrate-DAMO古菌为优势菌种的Nitrate-DAMO系统为研究对象, 该系统以西溪河底泥、西湖底泥与农田水稻土壤的混合污泥为接种物, 结合经高纯N2曝气30 min的以去离子水为溶剂配制的新鲜营养液(表 1), 只提供甲烷和硝态氮, 在25 ℃下富集而得(Lou et al., 2018).Nitrate-DAMO系统运行稳定, 系统优势菌种为Nitrate-DAMO古菌和Nitrite-DAMO细菌.在运行过程中, Nitrate-DAMO系统内部始终保持厌氧状态, 并利用0.1 mol·L-1 HCl或0.1 mol·L-1 NaOH将系统内pH维持在7.0±0.2.
表 1(Table 1)
| 表 1 营养液组分 Table 1 Nutrient solution components | |||||||||||||||
表 1 营养液组分 Table 1 Nutrient solution components
| |||||||||||||||
2.1.2 试验装置短期和长期试验装置分别为直径7.0 cm、高度14.0 cm的250 mL厌氧反应器和直径9.0 cm、高度23.0 cm的1000 mL厌氧反应器.
2.2 试验方法2.2.1 短期试验方法短期试验采用序批式试验, 设1个空白对照组和3个试验平行组, 从母反应器中各取200.0 mL混合液注入每个250 mL子反应器中, 试验时长为7 d.硫酸盐浓度梯度分别为0、0.21、0.42、0.63、0.83、1.88、2.92、3.96 mmol·L-1.每24 h取水样2.0 mL, 经0.22 μm微孔滤膜过滤后测定NO3--N、NO2--N及SO42-浓度, 同时监测系统中甲烷含量.
2.2.2 长期试验方法根据短期试验结果, 选取两个代表性硫酸盐浓度开展长期试验, 从母反应器中各取800.0 mL泥水混合液注入每个1000 mL子反应器中, 设置一个空白对照组和两个试验组, 连续运行90 d, 初始硝态氮浓度控制在(20±2) mg·L-1.每24 h取水样5.0 mL, 经0.22 μm微孔滤膜过滤后测定NO3--N、NO2--N及SO42-浓度.只提供充足的甲烷作为唯一碳源, 每48 h测定CH4含量, 每7 d补充一次甲烷.试验过程中, 当反应器中的硝态氮浓度低于检出限时, 重新投加硝酸盐, 从投加到消耗完视为一个加药周期.
2.2.3 内源性呼吸试验方法长期试验结束后, 停止提供甲烷, 控制其他运行条件不变, 将反应器继续运行6 d;每24 h取水样2.0 mL, 经0.22 μm微孔滤膜过滤后测定NO3--N、NO2--N及SO42-浓度.
2.3 测定项目及方法2.3.1 常规水质测定根据《水和废水监测分析方法》(第四版)(魏复盛, 2002), 利用普析TU-1901双光束紫外可见分光光度计测定硝态氮(NO3--N)、亚硝态氮(NO2--N)的浓度.通过装配有FID的气相色谱仪(GC2030, 岛津)测定顶空甲烷气体含量(He et al., 2015).利用梅特勒FG2便携式pH计监测子反应器在试验期间的pH变化情况.利用离子色谱仪(Dionex Aquion, 赛默飞)测定SO42-浓度.
2.3.2 N-DAMO反应速率的计算基质降解速率的计算采用差减法(Fu et al., 2015; Hu et al., 2015), 如式(1)~(3)所示.利用1stOpt 6.0软件(http://7d-soft.com/cn/index.htm)完成数据拟合.
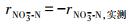 | (1) |
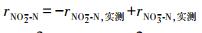 | (2) |
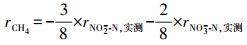 | (3) |
2.4 动力学模型2.4.1 基本假设在本次Nitrate-DAMO动力学模型建立过程中设定了如下的前提假设:①Nitrate-DAMO系统中进行的N-DAMO过程由Nitrite-DAMO细菌完成还原亚硝酸盐的Nitrite-DAMO反应和由Nitrate-DAMO古菌完成还原硝酸盐的Nitrate-DAMO反应组成;②忽略定期取水样对反应器中总水量的影响;③系统内泥水混合均匀, SBR反应体系能够迅速达到准稳态;④甲烷转移系数(KLa)是恒定的, 忽略底物和营养液之间甲烷溶解度和传质系数的差异.
2.4.2 动力学模型的选择本研究拟选用非底物抑制方程(式(4))(Vadielu et al., 2006; 宋静, 2010)、Haldane方程(式(5))(朱泽沅, 2015; 杨振琳, 2018)和Han-Levenspiel方程(式(6))(He et al., 2015)来模拟硫酸盐对N-DAMO过程的影响动力学.
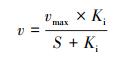 | (4) |
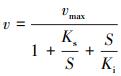 | (5) |
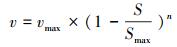 | (6) |
3 结果与讨论(Results and discussion)3.1 系统脱氮性能研究Nitrate-DAMO系统运行稳定, 脱氮速率为0.063 mmol·L-1·d-1, 甲烷氧化速率为0.085 mmol·L-1·d-1(图 1), 且没有亚硝酸盐积累.Nitrate-DAMO系统中ANME-2d古菌和Nitrite-DAMO细菌的拷贝数分别为4.12×106 copies·g-1和3.03×107 copies·g-1, 两者比值约为7.35.
图 1(Fig. 1)
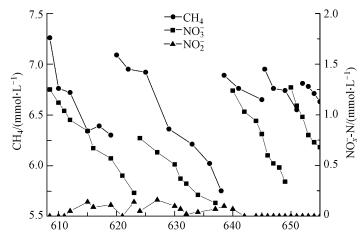 |
| 图 1 Nitrate-DAMO试验系统的脱氮性能 Fig. 1Nitrogen removal performance in nitrate-DAMO system |
3.1.1 硫酸盐对Nitrate-DAMO系统脱氮性能的短期影响在短期试验过程中, 硫酸盐浓度几乎没有变化, 这是因为硫酸盐型甲烷厌氧氧化(Sulphate anaerobic methane oxidation, SAMO)反应的吉布斯自由能仅为-16.6 kJ·mol-1(陈健等, 2018), 远大于Nitrite-DAMO的反应吉布斯自由能(-928.0 kJ·mol-1)和Nitrate-DAMO的吉布斯自由能(-765.0 kJ·mol-1), 即N-DAMO反应比SAMO反应更容易自发;且短期试验时长低于SAMO微生物的富集时长.已知盐度是影响N-DAMO过程的一个重要因素(Zhang et al., 2018).高盐度环境下, 微生物需要额外的能量用于渗透适应;盐度会影响细胞代谢过程中酶的活性和稳定性, 如氯盐度会影响Nitrite-DAMO细菌内酶, 从而抑制Nitrite-DAMO活性(He et al., 2015);还会影响系统原本的菌群结构, 如高氯酸盐的添加会改变N-DAMO系统中微生物菌群结构(Chen et al., 2016).由于硫酸盐含量在Nitrate-DAMO系统中没有变化, 说明硫酸盐对Nitrate-DAMO系统的影响主要是盐度引起的.
不同浓度梯度硫酸盐(0~3.96 mmol·L-1)对Nitrite-DAMO反应的短期影响见图 2.从图 2可知, 0~3.96 mmol·L-1范围内的不同浓度梯度硫酸盐对Nitrate-DAMO系统的短期影响呈先促进后抑制趋势;相对空白组而言, 0.21、0.42、0.63、0.83、1.88、2.92和3.96 mmol·L-1试验组的7 d平均脱氮速率依次为空白组的114.69%、163.14%、145.24%、77.32%、56.95%、44.8%和39.62%.当浓度低于0.63 mmol·L-1时, 硫酸盐的存在对N-DAMO过程有促进作用, 在0.42 mmol·L-1时, 促进作用最明显.当浓度达到0.83 mmol·L-1时, 开始有明显的抑制作用, 且随着浓度的增加, 抑制作用增加.这种先促进后抑制的现象与氯盐对Anammox菌的影响结果相似.有研究表明, Anammox菌在受到较低浓度氯盐的影响时, Anammox污泥胞外聚合物(EPS)中的蛋白质含量增加, 增强了Anammox污泥稳定性, 促进了Anammox菌的脱氮性能;氯盐浓度过高时, Anammox污泥EPS总含量降低, 继而导致Anammox污泥稳定性降低, 从而导致Anammox菌的脱氮性能降低(Xing et al., 2017).
图 2(Fig. 2)
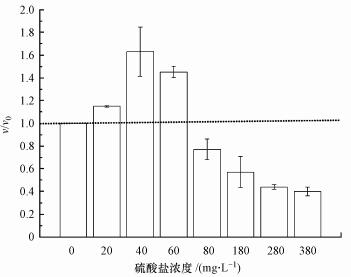 |
| 图 2 不同硫酸盐浓度对Nitrate-DAMO反应的短期影响(v和v0分别为试验组和空白组的7 d平均脱氮速率) Fig. 2Short-term effect of different sulfate concentrations on the Nitrate-DAMO process |
3.1.2 硫酸盐对Nitrate-DAMO系统脱氮性能的长期影响由短期试验结果(图 2)可知, 0.42 mmol·L-1硫酸盐对Nitrate-DAMO系统的脱氮性能促进作用最明显;0.83 mmol·L-1硫酸盐开始对Nitrate-DAMO系统的脱氮性能产生明显的抑制作用.本次硫酸盐对Nitrate-DAMO系统的长期影响试验浓度分别设置为0.42 mmol·L-1(促进组)和0.83 mmol·L-1(抑制组), 同时设计空白对照组和平行试验组, 并控制长期实验过程中每个加药周期的空白组、促进组和抑制组中初始硝态氮浓度基本无差异.式(7)为Nitrate-DAMO反应.
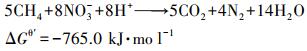 | (7) |
图 3(Fig. 3)
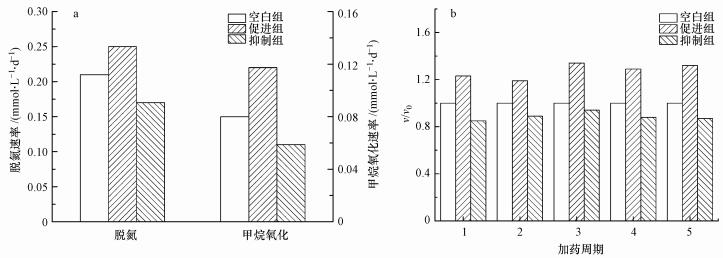 |
| 图 3 Nitrate-DAMO系统的长期平均脱氮速率、平均甲烷氧化速率(a)及各加药周期的平均脱氮性能(b) (v/v0为各试验组与空白组的平均脱氮速率的比值) Fig. 3Long-term average nitrogen removal rate and average methane oxidation rate of Nitrate-DAMO system (a) and the average nitrogen removal performance in each dosing cycle(b) |
 | (8) |
由图 3b可知, 相对空白组而言, 促进组的平均脱氮速率和平均甲烷氧化速率分别增加了30.53%、34.79%, 抑制组的平均脱氮速率和平均甲烷氧化速率分别降低了12.40%、37.24%.随着时间的推移, 促进组的每个加药周期的脱氮速率呈上升趋势, 后3个加药周期的平均脱氮速率比前两个周期的平均脱氮速率高33.11%.这种趋势与相关研究报道的盐度影响厌氧微生物的结果一致(Xing et al., 2017), 表明Nitrate-DAMO系统在0.42 mmol·L-1硫酸盐的长期影响下, 系统的脱氮性能在反应器稳定运行时有所提高, 说明Nitrate-DAMO微生物能够适应0.42 mmol·L-1的硫酸盐环境.这种适应现象的出现与Xing等(2017)的研究结果相同, 这是因为Nitrate-DAMO微生物会产生EPS来维持细胞稳定性, 同时通过增强细胞内物质转化及改变其原本的菌群结构和群体行为来适应硫酸盐环境(Wang et al., 2019).长期试验过程中, 抑制组的脱氮性能稳定, 但0.83 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能的长期抑制程度低于短期抑制程度, 这与氯盐对Anammox菌的影响结果相左(Li et al., 2018).这种抑制程度的差异性与盐类相关, 如硫酸盐对Anammox菌的抑制程度比氯盐对Anammox菌的抑制程度更大(金仁村等, 2013);同时还与微生物菌群结构有关, 如相同浓度硫酸盐对不同Anammox系统的半抑制浓度不同(Dapena-Mora et al., 2007), 具体机制有待进一步研究.当Nitrate-DAMO微生物受到0.83 mmol·L-1硫酸盐的短期急性刺激后, Nitrate-DAMO微生物的EPS受到影响(Xing et al., 2017), 同时Nitrate-DAMO系统的脱氮性能呈现出明显的受抑制现象;随后, 为适应0.83 mmol·L-1的硫酸盐环境, Nitrate-DAMO微生物会合成更多的能与阴离子结合、催化和氧化还原反应的蛋白质(Meng et al., 2018), 以维持Nitrate-DAMO微生物活性.综上, Nitrate-DAMO微生物能够适应一定浓度的硫酸盐环境.
为了解Nitrate-DAMO系统中EPS受硫酸盐影响情况, 对Nitrate-DAMO系统中的EPS含量进行了监测(图 4).由图 4可知, 在0.42 mmol·L-1硫酸盐作用下, 促进组中的多糖、蛋白质和腐殖酸含量均有所增加;在0.83 mmol·L-1硫酸盐作用下, 抑制组中的多糖含量略微增加, 腐殖酸、蛋白质含量减少, EPS总量呈下降趋势.这说明在硫酸盐作用下, Nitrate-DAMO系统中的EPS含量受到影响.促进组中, 蛋白质的增加有利于促进N-DAMO微生物的形成与稳定(Fu et al., 2017), 多糖的增加有利于促进细胞保护膜的形成(Ni et al., 2010), 缓解钠离子对细胞压力的作用(陈玉娟, 2018), 腐殖酸的醌等官能团通过充当末端电子受体促进了系统中的甲烷氧化过程(Valenzuela et al., 2017), 因此, 腐殖酸的增加有利于促进甲烷氧化过程.抑制组中, EPS总量减少的现象与大多数盐度抑制微生物影响的研究结果相符, 其中, 多糖的增加可能是N-DAMO微生物在受硫酸盐刺激后自我调节的结果, 多糖可稳定细胞膜表面的原生质层, 保护胞内酶蛋白(许硕, 2018).综上所述, 硫酸盐对Nitrate-DAMO系统的影响来自于对系统EPS的影响.
图 4(Fig. 4)
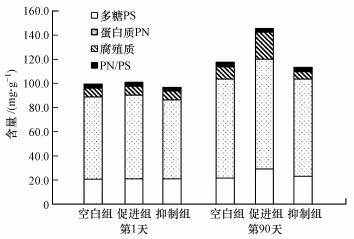 |
| 图 4 硫酸盐作用下Nitrate-DAMO系统EPS含量变化 Fig. 4Changes of EPS in nitrate-DAMO system |
3.2 动力学模型的建立3.2.1 硫酸盐对Nitrate-DAMO系统脱氮性能影响动力学如图 2所示, 在0~3.96 mmol·L-1硫酸盐条件下, Nitrate-DAMO系统的脱氮速率随着硫酸盐浓度的增加呈先增加后下降趋势.通过1stOpt 6.0软件拟合硫酸盐度对Nitrate-DAMO系统脱氮性能影响的动力学方程(图 5), 其中, 利用非底物抑制方程(式(4))拟合的0~3.96 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学结果见图 5a和图 5b;利用Haldane和Han-Levenspiel方程(式(5)和式(6))拟合的0.42~3.96 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学结果见图 5c和图 5d.
图 5(Fig. 5)
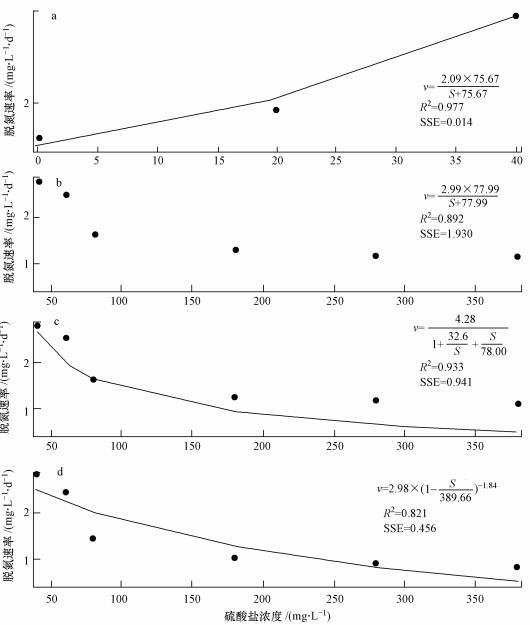 |
| 图 5 方程拟合曲线(a, b.非底物抑制方程; c.Haldane方程; d.Han-Levenspiel方程) Fig. 5Fitted equation curves(a, b.non-substrate inhibition equation; c.Haldane equation; d.Han-Levenspiel equation) |
由图 5a可知, 0~0.42 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学过程符合非底物抑制方程, 该拟合曲线的拟合度(R2)和残差平方和(SSE)分别为0.997和0.014;结合图 5a中的拟合方程可知, Nitrate-DAMO系统的最佳脱氮速率为2.09 mg·L-1·d-1, 硫酸盐对Nitrate-DAMO系统的初始抑制浓度为0.79 mmol·L-1.由图 5b~5d可知, 0.42~3.96 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学过程符合非底物抑制方程、Haldane方程和Han-Levenspiel方程, 对应拟合曲线的R2分别为0.892、0.933和0.821, 对应拟合曲线的SSE分别为1.930、0.941和0.456, 对应的最佳脱氮速率分别为2.99、4.28和2.98 mg·L-1·d-1.由图 5d中的拟合方程可知, 令Nitrate-DAMO系统完全失去脱氮性能的硫酸盐浓度为4.06 mmol·L-1.由图 5b~5d中的拟合方程计算可得, 在0.83 mmol·L-1硫酸盐作用下, Nitrate-DAMO系统的理论脱氮速率分别为1.47、1.78、4.54 mg·L-1·d-1;结合3.1节, 在0.83 mmol·L-1硫酸盐作用下, Nitrate-DAMO系统的实际脱氮速率为(1.54±0.09) mg·L-1·d-1, 故硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学过程更符合非底物抑制方程(图 5b)和Haldane方程(图 5c).结合图 5b和图 5c可知, Haldane方程的拟合程度较非底物抑制方程更佳, 因此, 硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学过程更符合Haldane方程, 硫酸盐对Nitrate-DAMO系统的初始抑制浓度为0.81 mmol·L-1.
3.2.2 硫酸盐对Nitrate-DAMO系统甲烷氧化速率影响动力学N-DAMO反应过程包括一个甲烷溶解过程, 理论上液体中的甲烷含量是恒定的.式(9)描述了准稳态下气相-液相的扩散反应动力学, 已知质量转换对异养生物反应具有重要意义(Chen et al., 2014), 目前He等(2013)证实了N-DAMO微生物对甲烷的亲和力高于SAMO微生物.N-DAMO微生物可生存于低甲烷负荷的淡水环境;SAMO反应在高盐度或者高碱度环境下更易发生(唐千等, 2018), 但结合3.1节的试验结果可知长短期试验中没有硫酸盐消耗现象, 这说明本研究中甲烷氧化反应均由N-DAMO微生物完成.
将式(7)、脱氮反应影响动力学(图 5b~5c)与甲烷质量转化热力学(式(9))结合, 可得到式(10)和式(11).由式(10)可知, 硫酸盐对Nitrate-DAMO系统甲烷氧化速率影响的动力学过程符合非底物抑制方程, 且实际的甲烷氧化速率与脱氮速率之比(5.03:8)符合理论值(5:8).已知厌氧反应器中, 液相中甲烷氧化速率与甲烷溶解性直接相关, 而甲烷负荷和甲烷传质(KLa)都会影响甲烷溶解性.又已知本研究过程中定期向反应器提供充足的甲烷, 且Nitrate-DAMO反应能在低甲烷负荷条件下保持稳定(Chen et al., 2015), 因此, 本研究中Nitrate-DAMO反应速率与甲烷传质速率密切相关(Chen et al., 2014; Fu et al., 2015).可见, Nitrate-DAMO系统甲烷氧化速率受硫酸盐影响的原因在于反应器中甲烷传质受到影响.
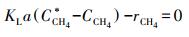 | (9) |
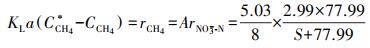 | (10) |
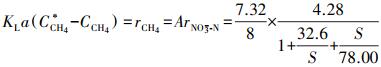 | (11) |
3.2.3 硫酸盐对Nitrate-DAMO系统内源性呼吸影响动力学式(12)和式(13)为Nitrate-DAMO系统的内源性呼吸过程方程.通过监测空白组、促进组和抑制组在无甲烷环境条件下的硝态氮降解速率, 结合式(14)可知, 0、0.42和0.83 mmol·L-1硫酸盐条件下, Nitrate-DAMO系统中N-DAMO微生物的衰减系数bDb分别为0.028、0.036和0.024.N-DAMO微生物的倍增期为
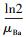
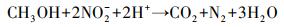 | (12) |
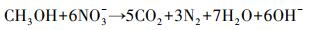 | (13) |
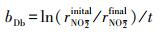 | (14) |
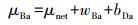 | (15) |
4 结论(Conclusions)1) 0~3.96 mmol·L-1范围内不同浓度硫酸盐对Nitrate-DAMO系统的短期影响呈先促进后抑制趋势, 在0.42 mmol·L-1时, 硫酸盐对Nitrate-DAMO系统的促进作用最明显, 当浓度达到0.83 mmol·L-1时, 硫酸盐对Nitrate-DAMO系统开始产生明显的抑制作用.
2) 0~0.42 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学过程符合非底物抑制方程;0.42~3.96 mmol·L-1硫酸盐对Nitrate-DAMO系统脱氮性能影响的动力学过程符合Haldane方程.动力学方程拟合结果显示, 硫酸盐对Nitrate-DAMO系统的初始抑制浓度为0.81 mmol·L-1, 令Nitrate-DAMO系统完全失去脱氮性能的硫酸盐浓度为4.06 mmol·L-1, 与试验结果相吻合, 相关方程可用于受硫酸盐影响的Nitrate-DAMO系统的模拟.
3) 本试验过程中未发生硫酸盐耦合甲烷厌氧化还原反应.硫酸盐对Nitrate-DAMO系统甲烷氧化速率影响的动力学符合非底物抑制方程, 且实际的甲烷氧化速率与脱氮速率之比(5.03:8)符合理论值(5:8).Nitrate-DAMO系统甲烷氧化速率受硫酸盐影响的主要原因是反应器中甲烷传质受到影响.
4) 硫酸盐会影响N-DAMO微生物的生长周期.0、0.42和0.83 mmol·L-1硫酸盐条件下, Nitrate-DAMO系统中N-DAMO微生物的倍增期分别为24.73、19.52和28.75 d.
参考文献
| 陈健, 申屠佳丽, 殷峻, 等. 2018. 甲烷厌氧氧化及其微生物特性研究进展[J]. 环境污染与防治, 40(2): 222. |
| 陈玉娟.2018.盐度对序批式生物反应器去除性能和活性污泥性能的影响[D].长沙: 湖南大学 |
| Chen X, Guo J, Shi Y, et al. 2014. Modeling of simultaneous anaerobic methane and ammonium oxidation in a membrane biofilm reactor[J]. Environmental Science Technology, 48: 9540-9547. DOI:10.1021/es502608s |
| Chen X, Guo J, Xie G J, et al. 2015. A new approach to simultaneous ammonium and dissolved methane removal from anaerobic digestion liquor:A model-based investigation of feasibility[J]. Water Research, 85: 295-303. DOI:10.1016/j.watres.2015.08.046 |
| Chen R, Luo Y H, Chen J X, et al. 2016. Evolution of the microbial community of the biofilm in a methane-based membrane biofilm reactor reducing multiple electron acceptors[J]. Environ Sci Pollut Res Int, 23(10): 9540-9548. DOI:10.1007/s11356-016-6146-y |
| Dapena-Mora A, Fernández J L C, Mosquera-Corral R M, et al. 2007. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production[J]. Enzyme and Microbial Technology, 40: 859-865. DOI:10.1016/j.enzmictec.2006.06.018 |
| Ettwig K F, Shima S, van de Pas-Schoonen K T, et al. 2008. Denitrifying bacteria anaerobically oxidize methane in the absence of Archaea[J]. Environmental Microbiology, 10: 3164-3173. DOI:10.1111/j.1462-2920.2008.01724.x |
| Ettwig K F, van Alen T, van de Pas-Schoonen K T, et al. 2009. Enrichment and molecular detection of denitrifying methanotrophic bacteria of the NC10 phylum[J]. Applied and Environmental Microbiology, 75: 3656-3662. DOI:10.1128/AEM.00067-09 |
| Fu L, Ding Z W, Ding J, et al. 2015. The role of paraffin oil on the interaction between denitrifying anaerobic methane oxidation and Anammox processes[J]. Applied Microbiology and Biotechnology, 99: 7925-7936. DOI:10.1007/s00253-015-6670-6 |
| Fu L, Ding J, Lu Y Z, et al. 2017. Hollow fiber membrane bioreactor affects microbial community and morphology of the DAMO and Anammox co-culture system[J]. Bioresource Technology, 232: 247-253. DOI:10.1016/j.biortech.2017.02.048 |
| Haroon M F, Hu S, Shi Y, et al. 2013. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage[J]. Nature, 500: 567-570. DOI:10.1038/nature12375 |
| He Z, Geng S, Shen L, et al. 2015. The short- and long-term effects of environmental conditions on anaerobic methane oxidation coupled to nitrite reduction[J]. Water Research, 68: 554-562. DOI:10.1016/j.watres.2014.09.055 |
| Hu S.2012.Enrichment and understanding of denitrifying anaerobic methane oxidation (DAMO) organisms[D]. Queensland: The University of Queensland |
| Hu S, Zeng R J, Haroon M F, et al. 2015. A laboratory investigation of interactions between denitrifying anaerobic methane oxidation (DAMO) and anammox processes in anoxic environments[J]. Scientific Reports, 5: 8706. DOI:10.1038/srep08706 |
| Hu Z, Ma R. 2016. Distribution and characteristic of nitrite-dependent anaerobic methane oxidation bacteria by comparative analysis of wastewater treatment plants and agriculture fields in northern China[J]. PeerJ, 4: e2766. DOI:10.7717/peerj.2766 |
| 金仁村, 马春, 郑平, 等. 2013. 盐度对Anammox的短期影响研究[J]. 高校化学工程学报, 27(2): 321-329. |
| Li J, Qi P, Qiang Z, et al. 2018. Is anammox a promising treatment process for nitrogen removal from nitrogen-rich saline wastewater?[J]. Bioresource Technology, 270: 722-731. DOI:10.1016/j.biortech.2018.08.115 |
| 刘正川, 袁林江, 周国标, 等. 2015. 从亚硝酸还原厌氧氨氧化转变为硫酸盐型厌氧氨氧化[J]. 环境科学, 36(9): 3345-3351. |
| Lou J Q, Wang X L, Li J P, et al. 2018. The short- and long-term effects of nitrite on denitrifying anaerobic methane oxidation (DAMO) organisms[J]. Environmental Science Pollution Research, 26: 4777-4790. |
| Lu P, Liu T, Ni B J, et al. 2019. Growth kinetics of Candidatus 'Methanoperedens nitroreducens' enriched in a laboratory reactor[J]. Science of The Total Environment, 659: 442-450. DOI:10.1016/j.scitotenv.2018.12.351 |
| Lu Y Z, Li N, Ding Z W, et al. 2017. Tracking the activity of the Anammox-DAMO process using excitation-emission matrix (EEM) fluorescence spectroscopy[J]. Water Research, 122: 624-632. DOI:10.1016/j.watres.2017.06.036 |
| Meng Y, Yin C, Zhou Z, et al. 2018. Increased salinity triggers significant changes in the functional proteins of ANAMMOX bacteria within a biofilm community[J]. Chemosphere, 207: 655-664. DOI:10.1016/j.chemosphere.2018.05.076 |
| Ni S Q, Fessehaie A, Lee P H, et al. 2010. Interaction of anammox bacteria and inactive methanogenic granules under high nitrogen selective pressure[J]. Bioresour Technol, 101(18): 6910-6915. DOI:10.1016/j.biortech.2010.03.125 |
| Raghoebarsing A A, van de Pas-Schoonen A Pol K T, Smolders A J, et al. 2006. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature, 440: 918-921. DOI:10.1038/nature04617 |
| Regnier P, Dale A W, Arndt S, LaRowe D E, et al. 2011. Quantitative analysis of anaerobic oxidation of methane (AOM) in marine sediments:A modeling perspective[J]. Earth-Science Reviews, 106: 105-130. DOI:10.1016/j.earscirev.2011.01.002 |
| Shen L, Ouyang L, Zhu Y, et al. 2019. Spatial separation of anaerobic ammonium oxidation and nitrite-dependent anaerobic methane oxidation in permeable riverbeds[J]. Environmental Microbiology, 21(4): 1185-1195. DOI:10.1111/1462-2920.14554 |
| Shen L D, Wu H S, Liu X, et al. 2017. Cooccurrence and potential role of nitrite- and nitrate-dependent methanotrophs in freshwater marsh sediments[J]. Water Research, 123: 162-172. DOI:10.1016/j.watres.2017.06.075 |
| 宋静.2010.氨氧化富集颗粒污泥短程硝化及自由亚硝酸抑制研究[D].合肥: 合肥工业大学 |
| 唐千, 薛校风, 王惠, 等. 2018. 湖泊生态系统产甲烷与甲烷氧化微生物研究进展[J]. 湖泊科学, 30(3): 597-610. |
| Vadivelu V M, Keller J, Yuan Z G. 2006. Effect of free ammonia and free nitrous acid concentration on the anabolic and catabolic processes of an enriched nitrosomonas culture[J]. Biotechnology Bioengineering, 95(5): 831-839. |
| Valenzuela E I, Prieto-Davó A, López-Lozano N E, et al. 2017. Anaerobic methane oxidation driven by microbial reduction of natural organic matter in a tropical wetland[J]. Appl Environ Microbiol, 83(11): AEM.00645-17. |
| 王凯.2018.生物电解池技术处理硫酸盐废水基础研究[D].杭州: 浙江大学 |
| Wang H, Li H X, Fang F, et al. 2019. Underlying mechanisms of ANAMMOX bacteria adaptation to salinity stress[J]. Journal of Industrial Microbiology and Biotechnology, 46: 573-585. DOI:10.1007/s10295-019-02137-x |
| Wang Y, Zhu G, Harhangi H R, et al. 2012. Co-occurrence and distribution of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in a paddy soil[J]. FEMS Microbiology Letters, 336: 79-88. DOI:10.1111/j.1574-6968.2012.02654.x |
| 魏复盛. 2002. 水和废水监测分析方法(第4版)[M]. . |
| 魏华, 韩芸, 张晓明, 等. 2005. 缺氧环境下硫酸盐还原对反硝化过程影响的特性试验研究[J]. 环境工程, 23(5): 76-79. |
| Xing H, Wang H, Fang F, et al. 2017. Effect of increase in salinity on ANAMMOX-UASB reactor stability[J]. Environmental Technology, 38: 1184-1190. DOI:10.1080/09593330.2016.1223174 |
| 许硕.2018.含盐有机废水生物降解群落结构分析及其耐盐机理研究[D].青岛: 青岛科技大学 |
| 杨东叶.2015.反硝化型甲烷厌氧氧化微生物富集及特性研究[D].杭州: 浙江工商大学 |
| 杨振琳.2018.相容性溶质强化厌氧氨氧化耦合反硝化工艺处理高盐废水脱氮除碳效能及其动力学特性[D].青岛: 青岛大学 |
| Yang J, Jiang H, Wu G, et al. 2012. Co-occurrence of nitrite-dependent anaerobic methane oxidizing and anaerobic ammonia oxidizing bacteria in two Qinghai-Tibetan saline lakes[J]. Frontiers of Earth Science, 6: 383-391. DOI:10.1007/s11707-012-0336-9 |
| Zhang X W, Liu Y, Gu J D. 2018. A global analysis on the distribution pattern of the bacteria coupling simultaneous methane oxidation to nitrite reduction[J]. Int Biodeter Biodegra, 129: 123-132. DOI:10.1016/j.ibiod.2018.01.014 |
| 张珍珍.2019.含硫酸盐废水MBR处理系统的微生物多样性[D].南昌: 南昌航空大学 |
| Zhou L, Wang Y, Long X E, et al. 2014. High abundance and diversity of nitrite-dependent anaerobic methane-oxidizing bacteria in a paddy field profile[J]. FEMS Microbiology Letters, 360: 33-41. DOI:10.1111/1574-6968.12567 |
| 朱泽沅.2015.ANAMMOX与反硝化协同反应脱氮性能及处理火电厂烟气脱硝尾液的实验研究[D].青岛: 青岛大学 |
