 , 颜志娇2,3, 朱江2,3, 张琪琪2,3, 许文来1,2,3, 刘静1,2,3
, 颜志娇2,3, 朱江2,3, 张琪琪2,3, 许文来1,2,3, 刘静1,2,3

1. 地质灾害防治与地质环境保护国家重点实验室(成都理工大学), 成都 610059;
2. 国家环境保护水土污染协同控制与联合修复重点实验室(成都理工大学), 成都 610059;
3. 成都理工大学生态环境学院, 成都 610059;
4. 四川省生态环境科学研究院, 成都 610041
收稿日期: 2020-03-13; 修回日期: 2020-05-20; 录用日期: 2020-05-20
基金项目: 2019年度四川省环境治理与生态保护重大科技专项(No.2019YFS0504);成都理工大学科研启动基金(No.10912-KYQD-06887)
作者简介: 钱磊(1995-), 女, E-mail:245716596@qq.com
通讯作者(责任作者): 刘静, E-mail:liujing17@cdut.edu.cn
摘要:研究污水处理厂出水受纳水体浮游植物群落结构特征并进行水质评价,可为污水厂是否需要提标改造提供指导.基于2018年10月—2019年9月期间浮游植物和水质理化指标的监测数据,分析了成都市3个污水处理厂出水受纳水体浮游植物群落结构特征,通过相关性分析研究了理化指标与浮游植物细胞密度的关系,并采用综合营养指数法与藻类生物学法进行了水质评价.结果表明,3个采样点共鉴定出浮游植物7门49属,优势属为小环藻属与假鱼腥藻属.全年浮游植物细胞密度为2.78×105~2.28×106 cells·L-1.全年时间内污水处理厂出水受纳水体浮游植物的多样性指数和均匀度指数变化趋势基本一致.相关性分析结果表明,水温和溶解性磷酸盐是影响研究区域部分采样点浮游植物细胞密度的主要环境因子.水质评价结果得出研究区域处于贫营养状态,污水厂出水不会导致水体富营养化,污水厂的提标改造有待进一步讨论.
关键词:污水处理厂受纳水体浮游植物群落结构水质评价
Phytoplankton community structure and the evaluation of water quality in receiving river of wastewater treatment plant effluents
QIAN Lei2,3,4
 , YAN Zhijiao2,3, ZHU Jiang2,3, ZHANG Qiqi2,3, XU Wenlai1,2,3, LIU Jing1,2,3
, YAN Zhijiao2,3, ZHU Jiang2,3, ZHANG Qiqi2,3, XU Wenlai1,2,3, LIU Jing1,2,3

1. State Key Laboratory of Geohazard Prevention and Geoenvironment Protection, Chengdu University of Technology, Chengdu 610059;
2. State Environmental Protection Key Laboratory of Synergetic Control and Joint Remediation for Soil & Water Pollution(SEKL-SW), Chengdu University of Technology, Chengdu 610059;
3. College of Environment and Ecology, Chengdu University of Technology, Chengdu 610059;
4. Sichuan Academy of Environmental Sciences, Chengdu 610041
Received 13 March 2020; received in revised from 20 May 2020; accepted 20 May 2020
Abstract: This study aims to study the phytoplankton community structure and the evaluation of water quality in receiving river of wastewater treatment plant effluents, provide guidance for whether the sewage treatment plant needs to be upgraded and reconstruct. Based on the monitoring data of phytoplankton and physicochemical indices of water quality from October, 2018 to September, 2019, the phytoplankton community structure characteristics were analyzed, and relationship between physicochemical indices of water quality and phytoplankton cell density was studied by Pearson correlation analysis. At the same time, algal biological indices and comprehensive nutrition state index TLI(∑) were used to evaluate the water quality. The results showed that, a total of 49 genera, belonging to 7 phyla were identified, the dominant genera were Cyclotella and Pseudanabaena. The density range of phytoplankton cells in the whole year was 2.78×105 ~2.28×106 cells·L-1. Annual variability was the same for the indices of Shannon-Wiener and Pielou evenness. The Pearson correlation analysis showed that water temperature, solubility reactive phosphorus were the main environmental factors that influenced the cell density of phytoplankton in some samples. The results of water evaluation showed the water quality in receiving river of wastewater treatment plant effluents was oligotrophic, the effluent of sewage treatment plant will not lead to eutrophication of water body, and the upgrading and reconstruction of sewage treatment plant is open to discuss.
Keywords: sewage treatment plantreceiving riverphytoplanktoncommunity structureevaluation of water quality
1 引言(Introduction)随着我国城市化进程的加快与人口的增长, 污水处理厂的日处理量与负荷也逐渐增大(魏亮等, 2016), 进一步导致越来越多的污水处理厂出水被直接排入水环境中, 从而增加了水环境容量负荷.目前, 已有大量文献证明污水处理厂出水中含有的污染物会对受纳水体产生较大影响.例如, 雷一帆等(2018)利用二维水动力水质耦合模型分析江苏某污水处理厂尾水对受纳河段水体水质的影响, 发现小潮期间尾水排放会导致沿岸水体污染物浓度增高.吴钦(2019)则采用理化监测的方式对某城镇污水处理厂尾水及受纳水体进行水质分析并得出了相同结论, 尾水的集中排放会导致排放口控制断面的污染物浓度显著升高.与此同时, 污水处理厂出水又是重要的天然水体补充来源, 其出水中的污染物会对水环境及水生生物产生一系列影响, 如水体污染物浓度增高、对水生生物的内分泌干扰(赵琛, 2019)及污染物生物富集等.因此, 降低污水处理厂出水对水环境的影响对于进一步保护水生系统具有十分重要的现实意义, 而实现这一目的往往也需要污水处理厂的提标改造.实际工程中的污水处理厂提标改造包括工艺改造、设备维修及调试能力提高等一系列措施, 是一项投资大成本高且综合性极强的系统工程, 而有效的水质评价可为提标改造方案提供科学依据, 避免工程中的不合理环节与冗余措施以进一步减少成本.因此, 系统全面性的水质评价也是污水处理厂提标改造、降低其出水对水环境影响的重要基础.
我国目前采用的水质营养评价一般分为两类, 一是以总氮、总磷等理化监测指标为基础的数值统计评价法, 如单因子污染指数法、有机污染指数法和综合营养状态指数法等(陈玉辉, 2013);二是以细胞密度、Shannon-Wiener多样性指数与Pielou均匀度指数等指标为参考标准的多样性指数法.理化监测具有简单、快捷灵敏性高等优点, 但同时也存在样品具有瞬时性及分析成本较高等缺点(廖芬等, 2019).而藻类生物学法则可以在一定程度上弥补理化监测的缺陷, 其具有长期性, 可以连续反映水质营养状况, 另外还具有综合性, 水环境中的污染物较为复杂且不稳定, 监测浮游植物能较好地反映出污染物对于水体中生物的综合效应, 更客观、全面地反映水质(王宝玲等, 2016).浮游植物群落对环境变化敏感, 通过分析浮游植物群落结构的变化可以在一定程度上反映其生长的环境状况(谢斌等, 2017).因此, 作为水域生态系统的初级生产者, 浮游植物的多样性与群落结构的变化成为衡量水环境现状的一个重要指标(何欣霞等, 2019), 基于浮游植物对水体营养状态变化产生响应的多样性指数法评价水质也逐渐在国内外得到了广泛应用(Sidiki et al., 2008).例如, 吉正元等(2019)研究了抚仙湖浮游植物群落结构特征, 运用藻类生物学法与综合营养状态指数法对水质进行评价并分析得出抚仙湖水质处于贫中营养状态;武丹等(2013)为了解于桥水库富营养化状况对水库浮游生物进行了调查, 依据多样性指数、均匀度指数和丰富度指数对水质进行评价, 结果表明, 于桥水库处于中-重污染水平.
基于此, 本文通过调查成都市3个污水处理厂出水受纳水体浮游植物的群落结构, 探讨水体中浮游植物的群落结构特征, 并通过相关性分析研究影响浮游植物细胞密度的重要环境影响因子, 最后运用多样性指数法与综合营养状态指数法同时对污水处理厂出水营养状态进行评价并探讨方法的适用性.旨在为污水处理厂出水受纳水体中浮游植物群落演替规律研究提供基础数据, 并为污水处理厂出水的生态效应评估及排放与控制提供科学基础, 同时也为污水处理厂提标改造提供科学依据, 这对降低污水处理厂出水对水环境的影响具有重要的现实意义.
2 材料与方法(Materials and methods)2.1 样点布设与采样时间本研究在成都市区内选取了3个污水处理厂, 分别在其出水口受纳水体设置采样点S1、S2和S3.采样时间为2018年10月—2019年9月, 采样频率为每月1次, 并根据采样点所属污水处理厂不同排水规律进行采样以保证所采水样为污水处理厂瞬时出水, 且出水与受纳水体中天然水体比例在60%以上.
S1所属污水处理厂生产工艺为水解酸化+CASS(循环活性污泥法)+转盘过滤, 处理污水类型为城镇生活污水, 日平均污水处理量为3.96万t, 每日上午11:00定时规律式间断排水, 污水排放标准为《城镇污水处理厂污染物排放标准》(GB18918—2002)一级A排放标准.S1采样点所在受纳水体属成都市府河锦江段, 采样断面较窄、流速较慢, 平均流量为12.27 m3·s-1.S2所属污水处理厂生产工艺为A2O(厌氧-缺氧-好氧法)+MP(混合益生菌法)+MBR(膜生物反应器), 处理污水类型为城镇生活污水, 日平均污水处理量为15.00万t, 为稳定连续式排水, 污水排放标准为《城镇污水处理厂污染物排放标准》(GB18918—2002)一级A排放标准.S2采样点所在受纳水体属成都市沙河, 采样断面较宽, 约为20 m, 平均流量为36.50 m3·s-1.S3所属污水处理厂生产工艺为MP+MBR, 处理污水类型为城镇生活污水, 日平均污水处理量为20.00万t, 为稳定连续式排水, 污水排放标准为《城镇污水处理厂污染物排放标准》(GB18918—2002)一级A排放标准.S3采样点所在受纳水体属成都市江安河, 采样断面较窄、流速较慢, 平均流量为13.40 m3·s-1.
2.2 样品采集与处理用1 L有机玻璃采水器采集0.5 m处水样1.5 L作为浮游植物定性定量样品, 加入15 mL鲁哥试剂固定, 在实验室中静置24 ~48 h后浓缩至50 mL, 然后在10×40倍光学显微镜(上海测维, LWD300-38HMC)下使用0.1 mL计数框对浮游植物进行定性定量鉴定, 具体鉴定方法参照《中国淡水藻类—系统、分类和生态》(胡鸿钧, 2006).为避免定性至种层面上分析的复杂性及更好地明晰研究区域群落结构的特征, 本研究中藻类定量数据统计至属.
利用便携式pH计(上海三信, SX620)、便携式溶解氧仪(上海雷磁, JPB-607A)及水下光量子仪(美国APOGEE, MG-210)进行水温(WT)、酸碱度(pH)、溶解氧值(DO)和水下光照(PAR)等现场指标的测定, 实验室水质指标化学需氧量(COD)、总氮(TN)、氨氮(NH3-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、总磷(TP)、溶解性磷酸盐(SRP)均参照《水和废水监测分析方法》(第四版)(国家环保总局, 2002)进行.
2.3 分析评价方法浮游植物优势种采用Mcnaughton优势度指数Y进行表征, 其计算方法见式(1).
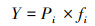 | (1) |
采用细胞密度、Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)和Berger-Parker优势度指数(D)对浮游植物群落结构特征进行分析, 计算公式分别见式(2)~(4)(吉正元等, 2019;汪晨琛等, 2019).
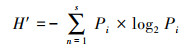 | (2) |
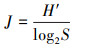 | (3) |
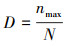 | (4) |
采用细胞密度、H′和J对污水处理厂出水受纳水体营养状态进行多样性指数评价, 评级标准见表 1(王朝辉等, 2005;况其军等, 2005;宋勇军等, 2019).
表 1(Table 1)
| 表 1 水体营养状态评价的多样性指数及标准 Table 1 Diversity indices and standards for evaluation of water trophic state | ||||||||||||||||||||||||||||||||
表 1 水体营养状态评价的多样性指数及标准 Table 1 Diversity indices and standards for evaluation of water trophic state
| ||||||||||||||||||||||||||||||||
以Chla(叶绿素a)为基准参数, TN与TP为其他参数, 采用综合营养状态指数TLI(∑)对污水处理厂出水受纳水体进行评价, 计算方法见式(5).
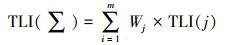 | (5) |
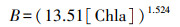 | (6) |
2.4 数据处理采用Excel2010进行浮游植物细胞密度和生物量的计算及表格的绘制, 采用Origin2018进行图形绘制, 采用SPSS19.0分析浮游植物细胞密度与环境因子的相关关系.
3 结果与分析(Results and analysis)3.1 浮游植物群落结构特征3.1.1 浮游植物种群组成调查期间, 全年12个月3个采样点共记录到藻类7门49属(图 1a).其中, 硅藻门属数最多, 为16属, 占总属数的32.65%;其次为绿藻门14属和蓝藻门12属, 分别占总属数的28.57%和24.49%;裸藻门3属, 占总属数的6.12%, 金藻门2属, 占总属数的4.08%;隐藻门和甲藻门均只检测出1属, 占总属数的2.04%.2019年6月属数最多为25种, 2019年9月属数最少为11种.全年时间范围内, 硅藻与蓝藻占据主要优势, 而部分藻种仅在特定时间检测出, 如金藻仅在1月与6月被检测出, 甲藻仅在7月检测出.
图 1(Fig. 1)
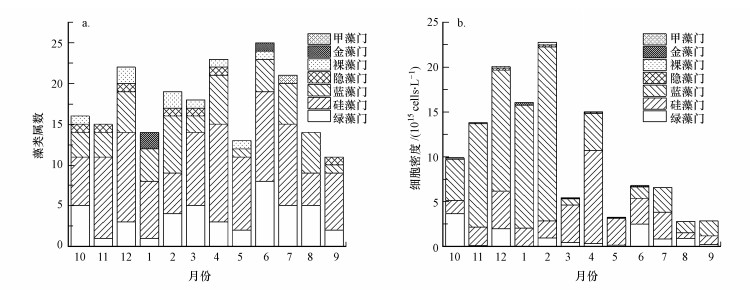 |
| 图 1 浮游植物群落结构组成(a)及细胞密度分布(b) Fig. 1The community structure composition(a) and the cell density distribution(b) of phytoplankton |
3.1.2 浮游植物细胞密度调查期间, 全年藻类细胞密度差异较大, 为2.78×105~2.28×106 cells·L-1(图 1b).其中, 2月藻类细胞密度达到全年最大为2.28×106 cells·L-1, 蓝藻占据主要优势, 其细胞密度为1.94×106 cells·L-1, 其次为硅藻, 细胞密度为1.90×105 cells·L-1;8月藻类细胞密度全年最低为2.78×105 cells·L-1, 且该月藻类种群组成较为单一, 仅有绿藻、硅藻和蓝藻, 其细胞密度分别为8.88×104、6.50×104和1.24×105 cells·L-1.
3.1.3 浮游植物优势属Mcnaughton优势度指数结果见表 2.由表可知, 3个采样点全年12个月共有24种优势属.全年12个月中, 3月和4月优势属最多, 高达8种, 主要为硅藻与蓝藻, 9、10和11月优势属最少, 仅为4种.小环藻Cyclotella与假鱼腥藻Pseudanabaena在全年占据主要优势, 优势度分别在8月与11月达到全年最高(Y值分别为0.15与0.60).另外, 不同月份优势属存在较大区别, 3、4及5月硅藻占主要优势, 舟形藻Navicula与小环藻Cyclotella为绝对优势属, 其中, 小环藻Cyclotella在3月优势度高达0.14, 而舟形藻Navicula在4月优势度高达0.19.蓝藻则在12月与2月占主要优势, 其中, 假鱼腥藻Pseudanabaena在12月优势度为0.22, 螺旋藻Spirulina在2月优势度也高达0.11.绿藻仅在10、12、6、7与8月形成优势, 其中优势属为栅藻Scendesmus, 在12月优势度达到0.06.
表 2(Table 2)
| 表 2 不同月份浮游植物优势属及其优势度 Table 2 Dominant genera and dominance of phytoplankton in different months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 不同月份浮游植物优势属及其优势度 Table 2 Dominant genera and dominance of phytoplankton in different months
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.1.4 浮游植物多样性污水处理厂出水受纳水体浮游植物多样性变化情况见表 3.全年12个月中, 采样点S1的H′值与J值变化趋势基本一致.H′值为0~3.61, 最高值出现在7月(3.61), 而9月仅检测出一种藻属, H′值达到最低(0);J值为0~1.07, 分别出现在9月与11月;D值全年分布较为平均, 变化范围在0.51~1.00之间, 11月、5月与9月所监测出的藻属优势度均≥0.2, 因此也出现了D值最大值(1.00), 而7月总细胞密度较大, 因此D值较低(0.51).
表 3(Table 3)
| 表 3 不同月份浮游植物多样性分布 Table 3 Distribution of phytoplankton diversity in different months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 不同月份浮游植物多样性分布 Table 3 Distribution of phytoplankton diversity in different months
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
采样点S2的H′值为1.00~3.76, 最高值出现在6月(3.76), 由于8月仅检测出两种藻且其细胞密度相同, 因此8月出现最低值(1.00);J值为0.53~1.00, 秋、冬季节J值较低并在11月出现全年最低值(0.53), 最高值则出现在8月(1.00), 全年范围内H′值与J值变化趋势基本一致;D值在时间上分布较为均匀, 变化范围在0.78~1.00之间, 2月、5月与8月出现全年最高值(1.00), 11月出现全年最低值(0.78).
采样点S3的H′值全年较低, 仅在3月达到全年最高值(3.66), 其余月份H′值均在1~2之间浮动, 其中, 最低值出现在10月与8月(1.00), 推测是由于在10月与8月均只检测出两种藻且其细胞密度一致, 所以H′值为1.00;J值为0.56~1.00, 在10月、1月、5月与8月出现最高值(1.00), 7月出现最低值(0.56);D值全年均在1.00左右浮动, 分布较为平均, 最高值(1.00)出现在10月、1月、5月、6月与8月, 在12月达到全年最低值(0.70).
3.1.5 浮游植物与环境因子的相关性对全年浮游植物细胞密度与环境因子进行Pearson相关性分析, 结果见表 4.结果表明, 采样点S1的浮游植物细胞密度与环境因子无任何显著性关系;采样点S2的浮游植物细胞密度与水温(WT)呈显著负相(p<0.05), 即随着WT升高水体中浮游植物细胞密度下降;采样点S3的浮游植物细胞密度与溶解性磷酸盐(SRP)呈显著正相关(p<0.05), 表明随着水体中SRP的上升, 浮游植物细胞密度变大.
表 4(Table 4)
| 表 4 浮游植物细胞密度与环境因子的相关性分析 Table 4 Preason correlation among abundance of phytoplankton and physicochemical parameters | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 浮游植物细胞密度与环境因子的相关性分析 Table 4 Preason correlation among abundance of phytoplankton and physicochemical parameters
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 水质评价3.2.1 水质理化指标评价各采样点全年不同时间的环境理化参数见表 5、表 6与表 7.由表 5可知, 采样点S1在全年范围内, COD在少部分月份能达到国家《地表水环境质量标准》(GB 3838—2002)Ⅰ类水质标准;NH3-N全年大部分时间均能达到Ⅲ类水质标准;TP在少部分月份能达到Ⅱ类或Ⅲ类水质标准;DO全年浮动较大, 大部分时间能达到Ⅲ类或Ⅲ类以上水质标准;pH全年稳定在7.0左右;水温全年差异较大, 范围为15.3~29.1 ℃, 2019年1月监测到全年最低温, 2019年7月达到全年最高温.
表 5(Table 5)
| 表 5 采样点S1不同月份理化参数(平均值) Table 5 The variation of physical-chemical parameters in different months in the sample 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 5 采样点S1不同月份理化参数(平均值) Table 5 The variation of physical-chemical parameters in different months in the sample 1
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 6(Table 6)
| 表 6 采样点S2不同月份理化参数(平均值) Table 6 The variation of physical-chemical parameters in different months in the sample 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 6 采样点S2不同月份理化参数(平均值) Table 6 The variation of physical-chemical parameters in different months in the sample 2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 7(Table 7)
| 表 7 采样点S3不同月份理化参数(平均值) Table 7 The variation of physical-chemical parameters in different months in the sample 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 7 采样点S3不同月份理化参数(平均值) Table 7 The variation of physical-chemical parameters in different months in the sample 3
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由表 6可知, 采样点S2在全年范围内, COD有1/2的时间能达到国家《地表水环境质量标准》(GB 3838—2002)Ⅰ类水质标准;TN全年有1/2的时间内能满足Ⅴ类水质标准;NH3-N全年均能达到Ⅲ类水质标准;TP全年在Ⅱ~Ⅲ类水质标准值之间浮动;DO全年均能满足Ⅲ类水质标准;pH全年稳定在7.0左右;水温全年差异较大, 范围为10.5~29.2 ℃, 2019年1月监测到全年最低温, 2019年8月达到全年最高温.
由表 7可知, 采样点S3在全年范围内, COD在少部分月份能达到国家《地表水环境质量标准》(GB 3838—2002)Ⅰ类水质标准;NH3-N基本全年能达到Ⅲ类及Ⅲ类以上水质标准;TP全年大部分时间在Ⅰ~Ⅲ类水质标准值之间浮动;DO全年均能满足Ⅲ类水质标准;pH全年稳定在7.0左右;水温全年差异较大, 范围为14.7~27.8 ℃, 2018年12月监测到全年最低温, 2019年7月达到全年最高温.
3.2.2 生物多样性指数法水质评价以藻类生物学指标评价污水处理厂出水受纳水体的营养状况, 结果见表 8.由表可知, 采样点S1全年细胞密度偏低, 除10月水体状况为贫营养外, 其余时间水体营养状态均为极贫营养状态.9月仅监测到一种藻属, H′值为1.00, 因此, 对9月的水质状况不予评价, 其余大部分时间为中营养或贫营养;除9月外, J值评价显示全年水体处于贫营养状态.
表 8(Table 8)
| 表 8 生物多样性法水质营养状态评价 Table 8 Water quality evaluation by diversity indices | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 8 生物多样性法水质营养状态评价 Table 8 Water quality evaluation by diversity indices
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
采样点S2冬季细胞密度偏高, 水体呈贫中营养状态, 其余时间均为极贫营养状态.采样点2在8月仅监测到两种藻属且其细胞密度相等, H′值为1.00, 因此, 不以该指标对8月水体进行评价, 全年有1/2的时间水质评价为中营养, 其中, 11月出现中富营养状况.除9月外, J值评价显示全年水体处于贫营养状态.
采样点S3全年细胞密度偏低, 除12月与2月外全年水体呈极贫营养状态.10月与8月均只调查到两种细胞密度相同的藻属, H′值计算结果为1.00, 全年其余时间水体呈中富营养或中营养状态.除10月与8月外, J值评价显示全年水体处于贫营养状态.
3.2.3 综合营养状态指数法水质评价以Chla为基准参数, TN与TP为其他参数, 采用综合营养状态指数法对污水处理厂出水受纳水体营养状态进行评价, 结果见表 9.由表可知, 采样点S1除10月、12月、1月和4月外, 其余月份TLI(∑)均小于30, 水体为贫营养状态, 在12月出现最大值34.61, 最小值则出现在9月为20.40.采样点S2全年TLI(∑)均小于30, 范围为14.89~26.52, 最高值与最低值分别出现在1月与3月, 全年水体为贫营养状态.采样点S3除2月外, 其余月份TLI(∑)均小于30, 水体呈贫营养状态, 2月出现全年最高值33.61, 水体为中营养状态, 9月初现全年最低值1.27.
表 9(Table 9)
| 表 9 综合营养状态指数法水质状态评价 Table 9 Water quality evaluation by trophic state index | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 9 综合营养状态指数法水质状态评价 Table 9 Water quality evaluation by trophic state index
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 讨论(Discussion)4.1 浮游植物群落结构特征污水处理厂出水受纳水体浮游植物种群组成以硅藻门占绝对优势, 检出藻类占总属数的32.65%, 其次为绿藻门, 这一结果与陈立靖等(2014)在小洋山近岸水域调查到的情况类似.全年共检出7门49属, 其中, 6月调查到的浮游植物种类最多为25属, 9月调查到的种类最少为11种, 对比种群发现主要是由于绿藻在9月仅检测到2种藻类, 这与侯秀丽等(2018)在滇池调查到的绿藻在9—11月占优这一现象相反, 推断是因为2月氮磷比偏低不利于绿藻生长.数量组成方面, 全年浮游植物细胞密度差距较大, 其中, 2月细胞密度全年最高为2.28×106 cells·L-1, 蓝藻占据主要优势, 8月浮游植物细胞密度全年最低为2.78×105 cells·L-1, 观察数据得知主要是由于2月监测出了蓝藻门细鞘丝藻Leptolyngbya且其细胞密度高达6.03×105 cells·L-1, 占据绝对优势, 使得2月总细胞密度成为全年最高, 这一调查结果与赵辰红等(2008)在实验室条件下研究得出坑形细鞘丝藻最适宜生长温度为30 ℃的结论完全不符.另外, 也与何冬琼(2013)对三岔湖浮游植物群落结构调查得出的浮游植物细胞密度在春夏季最高、冬季最低的结论大不相同.然而, 吉正元等(2019)在对抚仙湖的研究中发现, 伪鱼腥藻属在水温较低的冬春季占据较大优势, 因此认为某些蓝藻种类在水温相对较低的情况下形成优势是有可能的.分析认为, 污水处理厂出水受纳水体蓝藻门细鞘丝藻在冬季2月细胞密度较高的原因还有待进一步研究解释.另外, 小环藻属与假鱼腥藻属全年占据绝对优势, 其中, 小环藻主要在冬季与春季占优, 符合小环藻更能适宜低温环境的生长特性, 作为微污水生物带的指示物, 小环藻的占优或许也能反映水体总体处于较清洁的状态(潘晓洁等, 2014).除春末夏初外, 假鱼腥藻在全年均拥有较高的优势度, 根据其生长特性, 假鱼腥藻易在透明度较低的富营养化水体中形成优势(Rojo et al., 1994;Mischke et al., 2003), 这点与小环藻的占优有一定矛盾, 推测是由于不同采样点水质指标差异过大导致浮游植物群落结构较为复杂.
物种多样性即生物资源的丰富性, 多样性指数越高表明浮游植物种类数越多或各种类的个体数量分布越均匀.在对污水处理厂出水受纳水体浮游植物的调查研究中, 采样点S1与采样点S2全年H′值与J值变化趋势基本一致, 而采样点S3的H′值与J值变化趋势基本相反, 这与大多数研究结果相反(汪晨琛等, 2019).
4.2 环境因子对浮游植物群落结构的影响浮游植物群落结构与环境因子有着密切的关系(闵文武等, 2015), 不同水体中的浮游植物群落细胞密度对于环境因子的响应是不同的.本研究通过Perason相关性分析表明, 采样点S1浮游植物细胞密度与环境因子无任何显著性关系, 采样点S2浮游植物细胞密度与水温(WT)呈显著负相关;采样点S3浮游植物细胞密度与溶解性磷酸盐(SRP)呈显著正相关.
多个环境因子在时间和空间上共同作用影响浮游植物群落结构, 不同水体具有不同的主要环境影响因子, 一般而言, 水温和营养盐是影响浮游植物生长演替的关键环境因子(石晓丹等, 2008).水温可影响浮游植物细胞内的酶活性、呼吸及代谢等生理过程(吉正元等, 2019), 进而影响浮游植物的光合作用.严广寒等(2019)通过对浮游植物与环境因子数据进行CCA分析得出, 水温是影响长江三口及西洞庭湖浮游植物群落结构的主要环境因子, 原因是水温变化导致浮游植物细胞新陈代谢速率发生改变, 进一步影响了浮游植物细胞分裂周期.水温会对浮游植物的生长产生影响, 而不同的浮游植物适宜的生长温度不同, 硅藻和隐藻适宜在较低的温度下生长, 绿藻适合生长在较高的温度中(田永强等, 2012).推测由于采样点S2的硅藻全年占优, 而硅藻喜好低温, 因此, 该采样点全年浮游植物细胞密度与水温呈显著负相关, 即随着水温的升高浮游植物细胞密度下降, 这一结论也与贾海燕等(2019)对丹江口浮游植物群落与环境因子关系的研究结果一致.不同浮游植物对于氮、磷等营养盐的利用效率不同, 致使不同浮游植物的生长效率也存在差异, 进而引起浮游植物群落中藻种之间的生态关系改变, 产生群落演替(侯秀丽等, 2018).已有研究证明水体中磷的浓度是影响浮游植物生物量的关键控制因素(Bowes et al., 2012), 磷对于藻类生长的影响比氮更大.周然等(2013)对渤海湾的浮游植物和环境因子进行调查, 并通过冗余分析得出溶解性磷酸盐(SRP)是该研究区域春季影响浮游植物的关键环境因子.而本研究中采样点S3浮游植物细胞密度也与SRP呈显著正相关, 推测是因为采样点S3的蓝藻细胞密度较高, 而SRP较高会导致水体中氮磷比较低, 更适宜蓝藻生长, 这一结论与前人研究(Su et al., 2016)相似, 即当水体中磷含量降低后, 浮游植物生物量也逐渐降低, 其中, 蓝藻对于磷含量的变化受到的抑制最大.
4.3 水质营养评价采用国家《地表水环境质量标准》(GB 3838—2002)对污水处理厂受纳水体进行评价, 发现3个采样点水质较好, 除TN外其余监测指标在全年范围大部分时间内均能达到Ⅴ类以上水质标准.采用综合营养状态指数法与多样性指数法对污水处理厂出水受纳水体进行水质评价, 依据多样性指数法评价显示:采样点S1水质总体处于贫营养状态, 采样点S2水质总体处于贫中营养状态, 采样点S3水质总体处于贫营养状态(表 8).分析数据可发现, 当采集浮游植物样品仅为1种或2种时, 细胞密度较低, H′值与J值计算结果为1.00或0, 以多样性指数与均匀度指数为参考标准时水质处于富营养状态, 以细胞密度为参考标准时水质处于极贫营养或贫营养状态, 二者矛盾.推测是因为与湖库水体相比, 污水处理厂出水受纳水体污染物浓度偏高, 水体性质复杂.综合营养状态指数法TLI(∑)结果则显示, 采样点S1除10月、12月、1月和4月外, 全年水体为贫营养状态, 采样点S2全年水体为贫营养状态, 采样点S3除2月外, 全年水体呈贫营养状态, 说明污水处理厂出水水质状态暂为良好, 推测是因为出水口流速较快在一定程度上对污染物进行了稀释.另外, 通过分析水质评价结果可发现, 与其他采样点相比, 采样点S1水体营养状态较差, 原因是部分月份水体中TN含量较高导致水体呈中营养状态.这一结论也与全年理化参数指标的监测结果一致, 采样点S1全年TN平均值较高为13.53 mg·L-1, 比采样点S2与采样点S3全年TN平均值分别高10.78 mg·L-1与7.86 mg·L-1.推测是因为采样点S1所属污水处理厂厂区主体处理工艺为CASS工艺, 在秋、冬季节温度较低的环境下, 微生物活性下降、水体自净能力变差, 从而进一步导致水体污染物浓度升高.采样点S2水体营养状态最佳, 全年水体均为贫营养状态, 推测是因为采样点S2所属受纳水体采样断面相对于其他采样点断面水流速度稍快, 在一定程度上稀释了污水处理厂排水中的污染物浓度.建议污水处理厂增强对于TN污染物的去除, 如投加悬浮填料并增加搅拌以提高脱氮去磷能力, 同时可在不同季节采用不同排放标准以降低污水处理难度与污水处理厂运行成本.
分析得出, 综合营养指数法与多样性指数法评价结果差异不大, 然而当调查到的浮游植物样品较少时, 多样性指数法的评价结果会产生一定的矛盾与偏差.陈家长等(2010)研究也表明, 在进行水质评价时, 应将生物监测与理化监测相结合以提高结果的准确性与可靠性.因此, 建议在对污水处理厂出水进行水质营养评价时应采用综合营养指数评价法, 同时运用多样性指数法进行辅助评价.污水处理厂的提标改造工程是一项专业性极强的系统工程, 需要耗费较高成本.本研究通过对污水处理厂受纳水体进行有效水质营养评价, 可为实际工程中污水厂是否需要提标改造提供指导, 避免工程中的不合理环节以降低经济成本, 同时也是降低污水厂对水环境影响的重要理论基础.
5 结论(Conclusions)1) 全年12月监测期间, 污水处理厂出水受纳水体共鉴定出游植物7门49属, 其中, 硅藻门属数最多, 其次为绿藻门和蓝藻门;3个采样点全年调查到24种优势属, 其中, 小环藻Cyclotella与假鱼腥藻Pseudanabaena在全年占优;在多样性水平上, 采样点S1全年H′值、J值和D值范围分别为为0~3.61、0~1.07和0.51~1.00, 采样点S2全年H′值、J值和D值范围分别为1.00~3.76、0.53~1.00和0.84~1.00, 采样点S3全年H′值、J值和D值范围分别为1.00~3.66、0.56~1.00和0.70~1.00;运用多样性指数法对水体营养状态进行评价得出, 污水处理厂出水受纳水体采样点S1水质处于贫营养状态, 采样点S2水质处于贫中营养状态, 采样点S3水质处于贫营养状态, 运用综合营养状态指数法评价发现全年3个采样点水体总体均处于贫营养状态.尽管目前污水处理厂出水受纳水体处于贫营养状态, 但蓝藻在2月细胞密度较高且占据绝对优势及假鱼腥藻Pseudanabaena在全年占据主要优势这一现象也不容忽视, 建议污水厂适当加强对水体中磷元素的去除效果, 防止受纳水体中蓝藻密度过高而爆发水华.
2) 本研究对污水处理厂出水受纳水体进行营养评价时, 多样性指数法会出现多项指标矛盾进而产生结果偏差, 建议在进行污染物浓度较高、水体扰动性较大及水体性质较为复杂的水体(如污水处理厂出水)的水质营养状态评价时, 应以综合营养状态指数法为主, 多样性指数法为辅, 便于更加准确地评估研究区域水体营养状态.污水处理标准与地表水水质存在较大差异, 建议污水处理厂在进行建设时不仅要考虑建设成本、日处理量与污染负荷等因素, 还应关注其排水对于水环境的影响.本研究为污水处理厂出水的生态评估提供了基础数据, 并对降低污水厂出水对于水环境的危害具有重要的现实意义.
参考文献
| Bowes M J, Gozzard E, Johnson A C, et al. 2012. Spatial and temporal changes in chlorophyll-a concentrations in the River Thames basin, UK:Are phosphorus concentrations beginning to limit phytoplankton biomass?[J]. Science of the Total Environment, 426: 45-55. DOI:10.1016/j.scitotenv.2012.02.056 |
| 陈家长, 孟顺龙, 胡庚东, 等. 2010. 长江下游江段秋季浮游植物生态指标与理化指标评价[J]. 长江流域资源与环境, 19(Z2): 34-39. |
| 陈立婧, 张薇, 边佳胤, 等. 2014. 2012年小洋山近岸水域浮游植物群落结构的特征[J]. 上海海洋大学学报, 23(3): 395-402. |
| 陈玉辉.2013.典型城市黑臭河道治理后的富营养化分析与预测研究[D].上海: 华东师范大学 |
| 国家环保总局. 2002. 水和废水监测分析方法(第4版)[M]. .北京: 中国环境科学出版社. |
| 何冬琼. 2013. 三岔湖浮游植物四季群落结构变化[J]. 中国环境监测, 29(2): 46-50. |
| 何欣霞, 陈诚, 董建伟, 等. 2019. 江苏里下河腹部地区湖泊湖荡春季浮游植物群落结构和营养状态[J]. 环境科学学报, 39(8): 2626-2634. |
| 侯秀丽, 苑春刚, 李学平, 等. 2018. 滇池氮磷浓度变化对蓝、绿、硅藻年际变化的影响[J]. 水生态学杂志, 39(1): 16-22. |
| 胡鸿钧, 魏印心. 2006. 中国淡水藻类-系统、分类及生态[M]. 北京: 科学出版社. |
| 吉正元, 刘绍俊. 2019. 抚仙湖浮游植物群落结构、影响因子及水质评价[J]. 中国环境监测, 35(4): 67-77. |
| 贾海燕, 徐建锋, 雷俊山. 2019. 丹江口库湾浮游植物群落与环境因子关系研究[J]. 人民长江, 50(5): 52-58. |
| 况琪军, 马沛明, 胡征宇, 等. 2005. 湖泊富营养化的藻类生物学评价与治理研究进展[J]. 安全与环境学报, 5(2): 87-91. |
| 雷一帆, 姜彬彬, 陈豪. 2018. 感潮河段污水处理厂尾水对受纳水体的水质影响研究[J]. 环境科学与管理, 43(1): 58-62. |
| 李祚泳, 丁晶, 彭荔红. 2004. 环境质量评价原理与方法[M]. 北京: 化工工业出版社. |
| 廖芬, 李维旭, 王洁, 等. 2019. 浮游藻类在水质监测及评价中的应用[J]. 环境与发展, (6): 150-152. |
| 闵文武, 王培培, 李丽娟, 等. 2015. 渭河流域浮游植物功能群与环境因子的关系[J]. 环境科学研究, 28(9): 1397-1406. |
| Mischke U. 2003. Cyanobacteria associations in shallow polytrophic lakes:influence of environmental factors[J]. Acta Oecologica, 24(3): 11-23. |
| 潘晓洁, 朱爱民, 郑志伟, 等. 2014. 汉江中下游春季浮游植物群落结构特征及其影响因素[J]. 生态学杂志, 33(1): 33-40. |
| Rojo C, Cobelas M A. 1994. Population dynamics of Limnothrix redekei, Oscillatoria lanceaeformis, Planktothrix agardhii and Pseudanabaena limnetica(Cyanobacteria) in a shallow hypertrophic lake (Spain)[J]. Hydrobiologia, 275-176(1): 165-171. |
| 石晓丹, 阮晓红, 邢雅囡, 等. 2008. 苏州平原河网区浅水湖泊冬夏季浮游植物群落与环境因子的典范对应分析[J]. 环境科学, 29(11): 2999-3008. |
| Sidiki M J, Rashed-Un-Nabi M, Hoque M A. 2008. Distribution of phytoplankton community in relation to environmental parameters in cage culture area of Sepanggar Bay, Sabah, Malaysia[J]. Estuarine Coastal and Shelf Science, 80(2): 251-260. DOI:10.1016/j.ecss.2008.08.004 |
| 宋勇军, 戚菁, 刘立恒, 等. 2019. 程海湖夏冬季浮游植物群落结构与富营养化状况研究[J]. 环境科学学报, 39(12): 4106-4113. |
| Su Y P, Zhang C W, Liu J X, et al. 2016. Assessing the impacts of phosphorus inactive clay on phosphorus release control and phytoplankton community structure in eutrophic lakes[J]. Environmental Pollution, 219: 620-630. DOI:10.1016/j.envpol.2016.06.029 |
| 田永强, 俞超超, 王磊, 等. 2012. 福建九龙江北溪浮游植物群落分布特征及其影响因子[J]. 应用生态学报, 9(23): 2559-2565. |
| 汪晨琛, 吴奇丽, 万阳, 等. 2019. 淮北临涣采煤沉陷水域浮游植物群落结构特征及其影响因子[J]. 生物学杂志, 36(3): 37-41. |
| 王宝玲, 王丽卿, 张玮. 2016. 构筑根孔湿地夏季浮游植物群落结构特征[J]. 环境工程学报, 10(4): 2109-2121. |
| 王朝晖, 韩博平, 胡韧, 等. 2005. 广东省典型水库浮游植物群落特征与富营养化研究[J]. 生态学杂志, 24(4): 48-51. |
| 王骥, 王建. 1984. 浮游植物的叶绿素含量、生物量、生产量相互换算中的若干问题[J]. 武汉植物学研究, 2(2): 249-258. |
| 魏亮, 陈滢, 刘敏, 等. 2016. 城镇污水处理厂的综合绩效评价[J]. 环境工程学报, 10(1): 490-494. |
| 吴钦. 2019. 城镇污水处理厂尾水排放对水环境影响及对策[J]. 环境与发展, (6): 29-31. |
| 武丹, 王海英, 张震. 2013. 天津于桥水库夏季浮游生物调查及群落结构变化[J]. 湖泊科学, 25(5): 735-742. |
| 谢斌, 张硕, 李莉, 等. 2017. 海州湾海洋牧场浮游植物群落结构特征及其与水质参数的关系[J]. 环境科学学报, 37(1): 121-129. |
| 严广寒, 殷雪妍, 汪星, 等. 2019. 苏长江三口-西洞庭湖环境因子对浮游植物群落组成的影响[J]. 中国环境科学, 39(6): 2532-2540. |
| 赵琛.2019.污水处理厂排水对受纳水体微生物群落的影响[D].保定: 河北大学 |
| 赵辰红, 王文杰, 姚旦, 等. 2008. 温度对四种淡水颤藻目丝状藻体生长的影响[J]. 水产养殖, 29(3): 5-8. |
| 周然, 彭士涛, 覃雪波, 等. 2013. 渤海湾浮游植物与环境因子关系的多元分析[J]. 环境科学, 34(3): 864-873. |
