
 , 刘珂轶, 张安龙, 陈佳琛, 高俊玲, Atif Sial
, 刘珂轶, 张安龙, 陈佳琛, 高俊玲, Atif Sial陕西科技大学环境科学与工程学院, 西安 710021
收稿日期: 2020-02-08; 修回日期: 2020-05-06; 录用日期: 2020-05-06
基金项目: 陕西省自然科学基金(No.2020JQ14);陕西科技大学自然科学预研基金项目(No.2016BJ44)
作者简介: 张波(1986-), 男, E-mail:zb546170683@163.com
通讯作者(责任作者): 张波(1986—), 男, 副教授, 博士, 长期从事微藻生物技术研究
摘要:微藻富含油脂,可以用作合成生物柴油的原料,被认为是最具发展前景的生物质能源.微藻的光合培养体系往往是非纯培养体系,现有研究更多地关注微藻生物量的积累及其对废水环境的净化效果,而对体系中广泛存在的共栖细菌缺乏全面深入的认知.本文通过对棕鞭藻共栖细菌的16S rDNA基因进行高通量测序分析,研究棕鞭藻(Ochromonas)在生活废水、BG11及Glu+BG11(BG11中添加10 g·L-1葡萄糖)3种不同营养环境中共栖细菌的群落结构差异,进而阐明有机物及复杂废水环境对微藻共栖细菌群落结构的影响效果.结果表明,生活废水、BG11及Glu+BG11 3种营养环境中共栖细菌群落结构存在显著差异,生活废水体系中生物多样性显著高于BG11及Glu+BG11体系,生活废水中共栖细菌香浓(Shannon)多样性指数高达4.32,其次是BG11及Glu+BG11,Shannon指数分别为2.13、1.54.从共栖细菌群落的组成上看,3种营养环境中优势菌属差异显著,生活废水中优势菌属有芽殖杆菌属(Gemmobacter)、鞘脂单胞菌属(Sphingomonas)及玫瑰球菌属(Roseococcus),相对丰度分别为14.46%、14.9%、14.54%,其中,芽殖杆菌属只在生活废水中有较高丰度.BG11中寡养单胞菌属(Stenotrophomonas)与玫瑰球菌属的丰度分别高达26.86%、51.03%.Glu+BG11中寡养单胞菌属较BG11中显著增加,达到82.41%,而玫瑰球菌属较生活废水及BG11中则明显降低,菌群丰度仅为6.2%.对比3种营养环境,玫瑰球菌属均具有较高丰度,是棕鞭藻良好的共生菌.
关键词:棕鞭藻共栖细菌高通量测序群落结构
Comparison of community structure of symbiotic bacteria of Ochromonas in different nutritional environments
ZHANG Bo

 , LIU Keyi, ZHANG Anlong, CHEN Jiachen, GAO Junling, Atif Sial
, LIU Keyi, ZHANG Anlong, CHEN Jiachen, GAO Junling, Atif SialSchool of Environmental Science and Engineering, Shaanxi University of Science & Technology, Xi'an 710021
Received 8 February 2020; received in revised from 6 May 2020; accepted 6 May 2020
Abstract: Microalgae is usually considered to be the most promising biomass energy due to high oil content, which can be used as feedstock for the production of biodiesel. Lots of attention has been paid to the accumulation of microalgae biomass and its purification performance for wastewater. However, for such non-axenic cultivation system of microalgae, limited studies have been conducted on the effect of indigenous bacteria. In this study, the community structure of symbiotic bacteria in domestic wastewater, BG11 and Glu+BG11 (10 g·L-1 glucose added to BG11) were analyzed with high throughput sequencing, and the effect of organic matter and complex wastewater environment on the community structure of microalgae symbiotic bacteria was clarified. The results showed that there were significant differences in the community structure of symbiotic bacteria in the three systems. The biodiversity of domestic wastewater system was significantly higher than that of BG11 and Glu+BG11. In terms of the composition of symbiotic bacterial community, the dominant bacteria were significantly different. The dominant bacteria in domestic wastewater were Gemmobacter, Sphingomonas and Roseococcus, accounting for 14.46%, 14.9% and 14.54% of the total bacterial community respectively, and only in domestic wastewater Gemmobacter occupied high abundance. In the BG11 culture system, the dominant symbiotic bacteria of Ochromonas mainly included Stenotrophomonas and Roseococcus, and the population abundance accounted for 26.86% and 51.03%, respectively. Compared with BG11, the abundance of Stenotrophomonas in Glu+BG11 increased significantly, reaching 82.41%, while Roseococcus was dramatically lower than domestic wastewater and BG11, accounting for 6.2% of the total bacterial community. It is worth noting that Roseococcus has a high abundance in the three different nutrient environments, which is generally considered to be a favorable symbiotic bacteria of Ochromonas.
Keywords: Ochromonassymbiotic bacteriahigh-throughput sequencingcommunity structure
1 引言(Introduction)能源危机和环境污染问题已经成为遏制世界经济发展的瓶颈, 因此, 对可再生、清洁能源的开发迫在眉睫.微藻富含油脂, 可以用作合成生物柴油的原料, 被认为是最具有发展前景的生物质能源之一(Liu et al., 2017).微藻光合培养过程一般不是纯培养体系, 往往伴生着丰富的细菌.在自然生态系统中, 细菌是有机物的主要分解者, 微藻是无机盐的主要吸收者, 探讨细菌与微藻的关系是研究微藻培养系统生态环境与自然生态环境的关键.越来越多的研究发现在自然生态系统中微藻与细菌之间存在复杂的相互作用关系, 主要包括共生、竞争、寄生、敌对等, 且这种相互作用关系具有明显的种间特异性(Kouzuma et al., 2015; Al-Awadhi et al., 2017).现有研究表明, 藻菌间复杂的作用机制主要通过营养互作和信号转导两种方式来实现(Croft et al., 2005; Ramanan et al., 2016), 其中, 营养互作方式占据主导地位.
营养互作是微藻和细菌关系的基础.微藻在生长过程中产生并分泌的大量胞外代谢产物如溶解性有机碳(DOC), 可以被周围细菌有效摄取利用, 为细菌的生长繁殖提供所需营养, 同时细菌在新陈代谢过程中也可以产生微藻生长所必需的营养盐及生长因子(Cooper et al., 2015), 并可通过直接或间接作用调节微藻的生长环境, 形成一种互利共生关系.有研究证实部分藻类可以产生颗粒有机物, 如TEP(Transparent Exopolymer Particles), 这类物质决定了藻类共栖菌的种群类型和细菌活性(张增虎等, 2010).细菌可将水体中的含碳有机物降解为水和CO2, CO2则作为微藻的主要碳源被利用;或将含氮有机物通过氨化和硝化作用转变为氨氮、亚硝酸盐和硝酸盐, 为微藻生长提供氮源(Kim et al., 2014).一项最新的研究指出了根瘤菌属与小球藻共生的重要性, 前者为后者提供氮源, 后者为前者提供碳源.其次, 部分细菌可将含磷有机物分解为正磷酸盐, 如水解ATP类的5′-核苷酸并再将其还原为无机磷, 为微藻生长繁殖提供磷源(Tadashi et al., 2018).此外, 还有很多微藻依赖异养细菌提供的维生素B12, 同时为菌提供有机碳, 这种互利共生的关系可能影响微藻群落的组成和生产力.因此, 营养互作是微藻与细菌间最基础的相互作用方式.
近年来, 利用微藻和细菌共生培养在污染水体修复与治理的同时获得微藻生物质, 从而降低微藻生物质生产成本的研究受到大量关注(Kim et al., 2014; Juan et al., 2016; Liu et al., 2017), 但对这样一个藻菌共生的复杂体系, 不同营养环境下微藻共栖细菌群落多样性的差异迄今还缺乏完整清晰的认识.棕鞭藻属于金藻门、金胞藻目(Chrysomonadales)、棕鞭金藻科(Ochromonadaceae)、棕鞭藻属(Ochromonas), 无细胞壁, 个体微小, 在废水环境中具有较高的生长效率.研究表明, 棕鞭藻向藻际环境(微藻在生长繁殖过程中不断向其周围环境分泌多种代谢产物, 使藻细胞周围形成具有独特结构与功能的微环境)中分泌游离脂肪酸, 具有很好的应用前景(Abomohra et al., 2014), 然而棕鞭藻共栖细菌群落结构的差异尚未可知.因此, 本文拟对棕鞭藻共栖细菌的16S rDNA基因进行高通量测序分析, 研究棕鞭藻在生活废水、BG11及Glu+BG11(BG11中添加10 g·L-1葡萄糖) 3种不同营养环境中共栖细菌的群落结构差异, 从而阐明有机物及复杂生活废水环境对微藻共栖细菌菌群结构的影响效果.以期为进一步揭示藻菌互作关系及高效藻菌共生体系的建立提供理论指导.
2 材料与方法(Materials and methods)2.1 藻种来源及培养条件棕鞭藻(Ochromonas sp. MN028526)分离自陕西科技大学人工湖.利用3种不同培养基(BG11、Glu+BG11、生活废水)培养棕鞭藻, 其中, Glu+BG11培养基为BG11中添加10 g·L-1葡萄糖, 生活废水培养基为利用3层纱布过滤后再稀释2倍的陕西科技大学污水处理厂进水口污水.取3种培养基各100 mL并置于250 mL三角瓶中, 接种藻株至棕鞭藻培养液OD540为0.2.将棕鞭藻培养液于光强3000 lx、温度28 ℃、光周期L:D=14 h:10 h、摇床转速150 r·min-1的条件下培养至稳定期.
2.2 生活废水水质将生活废水在3000 r·min-1下离心10 min后收集上清液, 并适当稀释后测定废水主要水质指标.总氮和总磷浓度分别采用碱性过硫酸钾消解紫外分光光度法(彭鹏等, 2008)和钼酸铵分光光度法(朱素华等, 2013)测定.COD采用连华科技多参数水质测定仪5B-6C测定, pH采用雷磁PHSJ-4A酸度计测定.水质分析结果如表 1所示.
表 1(Table 1)
| 表 1 生活废水主要水质指标 Table 1 Main quality indexes of domestic domestic wastewater | ||||||||
表 1 生活废水主要水质指标 Table 1 Main quality indexes of domestic domestic wastewater
| ||||||||
2.3 棕鞭藻共栖细菌总DNA提取及PCR扩增使用基因组DNA提取试剂盒(Ezup柱式细菌基因组DNA抽提试剂盒)对3种营养环境(生活废水、BG11及Glu+BG11)中棕鞭藻共栖细菌基因组DNA进行提取.以已提取的基因组DNA为模板, 采用细菌通用引物338F(5′-ACTCCTACGGGAG GCAGCAG-3′)与806R(5′-GGACTACHVGGGTW TCT-AAT-3′)进行PCR扩增(鞠峰等, 2019).PCR反应体系(25 μL)为:Taq PCR Master Mix 12.5 μL, 10 μmol·L-1的正反向引物各1 μL, DNA模板1 μL, 加纯水补充至25 μL.PCR反应条件:94 ℃预变性3 min;94 ℃变性3 min, 61 ℃退火1 min, 72 ℃延伸1 min, 29个循环;循环结束后72 ℃延伸5 min, 最后12 ℃保存.PCR扩增产物经1.5%琼脂糖凝胶电泳后, 经核酸染料染色后用凝胶成像系统进行验证, 使用胶回收试剂盒对混合后的PCR产物进行切胶纯化, 将纯化产物进行细菌宏基因组16S rDNA测序, 测序区间为V3~V4可变区, 测序平台为Illumina MiseqTM, 委托生工生物工程有限公司完成.
2.4 高通量测序数据分析使用QIIME(version1.8.0)软件中的UCLUST对Tags在97%的相似度水平下进行聚类, 获得分类操作单元(Operational Taxonomic Units, OTU)细菌分别基于Silva和UNITE参考数据库进行比对, 得到每个OTU对应的物种分类信息.使用Mothur(versionv.1.30)软件对样品Alpha多样性指数进行评估.利用QIIME软件生成不同分类水平上的物种丰度表, 再利用R语言工具绘制成样品各分类学水平下的群落结构图.
3 结果与讨论(Results and discussion)3.1 棕鞭藻共栖细菌群落丰度和多样性差异生活废水、BG11、Glu+BG11 3个样本高通量测序分别得到93510、108093、68390条有效序列, 以97%相似度划分, 生活废水、BG11、Glu+BG11的OTUs分别为5536、5123、3548.各样品文库的覆盖率(Coverage)为95%~96%, 说明样品中16S rDNA基因序列被检出的概率很高, 本次测序结果能够代表棕鞭藻共栖细菌群落结构的真实情况.结合稀释曲线(图 1)可以看出, 起初随着序列数的增加, 样品中OTU数迅速增加, 之后随着序列数的进一步增加, OTU数量增加的趋势逐渐变缓, 稀释曲线趋于饱和, 说明所用样品的序列数能够充分展示样品中的微藻共栖细菌的多样性.
图 1(Fig. 1)
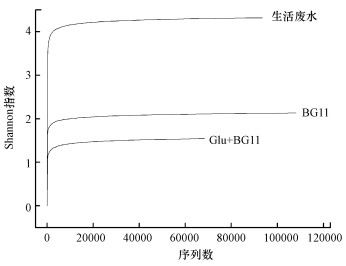 |
| 图 1 不同样品高通量测序分序OTU稀释曲线 Fig. 1Rarefaction curves of the different sample |
利用Illumina MiseqTM对生活废水、BG11和Glu+BG11环境下的共栖细菌进行分析, 比较3种环境共栖细菌菌群结构组成, 统计结果以Venn图形式得出.通常情况下, 分析时选用相似水平为97%的OTU, 此时OTU的数目也可以代表菌种的数目(何颖等, 2017).图 2结果显示, 生活废水和BG11中共栖细菌种类均较为丰富, 生活废水与BG11共有菌属131种, 生活废水与Glu+BG11和BG11与Glu+BG1共有菌属数量相近, 分别为67、68种.3个不同营养环境的共有菌属为80种.
图 2(Fig. 2)
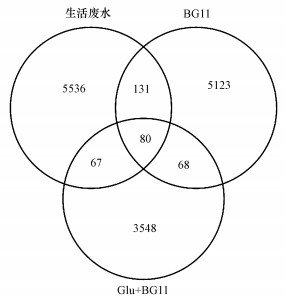 |
| 图 2 OTU样品分布维恩图 Fig. 2OTU sample distribution Venn diagram |
表 2为3种不同营养环境(生活废水、BG11及Glu+BG11)中棕鞭藻共栖细菌丰度和多样性的相关指数.Chao1指数用于估算样品中所含OTU总数, 反映了菌群丰度, Chao1越大说明细菌群落丰度越高.Shannon指数可反映细菌群落Alpha多样性, Shannon值越大, 说明细菌群落多样性越高(王长文等, 2019).由表 2可知, 3种不同营养环境中共栖细菌群落丰度与多样性的排序一致, 菌群丰度与多样性从高到低依次为:生活废水、BG11、Glu+BG11体系, 生活废水体系中共栖细菌生物多样性最高, Glu+BG11中共栖细菌生物多样性最低.研究表明, Glu+BG11体系中葡萄糖改变了无机营养环境, 为细菌提供了特异性的生存条件, 从而对细菌进行选择, 引起微藻共栖细菌群落结构发生明显变化, 共栖细菌多样性降低(侯进慧等, 2016).
表 2(Table 2)
| 表 2 不同营养环境棕鞭藻共栖细菌丰度和多样性(97%相似水平) Table 2 Bacterial richness and diversity in different samples | ||||||||||||||||||||||||
表 2 不同营养环境棕鞭藻共栖细菌丰度和多样性(97%相似水平) Table 2 Bacterial richness and diversity in different samples
| ||||||||||||||||||||||||
3.2 细菌门水平分类和属水平分类由表 3可知, 3种不同营养环境中棕鞭藻共栖细菌主要分布于变形菌门(Proteobacteria), 其在生活废水、BG11体系和Glu+BG11体系中的相对丰度分别为82.27%、99.2%和96.81%.此外, 棕鞭藻其他优势共栖细菌门类还包括浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria).
表 3(Table 3)
| 表 3 门水平主要细菌OTU占比情况 Table 3 The main bacterial OTU ratio at the phylum level | |||||||||||||||||||||||||||||||
表 3 门水平主要细菌OTU占比情况 Table 3 The main bacterial OTU ratio at the phylum level
| |||||||||||||||||||||||||||||||
根据Mothur分析结果绘制每个样品中棕鞭藻共栖细菌的种属分布图(图 3).图 3结果显示, 生活废水培养体系中棕鞭藻共栖细菌生物多样性最高, 优势菌属包括芽殖杆菌属、鞘脂单胞菌属及玫瑰球菌属, 菌群相对丰度分别为14.46%、14.9%、14.5%.其中, 芽殖杆菌属只在生活废水体系中有较高丰度, 在BG11及Glu+BG11中几乎不存在, 是典型的生活废水土著细菌.而鞘脂单胞菌属在生活废水、BG11及Glu+BG11 3种培养体系中丰度依次降低, 在BG11及Glu+BG11体系中丰度分别为5.05%、1.22%.研究发现, 鞘脂单胞菌属具有一定的溶藻性, 对蓝藻的溶藻率大于50%, 且可通过菌体的直接作用产生溶藻效果, 不利于微藻生物量积累(胡杰等, 2007).不同营养环境下, 微藻分泌胞外聚合物具有明显差异, 不同的藻际微环境会对微藻共栖细菌种类进行选择, 抑制了部分不利于微藻生物量积累的共栖细菌生长.因此, 相比于生活废水, BG11及Glu+BG11中鞘脂单胞菌属丰度较低.BG11体系中寡养单胞菌属、玫瑰球菌属丰度分别高达26.86%、51.03%, 二者丰度共占菌群总量的77.89%, 其他共栖细菌丰度较低, 均不超过5.05%.Glu+BG11体系中共栖细菌优势菌属包括寡养单胞菌属和玫瑰球菌属, 寡养单胞菌属丰度较生活废水、BG11体系中显著增加, 达到82.41%.研究表明, 寡养单胞菌属是一类具有较强溶藻效果的细菌, 随着微藻生物量快速积累, 寡养单胞菌数量快速增加, 同时, 寡养单胞菌属分泌的溶藻活性物质进入藻细胞内部, 作用于微藻细胞内的功能单位, 抑制光合活性或电子传递, 从而抑制微藻生物量继续积累.微藻细胞被溶解的过程中, 细菌立刻以裂殖的方式在其周质空间繁殖大量的后代, 释放出来迅速感染其他微藻细胞.寡养单胞菌属在共培养后期抑制棕鞭藻生长可能与寡养单胞菌属分泌溶藻活性物质有关.汪辉等(2011)研究发现, 寡养单胞菌属可以分泌耐热性小分子物质, 破坏铜绿微囊藻的光和系统, 抑制微藻生物量积累.有机物的添加可以在短时间内促进微藻生物量快速积累, 前期研究表明, Glu+BG11体系中棕鞭藻的生长速率是BG11体系的5倍, 生活废水体系中棕鞭藻的生长速率与BG11体系接近.随着棕鞭藻生物量的快速积累, Glu+BG11体系中对棕鞭藻生长有抑制作用的共栖细菌也会迅速繁殖, 从而抑制棕鞭藻生物量的持续增加.因此, 对微藻培养体系中相关藻类抑制菌的调控是微藻混养培养工程应用的关键.Glu+BG11中玫瑰球菌属丰度较生活废水及BG11中明显降低, 占菌群总量的6.2%.这是因为在Glu+BG11体系中微藻生物量快速积累不再是依赖玫瑰球菌属与棕鞭藻的互利共生作用, 而是藻细胞对葡萄糖的高效利用.因此, 棕鞭藻对于培养体系中可能存在互利共生作用的共栖细菌依赖性降低, 导致以玫瑰球菌属为代表的共生菌丰度降低.相反, Glu+BG11体系中快速积累的微藻生物量导致藻类抑制菌寡养单胞菌属快速繁殖, 其丰度高达82.4%, 从而使得该体系中微藻共栖细菌生物多样性降低.与此同时, 玫瑰球菌属与大量繁殖的寡养单胞菌属在营养物质、生存环境的竞争中处于劣势, 导致玫瑰球菌属丰度进一步降低(王华光等, 2018).对比3种不同棕鞭藻培养体系发现, 玫瑰球菌属在3种培养体系中均有较高丰度, 推测其是棕鞭藻良好的共生细菌.
图 3(Fig. 3)
 |
| 图 3 属水平样本物种丰度图 Fig. 3Sample species abundance map of genus |
3.4 物种丰度热图分析物种丰度热图是以颜色梯度来代表数据矩阵中数值的大小并通过对类型和数量相似的样品和菌种进行聚类的直观表现形式.根据物种丰度不同, 利用颜色差异将样品物种进行分类, 从蓝色到红色代表序列丰度由低到高, 进而显示多个样品菌群结构的相似点和不同点(王长文等, 2019), 上方聚类树体现了不同营养环境微藻共栖细菌的相似度.由图 4可以看出, 生活废水主要优势菌属中存在大量土著细菌, 主要包括芽殖杆菌属(Gemmobacter sp.)、吸血弧菌属(Vampirovibrio sp.)、小梨形菌属(Pirellula sp.)、甲基杆菌属(Methylobacterium sp.)、芽单胞菌属(Blastomonas sp.)等, BG11与Glu+BG11体系共栖细菌群落结构更为相似, 其中共有优势菌属包括寡养单胞菌属有(Stenotrophomonas sp.)、玫瑰球菌属(Roseococcus sp.)、鞘脂单胞菌属(Sphingomonas sp.)、慢生根瘤菌属(Bradyrhizobium sp.)、不粘柄菌属(Asticcacaulis sp.)、甲基杆菌属(Methylobacterium sp.)等.
图 4(Fig. 4)
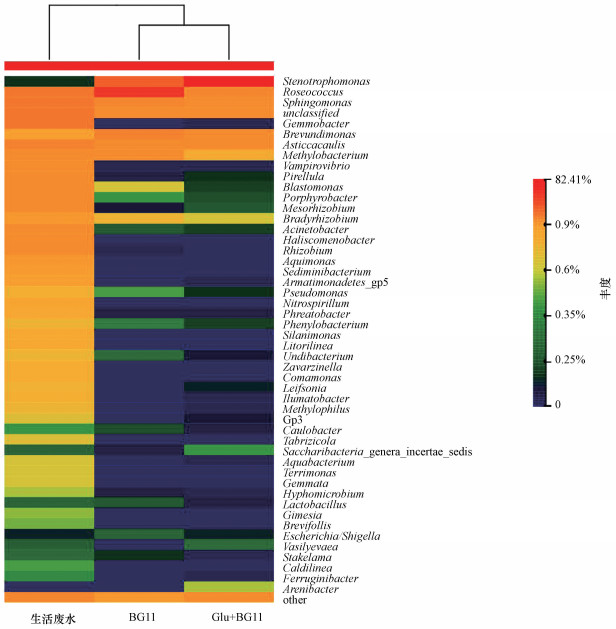 |
| 图 4 属水平物种丰度热图 Fig. 4Species abundance heat map of genus |
4 结论(Conclusions)1) 3种营养环境中棕鞭藻共栖细菌群落结构具有显著差异, 通过对比Alpha多样性发现, 生活废水中共栖细菌生物多样性最高, 其次是BG11、Glu+BG11环境.对样品进行聚类分析发现, BG11与Glu+BG11共栖细菌群落结构更相似, 与生活废水差异较大.
2) 不同营养环境中棕鞭藻共栖细菌优势菌属各不相同, 生活废水中优势菌属为芽殖杆菌属、鞘脂单胞菌属、玫瑰球菌属, BG11及Glu+BG11中优势菌属包括玫瑰球菌属、寡养单胞菌属.对比3种营养环境发现, 芽殖杆菌属仅在生活废水中具有较高丰度, 是生活废水中典型的土著细菌, 玫瑰球菌属相对丰度均较高, 是棕鞭藻良好的共生细菌.
3) 寡养单胞菌属在BG11及Glu+BG11体系中丰度较高, 而在生活废水中不存在.葡萄糖的加入使得Glu+BG11体系中寡养单胞菌属丰度快速增加, 其分泌的溶藻活性物质可抑制微藻生物量的积累, 成为抑制微藻生物量持续增加的主要原因之一.
参考文献
| Al-Awadhi H, Al-Hasan R H, Sorkhoh N A, et al. 2003. Establishing oil-degrading biofilms on gravel particles and glass plates[J]. International Biodeterioration & Biodegradation, 51(3): 181-185. |
| Amin S A, Hmelo L R, Van Tol H M, et al. 2015. Interaction and signalling between a cosmopolitan phytoplankton and associated bacteria[J]. Nature, 522(7554): 98-101. DOI:10.1038/nature14488 |
| Abomohra E F, El-Sheekh M, Hanelt D, et al. 2014. Extracellular secretion of free fatty acids by the chrysophyteOchromonas danicaunder photoautotrophic and mixotrophic growth[J]. World Journal of Microbiology & Biotechnology, 30(12): 3111-3119. |
| Croft M T, Lawrence A D, Raux-Deery E, et al. 2005. Algae acquire vitamin B12 through a symbiotic relationship with bacteria[J]. Nature, 438(7064): 90-93. DOI:10.1038/nature04056 |
| Cooper M B, Smith A G. 2015. Exploring mutualistic interactions between microalgae and bacteria in the omics age[J]. Current Opinion in Plant Biology, 26: 147-153. DOI:10.1016/j.pbi.2015.07.003 |
| Dao G H, Wu G X, W X X, et al. 2018. Enhanced microalgae growth through stimulated secretion of indole acetic acid by symbiotic bacteria[J]. Algal Research, 33: 345-351. DOI:10.1016/j.algal.2018.06.006 |
| 何颖.2017.浅水湖泊水华附生菌的种群结构和溶藻菌的选育及溶藻特性研究[D].南京: 东南大学 |
| 侯进慧, 韩芝洋, 侯蕴鑫. 2016. 小球藻共栖微生物种群多样性分析[J]. 生物技术, 26(4): 386-390. |
| 胡杰, 何晓红, 李大平, 等. 2007. 鞘氨醇单胞菌研究进展[J]. 应用与环境生物学报, 13(3): 431-437. DOI:10.3321/j.issn:1006-687X.2007.03.030 |
| Juan F, Garbayo I, Cuaresma M, et al. 2016. Impact of microalgae-bacteria interactions on the production of algal biomass and associated compounds[J]. Marine Drugs, 14(5): 100. DOI:10.3390/md14050100 |
| 鞠峰, 张彤. 2019. 活性污泥微生物群落宏组学研究进展[J]. 微生物学通报, 46(8): 2038-2052. |
| Kim B H, Ramanan R, Cho D H, et al. 2014. Role of Rhizobium, a plant growth promoting bacterium, in enhancing algal biomass through mutualistic interaction[J]. Biomass & Bioenergy, 69(3): 95-105. |
| Kouzuma A, Watanabe K. 2015. Exploring the potential of algae/bacteria interactions[J]. Current Opinion in Biotechnology, 33: 125-129. DOI:10.1016/j.copbio.2015.02.007 |
| Liu J, Wu Y, Wu C, et al. 2017. Advanced nutrient removal from surface water by a consortium of attached microalgae and bacteria:A review[J]. Bioresource Technology, 241: 1127-1137. DOI:10.1016/j.biortech.2017.06.054 |
| Liu H, Lu Q, Wang Q, et al. 2017. Isolation of a bacterial strain, Acinetobacter sp.from centrate wastewater and study of its cooperation with algae in nutrients removal[J]. Bioresource Technology, 235: 59-69. DOI:10.1016/j.biortech.2017.03.111 |
| 彭鹏, 石慧. 2008. 碱性过硫酸钾消解紫外分光光度法测定水样中的总氮[J]. 污染防治技术, (2): 86-88. |
| Ramanan R, Kim B H, Cho D H, et al. 2016. Algae-bacteria interactions:Evolution, ecology and emerging applications[J]. Biotechnology Advances, 34: 14-29. DOI:10.1016/j.biotechadv.2015.12.003 |
| Sanders R, Caron D, Davidson J, et al. 2001. Nutrient acquisition and population growth of a mixotrophic algain axenic and bacterized cultures[J]. Microbial Ecology, 42(4): 513-523. DOI:10.1007/s00248-001-1024-6 |
| Tadashi T, Mari K, Tsubasa H, et al. 2018. Growth promotion of three microalgae, Chlamydomonas reinhardtii, Chlorella vulgaris and Euglena gracilis, by in situ indigenous bacteria in wastewater effluent[J]. Biotechnology for Biofuels, 11(1): 176-182. |
| 王长文, 房柳, 梁运江, 等. 2019. 基于高通量测序的不同虫态洋虫内共生微生物群落分析[J]. 微生物学报, 58(9): 1705-1713. |
| 汪辉.2011.溶藻细菌对水华与赤潮微藻的抑制效应研究[D].南京: 南京农业大学 |
| 王华光, 王文静, 盛彦清. 2018. 污水处理工艺对微藻及藻际细菌群落的影响[J]. 中国环境科学, 38(10): 163-168. |
| 张增虎, 唐丽丽, 张永雨. 2018. 海洋中藻菌相互关系及其生态功能[J]. 微生物学通报, 45(9): 209-219. |
| 朱素华, 冯家望. 2013. 钼酸铵分光光度法测定水中总磷方法的改进[J]. 河南科技, (15): 220-221. DOI:10.3969/j.issn.1003-5168.2013.15.181 |
