 , 王亚楠1
, 王亚楠1
 , 孙英杰1, 开颜1, 陈璐2
, 孙英杰1, 开颜1, 陈璐21. 青岛理工大学 环境与市政工程学院 青岛市固体废物污染控制与资源化工程研究中心, 青岛 266033;
2. 青岛市环境保护局, 青岛 266003
收稿日期: 2019-06-16; 修回日期: 2019-08-04; 录用日期: 2019-08-04
基金项目: 国家自然科学基金面上项目(No.51678315);山东省自然科学基金重大基础研究项目(No.ZR2018ZC2364);山东省自然科学基金博士基金(No.ZR2018BEE037);中国博士后科学基金二等资助项目(No.2018M632642)
作者简介: 黄耀民(1995-), 男, E-mail:18453290227@163.com
通讯作者(责任作者): 王亚楠, E-mail:wangyanan1005@yeah.net
摘要:填埋垃圾的稳定化过程一般经历好氧过渡、水解酸化、初期产甲烷及稳定产甲烷阶段,固相垃圾的厌氧水解酸化阶段常被视为垃圾降解的限速步骤,而这一阶段微生物的降解作用是影响垃圾稳定化进程的关键.以青岛市小涧西生活垃圾填埋场短期填埋龄垃圾为研究对象,采用MiSeq高通量测序研究了填埋龄0~1、1.0~1.5、1.5~2 a垃圾堆体内微生物的群落结构多样性及种群分布特征.结果表明,0~1 a填埋龄垃圾微生物多样性高于1.0~1.5 a和1.5~2 a垃圾堆体,且微生物多样性整体上随填埋深度呈降低趋势.参与垃圾降解细菌多样性比真菌更丰富,而真菌多样性随填埋区域、填埋龄的不同呈现更显著的差异.参与短期填埋龄垃圾降解的细菌中,Firmicutes在填埋层上层为优势菌门,最大比例达到65%,Proteobacteria在填埋层中下层为优势菌门,最大比例达到88%.填埋上层细菌菌属以Defluviitoga、Aerococcus、Clostridium Ⅲ和Proteiniphilum为主,而在中下层以Thiopseudomonas、Sporosarcina和Eionea为主.真菌主要包括3个菌门,Ascomycota在各点位均为最优势菌门,属水平上Kernia及Aspergillus作为常见的腐生菌属,在不同点位均有较高的丰度.冗余分析表明短期填埋龄垃圾堆体内微生物不同时空分布存在显著差异性,且细菌群落结构的变化受pH值影响较大,而真菌群落结构的变化与垃圾有机质密切相关.
关键词:短期填埋龄微生物多样性群落结构种群分布
Microbial community structure and population distribution characteristics in short-term landfill refuse
HUANG Yaomin1
 , WANG Yanan1
, WANG Yanan1
 , SUN Yingjie1, KAI Yan1, CHEN Lu2
, SUN Yingjie1, KAI Yan1, CHEN Lu21. School of Environmental and Municipal Engineering, Qingdao University of Technology, Qingdao Solid Waste Pollution Control and Resource Engineering Research Center, Qingdao 266033;
2. Qingdao Environmental Protection Bureau, Qingdao 266003
Received 16 June 2019; received in revised from 4 August 2019; accepted 4 August 2019
Abstract: The stabilization process of landfill waste generally went through aerobic transition, anaerobic acidification, initial methanogenesis and stable methanogenesis processes. The hydrolysis-acidification phase of solid waste was usually regarded as a rate-limiting step during the whole anaerobic degradation process, and the microbiological degradation in this period was the key to the stabilization of refuse. Based on the short-term landfill refuse with landfill age of 0~1 year, 1.0~1.5 year and 1.5~2 year from Qingdao Xiaojianxi Landfill, their microbial diversity and community structure distribution characteristics of the landfill were investigated by MiSeq high-throughput sequencing. The results show that the microbial diversity of 0~1 year landfill waste was higher than those of 1.0~1.5 and 1.5~2 years landfill waste, and the microbial diversity decreased with the overall landfill depth. The diversity of bacterial involved in refuse degradation was more abundant than that of fungi, while the diversity of fungi showed more significant differences with different landfill areas and landfill ages. Among the bacteria involved in the short-term landfill waste degradation, Firmicutes was the dominant phylum in the upper layer of the landfill, with a maximum proportion of 65%, and Proteobacteria was the dominant phylum in the deep layer of the landfill, with a maximum proportion of 88%. The upper bacteria of the landfill were mainly consisted of Defluviitoga, Aerococcus, Clostridium Ⅲ, and Proteiniphilum, while in the middle and deep layers, Thiopseudomonas, Sporosarcina and Eionea were the main genus. The fungi mainly consisted of three phyla, and Ascomycota was the most dominant phylum at each point. Keronia and Aspergillus were the common genus of saprophytic genus, which had high abundances at different points. The redundancy analysis shows that the distribution of microorganisms in short-term landfill refuse presented significant differences in the dimensions of time and space. The change of bacterial community structure was greatly affected by the pH of the landfill, and the change of fungal community structure was closely related to the degradation of waste organic matter.
Keywords: short-term landfill agemicrobial diversitycommunity structurepopulation distribution
1 引言(Introduction)卫生填埋是我国生活垃圾处理与处置的重要方式之一.2017年我国生活垃圾无害化处理量达21034.2×104 t, 其中卫生填埋约占60%(中国统计局, 2018).填埋场的稳定化是一个漫长复杂的过程, 且垃圾降解过程中产生的渗滤液、恶臭气体、温室气体等二次污染物存在的环境污染风险达几十年, 甚至上百年.填埋场垃圾稳定化实质上是垃圾中可降解组分在各种微生物作用下, 经过一系列的分解、吸收、转化等生化反应, 逐步达到无害化和稳定化的一个过程(夏向利等, 2016).因此, 研究填埋过程中微生物的群落结构变化对于解释填埋场微生物过程及稳定化进程具有重要的意义.
目前, 国内外****对填埋场稳定化过程中渗滤液特性、填埋气组成和产气量、固相垃圾有机组分特征等进行了大量研究, 并根据固相-液相-气相的变化特性, 将其稳定化过程分为初始调整阶段、水解酸化阶段、初始产甲烷阶段及稳定产甲烷阶段(王罗春等, 2000).填埋场的稳定化实质上是由堆体内各种微生物共同作用的结果, 且随着填埋层内有机物基质的不断变化, 参与有机物降解的功能微生物菌群(如水解酸化菌、产氢产酸菌、产甲烷菌等)在不同稳定化阶段呈现一定的演替变化(杨琦等, 1997).
近年来, PCR-DGGE、克隆文库、宏基因组等生物技术应用于填埋场微生物菌群结构和功能的研究.苏月等利用高通量测序技术研究了北京市大屯垃圾转运站渗滤液细菌、真菌和古菌群落结构, 发现细菌群落的多样性最高, 真菌、古菌次之(苏月等, 2018).Liu等基于PCR-DGGE技术研究表明厚壁菌门、变形菌门、放线菌门是填埋场微生物的优势菌门(Liu et al., 2019).K?chling等利用454-焦磷酸测序研究不同填埋龄渗滤液中细菌群落结构, 发现厚壁菌门在所有样品中占比最高, 并且其比例随着填埋龄的升高而增加(K?chling et al., 2015).垃圾降解过程中, 微生物群落结构的变化与垃圾降解程度相互作用, Xu等利用高通量测序技术对我国北方和西部两个大型填埋场的细菌群落结构和多样性进行了研究, 结果表明填埋垃圾的理化性质与细菌群落结构密切相关(Xu et al., 2017).
垃圾降解过程中固相组分中复杂的有机物转变为可溶性有机物才能被微生物有效利用, 且有机组分的水解速率影响后续填埋层甲烷化水平.瞿贤等研究发现, 垃圾中总糖和蛋白质的快速水解发酵是填埋初期渗滤液有机质浓度高的主要来源, 纤维素的水解速率是甲烷化过程的限速步骤(瞿贤等, 2005).因此, 固相垃圾的水解酸化阶段常被视为垃圾厌氧降解的限速步骤, 但目前针对这一阶段微生物降解作用的研究相对较少.基于此, 本文以青岛市小涧西垃圾填埋场短期填埋龄垃圾为研究对象, 研究了短期填埋龄垃圾堆体内细菌和真菌的群落结构组成、分布特征及其与填埋稳定化进程的关系, 从而为加速填埋场有机物的降解及其作用机制提供研究基础.
2 材料与方法(Materials and methods)2.1 样品采集垃圾样品取自青岛市小涧西垃圾填埋场一期工程.填埋场于2002年建成投入使用, 填埋库区占地面积约为27×104 m2, 设计标高为45 m, 设计库容为710×104 m3, 计划使用年限为21~27 a.至2018年, 填埋标高增至55 m, 扩容24.8×104 m3, 目前一期工程已完成封场.
鉴于研究的垃圾样品为水解酸化阶段垃圾, 选取的垃圾为短期填埋龄(0~2 a)垃圾.填埋场封场前, 钻取第五平台和第四平台垂直深度上的垃圾样品(图 1), 其中, A和B点位位于第五平台, 钻井深度为15 m, A点位(0~1 a)采集5、10、15 m深度上的垃圾, B点位(0~1 a)采集5、15 m深度上的垃圾;C(1~1.5 a)和D(1.5~2 a)点位于第四平台, 钻井深度为15 m, 分别采集5、10和15 m深度上的垃圾.将现场采回的湿样送回实验室于4 ℃保存.
图 1(Fig. 1)
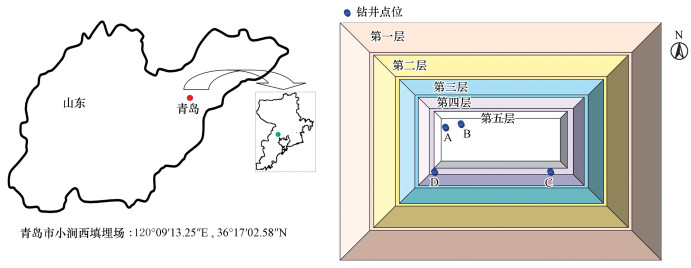 |
| 图 1 填埋场地理位置及采样点位 Fig. 1Landfill geographical position and sampling sites |
2.2 DNA提取及测序采用Mobio Power Soil? DNA Isolation kit试剂盒进行垃圾样品DNA提取, 提取步骤参照试剂盒说明书进行, 提取的DNA样品浓度和纯度采用超微量分光光度计进行检测.提取合格的DNA样品委托上海生工生物工程股份有限公司进行测序, 对样品16S rDNA基因的V3~V4区、ITS rDNA的ITS 1-2区进行PCR扩增, 采用Illumina Miseq 2×250 bp平台进行测序.V3~V4区扩增引物为341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)(Sinclair et al., 2015);ITS1-2区扩增引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R (5′-GCTGCGTTCTTCATCGATGC-3′)(Smith et al., 2014).
2.3 分析方法样品pH采用玻璃电极法(PHS-3C)测定, 凯氏氮(KN)测定采用硫酸汞催化消解法(KDN-20C消化炉和KDN-08C定氮仪), 有机质(OM)采用灼烧法(KSY6D-16马弗炉)分析.填埋垃圾理化性质数据的统计分析采用SPSS 22.0软件单因素方差分析、Duncan法进行多重比较.采用Usearch软件进行操作分类单元(OTU)分析, 并通过样本聚类树图分析样本间的相似性和差异性.微生物群落的丰度和多样性通过样本的多样性分析(α-多样性)进行表征, 包括ACE/Chao1/Shannon/Simpson/Coverage等指数.基于Bergey′s系统分类方法对OUT进行物种分类, 并通过R语言进行非度量多维尺度分析(NDMS)及冗余分析(RDA), 并采用SPSS 22.0进行微生物群落结构与环境因子相关性分析.
3 结果与讨论(Results and discussion)3.1 填埋垃圾理化性质如图 2所示, 短期填埋龄垃圾pH各深度变化不显著, 中下层垃圾中A、B、C点位与D点位有显著差异.不同点位OM含量随深度增加呈现显著波动, A、B点位随着填埋深度增加, OM含量逐渐减少, C、D点位OM含量则先增加后减少.在填埋中上层, A、B、D点位与C点位有显著差异性.在填埋下层, A、C点位与B、D点位有显著差异性.不同点位KN含量随深度呈现不同规律, A、D点位随着深度增加, KN含量逐渐增加, B点位KN含量随深度逐渐减少, C点位则呈现先增加后减少的趋势.总体上, A、B点位在填埋中上层与C、D点位有显著差异, 而在填埋下层, A、B、D点位与C点位呈现显著差异性, 表明即使同一填埋龄的垃圾, 由于堆体内部物质分布不均匀可能造成垃圾降解程度的波动, 且垃圾的降解程度沿填埋深度呈现较大的差异.
图 2(Fig. 2)
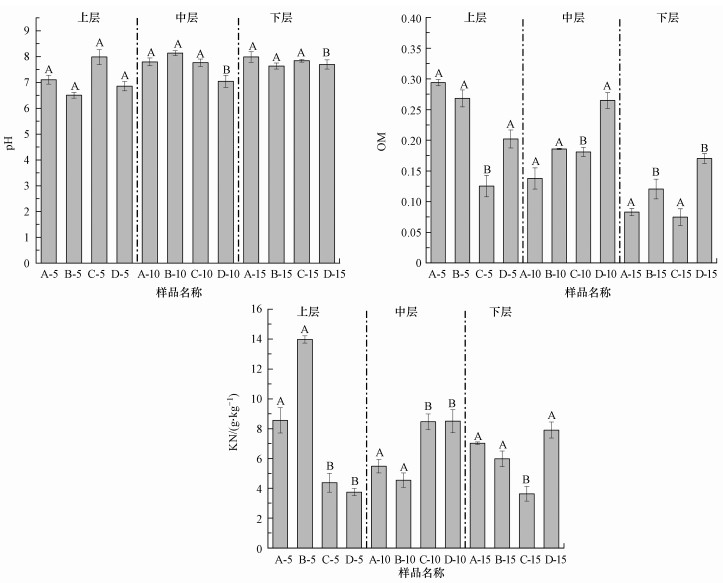 |
| 图 2 填埋垃圾理化性质 Fig. 2Physicochemical properties of landfill waste |
3.2 细菌和真菌群落组成的相似性和差异性在97%相似水平上对不同样本中细菌和真菌进行OUT聚类分析.不同样本间细菌和真菌群落组成的相似性和差异性通过OUT样本聚类树图和韦恩图进行表征, 见图 3和4.
图 3(Fig. 3)
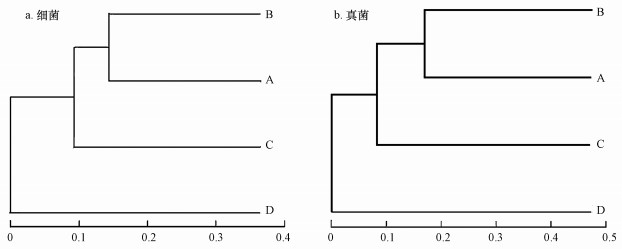 |
| 图 3 基于OTU的样本聚类树图 Fig. 3Hierarchical clustering figure of sample communities |
图 4(Fig. 4)
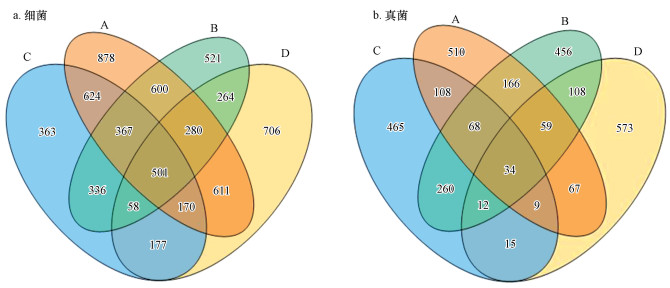 |
| 图 4 不同垃圾样本OTU分布韦恩图 Fig. 4Different garbage samples OTU distribution VENN diagram |
图 3表明, A与B点位、C与D点位的微生物群落组成更相近, 表明同一填埋龄垃圾的OTU较为相似, 所含微生物种群的相似度较高, 而不同填埋龄的垃圾之间的OTU存在一定的差异性, 表明随着垃圾的降解, 微生物群落结构发生了变化.
不同点位细菌和真菌群落组成的相似性及差异性如图 4所示.A、B、C和D点位的细菌OUT数目分别为4031、2927、2596和2767, A和B点位共有OUT数目为1748(33.55%), C和D点位共有OUT数目为906(20.33%), A和C点位共有OUT数目为1662(33.47%), B和D点位共有OUT数目为1103(24.02%).A、B、C和D点位的真菌OUT数目分别为1021、1163、971和877, A和B点位共有OUT数目为327(17.61%), C和D点位共有OUT数目为70(3.94%), A和C点位共有OUT数目为219(12.35%), B和D点位共有OUT数目为213(11.66%).总体上, 细菌的OUT数目高于真菌, 表明参与垃圾降解细菌种类更丰富;而不同点位真菌的共有OUT比例低于细菌, 表明真菌多样性随填埋区域、填埋龄的差异呈现更大的差异性.不同填埋龄垃圾之间存在比例互补的微生物群落, 说明细菌在垃圾降解过程中发生了“此消彼长”的演替特征.同一填埋龄但填埋位置不同的垃圾, 其微生物群落组成有较大的差异, 说明垃圾填埋的异质性造成不同填埋区微生物群落组成的差异性.
3.3 细菌和真菌群落组成的多样性分析3.3.1 微生物群落α-多样性分析α-多样性分析反映了微生物群落的丰富度(Chao1和Ace指数)和多样性(Shannon和Simpson指数), 不同填埋龄垃圾样本的细菌和真菌的α-多样性见表 1和表 2.
表 1(Table 1)
| 表 1 细菌α-多样性指数 Table 1 Bacterial α-diversity index | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 细菌α-多样性指数 Table 1 Bacterial α-diversity index
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2(Table 2)
| 表 2 真菌α-多样性指数 Table 2 Fungal α-diversity index | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 真菌α-多样性指数 Table 2 Fungal α-diversity index
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A点位上细菌的Chao1和ACE指数随填埋深度的增加而升高, 即其丰富度随深度逐渐升高;Shannon指数随着填埋深度的增加而降低, Simpson指数随着填埋深度的增加而升高, 表明细菌群落多样性随深度逐渐降低.B点位的细菌群落多样性和丰富度随着填埋深度均呈降低的趋势.C点位的细菌群落多样性随深度呈现先降低后升高的趋势, 丰富度则逐渐降低.D点位的细菌群落多样性与A和B点位呈相似的规律, 但其丰富度却呈现先降低后显著升高的趋势.总体上, A、B、D点位的细菌群落多样性高于C点位;且随着深度的增加, 微生物多样性呈降低的趋势.
A点位上真菌的Chao1和ACE指数随着填埋深度的增加降低, 即其丰富度随填埋深度的增加而逐渐降低, 多样性随深度呈现先降低后升高的趋势.B点位上真菌的丰富度随深度逐渐升高;多样性随深度增加却逐渐降低.C点位的真菌群落丰富度、多样性变化与B点位呈相似的规律.D点位的真菌群落丰富度随深度逐渐升高, 多样性随深度呈现先降低再升高的趋势.总体上, A、B、D点位的真菌群落多样性高于C点位, 但丰富度低于C点位.
整体上, 浅层垃圾中微生物的多样性高于中深层, 这可能由于浅层垃圾局部存在好氧区和缺氧区, 为好氧、兼性微生物提供了适宜的生长环境, 导致浅层微生物多样性高于中层和深层.此外, 0~1 a填埋龄垃圾微生物多样性较高, 这与初始填埋过程中堆体内环境的复杂变化有关, 既有好氧至厌氧过渡阶段的微生物, 也有水解酸化阶段的微生物;而填埋龄1.5~2 a垃圾微生物多样性高于1~1.5 a.
3.3.2 微生物群落β-多样性分析微生物群落β-多样性表征样本间的差异程度, 采用非度量多维尺度分析(NMDS)解析不同垃圾样本间的差异性, 细菌和真菌的NMDS分析见图 5.由图 5a可知, A和D点位的样本呈现较大的离散度, 表明这两个点位不同填埋深度的细菌群落组成存在较大的差异.B和C点位样本相对聚集, 表明这两个点位不同深度样本上的细菌群落组成较为相近.由图 5b可知, C和D点位的样本呈现较大的离散度, 表明这两个点位不同填埋深度的真菌群落组成存在较大的差异.A和B点位样本相对聚集, 表明它们在各自点位的不同深度上的真菌群落组成较为相近.细菌和真菌的组间差异程度在不同点位上呈现较大的差异;进一步表明了垃圾降解过程中细菌和真菌群落组成的时间和空间分布变异性较大.
图 5(Fig. 5)
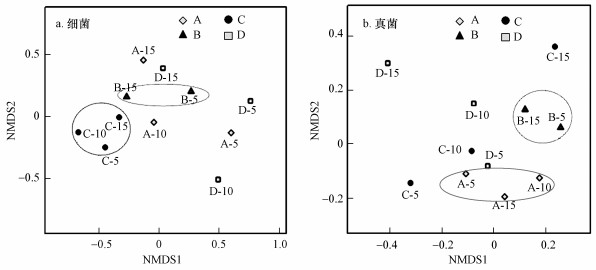 |
| 图 5 基于OTU的NMDS图 Fig. 5OTU-based NMDS map |
3.4 微生物物种组成分析3.4.1 门水平上物种组成图 6a反映了不同点位门水平上细菌的物种组成.A点位中Firmicutes(厚壁菌门)和Proteobacteria(变形菌门)为优势菌.Firmicutes随填埋深度呈显著降低的趋势, 比例由63%降低至7%, 而Proteobacteria随深度呈显著升高趋势, 比例由2%升高至90%.Thermotogae(热袍菌门)和Bacteroidetes(拟杆菌门)的比例随填埋深度分别由28%和5%降至5%和0.5%.B点位中Firmicutes和Proteobacteria是优势菌门, Firmicutes的比例随填埋深度由40%降至12%, 而Proteobacteria的比例则由56%升至87%.C点位中Proteobacteria占有绝对优势, 且随填埋深度呈逐渐上升的趋势, 比例由79%升至96%, 其次是Firmicutes, 占比为3%~12%, Bacteroidetes(0.1%~3%)及Thermotogae(0.5%~4%)随着填埋深度增加而降低.D点位中Firmicutes和Thermotogae在填埋垃圾中上层相对丰度随深度增加而增加, 在填埋下层相对丰度迅速降低, 而Proteobacteria在深层所占比例最高, Bacteroidetes相对丰度随深度逐渐降低.总体上, 参与短期填埋龄垃圾降解的细菌主要包括Firmicutes、Proteobacteria、Thermotogae和Bacteroidetes.Firmicutes在填埋层上层占绝对优势, 最大比例达到65%, Proteobacteria在填埋层中下层占绝对主导, 最大比例达到88%, Thermotogae和Bacteroidetes则主要富集于填埋层上层.此外, 不同填埋龄垃圾微生物群落结构呈现显著差异, 从图 6a可以看出, A、B、C点位门水平上细菌群落结构随填埋深度的演替变化规律相似, 其中A与B点位更为相似, D点位则显著区别于其他3个点位.这与OUT的样本聚类树图结果相吻合.
图 6(Fig. 6)
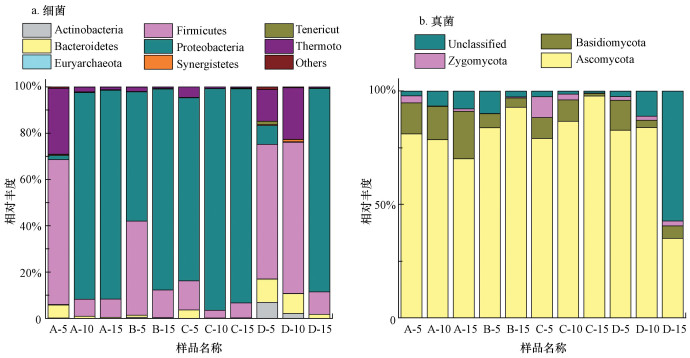 |
| 图 6 门水平上细菌(a)和真菌(b)的物种组成 Fig. 6Species composition of bacteria (a) and fungi (b) on phylum level |
Firmicutes多为革兰氏阳性菌, 包括厌氧的梭菌纲、兼性或专性好氧的芽孢杆菌纲, 它们在纤维素降解和发酵产酸方面发挥重要作用(Burrell et al., 2004; O′Sullivan et al., 2005).填埋层上层Firmicutes较高的比例可能与其含有兼性或专性好氧芽孢杆菌纲相关.Proteobacteria多为革兰氏阴性菌, 在兼性或专性厌氧条件下具有较强的分解糖类等有机物的能力.Bacteroidetes同样具有降解纤维素的能力(Shipman et al., 2000; Céline et al., 2007; Mackenzie et al., 2012).吴双等研究了北京市北神树生活垃圾填埋场中细菌群落结构, 发现优势菌门主要为Firmicutes、Proteobacteria(王磊, 2014; 吴双等, 2016).刘洪杰等在模拟垃圾填埋场稳定化研究中也发现, 垃圾中细菌群落主要由Bacteroidetes、Firmicutes及Proteobacteria三大门类细菌组成.通常, 随着垃圾的稳定化进程, Bacteroidetes所占比例会逐渐升高(刘洪杰等, 2017), 而研究中Bacteroidetes所占比例较低, 这与其填埋龄较短密切相关.
图 6b为不同点位门水平上真菌的物种组成.垃圾堆体中存在3个真菌菌门, A点位中优势菌门有子囊菌门Ascomycota(79%~81%), 其次为担子菌门Basidiomycota(13.6%~21%), B点位中优势菌门有Ascomycota(84%~93%), 其次为Basidiomycota(4%~9%).C点位优势菌门有Ascomycota(79%~98%)、Basidiomycota(1%~9.4%)和Zygomycota(0.2%~9.2%).D点位优势菌门有Ascomycota(35%~83%)、Basidiomycota(3%~13%)及unclassified(2%~57%).总体上, Ascomycota在各点位均为最优势菌门, 其次为Basidiomycota, 表明腐生的Ascomycota和Basidiomycota在动植物残体的分解以及有机物的霉烂中起到重要的作用.
3.4.2 属水平物种组成图 7a反映了不同点位属水平上细菌的物种组成.A点位中随着填埋深度的增加, Defluviitoga所占比例由填埋层上层的28.4%降低至中下层的1.2%, Aerococcus由5.3%降至0, Clostridium Ⅲ由10.3%降至0.2%, Proteiniphilum由3.5%降至0.3%;而Thiopseudomonas由0.16%显著升高至85%, 同时, Sporosarcina(2.6%~14.8%)和Eionea(0.1%~22.3%)作为新物种出现在填埋层中下层.填埋层纵向深度上细菌菌属结构的变化, 一方面是由于填埋上层垃圾填埋时间相对较短, 易受环境因素的影响;另一方面, 中下层垃圾的填埋周期相对较长, 填埋层内微生物的群落结构变化主要与垃圾自身的降解有关.B点位上优势菌属有Thiopseudomonas(49%~53.6%)、Sporosarcina(2.6%~14.8%)和Eionea(0.1%~22.3%).C点位中优势菌属主要为Thiopseudomonas(71%~95%), 其填埋上层参与垃圾降解的菌属种类显著高于中下层.D点位中优势菌属在填埋上层和中层呈现较高的相似性, 优势菌属主要有Aerococcus(比例约为18.7%)、Defluviitoga(比例约为22%)、Proteiniphilum(比例约为7.7%)、Clostridium Ⅲ(比例约为7.3%);而在填埋下层Thiopseudomonas所占比例显著升高, 高达69%, Sporosarcina和Eionea作为新物种出现在填埋层下层.
图 7(Fig. 7)
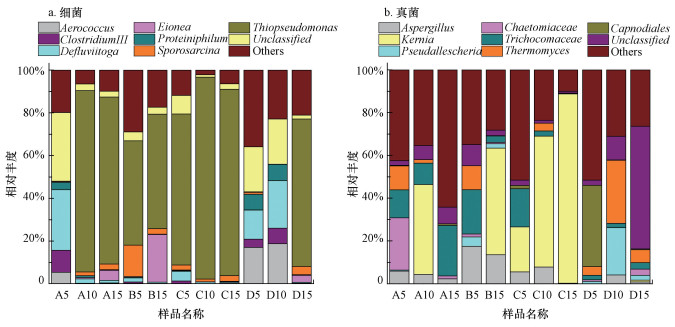 |
| 图 7 属水平上细菌(a)和真菌(b)的物种组成 Fig. 7Species composition of bacteria (a) and fungi (b) on genus level |
总体上, 短期填埋龄垃圾降解阶段的主要细菌菌属主要有Thiopseudomonas、Defluviitoga、Aerococcus、Clostridium Ⅲ、Proteiniphilum、Sporosarcina和Eionea.随着填埋深度的变化, 填埋上层细菌菌属结构更具多样性, 以Defluviitoga、Aerococcus、Clostridium Ⅲ、Proteiniphilum为主, 而在中下层以Thiopseudomonas、Sporosarcina和Eionea为主.Thiopseudomonas在A、B、C点位不同填埋深度下均为优势菌属, 这可能是因为Thiopseudomonas参与了初期填埋垃圾中有NO3-的厌氧还原.Clostridium Ⅲ和Defluviitoga菌属能够利用纤维素、木聚糖在内的大量单糖、双糖及多糖, 最终代谢产物有乙酸酯、乙醇、丙酸酯、CO2和H2, 是促使垃圾降解进入水解产酸阶段的功能菌(Maus et al., 2016; 赵磊等, 2018).同样的, 厌氧菌Proteiniphilum及兼性厌氧菌Sporosarcina在垃圾降解的过程中亦具有水解酸化的功能(韩睿等, 2018).Thiopseudomonas是一种兼性厌氧反硝化菌属, 可以利用糖酵解和柠檬酸途径代谢垃圾中的有机物, 同时在厌氧环境下可以代谢氮氧化物和硫化物(熊有为等, 2012; Tan et al., 2014; 谭文勃等, 2017).
图 7b反映了不同点位属水平上真菌的物种组成.A点位上优势菌属随深度变化较大, 填埋层上层主要由Aspergillus(曲霉属)、Chaetomiaceae(毛壳菌属)、unclassified Trichocomaceae(未分类发菌科)、Thermomyces(嗜热真菌属)、Others等组成, 随着填埋深度的加深, Kernia(闭小囊菌属)、unclassified Trichocomaceae逐渐成为优势菌属.B点位中, Aspergillus、unclassified Trichocomaceae、Thermomyces所占比例由上层的18%、21%、11%降低至深层的14%、3%、0, 而Kernia的比例由0显著升高至50%.C点位上, 上层菌属主要由Aspergillus(6%)、unclassified Trichocomaceae(18%)、Kernia(21%)组成, 而中下层Kernia所占比例由61%显著提升到88%.D点位上, unclassified Capnodiales(未分类煤炱目)在上层占有较高的比例, 而随着填埋深度增加, unclassified Trichocomaceae和unclassified Pseudallescheria在填埋中层成为优势菌属, 而在深层出现了大量的未知菌属.
总体上, A、B、C点位上参与垃圾降解的真菌主要包括Kernia、unclassified Trichocomaceae、Aspergillus和Thermomyces, 而D点位上的优势真菌主要为unclassified Capnodiales、unclassified Pseudallescheria和Thermomyces;且各点位上均含有大量的未知菌属.Kernia及Aspergillus作为常见的腐生菌属, 在不同点位均有较高的丰度.
3.5 垃圾降解过程中理化参数对微生物群落组成的影响不同填埋龄微生物丰度与填埋场理化性质相关性分析如表 3所示.填埋龄0~1 a样品中, Sporosarcina与KN显著正线性相关, 相关系数为0.895.Thermomyces与OM显著正线性相关, 相关系数为0.992.填埋龄1~2 a样品中Aerococcus、Proteiniphilum、Capnodiales与pH显著负线性相关, 相关系数分别为-0.883、-0.897、-0.856.Thiopseudomonas与pH呈显著正相关, 相关系数为0.882.由于垃圾中各理化指标波动大, 大部分菌属丰度与填埋垃圾理化性质相关性不显著, 这主要是因为短期填埋龄垃圾组成的不均匀性及其所处环境的差异是造成填埋场内不同区域的微生物群落结构存在一定的差异(王罗春等, 2001).
表 3(Table 3)
| 表 3 填埋场理化性质与微生物组成相关性分析 Table 3 Correlation analysis between physicochemical properties and microbial structure | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 填埋场理化性质与微生物组成相关性分析 Table 3 Correlation analysis between physicochemical properties and microbial structure
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
采用RDA分析垃圾降解过程中微生物群落与环境因子之间的关系, 图 8分别为细菌、真菌二维排序图, 图中带箭头的矢量线代表相应的环境因子(pH、KN、OM), 4种几何图形代表A、B、C、D点位.由图 8a可知不同空间层次呈现较大差异性, 4个采样点位细菌群落在0~10 m填埋层中差异性较大, 10~15 m填埋层则无明显差异.填埋龄0~1、1~1.5 a样本较为聚集, 而填埋龄1.5~2 a样本呈现明显差异性.由图 8b可知4个采样点位真菌群落在5~15 m填埋层中差异较小, 0~5 m填埋层中有较大离散度呈现显著差异性.填埋龄0~1、1~1.5 a样本较为聚集, 而填埋龄1.5~2 a样本呈现明显差异性, 这与样本OUT聚类结果一致.
图 8(Fig. 8)
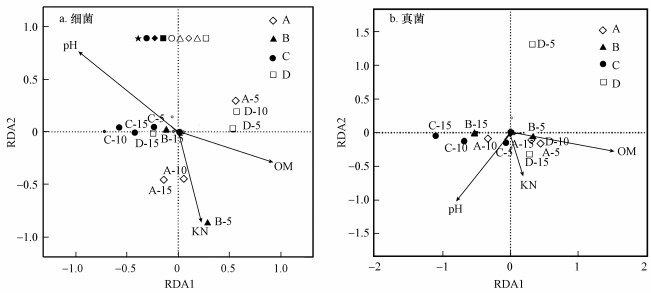 |
| 图 8 属水平上微生物群落变化与环境因子冗余分析(RDA) Fig. 8Microbial community change and environmental factor redundancy analysis on genus level |
在RDA分析中, 矢量线长度反映样本与环境因子的相关程度, 矢量线越长, 相关性越高.几何图形在矢量线上的垂直投影与箭头距离越近, 相应环境因子对样本的作用越大.环境因子对细菌群落结构影响相关性排序为pH>OM>KN, B、C、D点位10~15 m样本与pH投影距离近, 填埋层中细菌群落结构受pH影响较高, 表明垃圾降解进入水解酸化阶段, 填埋堆体pH值降低引起细菌群落结构的显著变化.而对真菌群落结构影响较大的环境因子是OM和pH, A、B点位0~5 m、10~15 m及D点位5~15 m样本与OM投影距离近, 表明真菌群落结构的变化与垃圾有机质的降解密切相关.
综上, 参与短期填埋龄垃圾降解的细菌多样性比真菌更丰富, 而真菌多样性随填埋区域、填埋龄的不同呈现更显著的差异.Firmicutes和Proteobacteria为优势细菌门, 填埋上层细菌菌属以Defluviitoga、Aerococcus、Clostridium Ⅲ和Proteiniphilum为主, 而在中下层以Thiopseudomonas、Sporosarcina和Eionea为主.Ascomycota为最优势真菌门, Kernia及Aspergillus作为优势真菌菌属.此外, 细菌群落结构的变化受pH值影响较大, 而真菌群落结构的变化与垃圾有机质密切相关.研究结果阐明了实际填埋场内部短期填埋垃圾的微生物群落结构分布特征及其与垃圾理化特性的关系, 有助于深入理解短期填埋龄垃圾易腐有机组分降解的微生物作用机制.
4 结论(Conclusions)1) A、B、D点位的细菌群落多样性高于C点位;且随着深度的增加, 微生物多样性呈降低的趋势.A、B、D点位的真菌群落多样性高于C点位, 但丰富度低于C点位.浅层垃圾中微生物的多样性高于中深层, 0~1 a填埋龄垃圾微生物多样性较高, 而填埋龄1.5~2 a垃圾微生物多样性高于1~1.5 a.
2) 细菌的优势菌门主要有Proteobacteria和Firmicutes.Firmicutes在填埋层上层为优势菌门, 最大比例达到65%, Proteobacteria在填埋层中下层为优势菌门, 最大比例达到88%.优势菌属包括Thiopseudomonas、Defluviitoga、Aerococcus、Clostridium Ⅲ、Proteiniphilum、Sporosarcina和Eionea.A、B、C点位群落结构较为相近, 其中A与B点位更为相近, D点位则明显不同.真菌主要包括Ascomycota、Basidiomycota和Zygomycota 3个菌门, 其中Ascomycota占绝对优势.优势菌属包括Kernia、unclassified Trichocomaceae、Aspergillus和Thermomyces, Kernia及Aspergillus作为常见的腐生菌属, 在不同点位均有较高的丰度.
3) 冗余分析结果表明填埋龄0~1、1~1.5 a样本微生物群落结构差异较小, 而填埋龄1.5~2 a样本呈现明显差异性, 不同空间层次呈现较大差异性.细菌群落结构的变化受pH值影响较大, 而真菌群落结构的变化与垃圾有机质密切相关.
参考文献
| Burrell P C, O'Sullivan C, Song H, et al. 2004. Identification, detection, and spatial resolution of clostridium populations responsible for cellulose degradation in a methanogenic landfill leachate bioreactor[J]. Applied and Environmental Microbiology, 70(4): 2414-2419. DOI:10.1128/AEM.70.4.2414-2419.2004 |
| Céline Robert, Chassard C, Lawson P A, et al. 2007. Bacteroides cellulosilyticus sp. nov. a cellulolytic bacterium from the human gut microbial community[J]. International Journal of Systematic & Evolutionary Microbiology, 57(7): 1516-1520. |
| 韩睿. 2018.青海农用沼气池发酵微生物群落结构与功能研究[D].武汉: 华中师范大学. 68-69 |
| K?chling T, Sanz J L, Gavazza S, et al. 2015. Analysis of microbial community structure and composition in leachates from a young landfill by 454 pyrosequencing[J]. Applied Microbiology and Biotechnology, 99(13): 5657-5668. DOI:10.1007/s00253-015-6409-4 |
| 刘洪杰, 徐晶, 赵由才, 等. 2017. 生活垃圾填埋场微生物群落结构与功能[J]. 环境卫生工程, 25(2): 5-9+14. DOI:10.3969/j.issn.1005-8206.2017.02.002 |
| Liu S J, Xi B D, Qiu Z P. 2019. Succession and diversity of microbial communities in landfills with depths and ages and its association with dissolved organic matter and heavy metals[J]. Science of the Total Environment, 651: 909-916. DOI:10.1016/j.scitotenv.2018.09.267 |
| O'Sullivan C A, Burrell P C, Clarke W P, et al. 2005. Structure of a cellulose degrading bacterial community during anaerobic digestion[J]. Biotechnology and Bioengineering, 92(7): 871-878. DOI:10.1002/bit.20669 |
| 瞿贤, 何品晶, 邵立明, 等. 2005. 生物反应器填埋条件下垃圾生物质组分的初期降解规律[J]. 环境科学学报, 25(9): 1219-1225. DOI:10.3321/j.issn:0253-2468.2005.09.013 |
| 苏月, 吴双, 夏孟婧, 等. 2018. 北京市大屯垃圾转运站渗滤液微生物群落分析[J]. 环境科学与技术, 41(2): 157-163. |
| Sinclair L, Osman O A, Bertilsson S, et al. 2015. Microbial community composition and diversity via 16S rRNA gene amplicons:evaluating the illumina platform[J]. Plos ONE, 10(2): e0116955. DOI:10.1371/journal.pone.0116955 |
| Smith D P, Peay K G. 2014. Sequence depth, not pcr replication, improves ecological inference from next generation DNA sequencing[J]. Plos ONE, 9(2): e90234. DOI:10.1371/journal.pone.0090234 |
| Shipman J A, Berleman J E, Salyers A A. 2000. Characterization of four outer membrane proteins involved in binding starch to the cell surface of Bacteroides thetaiotaomicron[J]. Journal of Bacteriology, 182(19): 5365-5372. DOI:10.1128/JB.182.19.5365-5372.2000 |
| Mackenzie A K, Pope P B, Pedersen H L, et al. 2012. Two susd-like proteins encoded within a polysaccharide utilization locus of an uncultured ruminant bacteroidetes phylotype bind strongly to cellulose[J]. Applied and Environmental Microbiology, 78(16): 5935-5937. DOI:10.1128/AEM.01164-12 |
| Maus I, Cibis K G, Bremges A, et al. 2016. Genomic characterization of Defluviitoga tunisiensis L3, a key hydrolytic bacterium in a thermophilic biogas plant and its abundance as determined by metagenome fragment recruitment[J]. Journal of Biotechnology, 232: 50-60. DOI:10.1016/j.jbiotec.2016.05.001 |
| Tan W B, Jiang Z, Chen C, et al. 2014. Thiopseudomonas denitrificans gen. nov. sp. nov. isolated from anaerobic activated sludge[J]. International Journal of Systematic & Evolutionary Microbiology, 65(Pt 1): 225-229. |
| 谭文勃. 2017.混养反硝化硫细菌Thiopseudomonas denitrificans X2的分离鉴定与基因组学研究[D].哈尔滨: 哈尔滨工业大学. 84-85 |
| 王磊. 2014.生活垃圾填埋堆体微生物分布特征及群落结构分析[D].北京: 北京大学 |
| 王罗春, 赵由才, 陆雍森. 2000. 垃圾填埋场稳定化及其研究现状[J]. 城市环境与城市生态, (5): 36-39. |
| 王罗春, 赵由才, 陆雍森. 2001. 大型垃圾填埋场垃圾稳定化研究[J]. 环境污染治理技术与设备, 2(4): 15-17. |
| 吴双, 王磊, 夏孟婧, 等. 2016. 北京市北神树生活垃圾填埋场细菌群落结构和分布特征[J]. 应用基础与工程科学学报, 24(6): 1135-1146. |
| 夏向利, 唐和清, 杨子陆, 等. 2016. 高温微生物菌剂加速垃圾填埋场好氧稳定化进程的研究[J]. 环境工程学报, 10(4): 2003-2008. |
| 熊有为, 王洪江, 吴爱祥, 等. 2012. 碱性微生物浸矿研究现状及发展趋势[J]. 湿法冶金, 31(4): 199-20. |
| Xu S, Lu W J, Liu Y T, et al. 2017. Structure and diversity of bacterial communities in two large sanitary landfills in China as revealed by high-throughput sequencing (MiSeq)[J]. Waste Management, 63: 41-48. DOI:10.1016/j.wasman.2016.07.047 |
| 杨琦, 张亚雷, 汪立忠, 等. 1997. 垃圾填埋场的厌氧降解作用及其微生物类群[J]. 中国沼气, (3): 7-10. |
| 赵磊, 刘慧. 2018. 江汉油田波动带土壤氮循环功能菌群分析[J]. 环境科学与技术, 41(11): 49-53. |
| 中国统计局. 2018. 中国统计年鉴2018[M]. 北京: 中国统计出版社. |
