 , 吕红
, 吕红
 , 周杨, 王晓磊, 张宝瑞
, 周杨, 王晓磊, 张宝瑞大连理工大学工业生态与环境工程教育部重点实验室, 大连 116024
收稿日期: 2019-01-29; 修回日期: 2019-04-03; 录用日期: 2019-04-03
基金项目: 国家自然科学基金(No.21577015)
作者简介: 张倩(1994-), 女, E-mail:15122569366@163.com
通讯作者(责任作者): 吕红(1973—), 副教授, 博士, 博导, 主要从事环境难降解污染物生物转化的新技术及新方法研究.E-mail: lvhonghj@163.com
摘要: 为揭示双酚F的厌氧归趋及提高双酚F的厌氧生物转化速率,本文以硝酸盐为电子受体,研究了Pseudomonas sp.HS-2厌氧转化双酚F的特性,并外加4种疏水性蒽醌类化合物(蒽醌、1-氨基蒽醌、2-氨基蒽醌、2-羟基蒽醌)来促进双酚F的厌氧转化.结果表明,菌株HS-2能够将双酚F厌氧转化为4,4-二羟基二苯基甲酮.最适培养条件为:硝酸盐5 mmol·L-1、pH=7和温度35℃.在最适条件下,4种疏水性蒽醌类化合物均能促进双酚F厌氧转化,且2-氨基蒽醌的促进作用最明显.当2-氨基蒽醌浓度为20 mg·L-1时,准一级反应速率常数为2.9×10-2 h-1,较不加2-氨基蒽醌体系提高了37.1%.在无硝酸盐存在时,2-氨基蒽醌不能使菌株HS-2厌氧转化双酚F.但当硝酸盐存在时,外加2-氨基蒽醌则能够促进双酚F的厌氧转化.
关键词:Pseudomonas sp. HS-2双酚F厌氧转化疏水性蒽醌类化合物
Anaerobic biotransformation of bisphenol F by Pseudomonas sp. HS-2 and promoted by hydrophobic anthraquinone compounds
ZHANG Qian
 , Lü Hong
, Lü Hong
 , ZHOU Yang, WANG Xiaolei, ZHANG Baorui
, ZHOU Yang, WANG Xiaolei, ZHANG Baorui Key Laboratory of Industrial Ecology and Environmental Engineering, Ministry of Education, Dalian University of Technology, Dalian 116024
Received 29 January 2019; received in revised from 3 April 2019; accepted 3 April 2019
Abstract: To reveal the fate and promote bisphenol F anaerobic biotransformation, the characteristics of bisphenol F biotransformation by Pseudomonas sp. HS-2 were studied using nitrate as an electron acceptor. Four hydrophobic anthraquinone compounds (ACs) anthraquinone, 1-aminoanthraquinone, 2-aminoanthraquinone (2-AAQ), 2-hydroxyanthraquinone were added to promote the biotransformation. The results show that strain HS-2 could anaerobically transform bisphenol F to 4, 4-dihydroxybenzophenone. The optimal reaction conditions were 5 mmol·L-1 nitrate, pH 7 and 35 ℃. All the four hydrophobic ACs could promote the biotransformation, 2-AAQ has the highest efficiency. Under 20 mg·L-1 of 2-AAQ, the pseudo-first-order reaction rate constant reached 2.9×10-2 h-1, 37.1% higher than that without 2-AAQ.
Keywords: Pseudomonas sp. HS-2bisphenol Fanaerobic biotransformationhydrophobic anthraquinone compounds
1 引言(Introduction)双酚F, 又名4, 4-二羟基二苯甲烷, 目前作为双酚A的替代物广泛用于合成聚碳酸酯和环氧树脂.这些产品的广泛使用造成双酚F在水体(如地表水和地下水)、沉积物和土壤中均有检出, 并且易在环境中积累(Liao et al., 2012;Yamazaki et al., 2015;Jin et al., 2016;Wang et al., 2017).由于双酚F是一种内分泌干扰物, 对生态环境和人体健康存在较大的潜在危害(Rosenmai et al., 2014;Mínguez et al., 2016;Han et al., 2016;沈杰等, 2018), 因此, 释放到环境中的双酚F亟需得到有效处理.
据报道, 在厌氧环境中, 当没有电子受体存在时, 双酚A很难被降解(Liao et al., 2012;Monsalvo et al., 2014).但在NO3-和SO42-还原条件下培养120 d, 河流沉积物中双酚A(50 mg·kg-1)的降解率可达到89%以上(Yang et al., 2015).在纯培养体系中, Bacillus sp. GZB能够在Fe3+还原100 h内去除10 mg·L-1双酚A(Li et al., 2012).当以硝酸盐为电子受体时, 在0.5 mg·L-1四溴双酚A的厌氧降解过程中发现, Comamonas sp. JXS-2-02能够将代谢中间产物双酚A转化为3, 4-二羟基扁桃酸和β-二羟基苯甲酸(Peng et al., 2013).这些研究表明, 厌氧环境中双酚A的去除速率十分缓慢.而其他双酚类化合物(如双酚F)厌氧降解的研究目前尚未见报道.近年来, 许多研究表明, 蒽醌类化合物在厌氧或缺氧条件下作为电子穿梭体可以加速电子受体偶氮染料、硝酸盐、高氯酸盐、Cr (Ⅵ)、砷和硒等污染物的生物还原转化(Liu et al., 2009;Wang et al., 2011;Kavita et al., 2013;Cui et al., 2015;苑宏英等, 2018;Zhu et al., 2019), 还可以加速电子供体苯酚、甲苯、石油烃和酰胺类药物等有机污染物的厌氧生物降解(Cervantes et al., 2001;Martínez et al., 2013;Adelaja et al., 2015;Wang et al., 2015;He et al., 2017).
基于此, 本文研究了菌株Pseudomonas sp. HS-2厌氧转化双酚F的特性, 并以硝酸盐为电子受体, 探究疏水性蒽醌类化合物对双酚F厌氧生物转化的促进作用, 以期为揭示双酚F的厌氧归趋及加速双酚F的厌氧转化提供一定的理论基础.
2 材料与方法(Materials and methods)2.1 菌种来源菌株Pseudomonas sp. HS-2由本实验室筛选并保藏(魏浩等, 2018).
2.2 主要药品及培养基双酚F、蒽醌和4, 4-二羟基二苯基甲酮(DHBP)购于百灵威科技有限公司, 1-氨基蒽醌购于大连美仑生物科技有限公司, 2-氨基蒽醌和2-羟基蒽醌购于东京化成工业株式会社, 以上试剂均为分析纯.
实验中活化培养基成分参考文献(魏浩等, 2018).厌氧培养基成分:双酚F 20 mg·L-1, K2HPO4·3H2O 6.0 g·L-1, KH2PO4 3.0 g·L-1, MgCl2 0.2 g·L-1, CaCl2 0.02 g·L-1, pH=7.0;根据实验需求加入相应浓度的KNO3.磷酸缓冲溶液成分:K2HPO4·3H2O 6.0 g·L-1, KH2PO4 3.0 g·L-1, pH=7.0.
2.3 双酚F的厌氧转化实验所有厌氧实验均在100 mL厌氧血清瓶中进行, 初始双酚F浓度为20 mg·L-1, 曝氮气20 min去除氧气, 瓶口用丁基胶塞铝封, 于121 ℃下高温蒸汽灭菌20 min.菌株HS-2在100 mL活化培养基中好氧培养12 h后, 10000 r·min-1下离心5 min, 去掉上清液, 加入20 mL磷酸缓冲溶液清洗两次后, 将细胞悬浊于脱氧的磷酸缓冲溶液中, 用注射器接入厌氧血清瓶中, 使初始细胞接菌量(OD600)为0.100, 实验设置3组平行样.
在厌氧条件下, 分别向反应体系中加入NO3-(1 mmol·L-1)、FeCl3(1 mmol·L-1)和SO42-(1 mmol·L-1), 研究这3种电子受体对双酚F厌氧转化的影响, 还分别研究了电子受体硝酸盐浓度(1~10 mmol·L-1)、pH(5.0~9.0)和温度(20~40 ℃)对双酚F厌氧生物转化的影响.并在相同细胞浓度下, 测定了不同温度下24 h时的脱氢酶活性.在菌株HS-2厌氧转化双酚F的最适条件下(5 mmol·L-1硝酸钾、35 ℃和pH=7.0), 以不加蒽醌类化合物为对照组分别研究了10 mg·L-1蒽醌、1-氨基蒽醌、2-氨基蒽醌、2-羟基蒽醌对双酚F厌氧生物转化的影响.以不加2-氨基蒽醌的体系作为对照组, 研究了5~40 mg·L-1 2-氨基蒽醌对双酚F厌氧转化的影响.并对双酚F厌氧转化过程进行准一级动力学拟合, 公式如下:
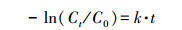 | (1) |
样品制备过程:0.5 mL样品加入到0.5 mL甲醇中, 振荡5 min使双酚F充分溶解, 然后过0.22 μm有机膜, 最后样品采用高效液相色谱分析, 其中, NO3-和NO2-浓度测定是将样品直接过0.22 μm水膜, 待测.
2.4 分析方法细胞浓度通过紫外-可见分光光度法于600 nm处测吸光值得到.采用岛津LC-20A高效液相色谱(HPLC)测定双酚F和DHBP, 测试色谱柱为C18柱(4.6 mm×250 mm, 5 μm), 流动相为甲醇和水(7/3, V/V), 柱温40 ℃, 流速为0.5 mL·min-1, 进样体积为10 μL, 检测波长分别为277 nm和298 nm(魏浩等, 2018).NO3-浓度通过水杨酸-浓硫酸法测定(Cataldo, 1975), NO2-浓度通过N-(1-萘基)-乙二胺光度法测定(国家环境保护总局, 2002), 脱氢酶活性测定采用氯化三苯基四氮唑法(Jasmina et al., 2012), 蛋白质的测定采用考马斯亮蓝G-250染色法(Bradford, 1976).
3 结果与讨论(Results and discussion)3.1 不同电子受体对双酚F厌氧转化的影响不同电子受体对双酚F厌氧转化的影响如图 1所示.当以Fe3+和硫酸盐作为电子受体时, 双酚F浓度略有降低, 并且没有检测到转化产物.而当NO3-存在时, 双酚F浓度显著降低, 并且有转化产物生成.可见, 菌株HS-2仅能够以硝酸盐作为电子受体厌氧转化双酚F.这与Bacillus sp. GZB(Li et al., 2012)不能以硝酸盐和硫酸盐为电子受体, 而能以Fe3+作为电子受体厌氧去除双酚A的特性不同.
图 1(Fig. 1)
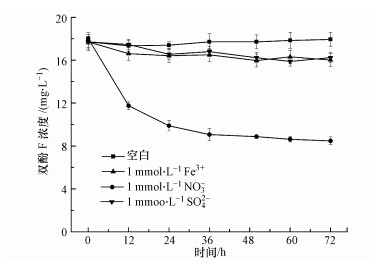 |
| 图 1 不同电子受体对双酚F厌氧生物转化的影响 Fig. 1Effect of different electron acceptors on anaerobic biotransformation of bisphenol F |
3.2 双酚F厌氧代谢产物分析图 2为采用HPLC对双酚F的代谢产物进行分析的色谱图.通过与标准品对照发现, 得到的代谢产物为DHBP, 保留时间为7.98 min.研究发现(图 3), 在以硝酸盐为电子受体的反应体系中, 随着双酚F浓度的降低, DHBP浓度不断积累, 并且菌株HS-2不能进一步转化DHBP.DHBP也是一种双酚类化合物, 据报道, 双酚F的雌激素活性及细胞毒性高于DHBP(Chen et al., 2002;Audebert et al., 2011).因此, 双酚F向DHBP的厌氧转化过程是一个毒性降低的过程, 这将有利于后续DHBP的降解.
图 2(Fig. 2)
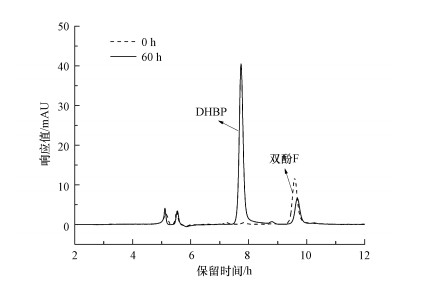 |
| 图 2 双酚F转化产物的高效液相色谱图 Fig. 2HPLC spectrum of bisphenol F and the biotransformation product |
图 3(Fig. 3)
 |
| 图 3 NO3-浓度对双酚F厌氧生物转化的影响(a)和60 h后反应体系中的菌蛋白浓度(b) Fig. 3Effect of nitrate concentration on anaerobic biotransformation of bisphenol F (a) and the bacterial protein concentration after 60 h (b) |
3.3 双酚F厌氧生物转化的条件优化图 3为电子受体硝酸盐浓度对双酚F和细胞浓度的影响.当硝酸钾浓度为1、3、5、7和10 mmol·L-1时, 反应60 h时双酚F的厌氧转化率分别为52.1%、63.9%、65.9%、56.5%和55.8%.可以看出, 当初始硝酸钾浓度为5 mmol·L-1时, 菌株HS-2对双酚F的厌氧转化率最高.当硝酸盐浓度继续升高时, 反应体系中的菌蛋白浓度降低, 即菌浓度降低, 从而导致双酚F的转化率降低.
本文进一步研究了温度对双酚F厌氧转化的影响.从图 4可以看出, 当温度从20 ℃升到35 ℃时, 双酚F的厌氧转化速率不断提高.当温度为35 ℃时, 培养24 h后双酚F的去除率达到61.5%.据报道, 温度是通过影响生物体内的酶活性而影响生物活性(张媛媛等, 2016).脱氢酶活性可以代表厌氧反应体系中微生物活性及电子转移活性(Wang et al, 2014).通过检测培养24 h后反应体系中菌的脱氢酶活性(以下F计)可以看出(图 4b), 双酚F厌氧转化率的升高主要归因于脱氢酶活性的升高.但当温度升到40 ℃时, 脱氢酶活性急剧下降, 从而使双酚F厌氧转化率明显降低.因此, 菌株HS-2厌氧转化双酚F的最适温度为35 ℃.
图 4(Fig. 4)
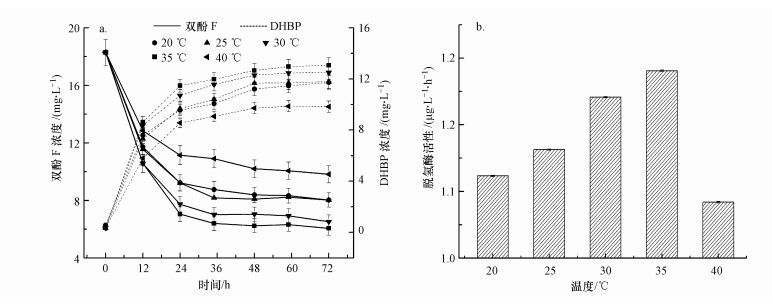 |
| 图 4 温度对双酚F厌氧生物转化(a)和24 h后脱氢酶活性(b)的影响 Fig. 4Effect of temperature on anaerobic biotransformation of bisphenol F (a) and dehydrogenase activities of cells after 24 h (b) |
反应体系的pH对菌株HS-2活性有较大的影响, 从而也影响双酚F的厌氧生物转化速率.由图 5可知, 当pH为7.0时, 双酚F的转化率最高, pH为6.0和5.0时双酚F的转化率逐渐降低, 说明双酚F的厌氧转化在中性条件下达到最优, 偏酸性条件也可以转化双酚F.而当溶液pH为8~9时, 双酚F基本不转化, 因为在此条件下, 细菌呈现絮凝状沉淀, 细胞丧失活性.因此, pH为7.0是双酚F厌氧转化的最适pH值.
图 5(Fig. 5)
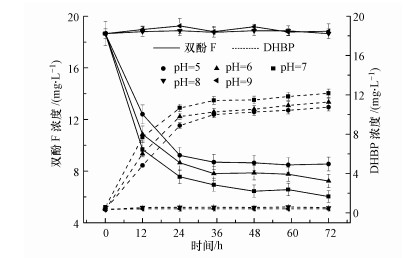 |
| 图 5 pH对双酚F厌氧生物转化的影响 Fig. 5Effect of pH on anaerobic biotransformation of bisphenol F |
3.4 疏水性蒽醌类化合物对双酚F厌氧转化的影响在菌株HS-2厌氧转化双酚F的最适条件下(5 mmol·L-1硝酸钾、35 ℃和pH为7.0), 研究了4种疏水性蒽醌类化合物对双酚F厌氧转化的影响.从图 6中可以看出, 反应36 h时, 对照组双酚F的转化率为64.3%, 而添加蒽醌、1-氨基蒽醌、2-氨基蒽醌、2-羟基蒽醌时双酚F的转化率分别为69.1%、70.4%、72.7%、68.2%, 转化率分别提高了4.8%、6.1%、8.4%、3.9%, 这表明这4种蒽醌化合物对双酚F厌氧转化均具有一定的促进作用.这4种醌类介体的促进效果不同, 主要是由于蒽醌环上取代基的不同及取代位置存在差异导致的(康丽等, 2011).其中, 2-氨基蒽醌对双酚F厌氧转化的促进效果最好.
图 6(Fig. 6)
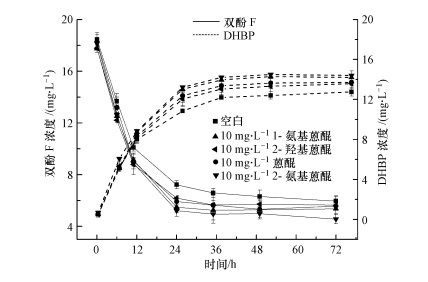 |
| 图 6 4种疏水性蒽醌类化合物对双酚F厌氧转化的影响 Fig. 6Effect of four hydrophobic anthraquinone compounds on anaerobic biotransformation of bisphenol F |
3.5 2-氨基蒽醌浓度对双酚F厌氧转化的影响据报道, 当介体浓度在一定范围内时, 其催化效果与浓度呈正相关, 然而当介体浓度过高时, 可能影响微生物功能的正常表达, 导致加速污染物降解的倍数降低甚至出现抑制作用(黄丹等, 2014;李俊江等, 2018).因此, 本文研究了2-氨基蒽醌浓度对双酚F厌氧转化的影响, 结果表明(图 7), 双酚F厌氧转化过程的准一级动力学线性拟合效果较好, R2均大于0.9, 说明该过程符合准一级动力学模型.准一级反应速率常数k值如图 7所示, 2-氨基蒽醌浓度在0~40 mg·L-1范围内k值随其浓度的增加先升高后降低.当2-氨基蒽醌浓度为20 mg·L-1时, 反应速率常数最大, 为2.9×10-2 h-1, 比不加2-氨基蒽醌体系(k=2.1×10-2 h-1)提高了37.1%.
图 7(Fig. 7)
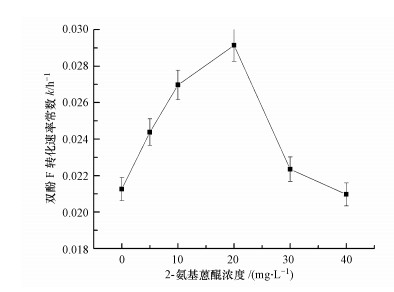 |
| 图 7 2-氨基蒽醌浓度对双酚F厌氧转化的影响 Fig. 7Effect of 2-aminoanthraquinone concentration on anaerobic biotransformation of bisphenol F |
在外加20 mg·L-1 2-氨基蒽醌条件下, 进一步分析了双酚F厌氧转化和硝酸盐还原过程, 实验结果如图 8所示.以2-氨基蒽醌为最终电子受体时, 双酚F不能进行转化, 这与很多文献报道中蒽醌类化合物能单独作为电子受体使污染物得到降解的现象不同(He et al., 2017;Cervantes et al., 2000;李海波等, 2012).但有硝酸盐存在时, 2-氨基蒽醌则能够同时促进双酚F及硝酸盐的去除.在此过程中, 菌株HS-2将通过双酚F、内源呼吸和胞外聚合物得到的电子传递给硝酸盐和2-氨基蒽醌, 后者可还原为氢醌.据报道, 在反硝化条件下, 还原后的AQDS(氢醌)可作为微生物还原硝酸盐和N2O的电子供体, 从而显著提高脱氮率(Aranda et al., 2007).因此, 在反应12 h后, 通过氢醌氧化-硝酸盐还原, 2-氨基蒽醌不断循环再生, 并作为电子穿梭体, 促进了硝酸盐的还原和双酚F的厌氧转化.
图 8(Fig. 8)
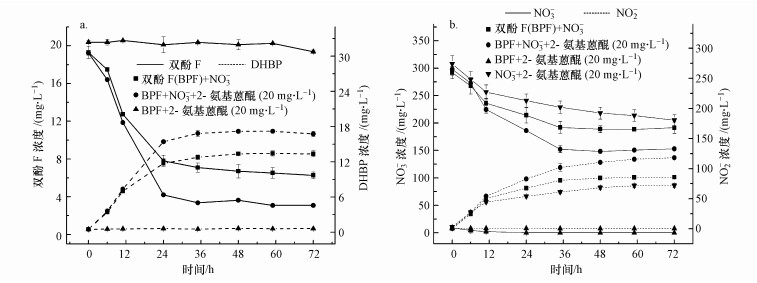 |
| 图 8 2-氨基蒽醌促进双酚F厌氧转化(a)和硝酸盐还原过程(b) Fig. 8Effect of 2-AAQ on the anaerobic biotransformation of bisphenol F (a) and nitrate reduction (b) |
不同于共代谢体系, 本文是以双酚F为唯一碳源研究其厌氧转化过程.从图 8中可以看出, 双酚F厌氧转化所产生的电子难以满足硝酸盐的降解及微生物的代谢需求.相关研究表明, 当微生物处于贫营养时, 其细胞的内源呼吸会显著增强, 同时溶解性微生物产物会大量增加(王盛勇等, 2009).通过分析不同体系内硝酸盐去除量可知, 菌株HS-2的内源呼吸对硝酸盐还原的贡献最大(占比为70.6%).在双酚F体系中, 双酚F的厌氧转化与硝酸盐还原趋势是一致的.可见, 在没有外加碳源的厌氧条件下, 菌株HS-2主要是通过内源呼吸来满足自身的代谢需求, 因此, 对双酚F的厌氧转化也有一定的影响.这一现象有助于理解贫营养条件下双酚F的厌氧转化归趋.
4 结论(Conclusions)1) 在厌氧条件下, 菌株HS-2能够以硝酸盐为电子受体将双酚F转化为4, 4-二羟基二苯基甲酮, 其最适条件为:5 mmol·L-1硝酸盐, pH=7, 温度为35 ℃.
2) 4种疏水性蒽醌类化合物对双酚F厌氧生物转化均具有促进作用, 其中, 2-氨基蒽醌促进效果最好.当2-氨基蒽醌浓度为20 mg·L-1时, 双酚F厌氧生物转化的准一级反应速率常数为2.9×10-2 h-1, 比不加2-氨基蒽醌体系提高了37.1%.
3) 在硝酸盐存在时, 2-氨基蒽醌能够通过氢醌氧化-硝酸盐还原而不断循环再生, 并作为电子穿梭体, 促进硝酸盐的还原和双酚F的厌氧生物转化.
参考文献
| Adelaja O, Keshavarz T, Kyazze G. 2015. The effect of salinity, redox mediators and temperature on anaerobic biodegradation of petroleum hydrocarbons in microbial fuel cells[J]. Journal of Hazardous Materials, 283: 211–217.DOI:10.1016/j.jhazmat.2014.08.066 |
| Aranda-Tamaura C, Estrada-Alvarado M I, Texier A C, et al. 2007. Effects of different quinoid redox mediators on the removal of sulphide and nitrate via denitrification[J]. Chemosphere, 69(11): 1722–1727.DOI:10.1016/j.chemosphere.2007.06.004 |
| Audebert M, Dolo L, Perdu E, et al. 2011. Use of the γH2AX assay for assessing the genotoxicity of bisphenol A and bisphenol F in human cell lines[J]. Archives of Toxicology, 85(11): 1463–1473.DOI:10.1007/s00204-011-0721-2 |
| Bradford M M. 1976. A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 72(1/2): 248–254. |
| Cataldo D A. 1975. Rapid colorimetric determination of nitrate in plant tissue by nitration of salicylic acid[J]. Communications in Soil Science and Plant Analysis, 6(1): 71–80.DOI:10.1080/00103627509366547 |
| Cervantes F J, Velde S V D, Lettinga G, et al. 2000. Quinones as terminal electron acceptors for anaerobic microbial oxidation of phenolic compounds[J]. Biodegradation, 11(5): 313–321.DOI:10.1023/A:1011118826386 |
| Cervantes F J, Dijksma W, Duongdac T, et al. 2001. Anaerobic mineralization of toluene by enriched sediments with quinones and humus as terminal electron acceptors[J]. Applied and Environmental Microbiogy, 67(10): 4471–4478.DOI:10.1128/AEM.67.10.4471-4478.2001 |
| Chen M Y, Ike M, Fujita M. 2002. Acute toxicity, mutagenicity, and estrogenicity of bisphenol-A and other bisphenols[J]. Environmental Toxicology, 17(1): 80–86.DOI:10.1002/tox.10035 |
| Cui D, Li G, Zhao D, et al. 2015. Effect of quinoid redox mediators on the aerobic decolorization of azo dyes by cells and cell extracts from Escherichia coli[J]. Environmental Science and Pollution Research, 22(6): 4621–4630.DOI:10.1007/s11356-014-3698-6 |
| Filipi? J, Kraigher B, Tepu? B, et al. 2012. Effects of low-density static magnetic fields on the growth and activities of wastewater bacteria Escherichia coli and Pseudomonas putida[J]. Bioresource Technology, 120: 225–232.DOI:10.1016/j.biortech.2012.06.023 |
| 国家环境保护总局. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社: 268–271. |
| 黄丹, 王竞, 李培良, 等. 2014. Shewanella sp.XB缺氧反硝化降解苯酚[J]. 环境工程学报, 2014, 8(4): 1345–1349. |
| Han C, Hong Y C. 2016. Bisphenol A, hypertension, and car-diovascular diseases:Epidemiological, laboratory, and clinical trial evidence[J]. Current Hypertension Reports, 18(2): 11.DOI:10.1007/s11906-015-0617-2 |
| He K, Yin Q, Liu A, et al. 2017. Enhanced anaerobic degradation of amide pharmaceuticals by dosing ferroferric oxide or anthraquinone-2, 6-disulfonate[J]. Journal of Water Process Engineering, 18: 192–197.DOI:10.1016/j.jwpe.2017.06.018 |
| Jin H B, Zhu L Y. 2016. Occurrence and partitioning of bisphenol analogues in water and sediment from Liaohe River Basin and Taihu Lake, China[J]. Water Research, 103: 343–351.DOI:10.1016/j.watres.2016.07.059 |
| Kavita B, Keharia H. 2013. Anthraquinone 2-sulfonic acid-mediated reduction of Cr(Ⅵ) by Bacillus sp.BT1[J]. Desalination and Water Treatment, 53(1): 221–229. |
| 康丽, 郭建博, 廉静, 等. 2011. 介体厌氧催化活性艳红K-2BP脱色及构效特性研究[J]. 环境科学, 2011, 32(4): 1060–1065. |
| 李海波, 廉静, 郭延凯, 等. 2012. 氧化还原介体催化强化Paracoccus versutus菌株GW1反硝化特性研究[J]. 环境科学, 2012, 33(7): 2458–2463. |
| 李俊江, 宋圆圆, 刘雁滨, 等. 2018. 氧化还原介体催化强化Shewanella oneidensis MR-1还原亚硒酸盐的研究[J]. 河北科技大学学报, 2018, 39(1): 73–83. |
| Li G, Zu L, Wong P K, et al. 2012. Biodegradation and detoxification of bisphenol A with one newly-isolated strain Bacillus sp.GZB:kinetics, mechanism and estrogenic transition[J]. Bioresource Technology, 114: 224–230.DOI:10.1016/j.biortech.2012.03.067 |
| Liao C, Liu F, Moon H B, et al. 2012. Bisphenol analogues in sediments from industrialized areas in the United States, Japan, and Korea:spatial and temporal distributions[J]. Environmental Science & Technology, 46(21): 11558–11565. |
| Liu G, Zhou J, Wang J, et al. 2009. Acceleration of azo dye decolorization by using quinone reductase activity of azoreductase and quinone redox mediator[J]. Bioresource Technology, 100(11): 2791–2795.DOI:10.1016/j.biortech.2008.12.040 |
| Martínez C M, Celis L B, Cervantes F J. 2013. Immobilized humic substances as redox mediator for the simultaneous removal of phenol and Reactive Red 2 in a UASB reactor[J]. Applied Microbiology and Biotechnology, 97(22): 9897–9905.DOI:10.1007/s00253-013-5190-5 |
| Mínguez-Alarcón L, Hauser R, Gaskins A J. 2016. Effects of bisphenol A on male and couple reproductive health:A re-view[J]. Fertility & Sterility, 106(4): 864–870. |
| Monsalvo V M, McDonald J A, Khan S J, et al. 2014. Removal of trace organics by anaerobic membrane bioreactors[J]. Water Research, 49: 103–112.DOI:10.1016/j.watres.2013.11.026 |
| Peng X, Zhang Z, Luo W, et al. 2013. Biodegradation of tetrabromobisphenol A by a novel Comamonas sp.strain, JXS-2-02, isolated from anaerobic sludge[J]. Bioresource Technology, 128: 173–179.DOI:10.1016/j.biortech.2012.10.051 |
| Rosenmai A K, Dybdahl M, Pedersen M, et al. 2014. Arestructural analogues to bisphenol A safe alternatives?[J]. Toxicological Sciences, 139(1): 35–47.DOI:10.1093/toxsci/kfu030 |
| 沈杰, 刘建超, 陆光华, 等. 2018. 双酚S和双酚F在水环境中的分布、毒理效应及其生态风险研究进展[J]. 生态毒理学报, 2018, 13(5): 37–48. |
| Wang J, Wang D, Liu G, et al. 2014. Enhanced nitrobenzene biotransformation by graphene-anaerobic sludge composite[J]. Journal of Chemical Technology & Biotechnology, 89(5): 750–755. |
| Wang J, Zhou Y, Li P. 2015. Effects of redox mediators on anaerobic degradation of phenol by Shewanella sp.XB[J]. Applied Biochemistry and Biotechnology, 175(6): 3162–3172.DOI:10.1007/s12010-015-1490-9 |
| Wang Q, Chen M, Shan G Q, et al. 2017. Bioaccumulation and biomagnification of emerging bisphenol analogues in aquatic organisms from Taihu Lake, China[J]. Science of the Total Environment, 598: 814–820.DOI:10.1016/j.scitotenv.2017.04.167 |
| Wang X, Liu G, Zhou J, et al. 2011. Quinone-mediated reduction of selenite and tellurite by Escherichia coli.[J]. Bioresource Technology, 102(3): 3268–3271.DOI:10.1016/j.biortech.2010.11.078 |
| 魏浩, 吕红, 周集体, 等. 2018. Pseudomonas sp.HS-2降解双酚F及脱氮的特性研究[J]. 工业水处理, 2018, 38(1): 52–56. |
| 王盛勇, 孙宝盛, 王金翠. 2009. 贫营养条件下溶解性微生物产物的产出研究[J]. 水处理技术, 2009, 35(7): 17–21. |
| 苑宏英, 李原玲, 李华, 等. 2018. 投加介体强化低温污水生物反硝化脱氮的研究[J]. 中国给水排水, 2018, 34(13): 110–114. |
| Yamazaki E, Yamashita N, Taniyasu S, et al. 2015. Bisphenol A and other bisphenol analogues including BPS and BPF in surface water samples from Japan, China, Korea and India[J]. Ecotoxicology and Environmental Safety, 122: 565–572.DOI:10.1016/j.ecoenv.2015.09.029 |
| Yang Y, Wang Z, He T, et al. 2015. Sediment bacterial communities associated with anaerobic biodegradation of bisphenol A[J]. Microbial Ecology, 70(1): 97–104.DOI:10.1007/s00248-014-0551-x |
| Zhu Y, Wu M, Gao N, et al. 2019. Enhanced dissimilatory perchlorate reduction in the presence of humic acids or 2, 6-anthraquinone disulfonate as quinone redox mediators[J]. Chemical Engineering Journal, 357: 75–83.DOI:10.1016/j.cej.2018.09.061 |
| 张媛媛, 郭延凯, 张超, 等. 2016. 非水溶性醌加速菌GWF生物还原高氯酸盐的研究[J]. 环境科学, 2016, 37(3): 988–993. |
