 , 周世真2, 马小龙2, 马子川1,3
, 周世真2, 马小龙2, 马子川1,3

1. 河北师范大学化学与材料科学学院, 石家庄 050024;
2. 河北师范大学生命科学学院, 石家庄 050024;
3. 河北省无机纳米材料重点实验室, 石家庄 050024
收稿日期: 2019-02-14; 修回日期: 2019-05-14; 录用日期: 2019-05-14
基金项目: 国家重点研发计划项目(No.2018YFC0506901);河北省自然科学基金(No.B2017205146)
作者简介: 赵天赐(1992-), 女, E-mail:1019909378@qq.com
通讯作者(责任作者): 马子川, E-mail:mazc@vip.163.com
摘要: 采用两步浸渍-草酸盐热解法制备了均匀负载铁锰氧化物的磁性玉米芯炭(MnFeOx@CCBC),通过X射线衍射(XRD)、扫描电子显微镜(SEM)、比表面积分析仪和pH漂移实验等表征,证明制备的MnFeOx@CCBC材料表面由MnFe2O4和无定形态的δ-MnO2或水合氧化锰组成,pHZPC约为6.0,比表面积为3.9 m2·g-1.同时,比较研究了MnFeOx@CCBC和原始玉米芯炭(CCBC)对Pb2+的吸附动力学和热力学行为.结果表明:吸附过程均符合准二级动力学方程和Langmuir等温吸附模型,在实验条件下,MnFeOx@CCBC对Pb2+的吸附速率和吸附量都明显优于CCBC,准二级动力学速率常数大3.3倍,理论平衡吸附量高6.95倍;在30℃时,MnFeOx@CCBC和CCBC的饱和吸附量分别为99.60和15.66 mg·g-1;Pb2+的吸附过程是熵驱动和吸热的.傅里叶变换红外光谱(FTIR)和X射线光电子能谱(XPS)等分析表明,MnFeOx@CCBC的主要吸附位是Mn—OH,其主要吸附机理是Pb2+对Mn—OH中H+的置换,并形成内层表面络合物.
关键词:玉米芯炭铁锰氧化物负载吸附作用Pb2+
Study on the adsorption of Pb2+ by MnFeOx-loaded corncob biochar
ZHAO Tianci1
 , ZHOU Shizhen2, MA Xiaolong2, MA Zichuan1,3
, ZHOU Shizhen2, MA Xiaolong2, MA Zichuan1,3

1. College of Chemistry and Material Science, Hebei Normal University, Shijiazhuang 050024;
2. College of Life Science, Hebei Normal University, Shijiazhuang 050024;
3. Key Laboratory of Inorganic Nanomaterial of Hebei Province, Shijiazhuang 050024
Received 14 February 2019; received in revised from 14 May 2019; accepted 14 May 2019
Abstract: Magnetic MnFeOx-loaded corncob biochar (MnFeOx@CCBC) was obtained by combining two-step impregnation of corncob biochar (CCBC) with the pyrolysis of oxalate. MnFeOx@CCBC and CCBC were characterized by XRD, SEM, specific surface area as well as by the measurements of pHZPC. The results revealed that Fe-Mn binary oxide is composed of microcrystal MnFe2O4 and amorphous δ-MnO2/hydrous manganese oxide which cover uniformly on the surface of CCBC. The as-prepared MnFeOx@CCBC demonstrates a pHZPC of about 6.0 as well as a specific surface area of 3.9 m2·g-1. The adsorption dynamics and thermodynamic behavior of MnFeOx@CCBC and CCBC for Pb2+ were investigated. The results showed that the adsorption of Pb2+ by MnFeOx@CCBC or CCBC is completely consistent with the pseudo-second-order kinetics model and the Langmuir model could correctly describe the adsorption isotherms. Under the experimental conditions, MnFeOx@CCBC displayed excellent performance in both the adsorption rate and adsorption capacity towards Pb2+, in which the fitted rate constant (k2) and equilibrium adsorption capacity (qe) were 3.3-fold and 6.95-fold, respectively higher than CCBC. From Langmuir isotherms, maximum adsorption capacity (qm) of MnFeOx@CCBC and CCBC towards Pb2+ was determined at various temperatures, which indicates that qm increases with an increase in temperature, which were 99.60 mg·g-1 of MnFeOx@CCBC and 15.66 mg·g-1 of CCBC at 30 ℃. The thermodynamic parameters exhibited that the adsorption process of both materials was endothermic and entropy driven. XPS and FTIR analysis revealed that the adsorption mechanism could mainly be ascribed to the replacement of Pb2+ for H+ in Mn—OH as the predominant adsorption site of MnFeOx@CCBC to form the inner surface complexes.
Keywords: corncob biocharFe-Mn binary oxideloadadsorptionPb2+
1 引言(Introduction)由于铅金属制品及铅化合物的广泛应用, 水体铅污染情况变得日趋严峻, 对于含铅废水的处理已经成为铅应用方面的重要课题(冀泽华等, 2017).目前, 用于去除水体中Pb2+的方法主要有化学沉淀、物理过滤分离、生物富集及理化吸附等(吴沣等, 2015).在这些方法中, 吸附法因具有成本低、效能高、易操作等特点而成为人们在实际中优先考虑选用的方法, 也被认为是目前最值得研究的方法之一(Wang et al., 2011; Alam et al., 2018).常用的吸附剂如活性炭、活性沸石、树脂吸附剂等存在费用高、分离困难、易造成二次污染等缺点(王耀等, 2018), 因此, 研制经济高效的新型吸附材料备受关注.
生物炭(Biochar, BC)主要由碳、氢、氧等元素组成, 是一种含碳量高且具有高度芳香化特性的轻质炭材料, 对铅等重金属具有一定的吸附能力, 从而影响着这些污染物在环境中的分布、迁移和生物有效性(于志红等, 2014).然而, 单一的生物炭对重金属的吸附能力远不如用其它物质改性后复合材料的吸附能力, 而且改性后的生物炭基复合材料具有制备成本低、理化性质优良、结构易于调控、环境相容性好等特征, 被广泛用于铅、铜、镉等重金属的吸附处理(Liu et al., 2015; Siddiqui et al., 2019).其中, 近年来将锰氧化物用于制备各种生物炭基复合材料一直是研究热点.例如, 于志红等(2014)采用浸润法制备生物炭-锰氧化物复合材料, 证明其能够明显提升红壤对铜的吸附能力, 且吸附量随其添加量的增加而增大; Song等(2014)用不同浓度的KMnO4溶液氧化玉米秸秆炭制备了负载δ-MnO2的生物炭, 用于吸附去除水中的Cu2+, 与原始玉米秸秆炭相比, 最大吸附量由19.6 mg·g-1提高到160.3 mg·g-1, 他们认为表面所生成的低结晶度的层状结构δ-MnO2对重金属离子Cu2+具有强亲和力, 是导致玉米秸秆炭吸附能力提高的主要因素; 后来, Wang等(2015)采用Mn(Ⅱ)浸渍- Mn(Ⅶ)氧化两步法制备出负载水合氧化锰的松木生物炭(Hydrous-manganese-oxide-loaded BC), 证明所负载的水合氧化锰具有类似于δ-MnO2的层状结构, 结晶性差但含有丰富的羟基基团, 显著提高了松木生物炭对重金属离子Cu2+的吸附性能(饱和吸附量由18.13 mg·g-1提高到121.8 mg·g-1).关于Pb2+的吸附, Wang等(2015)以松木生物质为原料, 利用MnCl2溶液和δ-MnO2水悬液预浸渍-热解法分别制备了MnO和δ-MnO2修饰的生物炭基吸附剂, 研究表明, 这两种改性生物炭都提高了Pb2+吸附能力, 且δ-MnO2修饰的复合材料性能更优; 在Tan等(2018)的研究中, 用KMnO4于室温下处理稻杆生物炭合成了MnOx涂层生物炭, 发现其对Pb2+的饱和吸附量由涂层前的0.5782 mmol·g-1提高到1.4732 mmol·g-1; Faheem等(2016)用KMnO4对稻壳生物炭进行类似处理, 得到的负载MnOx的复合材料使Pb2+的饱和吸附量由14.7 mg·g-1提高到86.5 mg·g-1; Wan等(2018)的研究表明, 在花生壳生物炭表面负载一种水合氧化锰纳米颗粒(HMO)可使Pb(Ⅱ)或Cd(Ⅱ)的吸附能力提高4~6倍.可见, 针对含Pb2+废水的处理, 通过在生物炭表面负载低结晶度甚至无定形态的氧化锰制备生物炭基吸附剂可能是一种有效策略, 但仅负载单一氧化锰的生物炭不具有磁性, 仍存在着使用后难分离的问题.因此, 本文设计了一种以锰为主、同时均匀负载无定形锰铁二元金属氧化物生物炭的新策略, 旨在获得兼具高吸附容量和磁分离性能的生物炭吸附材料, 选用某公司生产的玉米芯炭(CCBC)作为载体, 制备均匀负载锰铁二元金属氧化物的玉米芯生物炭(MnFeOx@CCBC), 并研究其对重金属Pb2+的吸附效果和吸附机理.
2 材料与方法(Materials and methods)2.1 材料与仪器材料及试剂:玉米芯炭(CCBC)购自河北八度生物科技有限公司, 制炭的热解温度约为700 ℃; 四水合氯化锰(MnCl2·4H2O, AR)购于天津市大茂化学试剂厂; 硝酸(HNO3, AR)购于天津市科密欧化学试剂有限公司; 七水合硫酸亚铁(FeSO4·7H2O, AR)、草酸(C2H2O4·2H2O, AR)和硝酸铅(Pb(NO3)2, AR)均为天津市永大化学试剂有限公司生产.实验用水均为本单位自制的去离子水(电导率≤1 μS·cm-1).
仪器:OTF-1200X型管式炉; PHS-3S型pH计; HZQ-F160振荡培养箱; T6型原子吸收分光光度计.
2.2 MnFeOx@CCBC的制备借鉴文献(邹雪刚等, 2018)中描述的高温热解金属草酸盐制备介孔铁锰双金属氧化物的方法, 包括锰与铁元素配比及草酸盐分解温度条件的控制, 但针对锰铁二元金属草酸盐前驱体在CCBC表面的形成方法做了改进, 具体操作如下:①将CCBC研磨过100目筛, 称量10 g放置于坩埚内备用; 称取8.5276 g七水合硫酸亚铁和19.7840 g四水合氯化锰溶解于200 mL容量瓶中, 得到铁元素和锰元素的物质的量比为1 : 4的溶液A; 将8 mL溶液A在坩埚中等体积浸渍CCBC 0.25 h, 然后置于70 ℃的烘箱中保持12 h, 此为浸渍步骤1.②称量7.5810 g二水合草酸溶解于30 mL蒸馏水中, 取6.40 mL该草酸溶液于60 ℃下对步骤1得到的含锰铁双金属盐的生物炭进行第2步等体积浸渍, 使锰和铁反应转化为相应的草酸盐, 反应0.5 h后转移到70 ℃的烘箱中再进行12 h的烘干处理.③然后, 将其送入管式炉, 以10 ℃·min-1的速率由室温升温至300 ℃, 保持1 h, 使表面的草酸盐分解为单一或复合锰铁氧化物, 待自然冷却后取出得到的黑色固体粉末, 研磨后用去离子水洗涤至中性, 再于120 ℃下干燥, 过100目筛, 得到目标材料MnFeOx@CCBC.
采用Kubo-X1000型比表面积&孔径分析仪(北京彼奥德电子技术有限公司)测定材料的比表面积、孔容和平均孔径; 使用S-4800型冷场发射扫描电子显微镜(Hitachi Limited, Japan)观察材料的形貌, 同时利用其附带的INCA Energy 350能谱仪测定材料表面区的元素组成; 利用Nicolet 6700型傅里叶红外光谱分析仪(Theromo Fisher, America)获得试样的FTIR谱图, 采用KBr压片, 4000 ~ 400 cm-1范围; 用D8ADVANCE型X射线衍射仪(Bruker AXS, Germany)获得XRD谱图, 进行晶相分析; 磁滞回线采用振动样品磁强计(TPMS, America)测定; 采用Escalab 250Xi型光电子能谱仪(Thermo Scientific, America)表征材料表面的元素组成及其化学形态; 通过pH漂移法测定材料的等电点(pHZPC)(孙文通等, 2011).
2.3 吸附实验用硝酸铅配制质量浓度为1000 mg·L-1的Pb2+储备液, 实验中用到的其他浓度的Pb2+溶液由该储备液稀释得到.向50 mL塑料离心管中量取一定浓度的Pb2+溶液30 mL, 调节初始pH至指定值(除pH的影响实验外, 初始pH均控制为5.0), 加入准确称取的0.0200 g吸附剂样品, 之后将离心管放入振荡培养箱中, 在30 ℃、160 r·min-1条件下持续振荡一定时间.对完成吸附实验的样品取样, 过孔径为0.45 μm的微孔滤膜, 得到含Pb2+的清液, 然后采用火焰原子吸收光度计测定清液中Pb2+浓度.依照上述步骤, 将20 mg受试材料加入到pH=5.0、质量浓度为200 mg·L-1的30 mL Pb2+溶液中, 在30 ℃下测定其不同时间的过程吸附量, 进行吸附动力学实验.在固体吸附剂投加量20 mg、pH=5.0、溶液体积30 mL、振荡时间2 h的条件下, 利用浓度分别为40、60、80、100、120和200 mg·L-1的系列Pb2+溶液, 依次进行吸附剂在30、40与50 ℃下的等温吸附实验.在Pb2+初始浓度200 mg·L-1、固体投加量20 mg、体积30 mL及30 ℃条件下, 测定3种NaNO3物质的量浓度情况下(代表不同的离子强度, 分别为0、0.01和0.1 mol·L-1)的平衡吸附量与溶液初始pH的关系曲线.CCBC和MnFeOx@CCBC对Pb2+的吸附效果可用过程吸附量和平衡吸附量来表示, 计算公式如式(1)和(2)所示.
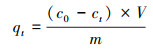 | (1) |
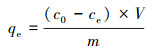 | (2) |
3 结果与讨论(Results and analysis)3.1 MnFeOx@CCBC和CCBC的表征结果3.1.1 XRD表征结果图 1为MnFeOx@CCBC和CCBC的X射线衍射图谱.由图可见, MnFeOx负载前后XRD谱图的背景噪声信号峰都比较强, 说明作为载体的CCBC属于无定形材料, 玉米芯在碳化过程中未发生石墨化转化; 其XRD谱图中均出现了两个较强、较尖锐的峰, 2θ分别为26.67°和40.56°, 这可归属于石英晶体(Quartz, JCPDS no. 0178661)(Chen et al., 2017), 这种微量的杂质无机矿物应该来自于玉米芯原料.将MnFeOx@CCBC的XRD谱图与CCBC的谱图比较还可发现, 在2θ≈28.33°处新出了一个谱峰, 非常接近立方尖晶石型MnFe2O4(220)晶面的衍射峰(JCPDS no.010640).MnFe2O4是具有良好磁性的顺磁性物质(Reddy et al., 2016), 使MnFeOx@CCBC具有磁性.图 2为MnFeOx@CCBC的磁滞回线及其被磁铁吸持分离的照片, 结果表明, MnFeOx@CCBC的饱和磁化强度(Ms)为5.03 emμ·g-1, 矫顽力(Hc)为140 Oe, 磁分离性能较好.从MnFeOx@CCBC制备条件与过程可以分析出, 在浸渍步骤1中Fe2+和Mn2+被均匀分散到CCBC粗糙表面, 在浸渍步骤2中被转化为难溶性的FeC2O4和MnC2O4, 在最后的热分解步骤中被分解氧化为锰铁氧化物, 同时部分氧化物进一步转化为磁性的MnFe2O4.按使用的原料计算, Mn和Fe两种元素在MnFeOx@CCBC中的质量分数约为2.48%, 其中, Mn与Fe的质量比为3.3 : 1.0, 原子数比为10 : 3.虽然Mn的含量高, 但MnFeOx@CCBC谱图中未出现MnOy的信号峰, 说明MnOy在CCBC表面是以无定形态存在的, 可能与以前文献报道的低结晶度层状结构的δ-MnO2或水合氧化锰相似, MnOx和Mn—OH与重金属离子(Cu2+或Pb2+)之间能形成表面络合物(Song et al., 2014; Wang et al., 2015), 因而可显著提高CCBC的吸附性能.
图 1(Fig. 1)
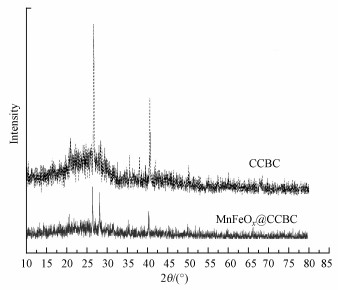 |
| 图 1 MnFeOx@CCBC和CCBC的XRD谱图 Fig. 1XRD patterns of MnFeOx@CCBC and CCBC |
图 2(Fig. 2)
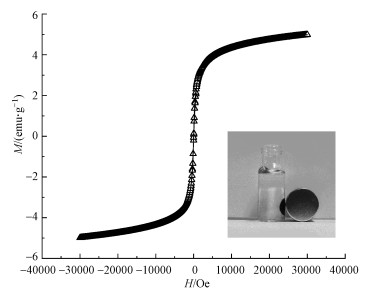 |
| 图 2 MnFeOx@CCBC的磁滞回线 Fig. 2Hysteresis loops of MnFeOx@CCBC |
3.1.2 SEM电镜表征图 3a~3d分别为不同放大倍数的材料颗粒的SEM照片.可以看出, 所制备的材料由尺寸和形貌差异都很大的不规则颗粒构成, 粒径在2~15 μm范围内, 这符合生物炭材料的普遍特征(张涵瑜等, 2016), 锰铁氧化物的负载未改变其特征, 也未观察到单独聚集态的金属氧化物颗粒存在.但从图 3e、3f给出的MnFeOx@CCBC表面区Mn与Fe的Mapping图可以判断, MnFeOx在CCBC表面呈均匀分散状态, 未见明显的聚集颗粒, 这有利于增加吸附位, 从而提高其吸附能力.
图 3(Fig. 3)
 |
| 图 3 SEM照片与mapping图 Fig. 3SEM photographs and mapping patterns |
3.1.3 BET表征结果由图 4可知, 按IUPAC的分类(近藤精一等, 2006), 氮气在CCBC和MnFeOx@CCBC上的吸附/脱附等温线属于典型的Ⅲ型等温线, 即在低相对压力区N2吸附量少, 随相对压力升高吸附量逐渐提高, 且不出现单分子吸附饱和点.MnFeOx负载于CCBC上后这种特征更为明显, N2吸附量更少.从图中的等温线还可看出, 在中间相对压力区未出现明显的回滞环.以上分析说明, CCBC和MnFeOx@CCBC既非微孔材料亦非介孔材料, 且N2与两种材料表面之间的作用力很弱(近藤精一等, 2006).由于N2是非极性分子, 说明材料表面的极性较强, MnFeOx的负载使极性变得更强, 这对以水合态或水解态存在的重金属离子(如Pb2+)的吸附是有利的(Xu et al., 2006).利用BET方程对等温吸附数据拟合处理, 得出CCBC的比表面积为17.1 m2·g-1, 复合材料MnFeOx@CCBC的比表面积减小至3.9 m2·g-1, 比表面积减小与其极性增强有关.
图 4(Fig. 4)
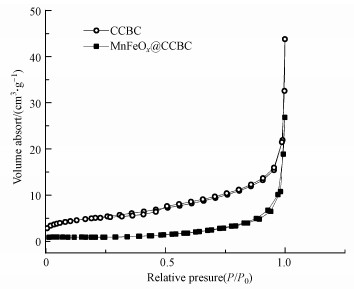 |
| 图 4 MnFeOx@CCBC和CCBC的N2吸/脱附等温线 Fig. 4N2 adsorption/desorption isotherms for of MnFeOx@CCBC and CCBC |
3.1.4 pH漂移实验表征结果MnFeOx@CCBC和CCBC的ΔpH~pH0曲线如图 5所示.由图可知, CCBC的pHZPC约为9.5, MnFeOx@CCBC的pHZPC约为6.0.由于pHZPC是指示矿物材料表面发生质子化与脱质子化反应的拐点, 也是判断表面带电性质的依据(邹雪刚等, 2018), 所以由结果可知, 在本研究所采用的Pb2+吸附条件下MnFeOx@CCBC和CCBC都是带正电荷的, 这就限制了Pb2+以静电作用机制进行吸附.与CCBC相比, MnFeOx@CCBC的pHZPC降低了3.5, 反映出其表面含可解离H+的基团(如—OH、—COOH)数量明显提高, 这有利于重金属离子以离子交换机制(与H+)或络合机制发生吸附(Xu et al., 2006).
图 5(Fig. 5)
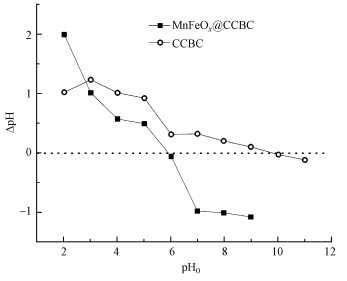 |
| 图 5 MnFeOx@CCBC和CCBC的ΔpH~pH0曲线 Fig. 5ΔpH~pH0 curves of MnFeOx@CCBC and CCBC |
3.2 MnFeOx@CCBC和CCBC的吸附动力学30 ℃下的吸附动力学曲线如图 6所示, 可以看出, MnFeOx@CCBC对Pb2+的吸附速率和吸附量都明显优于CCBC.从MnFeOx@CCBC吸附Pb2+过程来看, 可以大致分为3个阶段:快吸附阶段(0~10 min)、慢吸附阶段(10~60 min)和近平衡阶段(>60 min).在快吸附阶段, 过程吸附量随时间的增加而迅速增大, 10 min时吸附量达到85.24 mg·g-1.此后, 过程吸附量随时间的延长而慢速增长, 至60 min达到接近平衡的状态, 吸附量为97.32 mg·g-1; 而后进入近平衡阶段, 吸附量略有增长或波动变化, 但80 min可以达到稳定的平衡态, 平衡吸附量为98.74 mg·g-1.而CCBC对Pb2+的平衡吸附量仅为11.70 mg·g-1, 在该条件下MnFeOx@CCBC的Pb2+吸附量比CCBC大7.43倍.
图 6(Fig. 6)
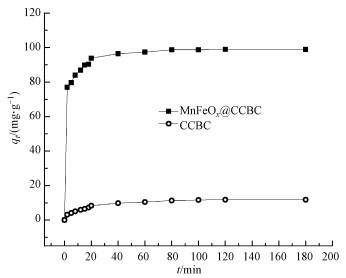 |
| 图 6 MnFeOx@CCBC和CCBC对Pb2+的吸附动力学实验曲线 Fig. 6Kinetic experimental results of Pb2+ adsorption onto MnFeOx@CCBC and CCBC |
为了阐明负载MnFeOx对CCBC吸附Pb2+动力学行为与机制的影响, 尝试使用准一级动力学方程(3)、准二级动力学方程(4)和粒子内扩散模型方程(5)对吸附过程进行阶段(含快吸附和慢吸附阶段)数据的拟合处理.
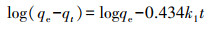 | (3) |
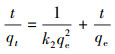 | (4) |
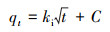 | (5) |
图 7(Fig. 7)
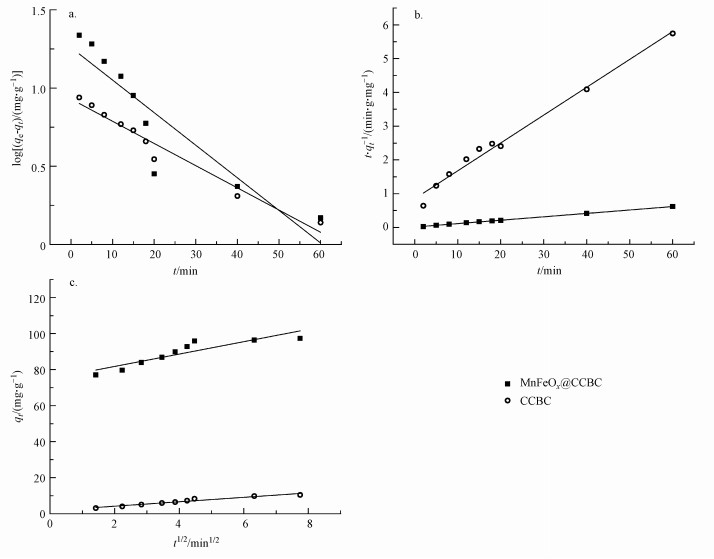 |
| 图 7 MnFeOx@CCBC和CCBC吸附Pb2+的动力学模型拟合曲线(a.准一级动力学模型, b.准二级动力学模型, c.粒子内扩散模型) Fig. 7Kinetic fitting results of Pb2+ adsorption onto MnFeOx@CCBC and CCBC |
表 1(Table 1)
| 表 1 吸附动力学拟合结果 Table 1 Adsorption kinetic fitting results | |||||||||||||||||||||||||||||||||||||||||||
表 1 吸附动力学拟合结果 Table 1 Adsorption kinetic fitting results
| |||||||||||||||||||||||||||||||||||||||||||
3.3 MnFeOx@CCBC和CCBC的等温吸附MnFeOx@CCBC及CCBC在30、40与50 ℃下的等温吸附曲线见图 8a与8b.由图可知, 各温度下MnFeOx@CCBC对Pb2+的平衡吸附量远高于CCBC, 但平衡吸附量随温度及随溶液中Pb2+平衡浓度的变化趋势相似, 即材料的吸附量都随温度的升高而增加, 随平衡浓度的增大而增加并趋于最大值(饱和吸附量).但对于MnFeOx@CCBC吸附剂, 当平衡浓度低于50 mg·L-1时, 随着Pb2+平衡浓度的增加其平衡吸附量陡直地增大, 等温线斜率很大, 随着Pb2+平衡浓度的继续增大其平衡吸附量变化很小; 然而, 在CCBC作吸附剂的情况下, 在很大的浓度范围内(< 120 mg·L-1)其平衡吸附量随Pb2+平衡浓度的增大而缓慢增加.
图 8(Fig. 8)
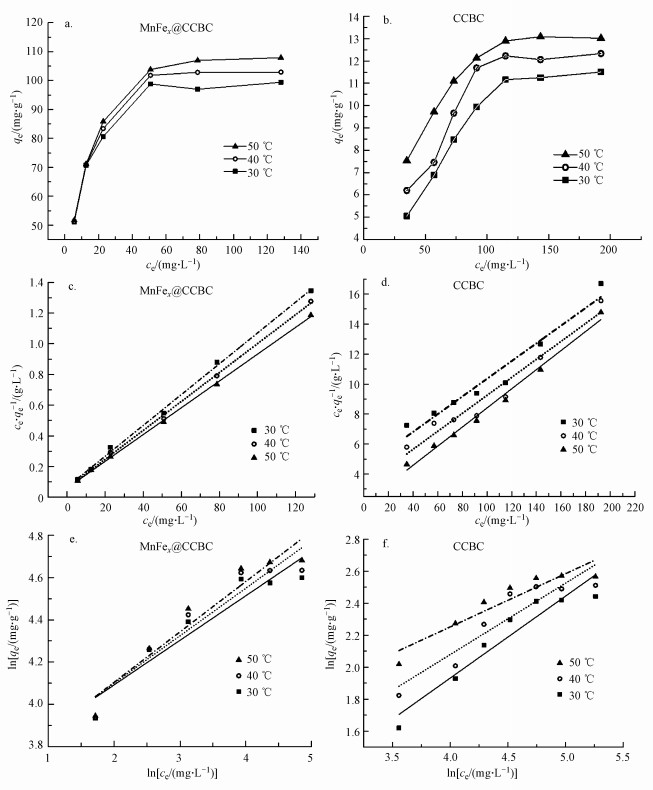 |
| 图 8 MnFeOx@CCBC和CCBC对Pb2+的吸附等温线(a, b)和Langmuir(c, d)与Freundlich(e, f)模型拟合结果 Fig. 8Adsorption isotherms of Pb2+ on MnFeOx@CCBC and CCBC(a, b), fitting results via Langmuir model (c, d) and Freundlich model(e, f) |
通常, 在固液吸附体系中的等温吸附过程遵循Langmuir或Freundlich模型方程, 其线性方程见公式(6)和(7), 其中, qm为单层饱和吸附量, KL为朗格缪尔吸附常数, KF和n均为Freundlich吸附常数.根据这两个方程分别绘制两种吸附剂的拟合Langmuir直线(图 8a、8b)和Freundlich直线(图 8c、8d), 得到的拟合结果见表 2.由图 8及表 2可见, Langmuir方程更适合描述不同温度(30、40、50 ℃)下Pb2+与MnFeOx@CCBC及CCBC之间的吸附作用, 可决系数R2都大于0.95, 特别是Pb2+在MnFeOx@CCBC表面吸附作用的R2达到0.99以上, 反映出Pb2+在MnFeOx@CCBC表面接近单层均匀吸附.在30、40与50 ℃下, MnFeOx@CCBC对Pb2+的饱和吸附量分别为99.60、106.16和114.55 mg·g-1, 而CCBC对Pb2+的饱和吸附量分别为15.66、16.66和16.93 mg·g-1, 证明MnFeOx的负载显著提升了CCBC对Pb2+的吸附能力, 增大幅度约为6.5倍.由于CCBC对Pb2+的吸附量很低, 而锰氧化物对Pb2+的吸附量很高(Xu et al., 2013; Zhang et al., 2017), 推测MnFeOx@CCBC对Pb2+的主要吸附位处于无定型MnFeOx部分, 故即使复合物的比表面降低很多, 其吸附量依然很高.
表 2(Table 2)
| 表 2 Langmuir和Freundlich模型拟合参数 Table 2 Parameters of Langmuir and Freundlich isotherms | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 Langmuir和Freundlich模型拟合参数 Table 2 Parameters of Langmuir and Freundlich isotherms
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
从Freundlich吸附常数n的数值判断, CCBC吸附Pb2+为非优惠型吸附(n<1), MnFeOx@CCBC吸附Pb2+则为优惠型吸附(n>1)(Luo et al., 2004).此外, 由表 3可见, MnFeOx@CCBC的吸附性能优于文献报道的一些吸附剂.
表 3(Table 3)
| 表 3 一些吸附剂对Pb2+吸附效果的比较 Table 3 Comparison of adsorption capacities of reported Pb2+ removal with some adsorbents | ||||||||||||||||||||||||
表 3 一些吸附剂对Pb2+吸附效果的比较 Table 3 Comparison of adsorption capacities of reported Pb2+ removal with some adsorbents
| ||||||||||||||||||||||||
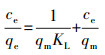 | (6) |
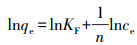 | (7) |
表 4(Table 4)
| 表 4 MnFeOx@CCBC和CCBC与Pb2+作用的吸附热力学函数 Table 4 Thermodynamic parameters for Pb2+ sorption on MnFeOx@CCBC and CCBC | |||||||||||||||||||||||||||||||||||||||
表 4 MnFeOx@CCBC和CCBC与Pb2+作用的吸附热力学函数 Table 4 Thermodynamic parameters for Pb2+ sorption on MnFeOx@CCBC and CCBC
| |||||||||||||||||||||||||||||||||||||||
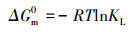 | (8) |
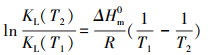 | (9) |
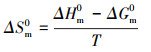 | (10) |
图 9(Fig. 9)
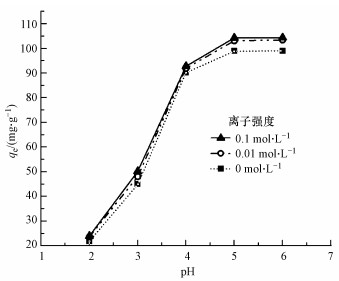 |
| 图 9 pH及离子强度对MnFeOx@CCBC吸附Pb2+的影响 Fig. 9Effects of pH and ionic strength on the adsorption of Pb2+ by MnFeOx@CCBC |
3.5.2 X射线光电子能谱分析通过比较Pb2+吸附前后MnFeOx@CCBC的XPS变化, 有助于明确Pb2+与MnFeOx@CCBC的表面作用机理.图 10 a为MnFeOx@CCBC和Pb-MnFeOx@CCBC的宽扫谱图, 图 10b和10c分别为Fe 2p与Mn 2p电子的窄扫谱图, 图 10d、10e分别显示出了MnFeOx@CCBC和Pb-MnFeOx@CCBC的O 1s窄扫谱及其最优拟合分峰结果.表 5列出了从上述图中提取到的各元素主峰峰位(结合能)、峰面积及由此计算得到的表面原子组成比, 特别是在表的末行列出了各元素吸附后主峰面积与吸附前的比值(FA), 以此反映Pb2+吸附的作用结果.结果表明:吸附前MnFeOx@CCBC检测出的元素包括C、O、Mn、Fe、Si、S、Cl和Na, 作为载体的C原子含量最高; 由于生物炭表面含有丰富的含氧基团且Mn、Fe以氧化物形态存在(Deng et al., 2011), 所以O原子含量次于C; Mn和Fe是以氧化物形态负载到表面的, 其含量可预期、可调控; 同时检测到少量Si原子存在, 这与前面XRD分析的含少量石英晶体的结果一致; S、Cl和Na来自于负载使用的原料.吸附后Pb-MnFeOx@CCBC检测出的元素包括C、O、Mn、Fe、Si、S、Cl、Na和Pb, 与吸附前相比多检测出Pb的存在, 说明MnFeOx@CCBC表面吸附了Pb2+ (Wang et al., 2015); 其它元素原子比的变化显然与Pb2+吸附有关, 若仅考虑Pb2+吸附引起的稀释效应, 各元素的原子比都应该发生小幅度降低, 然而, 结果显示C、Mn、Cl和Na 4种元素含量降低, 而O、Fe、Si和S这4种元素含量增高.比较表 5中的FA值可直观地发现, C原子比小幅降低, 可用稀释效应原理解释; Cl和Na两元素的原子比呈较大幅度的降低, 这可能主要是由Cl-和Na+易于溶解引起的; Mn原子比大幅度降低, 从Pb-MnFeOx@CCBC的Mn 2p电子窄扫谱图上几乎检测不到明显的峰(图 10c), 说明Mn—OH是主要吸附位, 吸附态的Pb严重阻挡了入射电子与Mn原子核外电子碰撞的机会, 导致其谱峰明显减弱; 它与Pb2+作用时先发生离子交换, 释放H+, 进而与Mn—O—基团形成单齿或双齿内层络合物, 其吸附反应方程式可表示为式(11)和(12)(邹雪刚等, 2018).
图 10(Fig. 10)
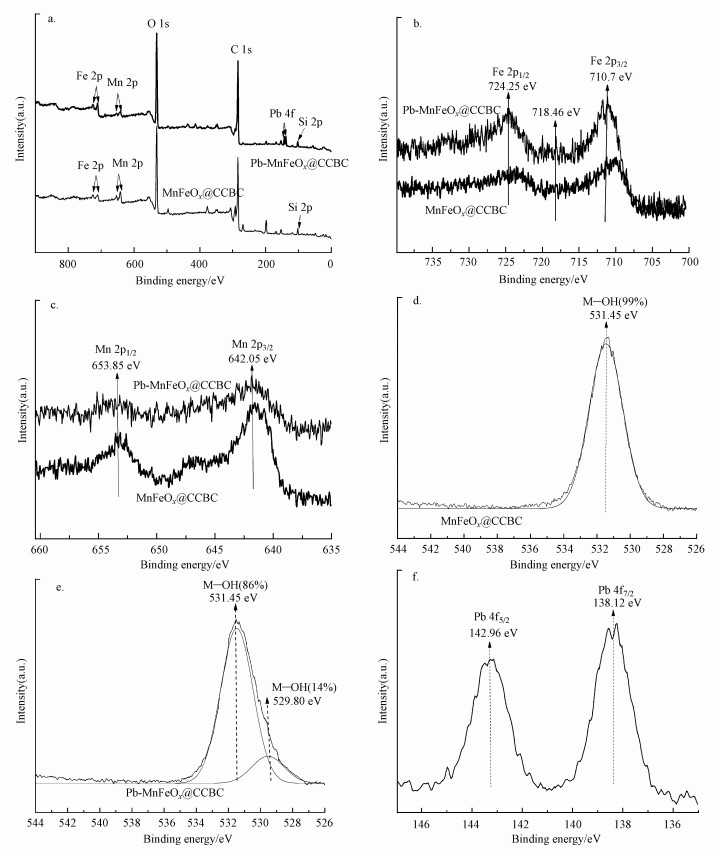 |
| 图 10 Pb2+在MnFeOx@CCBC表面吸附前后的XPS宽扫谱图(a)及Fe 2p(b)和Mn2p(c)的窄扫谱图、O 1s分峰拟合图(d, e)、Pb 2p窄扫谱图(f) Fig. 10Full-range XPS spectra of MnFeOx@CCBC before and after adsorption of Pb2+ (a), Fe 2p(b) and Mn 2p(c) spectra of MnFeOx@CCBC before and after adsorption of Pb2+, O 1s spectra of MnFeOx@CCBC before(e) and after (d) adsorption of Pb2+, Pb 4p spectra of MnFeOx@CCBC after adsorption of Pb2+(f) |
表 5(Table 5)
| 表 5 MnFeOx@CCBC吸附前后的XPS谱图参数 Table 5 XPS spectral parameters before and after MnFeOx@CCBC adsorption | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 5 MnFeOx@CCBC吸附前后的XPS谱图参数 Table 5 XPS spectral parameters before and after MnFeOx@CCBC adsorption
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
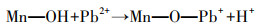 | (11) |
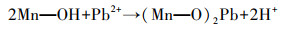 | (12) |
3.5.3 红外光谱分析图 11为MnFeOx@CCBC和吸附Pb2+后(表示为MnFeOx@CCBC-Pb)样品的FTIR谱图.比较发现, 中心位置在3433 cm-1处有一宽而强的峰, 吸附后保持不变, 归属为表面化学吸附水的H—O—H伸缩振动(Wen et al., 2014), 但因H—O—H弯曲振动产生的谱峰由1650 cm-1变到1600 cm-1, 反映出Pb2+吸附引起吸附剂表面状态发生改变; 吸附前MnFeOx@CCBC在1590~1050 cm-1区间有多个反映M—OH(M为Fe/Mn)弯曲振动的指纹峰, 包括中心位置约为1540、1460、1420、1400、1320和1100 cm-1的谱峰, 吸附后大部分谱峰都消失, 只在1290 cm-1和1075 cm-1处检测到两个较弱的峰, 这可解释为发生吸附时MnFeOx@CCBC表面的M—OH中的H+可能被Pb(Ⅱ)所置换, 进而形成内层表面络合物, 与前面提出的吸附反应方程式(11)和(12)一致; 图中796 cm-1和778 cm-1处的弱峰为石英相SiO2的特征谱峰(梅艳等, 2016), 这与XRD和XPS均能检测到硅化合物存在相一致; 另外, 520 cm-1附近有一个弱吸收的宽谱带, 应归属为Mn—O和Fe—O的振动峰(Ren et al., 2012).以上分析表明, MnFeOx@CCBC与Pb2+之间发生化学吸附, 其主要吸附位是表面的Mn—OH, 吸附机理为离子交换与内层络合协同作用, 这与前面pH、离子强度等影响因素分析及XPS表征分析结果相吻合.以前的研究也指出, 表面羟基在重金属阳离子吸附时能起到配位络合作用(Oyedoyin Adeeyo et al., 2014).
图 11(Fig. 11)
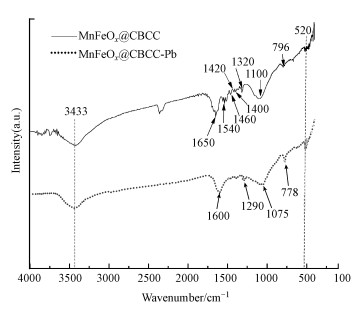 |
| 图 11 MnFeOx@CCBC和MnFeOx@CCBC-Pb的红外光谱 Fig. 11FTIR Spectra of MnFeOx@CCBC and MnFeOx@CCBC-Pb |
4 结论(Conclusions)1) 采用两步浸渍-草酸盐热解法成功制备出均匀负载铁锰氧化物的磁性玉米芯炭(MnFeOx@CCBC), 该材料表面由MnFe2O4和无定形态的δ-MnO2或水合氧化锰组成, 表面极性强, pHZPC约为6.0, 比表面积为3.9 m2·g-1.
2) 在pH=5.0、初始浓度200 mg·L-1及30 ℃条件下, MnFeOx@CCBC对Pb2+的吸附速率和吸附量都明显优于原始玉米芯炭(CCBC), 吸附过程符合准二级动力学方程.与CCBC相比, MnFeOx@CCBC吸附Pb2+的准二级动力学速率常数增大了2.3倍, 理论平衡吸附量增大了5.95倍, 吸附过程主要受化学吸附控制.
3) MnFeOx@CCBC和CCBC对Pb2+的等温吸附符合Langmuir等温吸附模型, 吸附过程为单层均匀吸附, 30 ℃及pH为5.0条件下的饱和吸附量分别为99.60和15.66 mg·g-1, 并随温度的升高而略有增加, 热力学参数表明对Pb2+的吸附过程是熵驱动和吸热的.
4) 实验证明MnFeOx@CCBC的主要吸附位是Mn—OH, 其吸附机理主要是Pb2+对Mn—OH中H+的置换, 并形成内层表面络合物.
参考文献
| Alam M S, Gorman-Lewis D, Chen N, et al. 2018. Thermodynamic analysis of nickel (Ⅱ) and zinc (Ⅱ) adsorption to biochar[J]. Environmental Science & Technology, 52(11): 6246–6255. |
| Chen C, Xu W Z, Charpentier P A. 2017. SiO2 encapsulated TiO2 nanotubes and nanofibers for self-cleaning polyurethane coatings[J]. Journal of Photochemistry and Photobiology A:Chemistry, 348: 226–237.DOI:10.1016/j.jphotochem.2017.08.014 |
| Deng S, Liu H, Zhou W, et al. 2011. Mn-Ce oxide as a high-capacity adsorbent for fluoride removal from water[J]. Journal of Hazardous Materials, 186(2/3): 1360–1366. |
| El-Wakeel S T, El-Tawil R S, Abuzeid H A M, et al. 2017. Synthesis and structural properties of MnO2 as sorbent for the removal of lead (Pb2+) from aqueous solution[J]. Journal of the Taiwan Institute of Chemical Engineers, 72: 95–103.DOI:10.1016/j.jtice.2017.01.008 |
| Faheem, Yu H, Liu J, et al. 2016. Preparation of MnOx-loaded biochar for Pb2+ removal:Adsorption performance and possible mechanism[J]. Journal of the Taiwan Institute of Chemical Engineers, 66: 313–320.DOI:10.1016/j.jtice.2016.07.010 |
| Gupta V K, Rastogi A. 2008. Biosorption of lead from aqueous solutions by green algae Spirogyra species:kinetics and equilibrium studies[J]. Journal of Hazardous Materials, 152(1): 407–414.DOI:10.1016/j.jhazmat.2007.07.028 |
| 近藤精一, 石川达雄, 安部郁夫.2006.吸附科学[M].李国希, 译.北京: 化学工业出版社.17-34 |
| 冀泽华, 冯冲凌, 李刘刚. 2017. 粟米糠吸附Pb2+的关键因素交互效应及吸附机理研究[J]. 环境化学, 2017, 36(1): 123–132. |
| Liu H, Sun X, Yin C, et al. 2008. Removal of phosphate by mesoporous ZrO2[J]. Journal of Hazardous Materials, 151(2): 616–622.DOI:10.1016/j.jhazmat.2007.06.033 |
| Liu W J, Jiang H, Yu H Q. 2015. Development of biochar-based functional materials:toward a sustainable platform carbon material[J]. Chemical Reviews, 115(22): 12251–12285.DOI:10.1021/acs.chemrev.5b00195 |
| Luo X, Wang C, Luo S, et al. 2004. Adsorption of As (Ⅲ) and As(Ⅴ) from water using magnetite FeO-reduced graphite oxide-MnO nanocomposites[J]. Chemical Engineering Journal, 99(2): 45–52.DOI:10.1016/j.cej.2012.01.073 |
| 梅艳, 贾曦, 安彩虹, 等. 2016. 镶嵌纳米晶硅的氧化硅薄膜微观结构调整及其光吸收特性[J]. 材料科学与工程学报, 2016, 34(5): 776–779+793. |
| Oyedoyin Adeeyo R, Bello O S. 2014. Use of Composite Sorbents for the removal of copper (Ⅱ) ions from aqueous solution[J]. Pakistan Journal of Analytical & Environmental Chemistry, 15(2): 1–12. |
| Ourbeyram S. 2016. Effective removal of heavy metals from aqueous solutions by graphene oxide-zirconium phosphate (GO-Zr-P) nanocomposite[J]. Industrial & Engineering Chemistry Research, 55(19): 5608–5617. |
| Rehman M U, Rehman W, Waseem M, et al. 2018. Adsorption of Pb2+ ions on novel ternary nanocomposite of tin, iron and titania[J]. Materials Research Express, 5(2): 1–10. |
| Reddy D H K, Yun Y S. 2017. Spinel ferrite magnetic adsorbents:Alternative future materials for water purification[J]. Coordination Chemistry Reviews, 315: 90–111.DOI:10.1016/j.ccr.2016.01.012 |
| Ren Y, Yan N, Feng J, et al. 2012. Adsorption mechanism of copper and lead ions onto graphene nanosheet/δ-MnO2[J]. Materials Chemistry & Physics, 136(2/3): 538–544.DOI:10.1016/j.matchemphys.2012.07.023 |
| Sari A, Tuzen M, Citak D, et al. 2007. Adsorption characteristics of Cu(Ⅱ) and Pb (Ⅱ) onto expanded perlite from aqueous solution[J]. Journal of Hazardous Materials, 148(1/2): 387–394. |
| Siddiqui M T H, Nizamuddin S, Baloch H A, et al. 2019. Fabrication of advance magnetic carbon nano-materials and their potential applications:A review[J]. Journal of Environmental Chemical Engineering, 7: 1–11. |
| Song Z G, Lian F, Yu Z, et al. 2014. Synthesis and characterization of a novel MnOx-loaded biochar and its adsorption properties for Cu2+ in aqueous solution[J]. Chemical Engineering Journal, 242(15): 36–42.DOI:10.1016/j.cej.2013.12.061 |
| 孙文通, 王仕兴, 张晓红, 等. 2011. 层层自组装修饰磁性纳米粒子及蛋白质吸附研究[J]. 环境科学学报, 2011, 31(3): 351–355. |
| Tan G, Wu Y, Liu Y, et al. 2018. Removal of Pb (Ⅱ) ions from aqueous solution by manganese oxide coated rice straw biochar - A low-cost and highly effective sorbent[J]. Journal of the Taiwan Institute of Chemical Engineers, 84: 85–92.DOI:10.1016/j.jtice.2017.12.031 |
| Wan S, Wu J, Zhou S, et al. 2018. Enhanced lead and cadmium removal using biochar-supported hydrated manganese oxide(HMO) nanoparticles:Behavior and mechanism[J]. Science of the Total Environment, 616: 1298–1306.DOI:10.1016/j.scitotenv.2017.10.188 |
| Wang C P, Wu J Z, Sun H W, et al. 2011. Adsorption of Pb(Ⅱ) ion from aqueous solutions by tourmaline as a novel adsorbent[J]. Industrial & Engineering Chemistry Research, 50(14): 8515–8523.DOI:10.1021/ie102520w |
| Wang M C, Sheng G D, Qiu Y P, et al. 2015. A novel manganese-oxide/biochar composite for efficient removal of lead(Ⅱ) from aqueous solutions[J]. International Journal of Environmental Science and Technology, 12(5): 1719–1726.DOI:10.1007/s13762-014-0538-7 |
| Wang P, Du M, Zhu H, et al. 2015. Structure regulation of silica nanotubes and their adsorption behaviors for heavy metal ions:pH effect, kinetics, isotherms and mechanism[J]. Journal of Hazardous Materials, 286: 533–544.DOI:10.1016/j.jhazmat.2014.12.034 |
| Wang S, Gao B, Li Y, et al. 2015. Manganese oxide-modified biochars:preparation, characterization, and sorption of arsenate and lead[J]. Bioresource Technology, 181: 13–17.DOI:10.1016/j.biortech.2015.01.044 |
| Wen Z, Zhang Y, Dai C, et al. 2014. Synthesis of ordered mesoporous iron manganese bimetal oxides for arsenic removal from aqueous solutions[J]. Microporous & Mesoporous Materials, 200: 235–244. |
| 王耀, 段正洋, 石康伟, 等. 2018. 锰铁氧体/生物炭的制备及其对Pb2+吸附性能的研究[J]. 化工新型材料, 2018, 46(12): 209–213. |
| 吴沣, 郝瑞霞, 鲁安怀, 等. 2015. 塔宾曲霉的生物学特征及其对环境中Pb2+的固定作用研究[J]. 环境科学学报, 2015, 35(1): 144–151. |
| Xu Y, Axe L, Yee N, et al. 2006. Bidentate complexation modeling of heavy metal adsorption and competition on goethite[J]. Environmental Science & Technology, 40(7): 2213–2218. |
| 于志红, 谢丽坤, 刘爽, 等. 2014. 生物炭-锰氧化物复合材料对红壤吸附铜特性的影响[J]. 生态环境学报, 2014, 23(5): 897–903.DOI:10.3969/j.issn.1674-5906.2014.05.026 |
| 邹雪刚, 吕文英, 王雅兰, 等. 2018. 介孔铁锰双金属氧化物对Pb2+的吸附及其机理研究[J]. 环境科学学报, 2018, 38(3): 982–992. |
| Zhang H, Wu A, Fu H, et al.2006.2017.Efficient removal of Pb (Ⅱ) ions using manganese oxides: the role of crystal structure[J].RSC Advances, 7: 41228-41240 |
| 张涵瑜, 王兆炜, 高俊红, 等. 2016. 芦苇基和污泥基生物炭对水体中诺氟沙星的吸附性能[J]. 环境科学学报, 2016, 37(2): 689–696. |
