 , 罗力1,3, 陈卫锋1,2, 倪进治1,2
, 罗力1,3, 陈卫锋1,2, 倪进治1,2
 , 魏然2,3
, 魏然2,3

1. 福建师范大学地理研究所, 福州 350007;
2. 福建师范大学福建省植物生理生态重点实验室, 福州 350007;
3. 福建师范大学地理科学学院, 福州 350007
收稿日期: 2018-06-02; 修回日期: 2018-07-03; 录用日期: 2018-07-03
基金项目: 国家自然科学基金(No.41671326);福建省公益类科研院所基本科研专项(No.2015R1034-3,2016R1032-4)
作者简介: 杨美玉(1994-), 女, E-mail:372780981@qq.com
通讯作者(责任作者): 倪进治(1971—), 男, 研究员, 博士, 从事土壤化学和土壤污染修复方面的研究, E-mail:nijz@fjnu.edu.cn
魏然(1974—), 女, 副教授, 从事污染生态学方面的研究, E-mail:rwei@fjnu.edu.cn
摘要: 污泥农用是三氯生(TCS)进入土壤的一个主要途径,TCS进入土壤后会通过食物链危及人体健康.基于此,本实验将含有TCS的污泥施入土壤后,分别添加不同比例(1%、2%和5%)在300℃和600℃下制备的生物炭(BC300和BC600),进行了为期90 d种植黄瓜的盆栽实验,研究了生物炭对土壤中TCS生物有效性和微生物群落结构的影响.结果表明,生物炭的添加显著降低了黄瓜根系对TCS的富集(p < 0.05),且生物炭添加量越多,根系富集的TCS量越少.添加1%和2% BC600处理的黄瓜根系富集的TCS量都显著低于添加相应比例BC300处理的黄瓜根系富集量.只添加生物炭并不能显著降低土壤中TCS的含量,添加生物炭并种植黄瓜能够显著降低土壤中TCS含量(去除率为31.57%~50.31%),且生物炭添加量越多,土壤中TCS去除率越高,但相同添加量下BC300和BC600对土壤中TCS的去除无显著性差异(p > 0.05).添加不同比例的生物炭对土壤中微生物群落结构有明显的影响,特别是添加不同比例的BC600,但种植黄瓜能够降低生物炭对土壤微生物群落结构改变的影响.
关键词:生物炭三氯生生物有效性微生物群落结构磷脂脂肪酸(PLFAs)
Effects of biochars on the bioavailability of triclosan and microbial community structure in the soil amended with sewage sludge
YANG Meiyu1,3
 , LUO Li1,3, CHEN Weifeng1,2, NI Jinzhi1,2
, LUO Li1,3, CHEN Weifeng1,2, NI Jinzhi1,2
 , WEI Ran2,3
, WEI Ran2,3

1. Institute of Geography, Fujian Normal University, Fuzhou 350007;
2. Fujian Provincial Key Laboratory for Plant Eco-physiology, Fujian Normal University, Fuzhou 350007;
3. School of Geographical Science, Fujian Normal University, Fuzhou 350007
Received 2 June 2018; received in revised from 3 July 2018; accepted 3 July 2018
Supported by the National Natural Science Foundation of China(No.41671326) and the Basic Scientific Research Special Project for Research Institutes of Fujian Province(No.2015R1034-3, 2016R1032-4)
Biography: YANG Meiyu(1994—), female, E-mail:372780981@qq.com
*Corresponding author: NI Jinzhi, E-mail:nijz@fjnu.edu.cn
WEI Ran, E-mail:rwei@fjnu.edu.cn
Abstract: Agricultural soil amended with sewage sludge is one of the main pathways of triclosan (TCS) entering into soil. TCS in soil can do great harm to human health through food chain. Biochar produced at 300℃ and 600℃ (BC300 and BC600) were added to the sewage sludge amended soil at the application rates of 1%, 2% and 5%, respectively. The effects of biochars on the bioavailability of TCS in soil and soil microbial community structures were then studied by pot experiments with and without planting cucumber for 90 days. The results show that biochars addition significantly reduced the accumulation of TCS in cucumber roots (p < 0.05), the concentration of which was lower at the dosage of 1% and 2% for BC600 than that for BC300. Singificant decrese of TCS concentration in soil cannot be accomplished only by amending biochar, and needs planting cucumber as well, which obtained 31.57% to 50.31% of TCS removal rate, regardless amending BC300 and BC600 (p > 0.05). Soil microbial community structure was significantly influenced by the addition of biochars with different dosage, especially for BC600, however, this influence can be alleviated by planting cucumber.
Keywords: biochartricolsanbioavailabilitymicrobial community structurePLFAs
1 引言(Introduction)三氯生(Triclosan, TCS)作为药品和个人护理品(PPCPs)中常见的杀菌消毒剂而被广泛应用, 目前, 越来越多的环境介质和生物体中可以检出TCS的存在(Singer et al., 2002).作为PPCPs典型代表污染物之一, TCS具有较高的亲脂性, 在水中的溶解度较低且具有较大的表面张力, 被土壤或沉积物吸附后很难自然消解(Kommalapati et al., 1997;Verma et al., 2010; Cha et al., 2010).有研究表明, TCS对人体内分泌系统有干扰效应(Foran et al., 2000), 会引起人体肝细胞DNA损伤(李林朋等, 2010), 且TCS在水体中光解后生成的副产物(如二

生物炭作为一种新型环境功能材料, 具有发达的孔隙结构和较大的比表面积, 将其添加到土壤中后可以降低污染物在土壤中的化学活性和生物毒性(Cornelissen et al., 2004;Lian et al., 2017).目前, 生物炭已被广泛用于治理持久性有机污染物(POPs), 如多环芳烃(PAHs)、多氯联苯(PCBs)和石油烃等的污染(Zhou et al., 2005; Ghosh et al., 2011).Yang等(2010)研究发现, 向污染土壤中添加生物炭可减少植物对杀虫剂的吸收与积累.生物炭的添加还能够改变土壤的理化性质, 提高土壤阳离子交换量(CEC)、pH值, 改善农作物生长环境(Kasozi et al., 2010);并且有利于土壤团聚体的形成, 使土壤或生物炭对POPs的锁定作用加强, 限制其迁移转化, 降低POPs的生物有效性(王萌萌等, 2013).另外, 生物炭能够为土壤微生物提供生长所需的碳源与能量, 加速微生物的新陈代谢, 进而提高微生物对POPs的降解能力(Wang et al., 2017; Anyika et al., 2015).性质不同的生物炭对POPs环境行为的影响机制不同, Ni等(2017)研究发现, 向土壤中分别添加两种不同生物炭都能减少胡萝卜根系对土壤中PAHs的富集, 但两种生物炭的作用机制不同, 700 ℃制备的竹炭主要是对土壤中的PAHs产生固定作用, 而300 ℃制备的玉米秸秆炭主要是提高了微生物对土壤中PAHs的降解作用.
本课题组前期研究表明, 低温(300 ℃)热解制备的生物炭含有未炭化的有机质, 对TCS的吸附以分配作用为主;高温(600 ℃)热解制备的生物炭具有较大的比表面积, 对TCS的吸附以表面吸附为主, 并且土壤对TCS的吸附量随生物炭添加比例的增加而增加(罗力等, 2017).然而, 有关生物炭添加能否降低土壤中TCS的生物有效性, 以及生物炭的添加对土壤微生物生态的影响还有待探究.因此, 本文以模拟污泥农用后土壤中的TCS为研究对象, 向土壤中添加不同温度下制备的互花米草生物炭, 通过种植黄瓜的盆栽实验, 研究生物炭对污泥农用土壤中TCS生物有效性的影响.同时, 利用磷脂脂肪酸(PLFAs)生物标记法研究土壤中微生物群落结构的变化, 以期为TCS污染土壤的生态风险评价及其原位修复提供理论依据.
2 材料与方法(Materials and methods)2.1 材料供试土壤采自福州闽侯大学城水稻土表层土壤(0~20 cm), 新鲜土样采回后, 除去石子和植物残体, 风干后过2 mm筛.土壤pH值用哈希pH计(配PHC301玻璃复合电极)测定, 水土比为2.5:1;土壤粒径分布采用马尔文激光粒度仪2000型进行测定.土壤的pH值为6.02, 有机碳和全氮的含量分别为7.48 g·kg-1和1.12 g·kg-1.土壤粒径组成中砂粒(> 50 μm)含量为25.58%, 粉粒(2~50 μm)含量为47.93%, 黏粒(< 2 μm)含量为26.49%.实验所需污泥采自福州市祥坂污水处理厂中的沉淀池, 新鲜样品运回实验室后置于-20 ℃冰箱冷冻保存.使用前用冷冻干燥机冻干, 除去杂质研磨后过60目筛,储存于干燥器中备用, 测得污泥(干重)中TCS含量为5.87 mg·kg-1.
生物炭的原料为互花米草, 采自福州闽江口湿地.利用管式炉(江苏前锦炉业, O-KTF1200)制备生物炭, 在持续通入高纯N2条件下, 分别于300 ℃或600 ℃时恒温热解2 h, 制备的生物炭分别表示为BC300和BC600, 将生物炭研磨过60目筛, 密封存储于棕色瓶中备用.向0.5 g生物炭中加入50 mL超纯水, 摇匀后静置过滤, 测定生物炭pH值.生物炭中C、H、N的百分含量用元素分析仪(ThermoFinnigan, Flash EA 1112)测定, O元素含量由生物炭总量减去C、H、N元素和灰分的含量后计算得到.生物炭的比表面积(SA)用NOVA-2000E表面分析仪测定, 计算BET-N2比表面积.生物炭的理化性质见表 1.
表 1(Table 1)
| 表 1 生物炭的性质 Table 1 Selected properties of biochar | ||||||||||||||||||||||||||||||
表 1 生物炭的性质 Table 1 Selected properties of biochar
| ||||||||||||||||||||||||||||||
盆栽植物为荷兰迷你水果黄瓜(Cucumis sativus Linn), 购于北京金土地农业技术研究所.
2.2 盆栽实验向约450 g土壤(根据需要添加生物炭的量,土样相应减少,使土样和生物炭总量为450 g)中加入50 g污泥(干重), 再分别添加BC300或BC600生物炭, 添加比例分别为0、1%、2%和5%, 使每盆中的样品总量为500 g.将污泥、生物炭与土壤混合均匀后装入陶瓷花盆(盆高为9.0 cm, 盆口和底部直径分别为13.5 cm和8.0 cm), 调节含水量为田间持水量的60%, 置于温室平衡稳定2周.将黄瓜种子撒在去离子水浸润的滤纸上催芽, 待种子发芽后移栽, 播种深度2~3 cm, 每盆8株, 盆栽时间为90 d, 设置种植和未种植黄瓜2个处理, 每个处理3个重复.盆栽实验结束后, 收集黄瓜地上部分和地下部分, 用去离子水清洗干净, 冷冻干燥后称重, 最后将样品粉碎过60目筛用于TCS的检测.同时收集花盆中全部土壤, 混匀后取出一部分冷冻干燥后过60目筛, 用于TCS的检测, 另一部分直接过2 mm筛, -80 ℃保存用于PLFA测定.
2.3 土壤与植物中TCS的提取与定量土壤、植物和污泥中TCS的提取方法参照姚思睿等(2015)的研究.具体如下:称取0.5 g冻干样品, 加入5 mL丙酮, 混匀后超声(40 kHz)30 min, 离心并吸取上清液, 再次向样品中加入5 mL丙酮, 重复超声并离心, 将两次上清液合并用N2吹干, 加入0.5 mL丙酮与4.5 mL超纯水制成水样样品后, 通过C18固相萃取柱净化, 利用超高效液相色谱进行测定, 外标法定量, 检测方法详见文献(罗力等, 2017).土壤中TCS的加标回收率分别为:添加量为0.1 mg·kg-1, 回收率为108.8%±2.6%;添加量为1.0 mg·kg-1, 回收率为101.5%±1.3%;添加量为10 mg·kg-1, 回收率为94.9%±2.5%.
2.4 土壤微生物PLFA分析称取相当于8 g干土重的鲜土, 依次加入5 mL磷酸缓冲液、6 mL三氯甲烷、12 mL甲醇, 振荡2 h后离心, 将上清液转移至分液漏斗中;向剩余土壤中再加入12 mL三氯甲烷和12 mL磷酸缓冲液, 振荡离心, 合并两次上清液, 振荡混匀并离心, 收集下层氯仿相, 氮气吹干, 通过硅胶柱分离出磷脂, 加入甲醇与甲苯混合液(1:1, V/V)和0.2 mol·L-1氢氧化钾溶液进行皂化和甲基化形成脂肪酸甲酯(White et al., 1979).脂肪酸甲酯的测定采用气相色谱仪(Agilent 6890 N, 美国), 根据不同保留时间结合MIDI微生物识别系统(MIDI Inc., Newark, DE)来进行鉴定.根据已有文献对土壤微生物PLFA进行分类, 结果见表 2.
表 2(Table 2)
| 表 2 土壤微生物群落的脂肪酸标志 Table 2 PLFAs used in the analysis of microbial communities | |||||||||||||||||||||
表 2 土壤微生物群落的脂肪酸标志 Table 2 PLFAs used in the analysis of microbial communities
| |||||||||||||||||||||
3 结果与讨论(Results and discussion)3.1 生物炭对黄瓜生物量和TCS含量的影响不同处理土壤中黄瓜的生物量(干重)如表 3所示, 生物炭对黄瓜生物量的影响随生物炭添加量和制备温度的不同而有所不同.对BC300来说, 与未添加生物炭的对照相比, 添加1%生物炭对黄瓜生物量几乎没有影响, 添加2%和5%生物炭处理的黄瓜平均生物量有所提高, 但差异都未达到显著水平(p > 0.05);不同生物炭添加量处理之间的黄瓜生物量也都未达到显著性差异.对于BC600来说, 与未添加生物炭的对照相比, 添加2%生物炭显著提高了黄瓜的生物量(p < 0.05), 添加1%和5%生物炭对黄瓜生物量的影响都未达到显著性水平(p > 0.05);添加1%和2%生物炭处理之间的黄瓜生物量无显著性差异, 但都显著高于添加5%生物炭的处理.以上结果表明, 生物炭添加在一定范围内(1%和2%)对黄瓜的生长具有一定的促进作用, 但过量施用又会对黄瓜的生长产生不利影响.生物炭对植物生长的影响可能是多方面的, 例如, Liao等(2014)研究表明, 含有较多持久性自由基的生物炭会抑制种子发芽和作物生长.此外, 高温制备的生物炭能够提高土壤的pH值(Zhang et al., 2018), 进而影响植物生长.本研究中, 添加5% BC600处理的黄瓜生物量最低, 可能与生物炭中自由基及土壤pH升高等不利条件的影响有关.
表 3(Table 3)
| 表 3 不同处理下黄瓜生物量与植物体内TCS含量 Table 3 Cucumber biomass and the concentrations of TCS in the cucumber | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 不同处理下黄瓜生物量与植物体内TCS含量 Table 3 Cucumber biomass and the concentrations of TCS in the cucumber
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由表 3可知, 不同处理下, 黄瓜根系中都能检测出TCS, 而地上部分都未检测出TCS, 说明TCS很难向黄瓜地上茎、叶中迁移.未添加生物炭处理的黄瓜根系中TCS含量显著高于添加生物炭的处理, 说明生物炭的添加能抑制黄瓜对TCS的吸收, 并且随着生物炭添加量的增加, 根系中TCS含量降低.添加1%和2%生物炭的处理中, BC600处理黄瓜根系中的TCS含量显著低于BC300处理, 这可能是由于BC600的比表面积远大于BC300, 因而对TCS吸附较强的缘故(Cao et al., 2009;罗力等, 2017).添加5% BC600的处理, 黄瓜根系中TCS含量有所增加, 可能是土壤pH的升高导致TCS电离度增加(pKa为7.8), 使土壤溶液TCS负离子增多, 提高了植物根系对其吸收.
3.2 生物炭添加对土壤中TCS可提取总量的影响由表 4可知, 盆栽前土壤中, 与未添加生物炭的处理相比, 添加两种生物炭都使土壤中TCS可提取总量明显降低.随着生物炭添加量的增加, 土壤中TCS可提取总量降低越多, 同一生物炭添加1%和5%两种处理下土壤中TCS可提取总量都差异显著(p < 0.05).与盆栽前土壤相比, 不同处理下未种植黄瓜土壤中TCS可提取总量都有不同程度的下降, 但降幅较小, 总体无显著性差异.未种植黄瓜土壤中TCS可提取总量也是随着生物炭添加量越多而降低越多, 且同一生物炭添加5%处理的土壤中TCS可提取总量显著低于添加1%和2%两种处理(p < 0.05), 添加1%和2% BC300处理之间差异不显著, 添加2% BC600的土壤中TCS可提取总量显著低于添加1% BC600的土壤(p < 0.05).种植黄瓜的土壤中, TCS可提取总量都显著低于相应的盆栽前和未种植黄瓜的土壤(p < 0.05), 也是随着生物炭添加量的增加土壤中TCS可提取总量降低得越多, 且同一生物炭添加1%、2%和5% 3种处理之间土壤中TCS可提取总量都有显著性差异(p < 0.05).就BC300和BC600两种生物炭的比较来看, 添加相同比例生物炭的不同处理(盆栽前、未种植黄瓜和种植黄瓜)土壤之间, TCS可提取总量虽然在数值上有所差异, 但都未达到显著性水平(p > 0.05).
表 4(Table 4)
| 表 4 生物炭的添加对土壤中TCS含量的影响 Table 4 Effect of biochar amendment on TCS concentration in soil | ||||||||||||||||||||||||||||||||||||||||||||||||
表 4 生物炭的添加对土壤中TCS含量的影响 Table 4 Effect of biochar amendment on TCS concentration in soil
| ||||||||||||||||||||||||||||||||||||||||||||||||
由以上结果可知, 土壤中添加生物炭可以降低TCS的可提取总量, 且添加量越大TCS可提取总量越低.单纯添加生物炭并不能显著促进土壤中TCS的消解, 而种植黄瓜能显著促进TCS的消解, 并且添加5%生物炭和种植黄瓜的组合对土壤中TCS消解的促进作用最大.
生物炭对土壤中有机污染物的去除作用受多方面因素的影响.生物炭中含有的持久性自由基会促进吸附在其表面的有机污染物的降解(Yang et al., 2015; Zhang et al., 2018).生物炭也能通过改变土壤微生物群落结构而影响有机物污染物的降解(Zhang et al., 2018).此外, 生物炭的比表面积越大, 孔隙度越丰富, 对土壤中有机污染物的吸附能力越强(Ahmad et al., 2014), 也会影响土壤中有机污染物的生物和化学降解(Ruby et al., 2016).本研究中BC600的比表面积(350.29 m2·g-1)显著高于BC300(4.92 m2·g-1), 但BC300和BC600处理的土壤中TCS含量之间却没有显著性差异, 这可能是生物炭进入土壤之后, 土壤中小分子天然有机质堵塞了生物炭微孔隙的缘故(Pignatello et al., 2006).黄瓜的种植使土壤中TCS含量大大降低, 这可能是由于植物根系分泌物增加了土壤中微生物可以利用的碳源, 激发了土壤微生物活性(Lu et al., 2015), 促进了TCS的微生物降解.有些土壤微生物不能将有机污染物作为生长营养加以利用, 但微生物在利用根系分泌物的同时, 可以通过共代谢作用将有机污染物最终分解为简单无机物(高彦征等, 2004).
3.3 生物炭对土壤中微生物群落结构的影响微生物降解是土壤中有机污染物去除的一个重要途径, 为了进一步探究不同处理下土壤中TCS消解与土壤微生物之间的关系, 对盆栽90 d后土壤中微生物磷脂脂肪酸(PLFAs)进行了提取分析.不同处理下的土壤中都检测到了57种PLFAs, 不同微生物群落PLFAs含量如图 1所示.土壤微生物群落以细菌(革兰氏阳性菌和革兰氏阴性菌)为主, 细菌PLFAs占微生物PLFAs总量的72.43%~75.82%, 其次为真菌(10.35%~13.38%), 最后是放线菌(7.68%~11.01%).总的来看, 与未添加生物炭的处理相比, 除1% BC600处理外, 添加生物炭未种植黄瓜的土壤中微生物PLFAs含量有不同程度的提高(提高率为12.14%~33.79%), 说明生物炭的添加使土壤中微生物PLFAs含量明显增加.种植黄瓜的所有处理中, 添加生物炭总体上也能增加土壤中微生物PLFAs的含量, 但增加不是很明显, 且相同添加量的BC300和BC600处理之间也没有明显的差异.对于种植黄瓜土壤中的真菌与革兰氏阳性细菌PLFAs含量来说, 生物炭的添加对其无显著影响(p > 0.05).革兰氏阳性菌的细胞壁相对较厚且自身能够形成芽孢, 对环境因子的改变具有较强的耐受性(Huang et al., 2009).不同生物炭添加量的处理中, 种植黄瓜土壤中革兰氏阴性菌PLFAs含量较未种植黄瓜土壤减少10.65%~36.19%, 且种植黄瓜的土壤中PLFAs总量绝大多数都低于相应的未种植黄瓜的土壤.这与Song等(2016)的研究结果类似, 在六氯苯(HCB)污染土壤中, 由于一些降解菌的增殖导致植物根际2 mm附近土壤中的细菌多样性最低.植物的种植是影响土壤中微生物群落结构的主要因素, 根系分泌物的释放为土壤中TCS降解菌提供了适宜的生态位, 促进了TCS降解菌的生长繁殖, 这可能也是种植黄瓜的土壤中TCS含量显著低于未种植植物的土壤(表 4)的原因之一.
图 1(Fig. 1)
 |
| 图 1 生物炭的添加对土壤中PLFAs含量的影响 (a.未种植黄瓜, b.种植黄瓜) Fig. 1Effect of biochar amendment on PLFAs concentration in soil |
根据图 1列出的PLFAs种类和数量, 对盆栽90 d后土壤中微生物群落进行了主成分分析, 结果如图 2所示.所有处理中提取出的两个主成分总共解释了微生物群落结构变化的74.42%.种植黄瓜与未种植黄瓜的处理之间具有较大的离散度, 说明种植黄瓜和未种植黄瓜的土壤中微生物群落结构有明显的不同.第一主成分对PLFAs数据变异的解释比例是53.75%, 第二主成分对PLFAs数据变异的解释比例是20.67%, 添加不同比例生物炭未种植黄瓜的样本在PC1和PC2轴上离散度都较大, 且添加不同比例的BC600之间的离散度要远大于BC300, 说明添加生物炭改变了土壤的微生物群落结构, 且添加不同比例的BC600对土壤微生物群落结构的改变最大.种植黄瓜的样本在PC1和PC2轴上的值都较为集中, 说明种植黄瓜能够降低添加生物炭对土壤微生物群落结构改变的影响, 但添加不同比例BC600之间的离散度仍大于BC300.
图 2(Fig. 2)
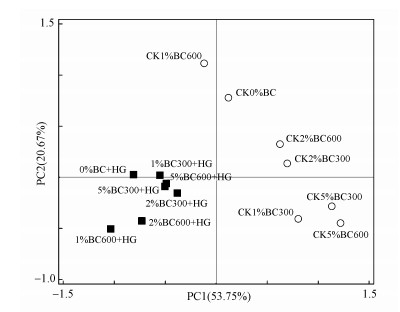 |
| 图 2 土壤微生物群落磷脂脂肪酸组成的主成分分析 (CK:未种植黄瓜, HG:种植黄瓜) Fig. 2Principal components analysis of PLFAs compositions of the microorganism communities in soils |
4 结论(Conclusions)1) 生物炭的适量(1%和2%)施用对黄瓜生长具有一定的促进作用, 但过量(5%)施用又会导致促进生长的效果下降.生物炭的添加能够抑制黄瓜根系对土壤中TCS的吸收, 并且随着生物炭添加量的增多, 抑制作用增大.
2) 添加生物炭明显降低了土壤中TCS的可提取总量, 且添加量越大, 土壤中TCS可提取总量越低.种植黄瓜能够显著促进土壤中TCS的消解, 添加5%的生物炭并种植黄瓜的土壤中TCS消解程度最大.
3) 生物炭的添加能够提高未种植黄瓜土壤中微生物PLFAs含量, 但对种植黄瓜的土壤微生物PLFAs含量影响较小.添加生物炭能够改变土壤微生物的群落结构, 种植黄瓜能够降低生物炭对土壤微生物群落结构改变的影响.
参考文献
| Ahmad M, Rajapaksha A U, Lim J E, et al. 2014. Biochar as a sorbent for contaminant management in soil and water:A review[J]. Chemosphere, 99(3): 19–33. |
| Anyika C, Majid Z A, Ibrahim Z, et al. 2015. The impact of biochars on sorption and biodegradation of polycyclic aromatic hydrocarbons in soils-a review[J]. Environmental Science and Pollution Research, 22(5): 3314–3341.DOI:10.1007/s11356-014-3719-5 |
| Bossio D, Scow K, Gunapala N, et al. 1998. Determinants of soil microbial communities:Effects of agricultural management, season, and soil type on phospholipid fatty acid profiles[J]. Microbial Ecology, 36(1): 1–12.DOI:10.1007/s002489900087 |
| Cao X, Ma L, Gao B, et al. 2009. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science and Technology, 43(9): 3285–3291.DOI:10.1021/es803092k |
| Cha J, Cupples A M. 2010. Triclocarban and triclosan biodegradation at field concentrations and the resulting leaching potentials in three agricultural soils[J]. Chemosphere, 81(4): 494–499.DOI:10.1016/j.chemosphere.2010.07.040 |
| Cornelissen G, Elmquist M, Groth I, et al. 2004. Effect of sorbate planarity on environmental black carbon sorption[J]. Environmental Science and Technology, 38(13): 3574–3580.DOI:10.1021/es049862g |
| Dann A B, Hontela A. 2011. Triclosan:environmental exposure, toxicity and mechanisms of action[J]. Journal of Applied Toxicology, 31(4): 285–311.DOI:10.1002/jat.1660 |
| Foran C M, Bennett E R, Benson W H. 2000. Developmental evaluation of a potential non-steroidal estrogen:triclosan[J]. Marine Environmental Research, 50(1/5): 153–156. |
| 高彦征.2004.土壤多环芳烃污染植物修复及强化的新技术原理研究[D].杭州: 浙江大学.9-10http://cdmd.cnki.com.cn/article/cdmd-10335-2004089147.htm |
| Ghosh U, Luthy R G, Cornelissen G, et al. 2011. In-situ sorbent amendments:a new direction in contaminated sediment management[J]. Environmental Science and Technology, 45(4): 1163–1168.DOI:10.1021/es102694h |
| Huang H L, Zhang S Z, Wu N Y, et al. 2009. Influence of Glomus etunicatum/Zea mays mycorrhiza on atrazine degradation, soil phosphatase and dehydrogenase activities, and soil microbial community structure[J]. Soil Biology and Biochemistry, 41(4): 726–734.DOI:10.1016/j.soilbio.2009.01.009 |
| Kasozi G N, Zimmerman A R, Nkedi-Kizza P, et al. 2010. Catechol and humic acid sorption onto a range of laboratory produced black carbons (biochars)[J]. Environmental Science and Technology, 44(16): 6189–6195.DOI:10.1021/es1014423 |
| Kommalapati R R, Valsaraj K T, Constant W D, et al. 1997. Aqueous solubility enhancement and desorption of hexachlorobenzene from soil using a plant-based surfactant[J]. Water Research, 31(9): 2161–2170.DOI:10.1016/S0043-1354(97)00052-3 |
| 李林朋, 马慧敏, 胡俊杰, 等. 2010. 三氯生和三氯卡班对人体肝细胞DNA损伤的研究[J]. 生态环境学报, 2010, 19(12): 2897–2901.DOI:10.3969/j.issn.1674-5906.2010.12.022 |
| Lian F, Xing B. 2017. Black carbon (biochar) in water/soil environments:molecular structure, sorption, stability, and potential risk[J]. Environmental Science and Technology, 51(23): 13517–13532.DOI:10.1021/acs.est.7b02528 |
| Liao S, Pan B, Li H, et al. 2014. Detecting free radicals in biochars and determining their ability to inhibit the germination and growth of corn, wheat and rice seedlings[J]. Environmental Science and Technology, 48(15): 8581–8587.DOI:10.1021/es404250a |
| Lu Y C, Zhang S, Miao S S, et al. 2015. Enhanced degradation of herbicide isoproturon in wheat rhizosphere by salicylic acid[J]. Journal of Agricultural and Food Chemistry, 63(1): 92–103.DOI:10.1021/jf505117j |
| 罗力, 陈卫锋, 魏然, 等. 2017. 互花米草生物炭的添加对土壤吸附三氯生的影响及其机制研究[J]. 环境科学学报, 2017, 37(7): 2736–2743. |
| Myers R T, Zak D R, White D C, et al. 2001. Landscape-level patterns of microbial community composition and substrate use in upland forest ecosystems[J]. Soil Science Society of America Journal, 65(2): 359–367.DOI:10.2136/sssaj2001.652359x |
| Ni N, Song Y, Shi R, et al. 2017. Biochar reduces the bioaccumulation of PAHs from soil to carrot (Daucus carota L.) in the rhizosphere:A mechanism study[J]. Science of the Total Environment, 601-602: 1015–1023.DOI:10.1016/j.scitotenv.2017.05.256 |
| Pignatello J J, Kwon S, Lu Y F. 2006. Effect of natural organic substances on the surface and adsorptive properties of environmental black carbon (char):attenuation of surface activity by humic and fulvic acids[J]. Environmental Science and Technology, 40(24): 7757–7763.DOI:10.1021/es061307m |
| Ruby M V, Lowney Y W, Bunge A L, et al. 2016. Oral bioavailability, bioaccessibility, and dermal absorption of PAHs from soil-state of the science[J]. Environmental Science and Technology, 50(5): 2151–2164.DOI:10.1021/acs.est.5b04110 |
| Sanchez-Prado L, Llompart M, Lores M, et al. 2006. Monitoring the photo-chemical degradation of triclosan in waste-water by UV light and sunlight using solid-phase micro-extraction[J]. Chemosphere, 65(8): 1338–1347.DOI:10.1016/j.chemosphere.2006.04.025 |
| Singer H, Muller S, Tixier C, et al. 2002. Triclosan:Occurrence and fate of a widely used biocide in the aquatic environment:Field measurements in wastewater treatment plants, surface waters, and lake sediments[J]. Environmental Science and Technology, 36(23): 4998–5004.DOI:10.1021/es025750i |
| Song Y, Li Y, Zhang W, et al. 2016. Novel biochar-plant Tandem approach for remediating hexachlorobenzene contaminated soils:proof-of-concept and new insight into the rhizosphere[J]. Journal of Agricultural and Food Chemistry, 64(27): 5461–5471. |
| Turpeinen R, Kairesalo T, H?ggblom M M. 2004. Microbial community structure and activity in arsenic-, chromium-, and copper-contaminated soils[J]. Fems Microbiology Ecology, 47(1): 39–50.DOI:10.1016/S0168-6496(03)00232-0 |
| Verma K S, Xia K. 2010. Analysis of triclosan and triclocarban in soil and biosolids using molecurlarly imprinted solid phase extraction coupled with HPLC-UV[J]. Journal of Aoac International, 93(4): 1313–1321. |
| 王萌萌, 周启星. 2013. 生物炭的土壤环境效应及其机制研究[J]. 环境化学, 2013, 32(5): 559–558. |
| Wang T, Sun H, Ren X, et al. 2017. Evaluation of biochars from different stock materials as carriers of bacterial strain for remediation of heavy metal-contaminated soil[J]. Scientific Reports, 79(1): 1211. |
| White D C, Davis W M, Nickels J S, et al. 1979. Determination of the sedimentary microbial biomass by extractible lipid phosphate[J]. Oecologia, 40(1): 51–62.DOI:10.1007/BF00388810 |
| Yang J, Pan B, Li H, et al. 2015. Degradation of p-nitrophenol on biochars:Role of persistent free radicals[J]. Environmental Science and Technology, 50(2): 694–700. |
| Yang X B, Ying G G, Peng P A, et al. 2010. Influence of biochars on plant uptake and dissipation of two pesticides in an agricultural soil[J]. Journal of Agricultural and Food Chemistry, 58(13): 7915–7921.DOI:10.1021/jf1011352 |
| 姚思睿, 魏然, 倪进治, 等. 2015. 福州内河沉积物中三氯生和甲基三氯生的含量、来源及其生态风险[J]. 环境科学学报, 2015, 35(8): 2519–2525. |
| Zelles L. 1997. Phospholipid fatty acid profiles in selected members of soil microbial communities[J]. Chemosphere, 35(1/2): 275–294. |
| Zelles L. 1999. Identification of single cultured micro-organisms based on their whole-community fatty acid profiles, using an extended extraction procedure[J]. Chemosphere, 39(4): 665–682.DOI:10.1016/S0045-6535(99)00131-9 |
| Zhang P, Sun H, Min L, et al. 2018. Biochars change the sorption and degradation of thiacloprid in soil:Insights into chemical and biological mechanisms[J]. Environmental Pollution, 236: 158–167.DOI:10.1016/j.envpol.2018.01.030 |
| Zhou Q X, Sun F H, Liu R. 2005. Joint chemical flushing of soils contaminated with petroleum hydrocarbons[J]. Environment International, 31(6): 835–839.DOI:10.1016/j.envint.2005.05.039 |
