 , 杨平1,2,3, 黄佳芳1,2,3, 张逸飞1,2, 李亚兰1,2, 仝川1,2,3
, 杨平1,2,3, 黄佳芳1,2,3, 张逸飞1,2, 李亚兰1,2, 仝川1,2,3

1. 福建师范大学湿润亚热带生态地理过程教育部重点实验室, 福州 350007;
2. 福建师范大学地理科学学院, 福州 350007;
3. 福建师范大学亚热带湿地研究中心, 福州 350007
收稿日期: 2018-05-16; 修回日期: 2018-07-06; 录用日期: 2018-07-06
基金项目: 国家自然科学基金(No.41371127,41877335);福建师范大学校级创新团队项目(No.IRTL1205)
作者简介: 郭谦谦(1993-), 女, E-mail:guoqq807@163.com
通讯作者(责任作者): 仝川(1964—), 男, 北京大学博士, 福建师范大学地理科学学院教授, 主要从事湿地生物地球化学循环和湿地生态系统服务功能研究, E-mail:tongch@fjnu.edu.cn
摘要: 以闽江河口塔礁洲感潮淡水野慈姑(Sagittaria trifolia Linn.)湿地为研究对象,于2016年2、4、7和9月每月均在连续2个小潮日内向研究样地施加人造海水和Fe(OH)3溶液,研究短期的盐水入侵及Fe(Ⅲ)浓度增强对河口感潮淡水湿地土壤反硝化速率及理化特征的影响.结果表明,短期的盐水入侵、Fe(Ⅲ)浓度增强对河口感潮淡水沼泽湿地土壤反硝化速率的影响不显著,然而,盐水和Fe(Ⅲ)共同施加会显著提高湿地土壤反硝化速率,与对照(CK)相比,盐水和Fe(Ⅲ)共同施加可使土壤反硝化速率提高270.9%.盐水入侵、盐水和Fe(Ⅲ)共同施加均可显著提高湿地土壤、间隙水的电导率及Cl-、SO42-的含量;Fe(Ⅲ)浓度增强可显著降低土壤和间隙水pH值,同时显著提高土壤三价铁含量.
关键词:土壤反硝化速率盐水入侵Fe(Ⅲ)施加感潮淡水湿地闽江河口
Effects of simulated saltwater intrusion and Fe(Ⅲ) increase on denitrification rate and soil environmental properties in tidal freshwater marsh of the Min River estuary
GUO Qianqian1,2
 , YANG Ping1,2,3, HUANG Jiafang1,2,3, ZHANG Yifei1,2, LI Yalan1,2, TONG Chuan1,2,3
, YANG Ping1,2,3, HUANG Jiafang1,2,3, ZHANG Yifei1,2, LI Yalan1,2, TONG Chuan1,2,3

1. Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fujian Normal University, Fuzhou 350007;
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007;
3. Research Centre of Wetlands in Subtropical Region, Fujian Normal University, Fuzhou 350007
Received 16 May 2018; received in revised from 6 July 2018; accepted 6 July 2018
Supported by the National Natural Science Foundation of China (No.41371127, 41877335) and the Program for Innovative Research Team of Fujian Normal University (No.IRTL1205)
Biography: GUO Qianqian(1993—), female, E-mail:guoqq807@163.com
*Corresponding author: TONG Chuan, E-mail:tongch@fjnu.edu.cn
Abstract: The effects of short-term saltwater intrusion and Fe(Ⅲ) amendament on the soil denitrification rates and soil environmental parameters of the tidal freshwater marsh dominated by Sagittaria trifolia in the Tajiaozhou of the Min River estuary were determined by the in situ additions of artificial sea salt and Fe(Ⅲ) solution in continuous two neap tide days in February, April, July and September 2016. The results showed that the simulated short-term saltwater intrusion coupled with Fe(Ⅲ) input significantly promoted the soil denitrification rates, and compared with the control treatments, the denitrification rate increased 270.9%, however, the soil denitrification rates did not significantly changed with the treatments of saltwater intrusion, and Fe(Ⅲ) increase alone. The treatments of saltwater intrusion, and saltwater intrusion coupled with Fe(Ⅲ) input significantly increased conductivity, the pore water SO42- and Cl- concentrations; and the Fe(Ⅲ) amendament significantly decreased pH, and significantly increased soil Fe(Ⅲ) contents.
Keywords: denitrification ratesaltwater intrusionFe (Ⅲ) amendamenttidal freshwater marshMin River estuary
1 引言(Introduction)氧化亚氮(N2O)作为大气中主要的温室气体之一, 其浓度增加会导致全球气温升高、臭氧层破坏和酸沉降, 已成为当前备受关注的全球性重大环境问题之一(Yu et al., 2010; IPCC, 2013; 朱永官等, 2014).湿地土壤N2O主要来源于硝化与反硝化过程, 其中, 反硝化作用是一个能永久去除生态环境中活性氮的生物脱氮过程(Deutsch et al., 2010).河口湿地是位于海陆交互地带的生态系统, 对全球气候变化和人类活动响应较为敏感(Simas et al., 2001; Nakata et al., 2003), 在全球生物地球化学循环中具有重要作用(Hu et al., 2014; 王树功等, 2005; 白军红等, 2003; 高建华等, 2004).研究发现, 处于河口区的感潮湿地, 尤其是感潮淡水湿地将受海平面上升引起的盐水入侵的深刻影响(胡松等, 2003; Carretero et al., 2013; 裘诚, 2014), 入海河川径流向海洋输送大量的铁、锰元素(吴晓燕, 2007; Yu et al., 2013), 其中一部分被河口湿地截获(Katz et al., 1981).我国东南沿海地区受暖热多雨的海洋性季风气候影响, 河流流域内母岩化学风化作用强烈, 矿物质分解彻底(李鹤等, 2011; 童亮等, 2017), 铁铝氧化物相对富集, 生物循环较强烈(王小红等, 2016).暴雨过后洪水除了携带大量营养物质输入河口湿地(徐皓等, 2013; 孙东耀等, 2017), 短时内也将铁、锰化合物输向河口区(黄文丹等, 2013).
近年来, 盐水入侵对河口区氮素生物地球化学循环过程的影响逐渐引起人们的关注(Bernhard et al., 2005; Clément et al., 2005; 张林海等, 2015), 然而, 关于盐水入侵、Fe(Ⅲ)浓度增加及两者耦合作用对河口淡水感潮湿地反硝化速率的影响研究还鲜见报道.从已有的研究来看, 盐度可通过多种途径影响反硝化速率, 研究结论也较为复杂, 存在抑制、无影响和短暂抑制后影响消失等情况(Fear et al., 2005; Wang et al., 2006; 邹航, 2014; 张林海等, 2015).Fe(Ⅲ)浓度增加对于反硝化速率的影响也受到一些****的关注(Huang et al., 2006; Park et al., 2009; Yang et al., 2012), 目前相关研究主要集中在污水脱氮工艺、调节N2O产生与排放等方面(李浩等, 2015; 付炳炳等, 2018), 针对Fe(Ⅲ)浓度日益增加背景下的河口淡水感潮湿地土壤反硝化速率变化的研究尚未见报道.
闽江口湿地是闽江入海携带的物质流、能量流的必经之地, 容易受到来自流域中、上游输送的Fe(Ⅲ)及台风风暴潮引起的短期盐水入侵的影响(牟晓杰等, 2013; 胡敏杰等, 2014).本研究以闽江河口塔礁洲淡水湿地为研究对象, 设计原位盐水入侵和Fe(Ⅲ)浓度增加模拟实验, 通过分析4个季节不同施加处理组样地土壤反硝化速率及理化特征的变化, 以探讨盐水入侵和Fe(Ⅲ)浓度增加对河口淡水感潮湿地土壤反硝化速率及理化特征的影响, 为进一步认识我国东南沿海河口感潮淡水湿地土壤氮循环过程及其对环境变化的响应提供科学依据与数据参考.
2 材料与方法(Materials and methods)2.1 研究样地塔礁洲是由闽江河流从上游携带泥沙在闽江口淤积而成的天然湿地, 地理坐标为119°19′55″E~119°22′45″E, 25°56′56″N~25°57′36″N(图 1), 面积约878 hm2, 属中亚热带与南亚热带海洋季风气候的过渡地带.该区域气候温暖湿润, 年均温为19.7 ℃.同时, 塔礁洲地处闽江口感潮段, 受潮汐作用影响显著, 表现为非正规的半日浅潮.目前, 塔礁洲中部已开发为居民点及农田, 四周仍由沙滩和泥滩组成, 分布的主要湿地植物有短叶茳芏(Cyperus malaccensis Lam. var. brevifolius Bocklr.)和野慈姑(Sagittaria trifolia Linn.), 年平均淹水频率为24.5%, 土壤为粉砂质壤土(粘粒为9.85%~12.02%, 粉粒为46.00%~52.75%, 砂粒为36.36%~42.87%), 盐度为0.10‰±0.04‰.本研究选取位于塔礁洲南侧的淡水感潮野慈姑湿地为研究样地(图 1), 野慈姑群落植株密度为18~25株·m-2, 植株高度为0.4~0.5 m, 地上和地下生物量分别为(116.4±42.3)和(216.3±100.8) g·m-2.
图 1(Fig. 1)
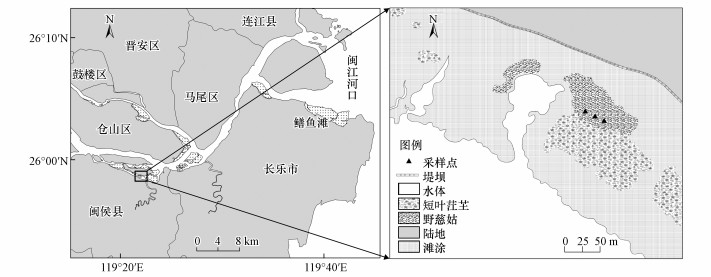 |
| 图 1 闽江河口塔礁洲研究样地位置示意图(张逸飞等, 2018) Fig. 1Location of study site in the Tajiaozhou of the Min River estuary |
2.2 样地布设与样品采集在塔礁洲南岸选取野慈姑长势良好、覆盖均匀且环境条件均一的地段, 随机布设一条样带, 所选取样带与河岸方向平行.在样带中, 埋设12个PVC材质的样方框(35 cm×35 cm×50 cm), 各样方框间距约1 m.为避免模拟试验添加盐水的表层横向流动, 样方框深入土壤30 cm, 顶部露出土壤表面小于5 cm.
经对样地土壤下渗效果测试, 每次样框施加溶液量以1 L为宜.12个样框分为4个处理, 分别为对照组(CK)、Fe(Ⅲ)增强组(Fe)、盐水入侵组(S)、盐水入侵+Fe(Ⅲ)增强组(S+Fe), 每组处理设置3个重复.Fe(Ⅲ)以氢氧化铁(Fe(OH)3)悬浊液的形式施加, 年添加量约为3000 g·m-2·a-1.施加的人造海水(盐度15‰)由热带海水珊瑚礁盐(Cnsic Marine Biotechnology Co., Ltd.)配制而成(Chambers et al., 2011).2016年2、4、7和9月每月均在连续2个小潮日内向研究样地施加人造海水溶液和Fe(OH)3悬浊液, 施加时段及随后的数小时地表出露且无潮水水淹, 在第2 d施加结束数小时后采集土样, 并原位测定相关环境因子.
土样采集时, 在每个处理组的样方框内利用自制圆柱型取土器(长20 cm, 直径5 cm)取0~5 cm深的土样, 用5 mL的注射器从土样中部取3 mL的土用于烘干测定土壤容重和含水率后, 将剩余的土样装入自封袋中密封运回实验室冷藏, 用于培养实验和其它土壤理化性质的测定分析.同时, 在每个样方框内提前设土壤间隙水采集器, 与采集土样同步采集深度为10 cm的间隙水样, 分装到60 mL透明聚乙烯塑料瓶中, 再加入1 mL饱和HgCl2溶液, 盖上瓶盖, 遮光冷冻保存至测定分析间隙水理化性质(Bullock et al., 2013; Morrissey et al., 2014).
2.3 土壤和间隙水理化性质的测定土壤电导率和pH值测定时设置水土质量比为2.5:1, 振荡30 min, 静置30 min后分别用便携式电导计(2265FS, USA)和便携式pH计(STARTER 300, USA)测定;土壤N-NH4+和N-NO3-含量用2 mol·L-1的KCl浸提后通过连续流动分析仪(SKALAR SAN++, Netherlands)测定;土壤Cl-、SO42-含量用离子色谱仪(Dionex ICS-2100, Japan)测定;土壤全碳(Total Carbon, TC)、全氮(Total Nitrogen, TN)含量采用CN元素分析仪(Elementar Vario MAX CN, Germany)测定;土壤粒径采用激光粒度分析仪(Master Sizer 2000, UK)测定, 按国际制分为黏粒(< 2 μm)、粉粒(2~20 μm)和砂粒(> 20 μm).
用于测定间隙水理化性质的水样运回实验室后立即用孔径为0.45 μm滤膜过滤.水样过滤后, 装于清洁的60 mL透明聚乙烯塑料瓶中.采用连续流动分析仪(SKALAR San++, Netherlands)分析水样中铵态氮(NH4+-N)、硝态氮(NO3--N)和亚硝态氮(NO2--N)的含量, 采用离子色谱仪(Dionex ICS-2100, Japan)测定水样中的Cl-、SO42-等理化指标(仝川等, 2012;朱文凤等, 2018).
2.4 室内培养和反硝化速率测定本研究对于土壤反硝化速率的测定参照Ballantine等(2014)提出的改进后的乙炔抑制法.乙炔抑制剂法是一种较准确、费用-效益比高的测定土壤反硝化速率的方法, 但该方法也被认为会低估湿地土壤反硝化速率(Seitzinger et al., 1993).目前, 虽然氮同位素双标记方法已被较多地应用于湿地土壤反硝化速率的测定, 但乙炔抑制剂法, 特别是改进后的乙炔抑制剂法在河口湿地土壤反硝化速率的研究中仍较多应用(Wall et al., 2005; Marton et al., 2012; Ballantine et al., 2014;刘晴晴等, 2016;李家兵等, 2017).本研究的区域为河口区, 接受着流域上、中游径流带来的相对大量的NO3--N, 在理论上具有运用乙炔抑制法测定湿地土壤反硝化速率的条件.
挑去野外采回鲜土样品中的残体根系和固体杂质, 称取15 g过2 mm孔径筛的供试土壤共2份, 分别放入添加乙炔(按照培养瓶体积的10%添加乙炔气体)和不添加乙炔的培养瓶中.2个培养瓶中都加入反应底物葡萄糖1.2 mg和硝酸钾21.6428 mg, 再分别添加抑制新酶产生的抑制剂氯霉素0.3 mg和原位采集的上覆水10 mL, 培养瓶密封, 共24个培养瓶, 在振荡器上振荡(设置转速为150 r·min-1, 时间为30 min), 使悬浊液混合均匀, 再对培养瓶进行约3~5 min的高纯氮气洗气, 使瓶内形成充分的厌氧环境.
培养瓶放入恒温培养箱中进行培养实验, 设置的温度分别为采样时的土温(2月:19.3 ℃, 4月:22.1 ℃, 7月:32.3 ℃, 9月:26.5 ℃).在培养第0 min和60 min时分别采集培养瓶中气体, 利用GC-2014气相色谱仪(SHIMADZU, Japan)测定培养期间培养瓶中的N2O浓度(Hou et al., 2007).反硝化速率根据加乙炔和不加乙炔样品中N2O浓度差异计算获得(刘晴晴等, 2016), 计算公式如下(Hou et al., 2007; Magalh?es et al., 2005):
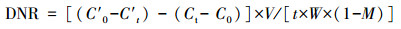 | (1) |
2.5 数据处理与统计分析实验数据的整理、统计分析和制图分别采用Microsoft Excel 2010、SPSS 20.0和Origin 8.0软件.所有数据在分析前先进行正态分布检验(Kolmogorov-Smirnov检验)和方差同质性检验(Levene检验), 采用单因素方差分析(one-way ANOVA)检验两组变量之间的差异性, 对于有显著性差异的结果, 组间的差异性利用Tukey事后检验分析.采用皮尔逊相关系数(Pearson′s correlation coefficient)分析两组变量之间的相关性.文中数据表示为平均值±标准误差.
3 结果(Results)3.1 盐水入侵及Fe(Ⅲ)浓度增强对反硝化速率的影响原位短期、脉冲式盐水入侵及Fe(Ⅲ)施加对感潮淡水湿地土壤平均反硝化速率的影响如图 2所示.由图可知, CK、S、Fe和S+Fe处理下, 土壤反硝化速率的平均值分别为8.94、13.45、17.27和33.16 nmol·g-1·h-1.与CK相比, S+Fe处理显著提高了湿地土壤反硝化速率(表 1), 增幅为270.9%, S处理和Fe处理对湿地反硝化速率无影响(表 1).S+Fe处理在不同季节对湿地反硝化速率的影响不尽一致, 在9月的促进效果最明显, 较CK处理提高了512.7%, 而在2月和4月, 对湿地反硝化速率无影响(图 2).
图 2(Fig. 2)
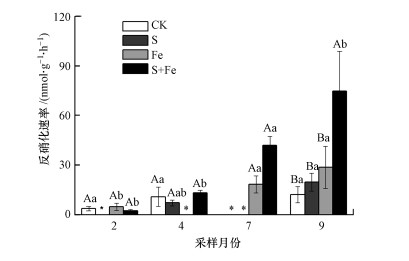 |
| 图 2 模拟盐水入侵及Fe(Ⅲ)浓度增加对河口感潮淡水湿地土壤反硝化速率的影响 (不同大写字母代表同一月份不同处理两两之间具有显著差异性, 不同小写字母代表同一处理在不同月份两两之间具有显著差异性, p < 0.05, 下同;*代表ND(not detected)) Fig. 2Effect of simulated saltwater intrusion and ferric iron increase on the denitrification rate of in tidal freshwater wetland |
表 1(Table 1)
| 表 1 不同处理对土壤理化性质、土壤反硝化速率影响 Table 1 The effects of different treatments on soil parameters and denitrification rate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 不同处理对土壤理化性质、土壤反硝化速率影响 Table 1 The effects of different treatments on soil parameters and denitrification rate
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 盐水入侵及Fe(Ⅲ)浓度增强对土壤及间隙水的理化性质的影响3.2.1 盐水入侵及Fe(Ⅲ)浓度增强对土壤理性质的影响原位短期、脉冲式盐水入侵及Fe(Ⅲ)浓度增强对感潮淡水湿地土壤理化性质影响的季节变化如表 1和图 3所示.方差分析结果显示, S处理下土壤电导率显著高于CK、Fe和S+Fe处理(p < 0.05);土壤pH在Fe处理下显著低于CK、S、S+Fe处理(p < 0.05);Fe和S+Fe处理下土壤三价铁含量显著高于CK和S处理(p < 0.05);S、S+Fe处理下土壤Cl-含量显著高于CK和Fe处理(p < 0.05);Fe处理下土壤SO42-含量显著低于CK、S和S+Fe处理(p < 0.05);S处理下土壤NH4+-N含量在冬季显著高于其它处理(p < 0.05), S+Fe处理下土壤NH4+-N含量则在夏季显著高于其它处理(p < 0.05);冬季S、S+Fe处理下的土壤NO3--N含量显著高于Fe处理(p < 0.05).总体上, 含水率、NH4+-N和NO3--N含量在不同处理间无显著差异(p > 0.05).
图 3(Fig. 3)
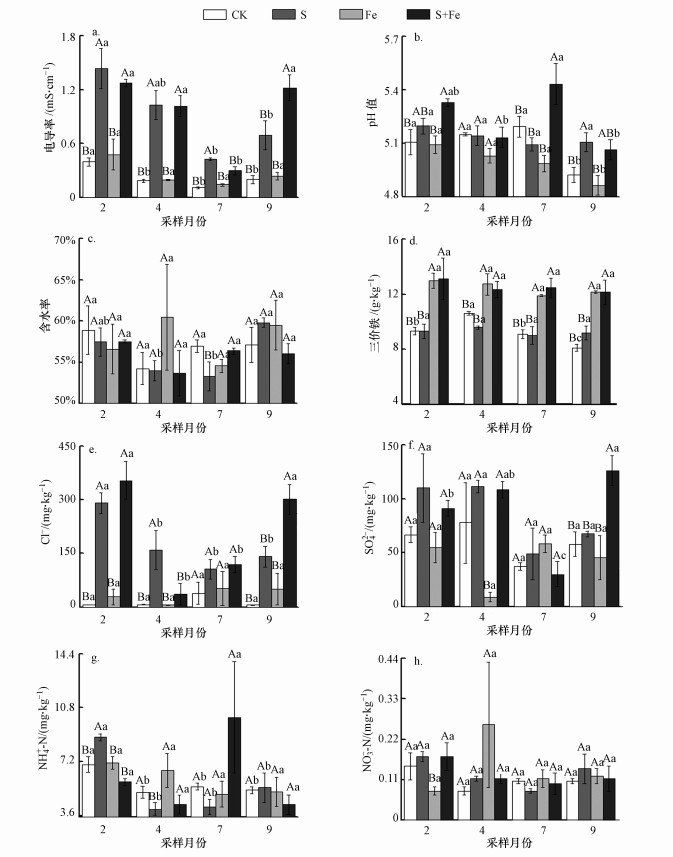 |
| 图 3 模拟盐水入侵及Fe(Ⅲ)浓度增加情景下湿地土壤环境因子的变化 Fig. 3Variations of soil environmental factors under simulated saltwater intrusion and ferric iron increase |
3.2.2 盐水入侵及Fe(Ⅲ)浓度增强对间隙水理化性质的影响原位短期、脉冲式盐水入侵及Fe(Ⅲ)浓度增强对感潮淡水湿地间隙水理化性质影响的季节变化如表 2所示.Fe处理下间隙水pH显著高于CK、S、S+Fe处理(p < 0.05);S和S+Fe处理下间隙水的电导率、SO42-、Cl-和NH4+-N含量均显著高于CK和Fe处理(p < 0.05);间隙水NO3--N含量在不同处理间无显著差异(p > 0.05).
表 2(Table 2)
| 表 2 不同处理对间隙水理化性质的影响 Table 2 The effects of different treatments on pore water | ||||||||||||||||||||||||||||||||||||||||||
表 2 不同处理对间隙水理化性质的影响 Table 2 The effects of different treatments on pore water
| ||||||||||||||||||||||||||||||||||||||||||
3.3 土壤环境因子与反硝化速率的关系Fe处理下土壤反硝化速率主要受土壤pH的影响, 呈现显著负相关关系(p < 0.05), CK处理土壤反硝化速率受土壤Cl-含量的影响, 亦呈现显著负相关关系(p < 0.01), 除CK处理下土壤反硝化速率与土温呈负相关关系(p < 0.05), 其余处理下土壤反硝化速率与土温均呈正相关关系(p < 0.05)(表 3).土壤反硝化速率与SO42-和NO3--N间主要为负相关关系(p < 0.05).整体而言, Fe和S+Fe处理下感潮湿地反硝化速率主要受间隙水NH4+-N的控制(p < 0.05), CK处理主要受NO3--N的影响(p < 0.05)(表 4).
表 3(Table 3)
| 表 3 不同处理土壤反硝化速率与土壤理化因子间的相关关系 Table 3 Pearson correlation analysis between soil denitrification rate and soil environmental parameters | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 不同处理土壤反硝化速率与土壤理化因子间的相关关系 Table 3 Pearson correlation analysis between soil denitrification rate and soil environmental parameters
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4(Table 4)
| 表 4 不同处理土壤反硝化速率与间隙水化学因子间的相关关系 Table 4 Pearson correlation analysis between soil denitrification rate and pore water chemistry | |||||||||||||||||||||||||||||||||
表 4 不同处理土壤反硝化速率与间隙水化学因子间的相关关系 Table 4 Pearson correlation analysis between soil denitrification rate and pore water chemistry
| |||||||||||||||||||||||||||||||||
4 讨论(Discussion)4.1 盐度变化对反硝化速率的影响盐度增加对湿地反硝化速率的影响已有较多报道, 但结论不一(Seitzinger et al., 1991;Yeh et al., 2005; Bernhard et al., 2005; 张林海等, 2015).Seitzinger等(1991)研究发现, 淡水沉积物中环境可交换的铵浓度比海洋沉积物中高, 因此, 淡水沉积物反硝化速率也更高;邹航(2014)在对珠江河口湿地的研究中发现, 盐度升高能够较为明显地抑制湿地土壤间隙水中反硝化作用的进行;Yeh等(2005)对葡萄牙Douro河口的研究发现, 耐盐微生物的主导作用使得反硝化速率随盐度的增加而增加;Fear等(2005)对美国Eutrophic Neuse河口和王东启等(2006)对中国长江口崇明东滩湿地土壤的研究发现, 盐度对土壤反硝化作用的影响不显著;张林海等(2015)对闽江河口潮滩湿地土样的培养实验中发现, 短期内盐度的增加会先抑制后提高土壤潜在反硝化速率, 但培养的第3 d后以上影响消失.本研究中, 短期、脉冲式盐水入侵对塔礁洲淡水感潮湿地反硝化速率的影响亦不显著(p > 0.05), 这与Fear等(2005)和Wang等(2006)的研究结果较为一致.分析原因可能是由于土壤中反硝化菌属在反硝化过程中起着重要作用, 河口潮滩反硝化细菌多为耐盐品种, 在潮滩水环境的广盐度性下, 其活性受盐度变化的影响较小(Wang et al., 2006).据此本研究认为, 河口地区短期、脉冲式的盐水入侵(如台风风暴潮带来的短时盐水入侵等)对河口感潮淡水沼泽湿地土壤反硝化速率的抑制可能不显著.
河口潮汐作用使得盐水施加后样地实际盐度(用电导率表征)和SO42-含量增加显著(p < 0.05), 与CK处理相比, 土壤电导率从(0.43±0.03) mS·cm-1增加到(1.04±0.20) mS·cm-1, 土壤SO42-含量从(59.88±14.79) mg·kg-1增加到(84.31±16.07) mg·kg-1.增加的SO42-与土壤反硝化作用竞争反应底物, 除了与NH4+-N相互作用, 其自身的氧化过程和硝酸还原反应共同驱动自养反硝化作用, 消耗大量的NO3--N和NO2--N生成N2(Wu et al., 2013).
4.2 Fe(Ⅲ)浓度增加对湿地土壤反硝化速率的影响本研究中短期、脉冲式的径流Fe(Ⅲ)浓度增加对淡水感潮湿地反硝化速率的影响不显著, 这一结果与Wang等(2015)和Huang等(2009)的研究结果相似.Fe(Ⅲ)浓度增加显著提高了土壤中的三价铁含量(p < 0.05), Fe(Ⅲ)浓度增加(> 60 mg·L-1)会导致脱氢酶活性降低, 在一定程度上减少相应反硝化细菌的种类和数量, 使得生物体活性下降, 最终导致Fe(Ⅲ)施加对反硝化速率的促进作用变小(付炳炳等, 2018).李浩等(2015)研究也证实, Fe(Ⅲ)浓度过高时, 反硝化速率变化并不显著.在同步硝化反硝化过程中, 氮迁移转化速度与Fe(Ⅲ)浓度有关(Clément et al., 2005).当Fe(Ⅲ)浓度在0~20 mg·L-1时, Fe(Ⅲ)浓度越高, NH4+-N的转化速率越快, NO2--N的积累速率就会越慢;然而, 当Fe(Ⅲ)浓度超过60 mg·L-1后, Fe(Ⅲ)将降低生物活性(闫玉洁, 2013; 陈娜等, 2014; 李浩等, 2015), 这可能与工艺反应系统内残留着上一周期内剩余的硝氮, 其会将反硝化过程中的N2O还原成N2, 对反硝化速率的计算造成较大干扰有关.本研究中Fe(Ⅲ)浓度增加对淡水感潮湿地反硝化速率影响不显著, 这可能与施加的Fe(Ⅲ)浓度未到达抑制土壤中相应微生物活性的阈值有关.pH是控制湿地土壤反硝化速率变化的关键环境因子, 反硝化反应最适宜的pH值是6.5~7.5(杨麟等, 2004), pH过高(> 8)或者过低(< 6)会严重影响反硝化细菌的还原酶活性(李家兵等, 2017).在本研究中, 湿地土壤pH值介于4.99~5.24之间, 较低的pH值可能是本研究样地施加Fe(Ⅲ)后对土壤反硝化速率影响不显著的原因之一.Huang等(2009)的研究也表明, 较低的土壤pH值可能导致Fe(Ⅲ)浓度增加对湿地反硝化速率的影响较小.
4.3 盐度增加与Fe(Ⅲ)浓度增加共同耦合作用对湿地土壤反硝化速率的影响本研究中短期、脉冲式的盐水入侵和Fe(Ⅲ)浓度增加的共同作用显著提高了反硝化速率(p < 0.05).这一结果可能归结于塔礁洲感潮淡水湿地土壤反硝化作用以耦合的硝化-反硝化过程为主, 这一推断可通过S+Fe处理下反硝化速率与间隙水NH4+-N含量呈显著正相关(p < 0.01)得以证实.杨麟等(2004)和李佳霖等(2009)研究指出, 受沉积物-水界面硝化作用的控制, 界面上硝化作用生成的NO2-或NO3-能为反硝化提供电子受体, 而Fe(Ⅲ)为反硝化提供电子供体, 进而促进耦合的硝化-反硝化作用的进行.SO42-与Fe(Ⅲ)的竞争中, 一定程度上也会消耗Fe(Ⅲ), 进而对反硝化速率提高具有积极效应(李佳霖等, 2009).目前还未见关于盐水入侵和Fe(Ⅲ)浓度增加共同作用对湿地土壤反硝化速率影响的文献报道, 因此, 有待今后进一步开展相关研究, 特别是关于影响机制的研究, 以期揭示盐水入侵和径流Fe(Ⅲ)浓度增加共同作用对于河口感潮淡水湿地土壤反硝化速率及N2O排放通量的影响及化学和微生物机制.
4.4 短期、脉冲式盐水入侵及径流Fe(Ⅲ)浓度增加对土壤环境指标的影响短期、脉冲式盐水入侵及径流Fe(Ⅲ)浓度增加后, 土壤NH4+-N和NO3--N含量随时间呈波动变化特征, 不同处理对土壤NH4+-N和NO3--N含量影响不显著(p > 0.05), 这主要是因为河口区盐度会影响湿地土壤对于NH4+-N的吸收能力和氮元素的转化(Rysgaard et al., 1999; 李建兵等, 2008), 河口区盐度变化大, 外部环境复杂, 短期、脉冲式盐水入侵及径流Fe(Ⅲ)浓度增加在短时间内不足以显著影响土壤NH4+-N和NO3--N含量的变化.电导率、Cl-和SO42-含量在短期、脉冲式盐水入侵增加后均显著高于对照组(p < 0.05), 这是因为盐水入侵同时伴随着大量的Cl-和SO42-输入, 进而引起电导率的增加(张子川等, 2015).Fe(Ⅲ)浓度增加在不同时间均显著降低了湿地土壤pH值(p < 0.05)(赵娜等, 2010).Fe(Ⅲ)的施加在不同时间均显著增加了湿地土壤三价铁含量(p < 0.05).
5 结论(Conclusions)1) 短期、脉冲式盐水入侵及径流Fe(Ⅲ)浓度增加均未对河口感潮淡水沼泽湿地土壤反硝化速率产生显著影响, 而两者的共同作用显著促进了湿地土壤反硝化速率.
2) 短期、脉冲式盐水入侵显著增加了土壤和间隙水电导率及Cl-和SO42-含量;短期、脉冲式盐水入侵及径流Fe(Ⅲ)浓度增加对河口湿地土壤NH4+-N、NO3--N及间隙水NO3--N含量无显著影响;径流Fe(Ⅲ)浓度增加会显著提高土壤三价铁含量, 而降低土壤和间隙水pH值.
3) 我国福建沿海台风事件可能造成入海河口区短期的盐水入侵和径流Fe(Ⅲ)浓度同时增加的现象, 而该现象将提升河口区感潮淡水湿地土壤反硝化速率, 进而可能影响河口区感潮淡水湿地温室气体排放量.
参考文献
| Allyson L, Bullock Ariana E, Sutton-Grier J, et al. 2013. Anaerobic metabolism in tidal freshwater wetlands:Ⅲ.Temperature regulation of iron cycling[J]. Estuaries and Coasts, 36(3): 482–490.DOI:10.1007/s12237-012-9536-5 |
| 白军红, 王庆改. 2003. 中国湿地生态威胁及其对策[J]. 水土保持研究, 2003, 10(4): 247–249.DOI:10.3969/j.issn.1005-3409.2003.04.069 |
| Ballantine K A, Groffman P M, Lehmann J, et al. 2014. Stimulating nitrate removal processes of restored setlands[J]. Environmental Science & Technology, 48(13): 7365–7373. |
| Bernhard A E, Donn T, Giblin A E, et al. 2005. Loss of diversity of ammonia-oxidizing bacteria correlates with increasing salinity in an estuary system[J]. Environmental Microbiology, 7(9): 1289–1297.DOI:10.1111/emi.2005.7.issue-9 |
| Carretero S, Rapaglia J, Bokuniewicz H, et al. 2013. Impact of sea-level rise on saltwater intrusion length into the coastal aquifer, Partido de La Costa, Argentina[J]. Continental Shelf Research, 62(4): 62–70. |
| Chambers L G, Reddy K R, Osborne T Z. 2011. Short-term response of carbon cycling to salinity pulses in a freshwater wetland[J]. Soil Science Society of America Journal, 75(5): 2000–2007.DOI:10.2136/sssaj2011.0026 |
| 陈娜, 廖敏, 张楠, 等. 2014. Fe2+对水稻生长及土壤微生物活性的影响[J]. 植物营养与肥料学报, 2014, 20(3): 651–660. |
| Clément J C, Shrestha J, Ehrenfeld J G, et al. 2005. Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils[J]. Soil Biology & Biochemistry, 37(12): 2323–2328. |
| Deutsch B, Forster S, Wilhelm M, et al. 2010. Denitrification in sediments as a major nitrogen sink in the Baltic Sea:an extrapolation using sediment characteristics[J]. Biogeosciences Discussions, 7(10): 3259–3271.DOI:10.5194/bg-7-3259-2010 |
| Edwards L, Küsel K, Drake H, et al. 2007. Electron flow in acidic subsurface sediments co-contaminated with nitrate and uranium[J]. Geochimica Et Cosmochimica Acta, 71(3): 643–654.DOI:10.1016/j.gca.2006.09.017 |
| Fear J M, Thompson S P, Gallo T E, et al. 2005. Denitrification rates measured along a salinity gradient in the eutrophic Neuse River estuary, North Carolina, USA[J]. Estuaries, 28(4): 608–619.DOI:10.1007/BF02696071 |
| 付炳炳, 潘建新, 马景德, 等. 2018. 采用含硫铁化学污泥作为反硝化电子供体进行焦化废水中总氮深度去除[J]. 环境科学, 2018, 39(7): 1–13.DOI:10.3969/j.issn.1673-1212.2018.07.001 |
| 高建华, 欧维新, 杨桂山. 2004. 潮滩湿地N、P生物地球化学过程研究[J]. 湿地科学, 2004, 2(3): 220–227.DOI:10.3969/j.issn.1672-5948.2004.03.010 |
| Hou L J, Liu M, Xu S Y, et al. 2007. The effects of semi-lunar spring and neap tidal change on nitrification, denitrification and N2O vertical distribution in the intertidal sediments of the Yangtze estuary, China[J]. Estuarine, Coastal and Shelf Science, 73(3): 607–616. |
| 胡敏杰, 邹芳芳, 仝川, 等. 2014. 闽江河口湿地沉积物生源要素含量及生态风险评价[J]. 水土保持学报, 2014, 28(3): 119–124. |
| 胡松, 朱建荣, 傅得健, 等. 2003. 河口环流和盐水入侵Ⅱ-径流量和海平面上升的影响[J]. 青岛海洋大学学报(自然科学版), 2003, 33(3): 337–342.DOI:10.3969/j.issn.1672-5174.2003.03.002 |
| Hu Y, Wang L, Tang Y, et al. 2014. Variability in soil microbial community and activity between coastal and riparian wetlands in the Yangtze River estuary-Potential impacts on carbon sequestration[J]. Soil Biology & Biochemistry, 70: 221–228. |
| Huang B, Yu K, Gambrell R P. 2009. Effects of ferric iron reduction and regeneration on nitrous oxide and methane emissions in a rice soil[J]. Chemosphere, 74(4): 481–486.DOI:10.1016/j.chemosphere.2008.10.015 |
| 黄文丹.2013.长江河口水体有机胶体含量、来源及其对重金属行为影响的研究[D].上海: 华东师范大学http://cdmd.cnki.com.cn/Article/CDMD-10269-1013272818.htm |
| Hou L J, Liu M, Xu S Y, et al. 2007. The effects of semi-lunar spring and neap tidal change on nitrification, denitrification and N2O vertical distribution in the intertidal sediments of the Yangtze estuary, China[J]. Estuarine Coastal & Shelf Science, 73(3): 607–616. |
| IPCC.2013.Climate Change 2013: The Physical Science Basis.Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M].United Kingdom and New York, NY, USA: Cambridge University Press |
| Katz A, Kaplan I R. 1981. Heavy metals behavior in coastal sediments of southern California:a critical review and synthesis[J]. Marine Chemistry, 10(4): 261–299.DOI:10.1016/0304-4203(81)90010-4 |
| 李浩, 闫玉洁, 谢慧君, 等. 2015. Fe3+对同步硝化反硝化过程氮元素迁移转化及N2O释放的影响[J]. 环境科学, 2015, 36(4): 1392–1398. |
| 李鹤.2011.东南沿海残积土地区降雨型滑坡预警预报体系的研究与应用[D].杭州: 浙江大学http://cdmd.cnki.com.cn/Article/CDMD-10335-1011204087.htm |
| 李家兵, 张宝珠, 朱雨晨, 等. 2017. 闽江河口短叶茳芏群落湿地沉积物反硝化强度对盐度的响应[J]. 生态学报, 2017, 37(1): 177–183. |
| 李家兵, 张党玉, 吴春山, 等. 2017. pH对闽江河口湿地沉积物氮素转化关键过程的影响[J]. 水土保持学报, 2017, 31(1): 272–278. |
| 李佳霖.2009.典型河口区沉积物的硝化和反硝化过程[D].青岛: 中国海洋大学http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1503898 |
| 李建兵, 黄冠华. 2008. 盐分对粉壤土氮转化的影响[J]. 环境科学研究, 2008, 21(5): 98–103. |
| 刘晴晴, 曾从盛, 张林海, 等. 2016. 氮输入条件下闽江河口沼泽土壤的反硝化速率[J]. 湿地科学, 2016, 14(3): 361–367. |
| Magalh?es C M, Joye S B, Moreira R M, et al. 2005. Effect of salinity and inorganic nitrogen concentrations on nitrification and denitrification rates in intertidal sediments and rocky biofilms of the Douro River estuary, Portugal[J]. Water Research, 39(9): 1783–1794.DOI:10.1016/j.watres.2005.03.008 |
| Marton J M, Herbert E R, Craft C B. 2012. Effects of salinity on denitrification and greenhouse gas production from laboratory-incubated tidal forest soils[J]. Wetlands, 32: 347–357.DOI:10.1007/s13157-012-0270-3 |
| Morrissey E M, Gillespie J L, Morina J C, et al. 2014. Salinity affects microbial activity and soil organic matter content in tidal wetlands[J]. Global Change Biology, 20(4): 1351–1362.DOI:10.1111/gcb.2014.20.issue-4 |
| 牟晓杰.2013.闽江河口湿地碳氮循环关键过程对氮输入的响应[D].长春: 中国科学院东北地理与农业生态研究所http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2440321 |
| Nakata H, Yasufumi S, Takashi M A, et al. 2003. Bioaccumulation and toxic potencies of polychlorinated biphenyls and polycyclic aromatic hydrocarbons in tidal flat and coastal ecosystems of the Ariake Sea, Japan[J]. Environmental Science & Technology, 37(16): 3513–3521. |
| Park W, Nam Y K, Lee M J, et al. 2009. Anaerobic ammonia-oxidation coupled with Fe3+, reduction by an anaerobic culture from a piggery wastewater acclimated to NH4+/Fe3+, medium[J]. Biotechnology & Bioprocess Engineering, 14(5): 680–685. |
| 裘诚.2014.长江河口盐水入侵对气候变化和重大工程的响应[D].上海: 华东师范大学http://cdmd.cnki.com.cn/Article/CDMD-10269-1014322337.htm |
| Rysgaard S, Thastum P, Dalsgaard T, et al. 1999. Effects of salinity on NH4+ adsorption capacity, nitrification, and denitrification in danish estuarine sediments[J]. Estuaries, 22(1): 21–30.DOI:10.2307/1352923 |
| Seitzinger S P, Nielsen L P, Caffrey J, et al. 1993. Denitrification measurements inaquatic sediments:a comparison of three methods[J]. Biogeochemistry, 23: 147–167.DOI:10.1007/BF00023750 |
| Seitzinger S P, Spratt A K. 1991. The effect of salinity on ammonium sorption in aquatic sediments:Implications for benthic nutrient recycling[J]. Estuaries, 14(2): 167–174.DOI:10.2307/1351690 |
| Simas T, Nunes J P, Ferreira J G. 2001. Effects of global climate change on coastal salt marshes[J]. Ecological Modelling, 139(1): 1–15.DOI:10.1016/S0304-3800(01)00226-5 |
| 孙东耀, 仝川, 陈坤龙, 等. 2017. 台风"杜鹃"对闽江河口区沼泽土壤间隙水和潮水中营养盐含量的影响[J]. 湿地科学, 2017, 15(6): 809–817. |
| 仝川, 黄佳芳, 王维奇, 等. 2012. 闽江口半咸水芦苇潮汐沼泽湿地甲烷动态[J]. 地理学报, 2012, 67(9): 1165–1180. |
| 童亮, 刘涛. 2017. 浅析东南沿海地区花岗岩球状风化体发育特征及对桩基工程的影响[J]. 资源信息与工程, 2017, 32(1): 137–139, 141. |
| Wall L G, Tank J L, Royer T V, et al. 2005. Spatial and temporal variability in sediment denitrification within an agriculturally influenced reservoir[J]. Biogeochemistry, 76: 85–111.DOI:10.1007/s10533-005-2199-6 |
| Wang D, Chen Z, Xu S, et al. 2006. Denitrification in Chongming east tidal flat sediment, Yangtze estuary, China[J]. Science in China, 49(10): 1090–1097.DOI:10.1007/s11430-006-1090-1 |
| 王树功, 周永章, 黎夏, 等. 2005. 干扰对河口湿地生态系统的影响分析[J]. 中山大学学报(自然科学版), 2005(1): 107–111.DOI:10.3321/j.issn:0529-6579.2005.01.027 |
| Wang W, Sardans J, Lai D Y F, et al. 2015. Effects of steel slag application on greenhouse gas emissions and crop yield over multiple growing seasons in a subtropical paddy field in China[J]. Field Crops Research, 171: 146–156.DOI:10.1016/j.fcr.2014.10.014 |
| 王小红, 杨智杰, 刘小飞, 等. 2016. 中亚热带山区土壤不同形态铁铝氧化物对团聚体稳定性的影响[J]. 生态学报, 2016, 36(9): 2588–2596. |
| Wu S, Kuschk P, Wiessner A, et al. 2013. Sulphur transformations in constructed wetlands for wastewater treatment:A review[J]. Ecological Engineering, 52(2): 278–289. |
| 吴晓燕.2007.黄河入海过程中重金属的变化特征研究[D].青岛: 中国海洋大学http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1071517 |
| 徐皓.2013.长江口营养盐的收支平衡及迁移模式[D].上海: 华东师范大学http://cdmd.cnki.com.cn/Article/CDMD-10269-1014150478.htm |
| 闫玉洁.2013.Fe3+对同步硝化反硝化污水处理过程中温室气体释放的影响[D].济南: 山东大学http://d.wanfangdata.com.cn/Thesis/Y2331794 |
| 杨麒, 李小明, 曾光明, 等. 2004. 同步硝化反硝化的形成机理及影响因素[J]. 环境科学与技术, 2004, 27(3): 102–104, 120.DOI:10.3969/j.issn.1003-6504.2004.03.044 |
| Yang W H, Weber K A, Silver W L. 2012. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 5(8): 538–541.DOI:10.1038/ngeo1530 |
| Yeh C C, Sinclair J B. 2005. Effect of salinity and inorganic nitrogen concentrations on nitrification and denitrification rates in intertidal sediments and rocky biofilms of the Douro River estuary, Portugal[J]. Water Research, 39(9): 1783–1794.DOI:10.1016/j.watres.2005.03.008 |
| Yu J B, Liu J S, Sun Z G, et al. 2010. The fluxes and controlling factors of N2O and CH4, emissions from freshwater marsh in Northeast China[J]. Science China Earth Sciences, 53(5): 700–709.DOI:10.1007/s11430-010-0003-5 |
| Yu K C, Tsai L J, Chen S H, et al. 2001. Correlation analyses on binding behavior of heavy metals with sediment matrices[J]. Water Research, 35(10): 2417–2428.DOI:10.1016/S0043-1354(00)00518-2 |
| 张林海, 刘荣芳, 仝川, 等. 2015. 盐度对闽江河口淡水洲滩土壤潜在反硝化速率及脱氮效率的影响[J]. 湿地科学, 2015, 13(5): 528–534. |
| 张逸飞, 刘小慧, 杨平, 等. 2018. 模拟SO42-沉降对闽江口淡水感潮野慈姑湿地甲烷排放通量的影响[J]. 生态学报, 2018, 38(13): 1–8. |
| 张子川, 杨平, 仝川. 2015. 盐分对河口淡水、微咸水沼泽湿地土壤甲烷产生潜力的影响[J]. 生态学报, 2015, 35(24): 8075–8084. |
| 赵娜, 李鹏飞, 林德华, 等. 2010. 炉渣对调节稻田土壤pH和盐度的有效性分析[J]. 亚热带农业研究, 2010, 6(4): 264–266. |
| 朱文凤, 仝川, 罗敏, 等. 模拟Fe(Ⅲ)和盐水输入对闽江河口潮汐湿地沉积物及间隙水Fe和S形态和含量的影响[J]. 环境科学学报.DOI:10.13671/j.hjkxxb.2018.0214 |
| 朱永官, 王晓辉, 杨小茹, 等. 2014. 农田土壤N2O产生的关键微生物过程及减排措施[J]. 环境科学, 2014, 35(2): 792–800. |
| 邹航.2014.珠江河口湿地沉积物和上覆水中氮的迁移转化过程研究[D].广州: 暨南大学http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D526278 |
