 , 汤兵
, 汤兵
 , 郑义, 丁杰伟, 李志杰
, 郑义, 丁杰伟, 李志杰广东工业大学, 环境科学与工程学院, 广州 510006
收稿日期: 2017-07-10; 修回日期: 2017-08-04; 录用日期: 2017-08-04
基金项目: 国家自然科学基金(No.21476050)
作者简介: 郑丽纯(1992-), 女, E-mail:442945059@qq.com
通讯作者(责任作者): 汤兵, E-mail:renytang@163.com
摘要: 研究了不同的C/N比对半悬浮生物填料同步硝化反硝化(SND)过程的影响,并尝试找出能够实现完全脱氮的最佳C/N比.半悬浮生物填料生物膜反应器采用一种新颖的DO微电极技术展开试验,其结果从物质传递和分子生物学角度来阐明SND效率的差别.结果表明,物质传质和微生物的因素对SND效率有联合作用,生物膜的生物量、生物膜的结构和厚度及EPS在SND过程中有着重要的作用.使用半悬浮生物填料明显提高生物膜反应器内的生物多样性,它可以在C/N比20的条件下运行8 h后实现总氮的去除.
关键词:半悬浮生物填料同步硝化反硝化DO微电极氧传递
Effect of different C/N ratios on the process of simultaneous nitrification and denitrification in a biofilm reactor packed with semi-suspended bio-carriers
ZHENG Lichun
 , TANG Bing
, TANG Bing
 , ZHENG Yi, DING Jiewei, LI Zhijie
, ZHENG Yi, DING Jiewei, LI Zhijie School of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006
Received 10 July 2017; received in revised from 4 August 2017; accepted 4 August 2017
Supported by the National Natural Science Foundation of China(No.21476050)
Biography: ZHENG Lichun(1992—), female, E-mail: 442945059@qq.com
*Corresponding author: TANG Bing, E-mail:renytang@163.com
Abstract: This work mainly focused on the effects of different C/N ratio on the process of simultaneous nitrification-denitrification (SND) on semi-suspended bio-carriers, and tried to find a suitable C/N ratio to achieve the total removal of nitrogen. The experiment was carried out by using a novel DO microelectrode technique in a biofilm reactor packed with semi-suspended bio-carriers, whose results illustrated the difference in the SND efficiency from the viewpoint of mass transferring and molecular biology. The results indicated that the mass transferring and microbial factors had a combined effect on the efficiency of SND, in which, the biomass of biofilm, structure and thickness of the biofilm, and EPS all played an important role in the process of SND. The used semi-suspended bio-carriers obviously improved the biodiversity within the biofilm reactor, which could achieve the total removal of nitrogen under the C/N ratio of 20 after operating for 8 h.
Keywords: semi-suspended bio-carrier biofilmsimultaneous nitrification and denitrification (SND)DO microelectrodeoxygen transfer
1 引言(Introduction)现有污水处理技术有活性污泥法和生物膜法.跟活性污泥法相比, 生物膜法因不存在污泥膨胀问题和剩余污泥少, 能够处理复杂的水质和节省处理空间等, 受到污水处理厂的青睐(许保玫等, 2003).目前使用的传统填料分两种, 一是固定型填料, 它材质轻、韧性好, 可长期使用, 但存在易堵塞, 需安装更换等问题.二是悬浮型填料, 它不易堵塞, 接触面大, 但需要安装拦截装置, 以免堵塞和流失.故此本实验尝试设计出一种半悬浮生物填料, 集中了固定型和悬浮型的优点.填料呈纺锤体型, 空隙率大, 能够在污水中三维均匀流动, 且不易堵塞.同时填料在污水处理过程中绕中心绳运动, 无须安装拦截装置.
氨氮在好氧条件下氧化为亚硝酸盐和硝酸盐(硝化), 随后在缺氧条件下还原为氮气(反硝化), 以上两个步骤同时发生在同一反应器中, 即为同步硝化反硝化(SND).相比活性污泥法, 生物膜法的优势为在单一反应器上实现SND (Pochana et al., 1999).SND脱氮效率的主要影响因素包括:碳源、溶解氧(DO)、生物膜形态学和微生物群落, 以及反应器的操作条件等(Fu et al., 2010).
不同的COD / NH4+(C / N)的比例会影响微生物群落的比例.微生物群落在生物膜中进行着物质交换, 然而微生物活动会影响生物膜中的物质传递(Fu et al., 2010;Vanbenthum et al., 1997).在前人研究的基础上, 本文将进一步研究以下问题(Deygout et al., 2013):首先由于不同C/N产生的不同微生物群落比例对于新填料生物膜的SND过程有何影响?其次不同C/N对生物膜中的物质传递速率有何影响?其传递速率对于生物膜SND过程有何影响?
物质传递中的DO在生物膜中的扩散限制促成了好氧、缺氧和厌氧微生物共存于生物膜中, 氧分层有利于生物膜SND的进行(Mattei et al., 2015).周小红等用微电极研究异养生物膜的反应动力学参数, 结果表明生物膜外部的葡萄糖浓度对生物膜内DO扩散有抑制的影响(Sriwiriyarat et al., 2008).而这种影响对生物膜SND过程的影响研究是少有的(Zhou et al., 2012).本试验将用微电极测量不同C/N生物膜中的DO变化, 分析DO传质系数, 进一步研究不同C/N下的DO传质系数对新填料生物膜SND过程的影响.由于微电极的脆弱性, 鲜有报道关于它应用于填料上的生物膜的测量.最普遍的方法是从填料上刮下生物膜放置于海绵上或在海绵上培养生物膜来进行测量, 但生物膜周围的营养基质和主反应器中不一样(Ning et al., 2014;Zhou et al., 2012).本研究创新性地设计蠕动泵将主反应器与测量槽连接在一起, 最大限度地还原生物膜周围的真实营养基质, 提高生物膜DO测量的可靠性.生物膜特性, 如EPS、外部形态、厚度和生物量也影响生物膜物质的传递.它对新填料上的生物膜SND有怎样的影响, 与物质传递和生物群落有怎样的影响, 也是本文研究的方向(Horn and Hempel, 1997;Bassin et al., 2012).总之, 不同C/N会产生生物膜不同的SND, 但其中包含的因素有多种.本实验旨在研究新填料由于不同C/N产生不同的物质传递、生物群落、生物膜特性对于SND过程的影响.
2 材料和方法(Materials and methods)2.1 填料本研究设计了一种新型载体, 用于处理废水, 如图 1所示.半悬浮生物填料由ABS材料制成, 呈纺锤体型形状, 其目的是减少其在水中的阻力.它长6 cm, 最大直径为4 cm, 并有40个2 mm直径的小孔.经仪器检测得其BET面积为35 m2·g-1, 湿密度接近水密度, 干重6.1768 g.
图 1(Fig. 1)
 |
| 图 1 半悬浮生物填料 Fig. 1Photograph of semi-suspended Bio-carrier |
2.2 反应器构建针对新型生物填料的特殊性, 设计了适用于生物填料的反应器.如图 2所示, 实验室规模的反应器是用有机玻璃(长156 mm, 宽160 mm, 高190 mm, 有效容积5.5 L)制作而成, 反应器内装有斜板, 斜板的作用是收集从底部侧面曝气器中心曝气出来的气泡到反应器中心, 以避免中心曝气对挂膜初期生物填料上生物膜的冲击导致的生物膜脱落.3 d之后, 运行反应器中心生物填料下面的曝气装置, 而侧面底部曝气装置用于调节水中溶解氧.
图 2(Fig. 2)
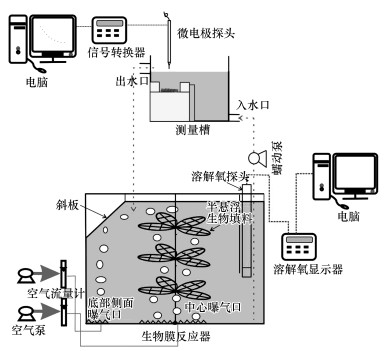 |
| 图 2 反应器和测量装置 Fig. 2Schematic diagram of Reactor and measuring |
2.3 微电极测量首先, 将生物填料上的生物膜刮下置于测量槽(图 2)上专用的海绵上.其次, 使用外部蠕动泵在转速20 r·min-1下连接测量槽和反应器, 实现测量槽和反应室的循环连接.反应室保持恒定的曝气通量, 然后测量过程开始,在反应器运行时间1、4、8、24 h进行.
2.4 运行方案从当地的污水处理厂曝气池的活性污泥取得接种污泥(沥滘污水处理厂, 位于广州市海珠区),其接种的浓度控制在1000 mg·L-1.启动操作时氮负荷率(NLR)和有机负荷率(OLR)分别在20和80~480 g·m-3·d-1.系统运行24 h, 喂养1 h, 曝气运行23 h.运行环境温度通过调节水浴设备保持在27~28 ℃.在运行的最初3 d里, 曝气方式为侧面底部曝气, 接后11 d, 曝气方式为中心曝气联合侧面曝气.反应器的初始溶解氧通过侧面曝气装置控制在3 mg·L-1.第14 d的平均流量数据如图 6所示.在第14 d, 此时的生物膜是成熟的, 分别在2、4、6、8、10、12、14、24 h提取反应器内的处理污水进行分析.不同的条件下的生活污水配方, 如表 1所示.
表 1(Table 1)
| 表 1 营养液配方 Table 1 Nutrient solution formula | |||||||||||||||||||||||||||||||||||
表 1 营养液配方 Table 1 Nutrient solution formula
| |||||||||||||||||||||||||||||||||||
生活污水配方为:溶解性葡萄糖(456、380、304、190、114、76 mg·L-1), 75 mg·L-1NH4Cl, 2 mg·L-1 KH2PO4, 2 mg·L-1Na2HPO4.其他营养成分包括:200 mg·L-1 NaHCO3, 58 mg·L-1 MgSO4, 0.517 mg·L-1 MnSO4·H2O, 13 mg·L-1 CaCl2, 1.43 mg·L-1 FeSO4·7H2O, 2.25 mg·L-1 ZnSO4·7H2O, 0.317 mg·L-1 EDTA, 0.08 mg·L-1 CuSO4·5H2O, , 0.05 mg·L-1 Co(NO3)2·6H2O, 0.037 mg·L-1 Na2B4O7·10H2O.
2.5 分析方法本研究测定了反应器进水和出水的化学成分.包括化学需氧量(COD)的化学分析, 以及氨氮(NH4+-N)、亚硝酸盐氮(NO2--N)、硝态氮(NO3--N)的测定, TN的测定值是基于NH4+-N和NO2--N和NO3--N的总和而不是直接的测试, 按照标准方法测定一个填料上的质量MLSS和MLVSS, 采取3个填料取平均值(国家环境保护总局, 2002).溶解氧(DO)和pH值使用DO和pH计.用游标卡尺测量在不同水位(高、中、低水位)填料上的生物膜厚度.EPS的提取和测量方法根据相关研究报告的方法(Geyik et al., 2015).
载体上的生物膜固定在4%多聚甲醛溶液中, 经乙醇脱水系列处理(即25%、50%、75%、100%, V/V, 0.25 h处理), 每次转移到丙酮3次, 每次0.25 h.这些载体在Tousimis 815 autosamdri临界点干燥器(Tousimis Inc., Rockville, MD, USA)进一步干燥.为了保持微生物的结构.处理后的样品涂金和可视化在15 kV扫描电镜(Hitachi, s-3400N, Japan).
2.6 COD、NH4+在生物膜内的传递分析利用回归方程得到NH4+、TN、COD消耗率(mg·L-1·h-1):R(NH4+)、R(TN)、R(COD).记NH4+消耗时间为T(NH4+)、COD消耗时间为T(COD)、TN消耗时间为T(TN)、TN去除效率为E(TN), 计算公式如下:
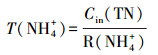 | (1) |
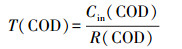 | (2) |
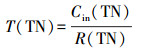 | (3) |
 | (4) |
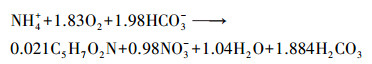 | (5) |
 | (6) |
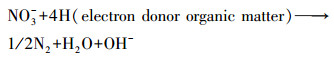 | (7) |
 | (8) |
鉴于在反应器中生物膜的氧消耗过程中溶解氧的质量平衡, 可以建立公式(9)(Garcia-Ochoa et al., 2009).此处OUR是生物膜中微生物的耗氧速率.
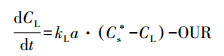 | (9) |
 | (10) |
当溶解氧的传质是稳定的, 即:
 | (11) |
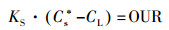 | (12) |
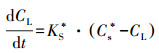 | (13) |
聚合酶链式反应(PCR)完成之后, 采用Sangon agarose回收工具(种类:SK8131)对反应产物进行凝胶电泳试验, 以便对DNA进行复原.根据实际测得的DNA浓度, 采用一定量的Qubit2.0对反应产物进行回收, 反应产物与所有样品进行1:1的混合;样品混合之后充分震动.将混合后的样品按顺序放入样本库(贴上序列标签), 以供测序时使用.基因的测序活动和生物信息学研究是在上海生工生物工程技术服务有限公司的支持下开展的.
焦磷酸测序数据分析:采用默认设置的微生物生态学定量分析工艺过程对16S rRNA基因扩增子焦磷酸测序分析过程中产生的基因序列进行加工(过滤、聚合、按分类学进行分配和校直).上述加工过程包括质量检查、消除干扰、微生物多样性分析.总之, 消除流程图的干扰, 然后采用UCLUST运算法对操作分类单元(OUT)进行分配.在最丰富序列的基础上选取具有代表性的操作分类单元, 利用带绿基因操作分类单元数据集合的核糖体数据库项目(RDP)分类器(置信级至少为0.8)进行分类任务.之后, 采用芬多精最近校直空间终端工具(PyNAST)的校直运算法对上述基因序列进行校直.
3 结果与讨论(Results and discussion)3.1 有机物、生物膜中的NH4+传递和SND过程分析从图 3a可知, COD消耗的时间远远短于氨氮消耗时间, COD的消耗时间为4~8 h, 而氨氮的消耗时间为8~14 h.随着COD的增加, 氨氮消耗时间呈递减趋势, 然而COD消耗时间和COD的消耗率却在增加.从图 3b可知, C20条件下TN去除率为最高, 基本能够完成SND, 但C24却低于C20, 与其他条件一样不能实现完全的SND.除了C24, TN去除率是随着COD的增加而增加.从上面的分析, 可以得出除了C24, 附着在新型生物填料上的生物膜的SND效率的提高主要取决于COD的增加;COD的增加加快了氨氮的传递速率和COD消耗率.
图 3(Fig. 3)
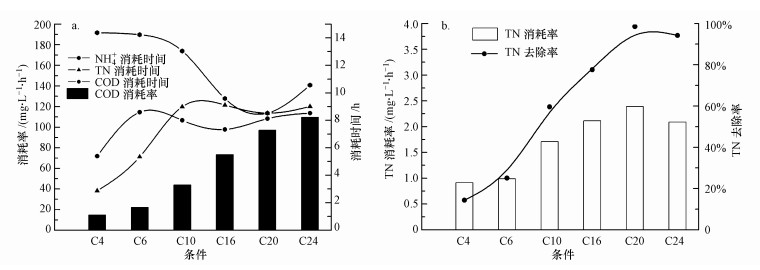 |
| 图 3 生物膜中物质传递 (a.不同条件下NH4+、TN消耗时间和COD消耗时间和消耗率, b.不同条件下TN去除率和消耗率) Fig. 3Matters transfer in biofilm performance (a. NH4+, TN and COD consumption time and rate in the different condition, b. TN consumption time and removal rate in the different condition) |
公式(6)和公式(7)表明, COD的增加, 会加速反硝化作用, 增加TN的去除率, 使公式中的NO2-和NO3-减少, 进而使得使氨氮氧化速率加快.即COD的增加使得SND过程中的硝化和反硝化过程缩短.由于氨氮的氧化速率加快相对应的是氨氮的消耗时间的缩短, 但从图 3a可知, COD的增加对氨氮的氧化速率不一定有完全的积极影响.在C24条件下, 氨氮消耗时间反弹增加, COD的消耗时间比氨氮的消耗时间短, TN不能完全去除, 故TN的去除率下降, 这表明在SND过程中过多的COD不会促进硝化反应, 也会使得完成反硝化受到限制.这其中的原因需要进一步去分析.
从图 3a可知, C4和C6的COD消耗时间大于TN的消耗时间, 这表明即使COD足够用于反硝化反应, 反硝化还是不进行.反硝化是在贫氧条件下进行的, 而有机质传递此时没有结束, 可以推测出在C4和C6条件下生物膜的缺氧条件丢失.C10、C16的条件下, COD消耗时间后, 生物膜仍能进行反硝化.由于生物膜外碳源已经用完, 则有两种存在的可能原因:一种是微生物在生物膜缺氧层可能使用自身代谢物进行反硝化, 目前这一方面没有充分的证实;另一种是贫氮层反硝化缓慢进行, 这说明反硝化的活性不高.在C20的条件下, TN和氨氮的消耗时间基本上与COD的消耗时间相同, 说明发生了同步硝化反硝化.COD消耗时间略低于前两种, 其原因与前两种条件是相同的.C24的条件下, 氨氮消耗时间反弹, TN不能完全去除.此时有机物无论是外源的还是内源的, 两者都是足够的, 则反硝化效率下降的主要原因是硝化效率下降.
理论上反硝化反应所需要的COD一般为3.5~4.5 g COD/ g N (Pochana et al., 1999), 试验中没有实现低碳比的SND.C4和C6条件下不能进行反硝化的原因是有机物不能被利用, 以及此时的硝化能力也较弱.故SND过程在低C/N条件下硝化和反硝化都受到了限制.根据菲克扩散定律:COD越高, 扩散到缺氧层越多.结合用于反硝化的COD和实际消耗的COD, 无论在任何条件, 试验中反硝化碳值占比都不会超过总碳值20%.这说明好氧层用的COD比缺氧层多的多, 才降低了脱氮效率.在这种情况下, C20是最好的条件.
3.2 EPS对SND过程的影响图 4a反映了在开启底部曝气装置前后TN去除率的改变值.在相同的流量范围变化前后, C24的条件下, TN去除率的差值最低.底部曝气出的气泡会冲击生物填料, 使得生物膜在生物膜初期生长过程中不容易粘附在生物填料上.图 4b反映了生物膜内3种类型的EPS的比例变化:Tightly Bound-EPS (TB-EPS)、Loosely Bound-EPS (LB-EPS)和Soluble EPS.根据研究结果, C20和C24相比其他条件的TB-EPS占EPS的比例最大.TB-EPS占EPS比重越大, 表明生物膜与生物填料表面的结合更加紧密(Tang et al., 2016).前3 d中微生物在生物填料上固定并在其上面形成生物膜, 由图 4a可知, 开启底部曝气之后, 低C/N的粘附并不稳定, 才使得整体的TN去除率下降.在生物膜SND过程中硝化和反硝化都需要实现反应的场所, 高C/N会使得生物膜在生物填料上粘附的更紧, 提高了SND的效率.
图 4(Fig. 4)
 |
| 图 4 EPS对SND的影响 (a.TN去除率变化值, b.不同条件生物膜中EPS不同成分的比例) Fig. 4The effect of EPS to SND (a. TN removal rate D-value, b. The sub-components of EPS in the biofilm in the different condition) |
3.3 生物膜的结构对SND过程的影响在废水处理中, 底物基质在生物膜内的消耗主要靠扩散.物质扩散传质速率与生物膜的结构和厚度有很大关系.最近的研究表明, 生物膜不是均匀而是不均匀和多孔结构复杂的(Seker et al., 1995).并且其内部的微生物聚集形式多样.其形态可以紧密或松散的, 生物膜的结构可致密光滑或粗糙(Iltis et al., 2011). 图 5显示了附着在生物填料上的不同条件下生物膜的形态.C4条件下, 长在生物膜表面有似弹簧形状的微生物, 使生物膜表面的孔比其他条件的大, 表现出比较疏松.由图 5a~5f可知, 直到条件C24可以看到越来越多的丝状微生物生长在膜表面.同时, 在条件C24可以证明高厚度的生膜空隙是更加的小, 表现出更加紧密.生物膜的结构是从疏松到紧密, 这说明从低C/N条件到高C/N条件, 微生物趋势为疏松生长到密集生长(Lewandowski et al., 2000).SND过程中物质需要有通道去传递, 过于密集和过于疏松的生物膜会难以实现SND.
图 5(Fig. 5)
 |
| 图 5 生物膜表面形态SEM图 (a. C4, b. C6, c. C10, d. C16, e. C20, f. C24) Fig. 5SEM photograph of the morphology on the surface of the biofilm |
3.4 生物膜氧传递对SND过程的影响3.4.1 反应器中的耗氧速率试验分析底部侧面流量增加会增加气泡和营养液之间的KLɑ值.在反应器中, 假定流体物质是恒定的, 那么因为温度是恒定的, 所以CS*是恒定的.当CL控制在3 mg·L-1, 结合公式(9), OUR与KLɑ正相关, 这意味着当KLɑ增加, OUR将增加.由此可以得出结论, 底部侧面流量的大小可以反映出OUR的大小, 即生物膜的活性指标.
从图 6a和图 6b可以看出, 大体上质量、OUR和厚度会随着C/N增加而增加.
图 6(Fig. 6)
 |
| 图 6 生物膜OUR与生物量的关系 (a.不同条件侧面底部曝气量, b.不同条件下粘附在生物填料的生物膜VSS和厚度) Fig. 6The relationship between OUR of biofilm and biomass (a.Side-bottom aeration flux on the different conditions, b. VSS and thickness of biofilm attached on the Bio-carrier in the different conditions) |
3.4.2 生物膜中的溶解氧分布定义好氧为大于0.5 mg·L-1, 缺氧是0.2~0.5 mg·L-1, 厌氧是小于0.2 mg·L-1.在同一时间的不同条件的生物膜内DO的分布都不一样.随着C/N增加, 生物膜好氧层厚度会更小, 但可以提供反硝化条件的缺氧和厌氧层厚度就更大.随着时间的推移, 缺氧和厌氧层逐渐减少, 有些甚至消失.前面讨论的问题, 在C4和C6条件下, TN消耗时间低于COD消耗时间的原因则可以解释为由于缺乏进行反硝化的缺氧环境.
根据公式(12), 在表 2所示的OUR在每一种条件下会随着时间变小.在同一生物膜外部营养物浓度变小会使得生物膜的OUR变小.这一点跟其他研究结论相同, 生物膜外COD越高生物膜的OUR就越大(Zhou et al., 2009).从图 7a~7b可以看出随着时间的变化, DO在生物膜内部的分布变化为好氧层厚度逐渐增加, 最后占领整个生物膜厚度.
图 7(Fig. 7)
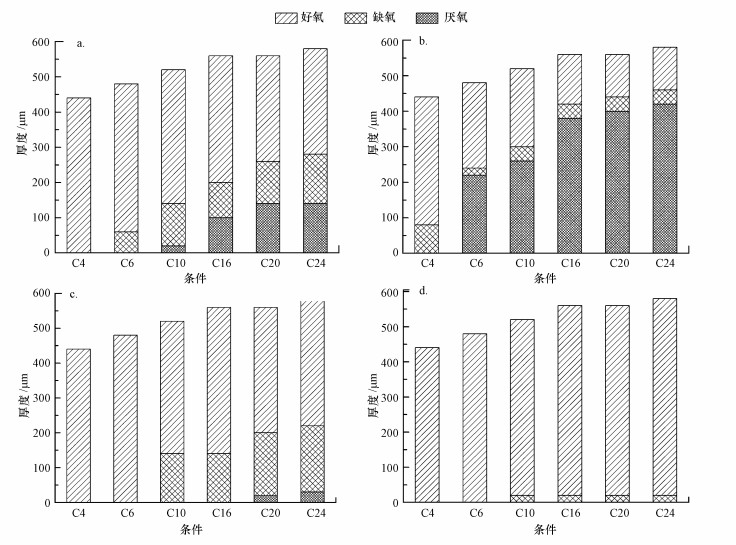 |
| 图 7 生物膜中溶解氧的分布 (a. 1 h, b. 4 h.c. 8 h, d. 24 h) Fig. 7Dissolved oxygen distribution in the biofilm (a. 1 h, b. 4 h.c. 8 h, d. 24 h) |
表 2(Table 2)
| 表 2 不同条件下随时间变化的OUR值 Table 2 OUR change with the time in the different condition | |||||||||||||||||||||||||||||||||||
表 2 不同条件下随时间变化的OUR值 Table 2 OUR change with the time in the different condition
| |||||||||||||||||||||||||||||||||||
结合图 7a和公式(13)可知, 因为距离长传递的时间越长, 有更多的时间来传递, 因此可以从传递距离得出:KS*(C4)> KS*(C6)> KS*(C10)> KS*(C16)> KS*(C20)> KS*(C24).由于传质系数越大, 传质阻力将越小.研究可以得出高COD会使得生物膜DO传质阻力更大.但这有助于DO在生物膜好氧、缺氧和厌氧层的形成.结合生物膜在图 5所示的形态, 更高的生物膜的孔密度具有更高的传递阻力.
C/N越高, 生物膜的生物量和OUR就越大, 反应器提供的氧气就要更多, 硝化反应需要在好氧的条件下进行, 即高C/N需要更高的曝气量.高C/N生物膜的传质阻力越大, 更加有利于反硝化进行.鉴于图 3, C20的运行时间可以减少到8 h就可以完成SND.
3.5 生物高通量数据分析生物膜样品分别取不同的条件C4、C6、C10、C16、C20、C24, 接种污泥(Initial)也被采样进行比较.一系列的通量数据分析, 结果显示在图 8a和图 8b, 代表着6个条件和接种污泥的门相对丰度和生物多样性.如图 8所示, 接种污泥的微生物群落中, 主要菌群为变形菌门、拟杆菌门和绿弯菌门;在C4样品的微生物群落中, 主要菌群为变形菌门、拟杆菌门、厚壁菌门和浮霉菌门;在C6样品的微生物群落中, 主要菌群为变形菌门、拟杆菌门、厚壁菌门和浮霉菌门;在C10样品的微生物群落中, 主要菌群为变形菌门、拟杆菌门、浮霉菌门和绿弯菌门;在C16样品的微生物群落中, 主要菌群为变形菌门、拟杆菌门、芽单胞菌门和暂定种Saccharibacteria; 在C20样品的微生物群落中, 主要菌群为变形菌门、拟杆菌门、暂定种Saccharibacteria和浮霉菌门;在C24样品的微生物群落中, 主要菌群为变形菌门、拟杆菌门、绿弯菌门和浮霉菌门;其中C4和C6的主要菌群一致, C10和C24主要菌群一致, C16和C20略微有差别.一开始碳氮的比例不是很明显, C4和C6差别不是很大, 随着COD的增加生物膜的主要菌群发生改变.在所有样品中, 硝化螺旋菌门类菌群分别占0.49、0.02、0.05、0.43、0.73、1.64和0.3.
图 8(Fig. 8)
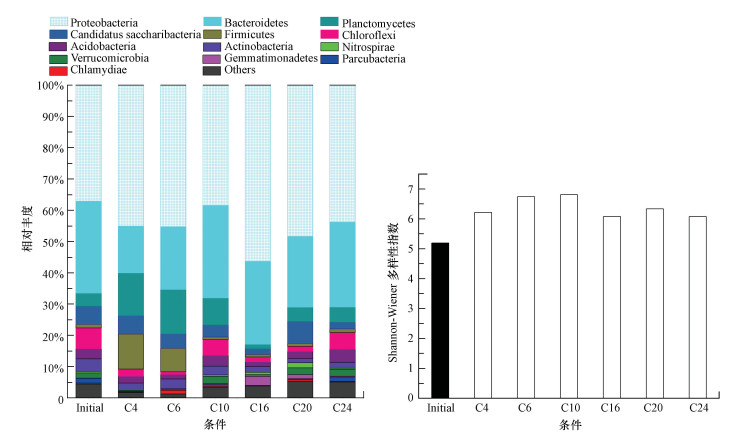 |
| 图 8 生物高通量数据分析 (a.不同条件和初始接种污泥的不同门相对丰度; b.不同条件的生物多样性) Fig. 8Biological high-throughput data analysis (a. Relative abundance of different phyla in the different condition and the initial inoculation sludge, b. Biodiversity in the different condition) |
一些研究已经表明, 变形杆菌和拟杆菌主要是负责一些污染物(COD的去除和脱氮硫代谢)(Gao et al., 2011;Snaidr et al., 1997).硝化螺旋菌门中包含有在氮素循环过程中重要的硝化螺旋菌种(Ushiki et al., 2013).在条件C20的硝化螺旋菌门的比例大于其他条件.条件C4到C20的硝化螺旋菌门的比例越来越大, 这表明碳源是硝化微生物生长所必需的.然而, 在条件C24, 硝化螺旋菌门比例下降并低于C10, 这表明较高的碳源会使得硝化细菌的生存空间减少.这一现象与一些研究生物膜SND是一样的(Bassin et al., 2012;FIgueroa et al., 1992).从而得出, 较高的COD将提高TN去除率, 但会占用硝化细菌的生存空间, 使得SND的硝化过程受阻碍, 降低了TN去除率.
为了定量评价生物膜不同状态下的生物多样性, 采用了Shannon-Wiener多样性指数.指数越高则代表其生物多样性越高.不同条件和接种污泥中微生物群落的差异有明显的变化.各个条件的生物多样性都比初始接种污泥的高, 表明半悬浮生物填料能够提高微生物的多样性, 除C24条件外, 不同条件下的微生物群落多样性呈上升趋势.在低C/N比下, 由于碳源缺乏, 大多数细菌、异养细菌可能受到限制(Fu et al., 2010).高COD有利于异养生物的发展, 它比自养生物的生长速度更快, 并掠夺更多的氧气和营养(Lee et al., 2004).生物膜微生物的多样性的提高增加了同步硝化反硝化效率.因此, C20是最佳条件.
4 结论(Conclusions)新的半悬浮生物填料生物膜最佳C/N比是20, 而运行时间可以缩短至8 h.不同C/N新型生物填料的SND过程影响研究表明:
1) 半悬浮生物填料在C/N=20实现完全脱氮, 在底部气泡的冲击下仍然可以实现高效的同步硝化反硝化, 表明填料具有很好的耐冲击能力, 符合填料的水流线性设计.填料上生物膜的主要菌群为变形菌门和拟杆菌门.该填料可以增加接种活性污泥的生物多样性, 因而也增加了SND的效率.
2) 半悬浮生物填料生物膜反应器的侧面曝气减少了迅速挂膜过程中对填料的冲击, 在处理水质方面, 在C/N=20时, COD消耗率为49.26 mg·L-1·h-1, TN的消耗率为2.4 mg·L-1·h-1, 两者基本完全去除.
3) 在基于该半悬浮生物填料的反应器中, C/N比对同步硝化反硝化过程的影响规律为:低C/N比的缺氧环境变少, 使得生物膜和生物填料之间的粘附力不足, 导致SND效率较弱;高C/N比可以促进硝化和反硝化反应的进行, 并且提高生物膜孔密度促使氧传质阻力变大, 增加了硝化螺旋菌门类菌群的比例和生物多样性, 更加有利于提高SND效率.然而太高的C/N比将减少硝化螺旋菌门类菌群的比例, 减少生物多样性, 使SND效率下降.
从生物膜特性、物质传递和分子生物学三大方面研究可以为新型填料的推广和稳定使用提供可靠的科学依据.
参考文献
| Bassin J P, Kleerebezem R, Rosado A S, et al. 2012. Effect of different operational conditions on biofilm development, nitrification, and nitrifying microbial population in moving-bed biofilm reactors[J]. Environmental Science & Technology, 46: 1546–1555. |
| Deygout C, Lesne A, Campillo F, et al. 2013. Homogenised model linking microscopic and macroscopic dynamics of a biofilm:Application to growth in a plug flow reactor[J]. Ecological Modelling, 250: 15–24.DOI:10.1016/j.ecolmodel.2012.10.020 |
| Figueroa L A, Silverstein J. 1992. The effect of particulate organic matter on biofilm nitrification[J]. Water Environment Research, 64: 728–733.DOI:10.2175/WER.64.5.10 |
| Fu B, Liao X, Ding L, et al. 2010. Characterization of microbial community in an aerobic moving bed biofilm reactor applied for simultaneous nitrification and denitrification[J]. World Journal of Microbiology and Biotechnology, 26: 1981–1990.DOI:10.1007/s11274-010-0382-y |
| Gao X Y, Xu Y, Liu Y, et al. 2011. Bacterial diversity, community structure and function associated with biofilm development in a biological aerated filter in a recirculating marine aquaculture system[J]. Marine Biodiversity, 42: 1–11. |
| Gapes D, Pratt S, Yuan Z, et al. 2003. Online titrimetric and off-gas analysis for examining nitrification processes in wastewater treatment[J]. Water Research, 37: 2678–2690.DOI:10.1016/S0043-1354(03)00022-8 |
| Garciaochoa F, Gomez E. 2009. Bioreactor scale-up and oxygen transfer rate in microbial processes:an overview[J]. Biotechnol Adv, 27: 153–176.DOI:10.1016/j.biotechadv.2008.10.006 |
| Geyik A G, ?een F. 2015. Variations in extracellular polymeric substances (EPS) during adaptation of activated sludges to new feeding conditions[J]. International Biodeterioration & Biodegradation, 105: 137–145. |
| 国家环境保护总局. 2002. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社: 211–213. |
| Horn H, Hempel D C. 1997. Growth and decay in an auto-heterotrophic biofilm[J]. War Res, 31: 2243–2252.DOI:10.1016/S0043-1354(97)00081-X |
| Iltis G C, Armstrong R T, Jansik D P, et al. 2011. Imaging biofilm architecture within porous media using synchrotron-based X-ray computed microtomography[J]. Water Resources Research, 47: W02601. |
| Lee L Y, Ong S L, Ng W J. 2004. Biofilm morphology and nitrification activities:recovery of nitrifying biofilm particles covered with heterotrophic outgrowth[J]. Bioresour Technol, 95: 209–214.DOI:10.1016/j.biortech.2003.05.004 |
| Lewandowski Z. 2000. Notes on biofilm porosity[J]. Water Research, 34: 2620–2624.DOI:10.1016/S0043-1354(00)00186-X |
| Mattei M R, Frunzo L, Dacunto B, et al. 2015. Modelling microbial population dynamics in multispecies biofilms including Anammox bacteria[J]. Ecological Modelling, 304: 44–58.DOI:10.1016/j.ecolmodel.2015.02.007 |
| Pochana K, Keller J. 1999. Study of factors affecting simultaneous nitrification and denitrification (SND)[J]. Wat Sci Tech, 39: 61–68. |
| Seker S, Beyenal H, Tanyolac A. 1995. The effects of biofilm thickness on biofilm density and substrate[J]. Journal of Biotechnology, 41: 39–47.DOI:10.1016/0168-1656(95)00050-Z |
| Snaidr J, Amann R, Huber I, et al. 1997. Phylogenetic analysis and in situ identification of becteria in activated sludge[J]. Applied and Environmental Microbiology, 63: 2884–2896. |
| Sriwiriyarat T, Unfkurarate W, Fongsatitkul P, et al. 2008. Effects of dissolved oxygen on biological nitrogen removal in integrated fixed film activated sludge (IFAS) wastewater treatment process[J]. Journal of Environmental Science and Health Part A, Toxic/Hazardous Substances & Environmental Engineering, 43(5): 518–527. |
| Tang B, Yu C, Bin L, et al. 2016. Essential factors of an integrated moving bed biofilm reactor-membrane bioreactor:Adhesion characteristics and microbial community of the biofilm[J]. Bioresour Technol, 211: 574–583.DOI:10.1016/j.biortech.2016.03.136 |
| Ushiki N, Fujitani H, Aoi Y, et al. 2013. Isolation of Nitrospira belonging to Sublineage Ⅱ from a Wastewater Treatment Plant[J]. Microbes and Environments, 28: 346–353.DOI:10.1264/jsme2.ME13042 |
| Vanbenthum W, Vanloosdrecht M, Heijnen J. 1997. Process design for nitrogen removal using nitrifying biofilm and denitrifying suspended growth in a biofilm airlift suspension reactor[J]. Water Science and Technology, 36: 119–128. |
| 许保玫, 龙腾锐. 2003. 当代给水与废水处理原理[M]. 北京: 高等教育出版社: 476. |
| Zerari K, Seyssieq I, Akretche D E, et al. 2013. Enhancement of oxygen mass transfer coefficients in a hybrid membrane bioreactor[J]. Journal of Chemical Technology & Biotechnology, 88: 1007–1013. |
| Zhou X H, Liu J, Song H M, et al. 2012. Estimation of heterotrophic biokinetic parameters in wastewater biofilms from oxygen concentration profiles by microelectrode[J]. Environmental Engineering Science, 29: 466–471.DOI:10.1089/ees.2010.0456 |
| Zhou X H, Qiu Y Q, Shi H C, et al. 2009. A new approach to quantify spatial distribution of biofilm kinetic parameters by in situ determination of oxygen uptake rate (OUR)[J]. Environ Sci Technol, 43: 757–763.DOI:10.1021/es802373q |
