 , 程文, 万甜
, 程文, 万甜
 , 王敏, 张晓晗
, 王敏, 张晓晗西安理工大学水利水电学院, 西北旱区生态水利国家重点实验室, 西安 710048
收稿日期: 2018-02-22; 修回日期: 2018-03-26; 录用日期: 2018-03-26
基金项目: 国家自然科学基金(No.51679192,51709224);陕西重点研究开发项目(No.2017SF-392)
作者简介: 任杰辉(1990-), 男, E-mail:rjh_xaut@163.com
通讯作者(责任作者): 万甜, E-mail:wantian@xaut.edu.cn
摘要: 采用热提取法提取污泥中微生物细胞外的胞外聚合物(Extracellular Polymeric Substance,EPS),分析了不同提取时间、提取温度、缓冲液盐度对污泥中EPS提取效果的影响,并采用平行因子模型(PARAFAC模型)分析了不同缓冲液盐度下EPS的荧光组分及特性,探究了缓冲液盐度对热提取污泥EPS的影响.结果表明,缓冲液盐度对热提取EPS的组分和荧光物质的强度均产生影响,0.50%的氯化钠缓冲液盐度条件下松散型EPS(loosely bound EPS,LB-EPS)组分含量及荧光物质最佳,0.05%氯化钠缓冲液盐度条件下紧密型EPS(tightly bound EPS,TB-EPS)的提取效果最佳;当提取时间为40 min,提取温度为70℃时,总EPS含量达(93.26±2.07)mg·g-1(以VSS计);三维荧光结果显示,不同缓冲液盐度条件下污泥中EPS均包含类蛋白质(C1:λEx/λEm=290 nm,302/350 nm)、类色氨酸(C2:λEx/λEm=278 nm,340 nm)、类胡敏酸(C3:λEx/λEm=310 nm,410 nm)和类腐殖酸(C4:λEx/λEm=380/420 nm,474/514 nm)4类荧光组分峰,在溶解性EPS(SMP)和LB-EPS中类色氨酸的荧光强度最高,TB-EPS中类蛋白质荧光强度最高.因此,合适的热提取缓冲液盐度,有利于污泥EPS中各组分的高效提取.
关键词:污泥胞外聚合物盐度平行因子模型蛋白质
Effect of buffer salinity on heat extraction of extracellular polymeric substances from activated sludge
REN Jiehui
 , CHENG Wen, WAN Tian
, CHENG Wen, WAN Tian
 , WANG Min, ZHANG Xiaohan
, WANG Min, ZHANG Xiaohan State Key Laboratory of Eco-hydraulics in Northwest Arid Region, Institute of Water Resources and Hydro-Electric Engineering, Xi'an University of Technology, Xi'an 710048
Received 22 February 2018; received in revised from 26 March 2018; accepted 26 March 2018
Supported by the National Natural Science Foundation of China (No.51679192, 51709224) and the Key R & D Plan in Shaanxi Province (No.2017SF-392)
Biography: REN Jiehui (1990—), male, E-mail:rjh_xaut@163.com
*Corresponding author: WAN Tian, E-mail:wantian@xaut.edu.cn
Abstract: In this paper, the heat extraction method was used for extracting extracellular polymeric substances (EPS) from microbial cells in activated sludge. The effects of extraction time, extraction temperature and buffer salinity on the EPS extraction were analyzed. The parallel factor model (PARAFAC model) was used to study the fluorescence components and properties of EPS in different buffer salinities. The result showed that buffer salinity greatly affected the substance content and the intensity of fluorescent substance of heat extracting EPS. For the content of loosely bound EPS (LB-EPS) was high and the intensity of fluorescent substance was heavy with a sodium chloride buffer salinity of 0.50%; and for tightly bound EPS (TB-EPS), extraction the sodium chloride buffer salinity of 0.05% has the best efficiency. The total extracting content of EPS reached to (93.26±2.07) mg·g-1 with a temperature of 70℃ and extraction time of 40 min. The results of three-dimensional fluorescence analysis showed that EPS in activated sludge contained four kinds of fluorescent component peaks of protein-like (C1:λEx/λEm=290 nm, 302/350 nm), tryptophan-like (C2:λEx/λEm=278 nm, 340 nm), humilic acid-like (C3:λEx/λEm=310 nm, 410 nm) and humic acids-like (C4:λEx/λEm=380/420 nm, 474/514 nm) in different buffer salinities. Tryptophan-like fluorescent intensity was the highest in soluble EPS (SMP) and LB-EPS, and protein-like fluorescent intensity was the highest in TB-EPS. Therefore, an appropriate buffer salinity of heat extraction was beneficial to the extraction of the components in sludge EPS.
Key words: sludgeextracellular polymeric substances (EPS)salinityparallel factor modelprotein
1 引言(Introduction)胞外聚合物(Extracellular Polymeric Substances, 简称EPS)是在一定条件下由微生物分泌于体外的一些高分子聚合物, 主要包括蛋白质、多糖和DNA(袁冬琴等, 2012).EPS源自于活性细菌分泌、细胞自溶和原水基质, 在微生物细胞之间起到架桥作用, 被用于细胞之间物质与能量的传递, 对活性污泥的絮凝、沉降和脱水性能产生直接影响(黄兴等, 2009), 其组成往往与污染物去除及污水处理方式密切相关(樊鹏超等, 2017; Carles et al., 2013; 龙向宇等, 2012).按EPS分布形式, 可以分为溶解性EPS(SMP)、松散型EPS(LB-EPS)、紧密型EPS(TB-EPS), 其中, SMP溶解于液体中, 与细胞衰减和基质代谢成比例;LB-EPS位于TB-EPS外, 黏合细胞群形成菌落或者絮体;TB-EPS附着于细胞壁表面, 起连接细胞群作用(Mahmoud et al., 2011).因此, 研究活性污泥中EPS的分布特性, 对于明确活性污泥的特性、污水的处理效率及污泥减量与资源化具有重要意义(Li et al., 2015; 龙向宇等, 2012).
针对EPS提取的方法很多, 主要的提取方法有离心法、超声波法、EDTA法、加热法、NaOH法、阳离子树脂交换法、甲醛+NaOH法、化学试剂外加电场法等(王淑莹等, 2016), 然而, 目前仍没有一种规范的提取EPS方法.周俊等(2013)、刘翔等(2011)、邬卓颖等(2012)发现, EPS提取方法按提取效率依次为:甲醛+NaOH>2%EDTA>加热>甲醛+超声>超声>对照>甲醛, 其中, 甲醛和NaOH的投加会对EPS后续分析产生影响, 超声提取EPS往往不完全, 这些研究均指出热提取法具有显著优势, 不仅对EPS的提取效率较高, 而且操作简单、方便.热提取法是一种利用加热使得细胞表面EPS与细胞间作用力降低, 在离心作用下使EPS与细胞剥离的提取方法.近年来, 已有许多****针对热提取法的提取温度及提取时间做了一些研究, 王淑莹等(2016)、李继宏等(2013)研究发现, 提取温度为80 ℃, 提取时间为40 min时, EPS的提取量最高.在热提取法中, 为了给污泥提供较为合适的环境, 往往采用氯化钠作为缓冲液, 为EPS提供溶解的环境.Li等(2013)分析了活性污泥在各种盐度下形成的可溶性微生物产物, 发现盐度会影响SMP的形成, 随着氯化钠浓度的增加, 酪氨酸和色氨酸区域的标准化体积百分比增加, 而腐殖酸和富里酸区域的体积百分比显著降低.然而, 目前很少有人针对热提取法的缓冲液盐度开展研究.因此, 本研究从不同类型EPS的含量及荧光特性出发, 探究盐度对热提取EPS效果的影响, 以期为EPS各组分更高效的提取提供技术参考.
同时, 袁冬琴等(2012)研究发现, 氯化钠浓度不同是导致离子强度差异的原因, 进而会引起EPS表面Zeta电位和电导率的改变;王浩宇等(2012)研究了Zeta电位、胞外多聚物的变化及两者之间的关系, 发现蛋白质对降低污泥表面电位, 促进污泥聚集及好氧颗粒污泥的形成生长等可能起着重要作用.安莹等(2014)采用三维荧光光谱分析了不同盐度下MBR中EPS的变化规律, 并应用平行因子模型(PARAFAC)处理三维荧光数据, 研究发现, 所有样品中均含有蛋白质组分(C1)、类胡敏酸组分(C2、C3、C4).因此, 研究缓冲液的盐度对热提取污泥EPS的影响具有重要意义.本文以活性污泥为研究对象, 采用热提取法提取污泥中的EPS, 分析提取缓冲液盐度、提取时间、提取温度对EPS提取的影响, 并基于PARAFAC模型深入探究缓冲液盐度对热提取EPS三维荧光特性的影响, 以优化热提取法在污泥EPS提取方面的应用.
2 材料与方法(Materials and methods)2.1 试验材料选用西安市某污水厂污泥浓缩池的剩余污泥作为研究对象, 该污水厂采用氧化沟活性污泥法处理城市污水.采集的污泥样品均在2 h内运至实验室, 并保存于冰箱中备用, 所有试验均在采集样品后7 d内完成, 所有指标的测量均采用标准方法.分析结果显示, 活性污泥的污泥沉降比(SV)为98.00%, 污泥容积指数(SVI)为74.6 mL·g-1, 悬浮固体(MLSS)含量为13.22 g·L-1, 可挥发性固体(VSS)为5.25 g·L-1.为了保证污泥性状不发生改变, 从现场取样后立即送实验室提取EPS, 分析EPS组分的含量.
2.2 试验方法活性污泥EPS组分采用热提取法提取, 具体提取过程如图 1所示.为了优化热提取法对EPS的提取, 参考李继宏等(2013)的研究成果, 提取方法的条件为:0.85%氯化钠缓冲液, 提取温度80 ℃, 提取时间40 min.为了进一步优化热提取法在EPS提取方面的应用, 探究不同氯化钠缓冲液盐度(0、0.05%、0.20%、0.35%、0.50%、0.65%、0.80%、1.00%)、提取温度(50、60、70、80、90、100 ℃)和提取时间(5、10、20、30、40、50、60 min)对热提取法提取EPS效果的影响.
图 1(Fig. 1)
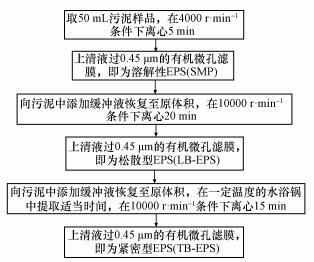 |
| 图 1 EPS提取方法 Fig. 1Method of extraction |
2.3 分析方法2.3.1 EPS组分分析EPS的提取效率通过蛋白质、多糖、DNA的含量表征.蛋白质采用修正Folin-Lowry法测定(标准物质为牛血清蛋白), 多糖采用蒽酮法测定(标准物质为葡萄糖), DNA采用二苯胺法测定(标准物质为小牛胸腺DNA), 各组分的含量以每克有机物中物质的含量表示, 单位为mg·g-1(以VSS计), 以3种物质的含量表征不同组分EPS的含量(刘翔等, 2011).
2.3.2 EEM分析采用FluoroMax-4荧光光谱仪测定EPS样品中的荧光物质, 如类蛋白、富里酸及腐殖酸等荧光物质(Sheng et al., 2013).激发波长(λEx)的扫描范围为240~450 nm, 发射波长(λEm)的扫描范围为290~550 nm, 步长均为2 nm, 狭缝宽度均为3 nm.
2.3.3 平行因子模型分析平行因子分析模型(PARAFAC模型)已在Stedmon和Bro(2008)的文章中被详细描述, 这里只做简单的介绍.PARAFAC是双线性主成分分析(PCA)到更高阶阵列的推广, 即将N路数组分解为N个加载矩阵.在EEM数据分析中, 平行因子模型方程如下(Yu et al., 2010; Elcoroaristizabal et al., 2015):
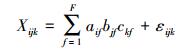 | (1) |
参照Stedmon等(2008)的平行因子分析步骤, 利用Matlab R2014a(Mathworks, Natick, MA)的DOMFluor toolbox分析EEM的测定结果.对参数应用非负性约束以仅允许化学相关的结果;几个预处理步骤被用来降低最小化散射线和EEM的其他属性的影响;从每个样品EEM中减去对照Milli-Q水的EEM;其他瑞利与拉曼散射被扣除.通过上面的处理, 减少不同样品中不同EPS含量对组分矩阵的影响.计算了2~7个分量的PARAFAC模型的EEM, 基于残差分析、目视检查等确定组分的正确数量(Liu et al., 2017).
3 结果与讨论(Results and discussion)3.1 提取时间对EPS提取的影响图 2为在提取温度80 ℃, 氯化钠缓冲液盐度0.85%条件下, 不同提取时间对污泥EPS 3种组分含量(以每g的VSS的含量计)分布的影响.可以发现, 总EPS含量在热提取时间为50 min时最高, 且蛋白质的含量最高, 约占总EPS的75.3%左右.当热提取时间小于30 min时, 随着时间的增加, 蛋白质、多糖和DNA的提取量基本相同;当热提取时间从30 min增加到40 min时, 3种组分的含量显著增加;当热提取时间大于40 min时, EPS提取量增加逐渐缓慢;在提取50 min之后, EPS的含量保持稳定.由于提取时间较短时, 细胞表面的TB-EPS仍与细胞紧密结合, 随着时间的延长, 在适当温度下TB-EPS与细胞表面的粘性降低, 有利于EPS的提取.说明热提取时间只有在达到某一适当时间(大于40 min), 才可使EPS的提取量达到最优.该结果与李继宏等(2013)的研究结论相似.
图 2(Fig. 2)
 |
| 图 2 提取时间对污泥EPS提取效果的影响 Fig. 2Effect of time on the extracting efficiency of EPS |
3.2 提取温度对EPS提取的影响温度在热提取法中起着至关重要的作用, 可使EPS与细胞之间的相互作用力降低, 有利EPS从细胞表面分离.图 3为在提取时间40 min, 氯化钠缓冲液盐度0.85%条件下, 不同提取温度对污泥EPS 3种组分含量(以每g的VSS的含量计)分布的影响.可以发现, 随着温度的增加, 蛋白质的含量逐渐增加, 而多糖与DNA的含量呈现先增加再降低, 最后又增加的趋势.当温度低于70 ℃时, 蛋白质、多糖和DNA增加的趋势较为显著, 在70 ℃时, 多糖和DNA含量达到最高值;当温度大于70 ℃小于90 ℃时, 多糖和DNA含量呈现降低趋势, 而蛋白质的含量仍逐渐增加;当温度大于90 ℃时, 3种组分含量呈增加趋势, 且蛋白质的含量显著增加.
图 3(Fig. 3)
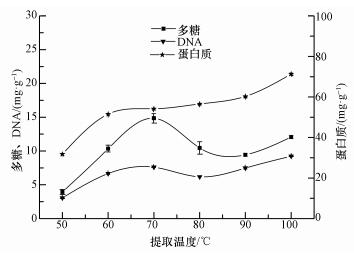 |
| 图 3 提取温度对污泥EPS提取效果的影响 Fig. 3Effect of temperature on the extracting efficiency of EPS |
在热提取法中, 提取温度过高, 可能会使细胞结构被破坏;温度过低, 细胞表面的EPS又很难被分离.图 3中温度在60~80 ℃之间时, DNA的含量基本保持不变, 而当温度高于80 ℃时, DNA和蛋白质含量逐渐增加, 主要是由于细胞被破坏, 细胞内的蛋白质和DNA被释放引起的.因此, 可以发现在温度过高时, 细胞结构可能被破坏, 使得EPS的含量增加, 该条件不利于研究细胞表面EPS的真实含量及组分.以上结果说明, 温度为70 ℃时, 热提取法对EPS的提取较为有利.该研究结果与周俊等(2013)、李继宏等(2013)、王淑莹等(2016)研究的热提取法的结论基本一致.
3.3 缓冲液盐度对EPS提取的影响图 4为8种缓冲液盐度下, 热提取法对不同层EPS和总EPS的提取效果(以每g VSS的含量计).从图 4中可以看出, 不同缓冲液盐度对EPS各组分提取的影响不同, 污泥EPS提取存在一个最佳缓冲液盐度.在LB-EPS的提取中, 随着缓冲液盐度的增加, 蛋白质、多糖和DNA含量呈先增高后降低的趋势, 在0.50%氯化钠缓冲液时LB-EPS的提取量最高, 为(11.94±0.24) mg·g-1 (图 4a);在TB-EPS提取中, 随着氯化钠缓冲液盐度的增加, TB-EPS提取量先增加后逐渐降低, 在0.05%氯化钠缓冲液盐度条件下, 热提取法对TB-EPS的提取量达到最高, 为(85.23±1.59) mg·g-1 (图 4b);对于总EPS的提取, 从图 4c可以发现, 0.05%氯化钠浓度时EPS提取量最高, 为(93.26±2.07) mg·g-1.
图 4(Fig. 4)
 |
| 图 4 缓冲液盐度对污泥EPS提取效果的影响(a.LB-EPS, b.TB-EPS, c.总EPS) Fig. 4Effect of buffer salinity on the extracting efficiency of EPS |
不同缓冲液盐度对各层EPS提取效果的影响不同, 主要是由于随氯化钠缓冲液浓度变化, 离子强度也随着变化, 导致EPS的原有Zeta电位、电导率机细胞渗透压发生改变(袁冬琴等, 2012; 安莹等, 2014), 因而各层EPS与细胞的相互作用受到影响, 使得不同氯化钠缓冲液盐度对热提取法的提取效率产生不同影响.因此, 在热提取法中, 存在一个最佳的缓冲液盐度, 可使EPS提取率达到最高.同时, 从图 4中还可以得出, 不同缓冲液提取的总EPS中, 蛋白质的含量最高, 约占总EPS的76.59%±2.69%, 而DNA含量大约仅占总EPS的5.00%;LB-EPS和TB-EPS中蛋白质、多糖和DNA所占的各层总EPS的比例基本一致.
3.4 基于平行因子模型的EEM分析基于平行因子模型, 利用Matlab软件运行DOMFluor工具包对不同缓冲液盐度的EPS提取液的EEM数据进行处理.图 5为不同缓冲液盐度条件下SMP、LB-EPS和TB-EPS的PARAFAC模型分峰结果, 平行因子分析确定的4组分模型适用于分析污泥EPS的EEM结果, 4个荧光组分主要包括(λEx/λEm):C1(290 nm, 302/350 nm)、C2(278 nm, 340 nm)、C3(310 nm, 410 nm)、C4(380/420 nm, 474/514 nm), 其基本特征见表 1, 其中, C1为类蛋白质, C2为类色氨酸(属于类蛋白), C3为类胡敏酸(属于类腐殖酸), C4为类腐殖酸.
图 5(Fig. 5)
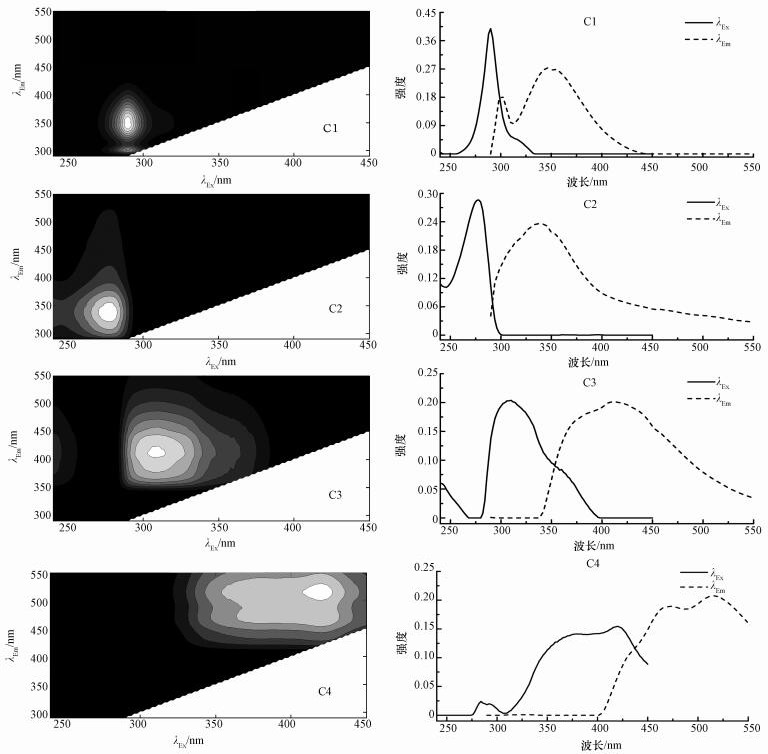 |
| 图 5 PARAFAC模型确定的荧光组分及其位置 Fig. 5Determining the fluorescent component and peak position by using the PARAFAC model |
表 1(Table 1)
| 表 1 不同缓冲液盐度下EPS的EEMs中的荧光组分及其特征 Table 1 Fluorescence components and characteristic from the EEMs of EPS under different buffer salinity | ||||||||||||||||||||
表 1 不同缓冲液盐度下EPS的EEMs中的荧光组分及其特征 Table 1 Fluorescence components and characteristic from the EEMs of EPS under different buffer salinity
| ||||||||||||||||||||
图 6为不同缓冲液盐度下热提取污泥EPS各组分最大荧光强度的分布图.从图 6中可以看出, 热提取法中缓冲液盐度不同, 对EPS中荧光强度产生的影响较为显著, 且SMP、LB-EPS和TB-EPS的最大荧光峰不同, 分别为C2、C2、C1, 这主要与不同组分EPS的特性有关.对于热提取法提取污泥中LB-EPS, 随着氯化钠溶液盐度的增加, 离子强度逐渐增加, 最大荧光强度先增大后降低, 在0.50%氯化钠条件下, 热提取法的最大荧光强度最高, 这与3.3节的结果相一致, 主要是由于离子强度改变, 可能导致EPS表面的Zeta电位和离子强度发生改变, 使得EPS与细胞间的作用力发生改变, EPS提取存在一个最佳提取条件.对于热提取法提取污泥中TB-EPS, 随着氯化钠溶液盐度的增加, 最大荧光强度具有降低的趋势, 在0.0%氯化钠盐度下有最大荧光强度(C1), 但此条件下C2、C3、C4的荧光强度相对于0.20%氯化钠缓冲液的相应组分较低, 综合考虑各组分的荧光强度, 0.20%氯化钠较为适合热提取法中对TB-EPS的提取, 综合3.3节的结果, 可得出0.05%氯化钠较为适合热提法提取污泥中TB-EPS组分.从不同荧光组分可以发现, EPS的荧光物质主要为类蛋白质物质, 这与EPS的提取分析结果是一致的.
图 6(Fig. 6)
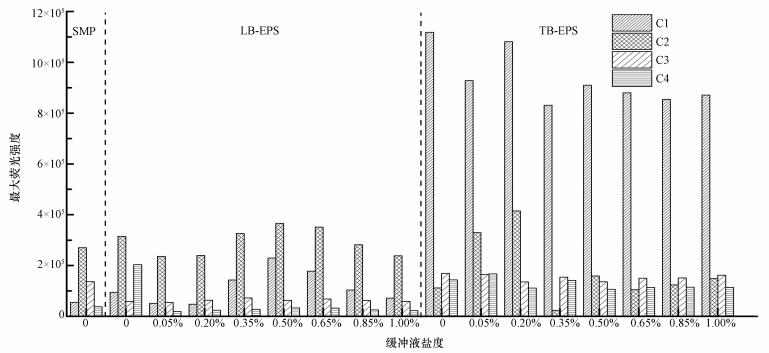 |
| 图 6 不同缓冲液盐度的最大荧光强度分布 Fig. 6Distribution of maximum fluorescence intensity under different buffer salinity |
4 结论(Conclusions)1) 提取时间、提取温度和缓冲液盐度均影响热提取法对污泥EPS的提取效果, 其中, 不同缓冲液盐度对EPS的提取效果及荧光强度均产生影响, 且合适的氯化钠缓冲液盐度有利于热提取法对EPS的提取.
2) 缓冲液盐度对不同层EPS的影响是不同的, 随着盐度增加, LB-EPS的提取量及荧光强度均先增加后降低, 而TB-EPS的提取量及荧光强度呈现降低的趋势, 在0.05%氯化钠条件下达到最佳提取效果.
3) 活性污泥中不同组分的EPS中均存在类蛋白峰C1(290 nm, 302/350 nm)、类色氨酸峰C2(278 nm, 340 nm)、类胡敏酸峰C3(310 nm, 410 nm)和类腐殖酸峰C4(380/420 nm, 474/514 nm), 在0.50%氯化钠缓冲液中LB-EPS的荧光强度最高, 在0.20%氯化钠缓冲液中TB-EPS的荧光强度较高.
4) 热提取法最佳提取条件为:提取时间40 min, 提取温度70 ℃, LB-EPS的缓冲液为0.50%氯化钠, TB-EPS的缓冲液为0.05%氯化钠, 总EPS的提取量最高可达(93.26±2.07) mg·g-1.
参考文献
| 安莹, 王志伟, 李彬, 等. 2014. 盐度冲击下MBR污泥SMP和EPS的三维荧光光谱解析[J]. 中国环境科学, 2014, 34(7): 1754–1762. |
| Carles P N, Carlos D F, Mutlu A G, et al. 2013. Critical assessment of extracellular polymeric substances extraction methods from mixed culture biomass[J]. Water Research, 47(15): 5564–5574.DOI:10.1016/j.watres.2013.06.026 |
| Coble P G, Del Castillo C E, Avril B. 1998. Distribution and optical properties of CDOM in the Arabian Sea during the 1995southwest monsoon[J]. Deep-Sea Research Ⅱ, 45(10/11): 2195–2223. |
| Elcoroaristizabal S, Bro R, García J A, et al. 2015. PARAFAC models of fluorescence data with scattering:A comparative study[J]. Chemometrics and Intelligent Laboratory Systems, 142: 124–130.DOI:10.1016/j.chemolab.2015.01.017 |
| 樊鹏超, 曾薇, 纪兆华, 等. 2017. 城市污水厂活性污泥中胞外聚合物与工艺运行及污泥沉降性能的相关性分析[J]. 环境科学学报, 2017, 37(8): 2996–3002. |
| 黄兴, 孙宝盛, 吕英. 2009. MBR中活性污泥胞外聚合物的物理提取方法研究[J]. 中国给水排水, 2009, 25(5): 80–88. |
| 李继宏, 单士亮, 李亮. 2013. 膜生物反应器中EPS的提取方法[J]. 环境工程, 2013, 31(3): 10–14. |
| Li W W, Zhang H L, Sheng G P, et al. 2015. Roles of extracellular polymeric substances in enhanced biological phosphorus removal process[J]. Water Research, 86: 85–95.DOI:10.1016/j.watres.2015.06.034 |
| Li Y, Li A M, Xu J, et al. 2013. Formation of soluble microbial products (SMP) by activated sludge at various salinities[J]. Biodegradation, 24(1): 69–78.DOI:10.1007/s10532-012-9558-5 |
| Liu L Z, Huang Q, Zhang Y L, et al. 2017. Excitation-emission matrix fluorescence and parallel factor analyses of the effects of N and P nutrients on the extracellular polymeric substances of Microcystis aeruginosa[J]. Limnologica, 63: 18–26.DOI:10.1016/j.limno.2016.10.006 |
| 刘翔, 黄映恩, 刘燕, 等. 2011. 活性污泥和生物膜的胞外聚合物提取方法比较[J]. 复旦学报, 2011, 50(5): 556–562. |
| 龙向宇, 方振东, 唐然, 等. 2012. 胞外聚合物在生物除磷中作用的研究[J]. 环境科学学报, 2012, 32(4): 784–789. |
| Mahmoud A, Olivier J, Vaxelaire J, et al. 2011. Electro-dewatering of wastewater sludge:influence of the operating conditions and their interactions effects[J]. Water Research, 45(9): 2795–2810.DOI:10.1016/j.watres.2011.02.029 |
| Murphy K R, Hambly A, Singh S, et al. 2011. Organic matter fluorescence in municipal water recycling schemes:toward a unified PARAFAC model[J]. Environmental Science & Technology, 45(7): 2909–2916. |
| Sheng G P, Xu J, Luo H W, et al. 2013. Thermodynamic analysis on the binding of heavy metals onto extracellular polymeric substances (EPS) of activated sludge[J]. Water Research, 47: 607–614.DOI:10.1016/j.watres.2012.10.037 |
| Sheng G P, Yu H Q. 2006. Characterization of extracellular polymeric substances of aerobicand anaerobic sludge using three-dimensional excitation and emission matrix fluorescence spectroscopy[J]. Water Research, 40(6): 1233–1239.DOI:10.1016/j.watres.2006.01.023 |
| Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis:a tutorial[J]. Limnology and Oceanography, Methods, 6: 572–579.DOI:10.4319/lom.2008.6.572 |
| 王浩宇, 苏本生, 黄丹, 等. 2012. 好氧污泥颗粒化过程中Zeta电位与EPS的变化特性[J]. 环境科学, 2012, 33(5): 1615–1620. |
| 王淑莹, 何岳兰, 李夕耀, 等. 2016. 不同活性污泥胞外聚合物提取方法优化[J]. 北京工业大学学报, 2016, 42(4): 569–576.DOI:10.11936/bjutxb2015070005 |
| Xu H C, Cai H Y, Yu G H, et al. 2013. Insights into extracellular polymeric substances of cyanobacterium Microcystis aeruginosa using fractionation procedure and parallel factor analysis[J]. Water Research, 47: 2005–2014.DOI:10.1016/j.watres.2013.01.019 |
| 邬卓颖, 郭峰, 叶成松, 等. 2012. 管网生物膜菌株胞外聚合物的提取方法比较[J]. 环境化学, 2012, 31(4): 539–544. |
| Yu G H, He P J, Shao L M. 2010. Novel insights into sludge dewaterability by fluorescence excitation-emission matrix combined with parallel factor analysis[J]. Water Research, 44: 797–806.DOI:10.1016/j.watres.2009.10.021 |
| 袁冬琴, 王毅力. 2012. 活性污泥胞外聚合物(EPS)的分层组分及其理化性质的变化特征研究[J]. 环境科学, 2012, 33(10): 3522–3528. |
| 周俊, 周立祥, 黄焕忠. 2013. 污泥胞外聚合物的提取方法及其对污泥脱水性能的影响[J]. 环境科学, 2013, 34(7): 2752–2757. |
| Ziegmann M, Abert M, Muller M, et al. 2010. Use of fluorescence fingerprints for the estimation of bloom formation and toxin production of Microcystis aeruginosa[J]. Water Research, 44: 195–204.DOI:10.1016/j.watres.2009.09.035 |
