 , 杨浩, 仪慧兰
, 杨浩, 仪慧兰

山西大学生命科学学院, 太原 030006
收稿日期: 2017-12-13; 修回日期: 2018-02-25; 录用日期: 2018-02-25
基金项目: 国家自然科学基金(No.31500504,31371868);山西省高等学校科技创新项目(No.2017102)
作者简介: 韩彦莎(1987-), 女, 副教授(博士), E-mail:hanyansha@sxu.edu.cn
通讯作者(责任作者): 仪慧兰(1963—),女,博士,教授,博士生导师,主要从事环境生物学与逆境生理学方面的研究.主持和完成国家级研究课题5项,省部级研究课题10余项.发表研究论文100余篇,获国家发明专利授权2项, E-mail:yihl@sxu.edu.cn
摘要: 二氧化硫(SO2)是一种常见的大气污染物.前期研究表明,过氧化氢(H2O2)和一氧化氮(NO)参与调控SO2诱导的胡杨细胞毒性.脱落酸(ABA)是一种植物逆境激素,目前关于ABA在植物细胞响应SO2胁迫中的具体作用并不清楚.因此,本文以胡杨愈伤细胞为材料,采用SO2衍生物处理,研究外源ABA在植物细胞SO2毒性缓解中的作用及相关机制.结果发现:2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,细胞电解质外渗率和细胞死亡率明显增加;外源施用5 μmol·L-1 ABA可明显缓解SO2对胡杨细胞的毒性,降低电解质外渗率和细胞死亡率.2 mmol·L-1 SO2衍生物胁迫下,与SO2单独处理组相比,添加外源ABA能够使胡杨细胞的抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)活性分别提高23.9%和48.0%,从而减少胞内H2O2水平.此外,SO2胁迫下,外施ABA后胡杨细胞的PeNia1、PeNia2基因表达受到明显抑制,细胞硝酸还原酶(NR)活性降低24.1%,胞内NO合成减少.以上结果表明,SO2胁迫下,外源施加ABA可有效降低胡杨细胞内H2O2和NO水平,从而缓解SO2对胡杨细胞的毒性.
关键词:胡杨SO2ABAH2O2NO
Exogenous abscisic acid alleviates sulfur dioxide-induced toxicity in Populus euphratica cells
HAN Yansha
 , YANG Hao, YI Huilan
, YANG Hao, YI Huilan

School of Life Science, Shanxi University, Taiyuan 030006
Received 13 December 2017; received in revised from 25 February 2018; accepted 25 February 2018
Supported by the National Natural Science Foundation of China (No.31500504, 31371868) and the University Science and Technology Innovation Project of Shanxi Province (No.2017102)
Biography: HAN Yansha (1987—), female, associate professor(Ph.D.), E-mail:hanyansha@sxu.edu.cn
*Corresponding author: YI Huilan, E-mail:yihl@sxu.edu.cn
Abstract: Sulfur dioxide (SO2) is a common air pollutant. Previous studies revealed that hydrogen peroxide (H2O2) and nitric oxide (NO) regulated SO2-induced cell toxicity of Populus euphratica. Abscisic acid (ABA) is a phytohormone involved in plant response to abiotic stress. To date, the role of ABA in cell responses to SO2 stress is largely unknown. In the present study, using SO2 derivatives treatment, we investigated the relevant mechanisms of exogenous ABA alleviation of SO2-induced toxicity in P. euphratica callus cells. The results showed that 2 mmol·L-1 SO2 derivatives treatment (9 h) caused significant increase of cell death and electrolyte leakage rate of P. euphratica cells. Exogenous ABA (5 μmol·L-1) application could alleviate SO2-induced toxicity, decreasing the cell death rate and electrolyte leakage rate. Under 2 mmol·L-1 SO2 derivatives exposure, exogenous ABA enhanced the activity of ascorbate peroxidase (APX) and catalase (CAT) by 23.9% and 48.0%, compared with SO2 treatment alone, respectively, contributing to the scavenging of H2O2 within P. euphratica cells. Furthermore, exogenous ABA could remarkably inhibit PeNia1 and PeNia2 gene expression, and decrease nitrate reductase (NR) activity by 24.1%, thus restricted NO generation within P. euphratica cells. These results suggested that exogenously applied ABA could alleviate SO2-induced toxicity by reducing H2O2 and NO level in P. euphratica cells.
Key words: Populus euphraticaSO2ABAH2O2NO
1 引言(Introduction)二氧化硫(SO2)是最常见的大气污染物之一,环境中高浓度的SO2可抑制植物的光合和呼吸过程,引起叶片失绿坏死,诱导细胞毒性,造成细胞核固缩、DNA断裂、细胞活力下降,甚至导致细胞死亡(Yi et al., 2012; Choi et al., 2014).SO2气体遇水产生亚硫酸根(SO32-)和亚硫酸氢根(HSO3-),两种分子物质的量的比为3:1(Shapiro, 1977).大气中的SO2经气孔进入植物体内,主要通过水解形成SO32-和HSO3-对组织和细胞产生毒性.在研究SO2对植物细胞的毒性效应时,常用衍生物(Na2SO3和NaHSO3混合液,物质的量的比3:1)作为SO2供体(付宝春等, 2015; Yi et al., 2012; Wei et al., 2013; 2015).目前关于SO2对植物的毒性效应研究大多集中在草本植物中,课题组前期利用生长在我国西北地区的高大乔木树种—胡杨的细胞为材料,研究发现一定浓度的SO2衍生物可诱导胡杨细胞死亡,并使胞内NO和H2O2水平升高(韩彦莎等,2016).
脱落酸(Abscisic acid,ABA)是一种植物激素,普遍存在于植物体内,在植物生长发育和响应逆境胁迫的过程中发挥重要作用(Vishwakarma et al., 2017).外源施加ABA可明显提高植物抵抗干旱、盐渍、重金属等环境胁迫的能力(Zhu, 2002; Yang et al., 2014; Han et al., 2016).例如,干旱胁迫下,外源ABA可诱导植物气孔关闭,减少水分蒸腾(Desikan et al., 2004).近期本课题组发现,外源ABA能够提高镉胁迫下胡杨细胞的抗氧化酶活性,从而减少细胞中的活性氧积累,有效缓解镉诱导的氧化损伤(Han et al., 2016).有研究表明,外施ABA溶液可通过调节叶片气孔开度来控制SO2气体进入,在一定程度上提高植物对SO2的防御能力(Kondo et al., 1978;刘荣坤等,1983;韩素梅,2001).但迄今为止,关于ABA在植物细胞SO2毒性缓解中的具体作用及相关机制尚未见报道.
本文通过研究外源ABA对SO2胁迫下胡杨细胞死亡率、细胞电解质外渗率、胞内NO和H2O2水平的影响,旨在从细胞水平上揭示ABA缓解植物SO2毒性的作用和机制,这对其应用于植物防御SO2毒害具有重要意义.
2 材料与方法(Materials and methods)2.1 植物材料以胡杨新鲜幼嫩叶片作为外植体,在含0.5 mg·L-16-BA和0.5 mg·L-1 NAA的Murashige & Skoog (MS)固体培养基(pH=5.7)上诱导产生愈伤组织,并在含0.25 mg·L-1 6-BA和0.5 mg·L-1 NAA的MS固体培养基上继代增殖.继代培养15 d后,选择颜色淡黄、生长旺盛的愈伤细胞进行处理和实验.
2.2 实验处理采用SO2衍生物处理(Na2SO3:NaHSO3=3:1,mmol·L-1/mmol·L-1),SO2衍生物浓度以混合液中的总S含量计算.根据本课题组前期在胡杨细胞中的研究结果,用2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,细胞死亡率达45%~50%(韩彦莎等,2016),本文使用该处理浓度和时间.将生长15 d的愈伤细胞转至MS液体培养基(pH=5.7)中,平衡6 h后,分别按以下方法进行处理.
① 分别用0 mmol·L-1 SO2、2 mmol·L-1 SO2、0.5 μmol·L-1 ABA、5 μmol·L-1 ABA、20 μmol·L-1 ABA、2 mmol·L-1 SO2+0.5 μmol·L-1 ABA、2 mmol·L-1 SO2+5 μmol·L-1 ABA、2 mmol·L-1 SO2+20 μmol·L-1 ABA处理细胞,9 h后检测细胞死亡率和电解质外渗率.
② 分别用2 mmol·L-1 SO2、5 μmol·L-1 ABA、5 μmol·L-1 ABA+2 mmol·L-1 SO2处理细胞,以MS液体培养基中的细胞作为对照,9 h后检测胞内H2O2和NO水平、抗氧化酶活性、硝酸还原酶活性及相关基因表达水平.
2.3 细胞死亡率检测利用Fluorescein Diacetate(FDA, Sigma-Aldrich,USA)荧光染料检测胡杨细胞死亡率.将细胞在20 μg·mL-1 FDA溶液中避光孵育5 min后,在荧光显微镜(BX51,Olympus,Japan)下检测细胞荧光.发亮绿色荧光的为活细胞,不发绿色荧光或绿色较暗的为死细胞.每个重复随机观察5个视野,每个视野至少观察100个细胞.细胞死亡率为死细胞数目与细胞总数之比.
2.4 电解质外渗率测定取0.2 g胡杨细胞,在5 mL重蒸水中振荡培养30 min后,利用电导率仪检测水中的电解质电导率(C1).之后在沸水中煮沸细胞30 min,待冷却后检测电导率(C2).电解质外渗率E=C1/C2×100%.
2.5 抗氧化酶活性测定具体方法参照文献(韩彦莎等,2016).利用Pierce BCA Protein Assay Kit(Thermo,USA)检测细胞提取液的蛋白浓度.
2.6 H2O2和NO水平检测分别利用2, 7-dichlorodihydrofluorescein diacetate(H2DCFDA, Sigma-Aldrich,USA)、4-Amino-5- Methylamino-2, 7-Difluoro-fluorescein Diacetate(DAF-FM DA, Sigma-Aldrich,USA)荧光探针检测胡杨细胞内的H2O2和NO水平.具体方法参照文献(韩彦莎等,2016).利用Image-Pro Plus version 6.0软件分析细胞荧光强度.
2.7 硝酸还原酶(NR)活性测定利用磺胺比色法检测胡杨细胞的NR活性,具体方法参照文献(刘洁等,2010).
2.8 基因表达水平检测利用Trizol法提取胡杨细胞总RNA,通过M-MLV逆转录酶(Promega,USA)反转录合成cDNA.以cDNA为模板,使用SYBR Green Kit(Bio-Rad,USA)进行Real-Time PCR扩增.以Actin作为内参基因,引物序列见表 1.PCR反应条件为:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min.
表 1(Table 1)
| 表 1 本文中使用的引物序列 Table 1 Primers used in this study | ||||||||||||||
表 1 本文中使用的引物序列 Table 1 Primers used in this study
| ||||||||||||||
2.9 数据统计分析利用SPSS17.0软件对数据进行方差分析(ANOVA),通过Duncan方法对不同处理组之间的数据进行多重比较,不同字母表示组间差异显著(p < 0.05).
3 结果(Results)3.1 ABA缓解SO2衍生物对胡杨细胞的毒性植物细胞遭受逆境胁迫时,细胞膜破坏,膜透性增大,使电解质外渗.2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,电解质外渗率明显增加,为对照的2.1倍(图 1A),细胞死亡率达到47.3%(图 1B).外源施加不同浓度的ABA(0.5、5、20 μmol·L-1)后,与SO2单独处理组相比,电解质外渗率和细胞死亡率均有不同程度的下降,其中,5 μmol·L-1 ABA作用最为显著.以上结果表明,ABA(5 μmol·L-1)能够明显缓解SO2衍生物对胡杨细胞的毒性.在后续实验中,选取5 μmol·L-1作为ABA处理浓度.
图 1(Fig. 1)
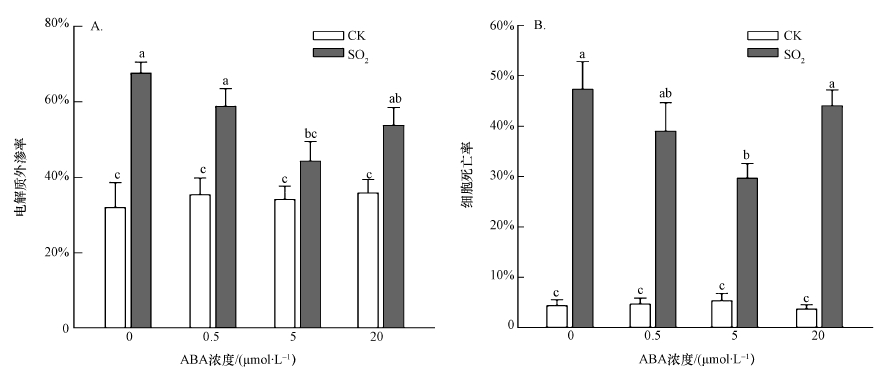 |
| 图 1 不同浓度外源ABA对SO2胁迫下胡杨细胞电解质外渗率(A)和细胞死亡率(B)的影响 (不同小写字母表示不同处理间差异显著(p < 0.05)) Fig. 1Effects of different concentration of exogenous ABA on electrolyte leakage rate (A) and cell death rate(B) of SO2-stressed P. euphratica |
3.2 外源施用ABA对SO2胁迫下胡杨细胞中的H2O2水平的影响前期研究表明,H2O2和NO参与调控SO2诱导的胡杨细胞死亡(韩彦莎等,2016).APX和CAT是植物细胞内负责清除H2O2的两种重要抗氧化酶.2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,与对照相比,细胞APX活性(以mg protein每分钟消耗的ASA量(nmol)表示)和CAT活性(以mg protein每分钟分解的H2O2量(nmol)计))显著下降(图 2),胞内H2O2水平明显升高(图 3A),H2O2荧光强度是对照的4.4倍(图 3B).与SO2单独处理组相比,外源ABA的添加使细胞的APX和CAT活性分别提高了23.9%和48.0%(图 2),胞内H2O2荧光强度降低了31.6%(图 3B).ABA单一处理组的APX和CAT活性、H2O2水平与对照组之间无明显差异(图 2、3).
图 2(Fig. 2)
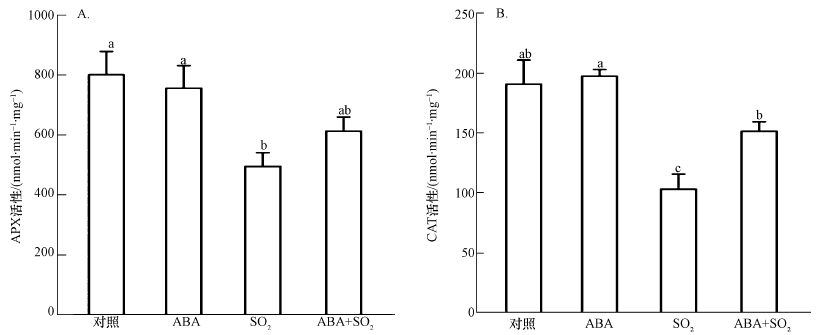 |
| 图 2 外源ABA对SO2胁迫下胡杨细胞APX(A)和CAT(B)活性的影响 Fig. 2Effects of exogenous ABA on APX(A) and CAT(B) activity of SO2-stressed P. euphratica cells |
图 3(Fig. 3)
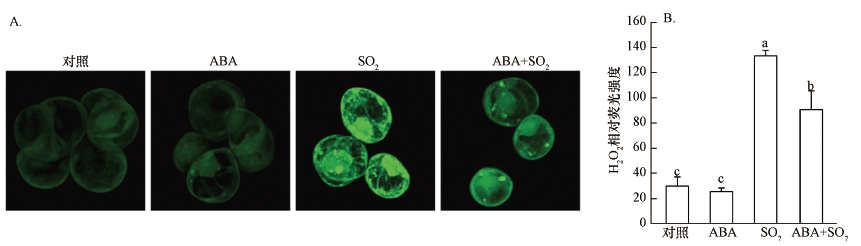 |
| 图 3 外源ABA对SO2衍生物处理后胡杨细胞内H2O2水平的影响 (A:代表性荧光图片;B:利用Image J软件计算的H2O2相对荧光强度;不同字母表示不同处理间差异显著(p < 0.05)) Fig. 3Effects of exogenous ABA on H2O2 level within P. euphratica cells after SO2 derivatives treatment |
3.3 外源施用ABA对SO2胁迫下胡杨细胞中NO水平的影响硝酸还原酶(NR)途径介导的NO合成是植物细胞内NO产生的重要来源.2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,与对照相比,细胞NR活性显著提高(图 4),胞内NO水平明显增加(图 5A),NO荧光强度是对照的3.3倍(图 5B).进一步的荧光定量PCR实验结果显示,SO2胁迫下,硝酸还原酶的两个编码基因PeNia1、PeNia2表达显著上调(图 6).与SO2单一处理组相比,ABA+SO2处理组的细胞NR活性明显下降(图 4),胞内NO荧光强度降低了24.2%(图 5B),PeNia1和PeNia2基因表达水平分别比SO2单一处理时下降了34.3%和25.8%(图 6).
图 4(Fig. 4)
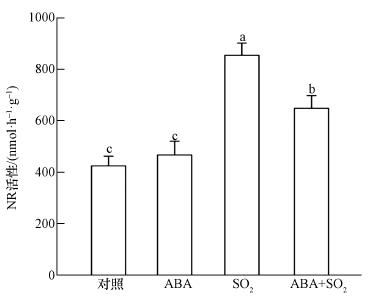 |
| 图 4 外源ABA对SO2胁迫下胡杨细胞硝酸还原酶活性的影响 (不同小写字母表示不同处理间差异显著(p < 0.05)) Fig. 4Effects of exogenous ABA on the nitrate reductase activity of SO2-stressed P. euphratica cells |
图 5(Fig. 5)
 |
| 图 5 外源ABA对SO2衍生物处理后胡杨细胞内NO水平的影响 (A.代表性荧光图片;B.利用Image J软件计算的NO相对荧光强度;不同小写字母表示不同处理间差异显著(p < 0.05)) Fig. 5Effects of exogenous ABA on NO level within P. euphratica cells after SO2 derivatives treatment |
图 6(Fig. 6)
 |
| 图 6 外源ABA对SO2胁迫下胡杨细胞PeNia1(A)、PeNia2(B)基因表达的影响 Fig. 6Effects of exogenous ABA on PeNia1(A) and PeNia2(B) gene expression in SO2-stressed P. euphratica cells |
4 讨论(Discussion)SO2是一种有毒的大气污染物.环境中高浓度的SO2对植物具有毒害效应,可破坏叶绿体结构、分解叶绿素、干扰植物光合过程、引起叶片失绿坏死(刘荣坤,1989;Swanepoel et al., 2007);还可诱发不可逆的遗传损伤,造成细胞核固缩、DNA断裂、染色体畸变率增高(Yi et al., 2012; Choi et al., 2014).研究表明,一定浓度的SO2衍生物能够诱导蚕豆、萱草、万寿菊等植物的保卫细胞凋亡(Yi et al., 2012; Wei et al., 2013;2015).SO2衍生物处理植物细胞时,进入胞内的SO32-被氧化形成硫酸根(SO42-),该过程伴随活性氧产生,从而导致胞内活性氧水平升高.胞内活性氧水平升高后,一方面可引发膜质过氧化,破坏细胞膜结构,导致电解质外渗;另一方面能够激活下游的Caspase途径,诱导细胞死亡(Yi et al., 2012; Brychkova et al., 2013; Zhao et al., 2014).课题组前期研究发现,1~5 mmol·L-1 SO2衍生物暴露使胡杨细胞死亡率显著上升,且处理时间越长,细胞死亡率越高(韩彦莎等,2016).本文利用2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,电解质外渗率明显增加(图 1A),细胞死亡率达到47.3%(图 1B).
ABA是一种逆境激素,能够通过调节气孔开度、诱导抗氧化防御系统、调控相关基因表达等过程来提高植物对干旱、盐渍、低温、重金属等多种胁迫的适应性(Zhu, 2002; Yang et al., 2014; Guo et al., 2012; Han et al., 2016).早期研究表明,叶片涂抹ABA溶液可明显提高植物对SO2的抗性(Kondo et al., 1978;刘荣坤等,1983; 1985;韩素梅,2001).外源ABA一方面能够通过促进气孔关闭而减少SO2气体进入植物(刘荣坤等,1983;韩素梅,2001);另一方面还能够抑制叶片K+渗出,有效减轻SO2对植物的损伤(刘荣坤等,1985).本研究发现,外源ABA对于胡杨细胞SO2毒害也具有保护效应.外施ABA可明显缓解SO2衍生物对胡杨细胞的毒性,显著降低胡杨细胞在SO2胁迫下的电解质外渗率和细胞死亡率,但这种缓解作用具有浓度依赖性,其中,5 μmol·L-1ABA的缓解效应最为明显(图 1),这与镉胁迫下胡杨细胞中的研究结果类似(Han et al., 2016).较高的ABA浓度(20 μmol·L-1)可能会抑制胡杨细胞在SO2胁迫下的生理响应,导致缓解作用下降,但具体机制尚待进一步研究.
H2O2和NO是植物体内两种重要的信号分子.植物细胞遭受环境胁迫时,胞内H2O2和NO快速积累,诱导细胞毒性(De Michele et al., 2009; Jiao et al., 2013; Sun et al., 2014).本课题组的前期研究表明,H2O2和NO参与调控SO2诱导的胡杨细胞死亡;使用外源H2O2清除剂、NO清除剂或合成抑制剂降低胞内H2O2、NO水平后,胡杨细胞死亡率明显降低(韩彦莎等,2016).APX和CAT是植物体内负责清除H2O2的两种关键抗氧化酶.本研究发现,SO2胁迫下,外源ABA能够提高胡杨细胞的APX、CAT活性(图 2),从而降低胞内H2O2水平(图 3).与此类似,本课题组前期在对胡杨细胞的研究中发现,通过外源施加ABA有助于增强镉胁迫下胡杨细胞APX、CAT等抗氧化酶的活性,减少胞内H2O2积累,从而缓解镉对细胞的毒性(Han et al., 2016).此外,Guo等(2012)在受冷害胁迫的辣椒中也发现ABA的类似作用.
硝酸还原酶(NR)途径介导的NO合成是植物细胞内NO产生的重要来源.课题组前期在拟南芥中的研究发现,SO2胁迫可诱导拟南芥保卫细胞的NR途径增强,使NR的两个编码基因AtNia1、AtNia2表达上调,导致胞内NO水平升高(赵均等,2014).本研究显示,SO2衍生物处理后,胡杨细胞中的NR活性明显提高(图 4),NR途径中的关键基因PeNia1、PeNia2均转录上调(图 6),导致胞内NO水平显著上升(图 5).外源ABA可抑制SO2胁迫下胡杨细胞的PeNia1、PeNia2基因表达,降低细胞NR活性,从而减少胞内NO生成(图 4~6).
综上,本文初步证明了外源ABA缓解胡杨细胞SO2毒性的作用,但对于其中具体的分子机制,以及内源ABA、H2O2、NO三者在SO2诱导胡杨细胞毒性中的相互关系仍需进一步研究.
5 结论(Conclusions)SO2胁迫下,外源ABA一方面能够通过提高胡杨细胞APX、CAT活性来减少胞内H2O2积累;另一方面,还可以抑制细胞PeNia1、PeNia2基因表达,降低细胞NR活性,从而减少胞内NO生成.综上,外源施加ABA可有效降低胡杨细胞内H2O2和NO水平,缓解SO2对胡杨细胞的毒性,降低细胞死亡率和电解质外渗率.
参考文献
| Brychkova G, Grishkevich V, Fluhr R, et al. 2013. An essential role for tomato sulfite oxidase and enzymes of the sulfite network in maintaining leaf sulfite homeostasis[J]. Plant Physiology, 161(1): 148–164.DOI:10.1104/pp.112.208660 |
| Choi D, Toda H, Kim Y, et al. 2014. Effect of sulfur dioxide (SO2) on growth and physiological activity in Alnus sieboldiana at Miyakejima Island in Japan[J]. Ecological Research, 29(1): 103–110.DOI:10.1007/s11284-013-1103-4 |
| De Michele R, Vurro E, Rigo C, et al. 2009. Nitric oxide is involved in cadmium-induced programmed cell death in Arabidopsis suspension cultures[J]. Plant Physiology, 150(1): 217–228.DOI:10.1104/pp.108.133397 |
| Desikan R, Cheung M K, Bright J, et al. 2004. ABA, hydrogen peroxide and nitric oxide signalling in stomatal guard cells[J]. Journal of Experimental Botany, 55(395): 205–212. |
| 付宝春, 魏爱丽, 翟晓燕, 等. 2015. NO、ROS对诱导的万寿菊保卫细胞凋亡的调控[J]. 环境科学学报, 2015, 35(7): 2289–2296. |
| Guo W, Chen R, Gong Z, et al. 2012. Exogenous abscisic acid increases antioxidant enzymes and related gene expression in pepper (Capsicum annuum) leaves subjected to chilling stress[J]. Genetics and Molecular Research, 11(4): 4063–4080.DOI:10.4238/2012.September.10.5 |
| Han Y, Wang S, Zhao N, et al. 2016. Exogenous abscisic acid alleviates cadmium toxicity by restricting Cd2+ influx in Populus euphratica cells[J]. Journal of Plant Growth Regulation, 35(3): 827–837.DOI:10.1007/s00344-016-9585-2 |
| 韩彦莎, 李琳, 王朝阳, 等. 2016. H2O2和NO互作调控SO2诱导的胡杨细胞死亡[J]. 环境科学学报, 2016, 36(8): 3073–3080. |
| 韩素梅. 2001. 树木气孔浸润级与SO2伤害及ABA的防护作用[J]. 应用生态学报, 2001, 12(3): 425–428. |
| Jiao J, Zhou B, Zhu X, et al. 2013. Fusaric acid induction of programmed cell death modulated through nitric oxide signalling in tobacco suspension cells[J]. Planta, 238(4): 727–737.DOI:10.1007/s00425-013-1928-7 |
| Kondo N, Sugahara K. 1978. Changes in transpiration rate of SO2-resistant and -sensitive plants with SO2 fumigation and the participation of abscisic acid[J]. Plant & Cell Physiology, 19(3): 365–373. |
| 刘洁, 王省芬, 张桂寅, 等. 2010. 棉花叶片硝酸还原酶活性的测定方法[J]. 河北农业大学学报, 2010, 33(4): 1–4. |
| 刘荣坤, 沈英娃, 刘小洁. 1983. 植物对二氧化硫生理反应的研究Ⅱ植物气孔与SO2伤害及ABA(脱落酸)的保护效应[J]. 植物生理学通讯, 1983(4): 25–28. |
| 刘荣坤, 曾晓非. 1985. ABA(脱落酸)对植物二氧化硫伤害的保护作用[J]. 辽宁大学学报(自然科学版), 1985(1): 64–69. |
| 刘荣坤. 1989. 二氧化硫对植物光合色素伤害的机理[J]. 生态学进展, 1989, 6(2): 102–109. |
| Shapiro R. 1977. Genetic effects of bisulfite[J]. Mutation Research, 39: 149–176.DOI:10.1016/0165-1110(77)90020-3 |
| Sun J, Yu Y, Li Z, et al. 2014. 1-Butanol triggers programmed cell death in Populus euphratica cell cultures[J]. Plant Growth Regulation, 74(1): 33–45.DOI:10.1007/s10725-014-9894-z |
| Swanepoel J W, Ghj K, Pdr V H. 2007. Effects of sulphur dioxide on photosynthesis in the succulent Augea capensis Thunb[J]. Journal of Arid Environments, 70(2): 208–221.DOI:10.1016/j.jaridenv.2006.12.014 |
| Vishwakarma K, Upadhyay N, Kumar N, et al. 2017. Abscisic acid signaling and abiotic stress tolerance in plants:a review on current knowledge and future prospects[J]. Frontiers in Plant Science, 8(120): 161. |
| Wei A, Xin X, Wang Y, et al. 2013. Signal regulation involved in sulfur dioxide-induced guard cell apoptosis in Hemerocallis fulva[J]. Ecotoxicology and Environmental Safety, 98(1): 41–45. |
| Wei A, Fu B, Wang Y, et al. 2015. Involvement of NO and ROS in sulfur dioxide induced guard cells apoptosis in Tagetes erecta[J]. Ecotoxicology and Environmental Safety, 114: 198–203.DOI:10.1016/j.ecoenv.2015.01.024 |
| Yang R, Yang T, Zhang H, et al. 2014. Hormone profiling and transcription analysis reveal a major role of ABA in tomato salt tolerance[J]. Plant Physiology and Biochemistry, 77(2): 23–34. |
| Yi H, Yin J, Liu X, et al. 2012. Sulfur dioxide induced programmed cell death in Vicia guard cells[J]. Ecotoxicology and Environmental Safety, 78(1): 281–286. |
| 赵均, 薛美昭, 白鹤丽, 等. 2014. 硝酸还原酶介导的NO合成参于SO2引发的拟南芥气孔运动的调节[J]. 环境科学学报, 2014, 34(3): 796–800. |
| Zhao J, Yi H. 2014. Genome wide transcriptome analysis of Arabidopsis response to sulfur dioxide fumigation[J]. Molecular Genetics and Genomics, 289(5): 989–999.DOI:10.1007/s00438-014-0870-0 |
| Zhu J K. 2002. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 53: 247–273.DOI:10.1146/annurev.arplant.53.091401.143329 |
