 , 唐娟1, 蔡恩祺1, 朱维琴1, 丁颖1, 王娇娇1, 吴应珠1, 牛丽丽1, 张杭君1,2
, 唐娟1, 蔡恩祺1, 朱维琴1, 丁颖1, 王娇娇1, 吴应珠1, 牛丽丽1, 张杭君1,2

1. 生命与环境科学学院, 杭州师范大学, 杭州 310016;
2. 杭州师范大学生态系统保护与恢复杭州市重点实验室, 杭州师范大学, 杭州 310036
收稿日期: 2017-11-10; 修回日期: 2017-12-21; 录用日期: 2017-12-21
基金项目: 浙江省自然科学基金(No.LY15B070014);浙江省新苗人才计划资助项目(No.2017R423082);杭州市"131"人才计划项目;浙江省"151"人才计划项目;杭州师范大学卓越人才计划
作者简介: 陆香君(1992-), 女, E-mail:luxiangjun1982@163.com
通讯作者(责任作者): 张杭君,zhanghangjun@hznu.edu.cn
摘要: 纳米氧化锌具有广泛的工业用途,其生态安全性受到广泛关注,针对纳米氧化锌诱导的呼吸道细胞毒性及其作用机理研究尚不广泛.本研究分别采用不同浓度和粒径(30 nm和90 nm)的氧化锌颗粒物处理大鼠气管上皮细胞(rat tracheal epithelial cells,RTE cells),暴露时间为12 h,通过检测细胞内锌元素含量,细胞增殖抑制率,细胞凋亡率,凋亡相关caspsae 3基因与蛋白相对表达量,细胞内金属硫蛋白活性,ROS和MDA含量、细胞内Ca2+-ATP酶和Na+/K+-ATP酶活性来分析纳米氧化锌诱导细胞毒效应机理.在90 nm纳米氧化锌高浓度暴露时,其细胞内锌元素浓度为0.845 μg·L-1,约为低浓度暴露组的4.7倍,是30 nm低浓度暴露组的9倍;纳米颗粒物诱导的细胞增殖和凋亡毒效应具有剂量和尺寸依赖效应;30 nm处理组的pro-caspase 3和cleaved-caspase 3蛋白表达量均高于90 nm暴露组;暴露浓度为10 mg·L-1的90 nm处理组的金属硫蛋白增加量为0.533 μg·L-1,增幅达到46%;不同粒径氧化锌颗粒物处理后,细胞内ROS和MDA含量显著上升,且30 nm处理组结果均高于90 nm处理组;纳米氧化锌颗粒物暴露诱导细胞Ca2+-ATP酶和Na+/K+-ATP酶活性显著下降,30 nm氧化锌颗粒物暴露组,其Na+/K+-ATP酶活性分别是对照组的1.8倍和3.5倍.纳米氧化锌颗粒物进入RTE细胞,通过干扰锌在细胞内代谢,诱导细胞内ROS和MDA水平升高,产生氧化应激,进而诱导细胞凋亡是导致纳米氧化锌产生细胞毒性的主要原因之一.纳米氧化锌会导致细胞内Ca2+-ATPase和Na+/K+-ATPase活性下降,离子通道失调,破坏细胞内离子平衡,进一步造成细胞凋亡.
关键词:纳米氧化锌颗粒大鼠气管上皮细胞细胞凋亡氧化应激离子通道
The mechanism of apoptosis of rat tracheal epithelial cells induced by zinc oxide nanoparticles through oxidative stress and ion channel dysfunction
LU Xiangjun1
 , TANG Juan1, CAI Enqi1, ZHU Weiqin1, DING Ying1, WANG Jiaojiao1, WU Yingzhu1, NIU Lili1, ZHANG Hangjun1,2
, TANG Juan1, CAI Enqi1, ZHU Weiqin1, DING Ying1, WANG Jiaojiao1, WU Yingzhu1, NIU Lili1, ZHANG Hangjun1,2

1. College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310016;
2. Key Laboratory of Hangzhou City for Ecosystem Protection and Restoration, Hangzhou Normal University, Hangzhou 310036
Received 10 November 2017; received in revised from 21 December 2017; accepted 21 December 2017
Supported by the Natural Science Foundation of Zhejiang Province (No. LY15B070014), the Program for New Bud Talents of College Students in Zhejiang Province (No. 2017R423082), the Program for '131' Talents in Hangzhou City, the Program for '151' Talents in Zhejiang Province and the Excellent Talent Program in Hangzhou Normal University
Biography: LU Xiangjun (1992—), female, E-mail:luxiangjun1982@163.com
*Corresponding author: ZHANG Hangjun, zhanghangjun@hznu.edu.cn
Abstract: Zinc oxide nanomaterials (ZnO NPs) have a wide range of industrial applications with extensive attention for their biosafety. However, little was known about the respiratory cytotoxicity and the mechanism induced by ZnO NPs. The objective of the study is to investigate the effects of ZnO NPs on rat tracheal epithelial (RTE) cells. RTE cells were treated with ZnO NPs of different concentrations and diameters (30 nm and 90 nm) for 12 h. Cytotoxicity effects and mechanism were detected by indexes of intracellular zinc content, cell proliferation inhibition percentage, apoptotic cell percentage, metallothionein activity, ROS and MDA content, intracellular Ca2+-ATPase and Na+/K+-ATPase activities and relative expressions of apoptosis related gene and protein of caspsae 3. The results showed that the intracellular zinc concentration was 0.845 μg·L-1 under the exposure of 90 nm ZnO NPs with a high concentration, which was about 4.7-fold of the low concentration exposure group and 9-fold of the 30 nm low concentration exposure group. The increment of metallothionein in the 90 nm treatment group was 0.533 μg·L-1. The increase of the content of ROS and MDA in the treated group was significantly higher than that in the control group. The activities of Ca2+ -ATPase and Na+/K+ -ATPase were significantly decreased, and the Na+/K+ -ATPase activity treated by 30 nm ZnO NPs was 1.8-fold and 3.5-fold higher than that in the control group, respectively. The effect of nanoparticle-induced cell proliferation and apoptosis was dose-dependent and size-dependent. The expression levels of pro-caspase 3 and cleaved-caspase 3 in the 30 nm treatment group were higher than those in the 90 nm exposure group in same exposure dose. These results suggested that ZnO NPs disrupted the metabolism process of zinc and increased the intracellular ROS and MDA content, which led to oxidative stress and further promoted apoptosis. In addition, ZnO NPs can decreased intracellular Ca2+ -ATPase and Na+/K+-ATPase activity, disorder Iron channel, destruct of intracellular ion balance, and further cause apoptosis.
Key words: ZnO NPsrat tracheal epithelial cellsapoptosisoxidative stressiron channel
1 引言(Introduction)纳米氧化锌是一种新型高功能精细无机产品, 因其独特的光、电、磁学等性能在众多工业生产应用领域取得突破性的成就(何艳等, 2016;张金洋等, 2010).纳米氧化锌在无线电、化妆品行业、橡胶工业以及传感器等工业领域应用广泛.然而正是其高利用率增加了环境释放量, 进一步促进了其在生态环境中的迁移与蓄积, 加剧了生物体暴露的可能性.目前纳米氧化锌的生物安全性受到广泛关注.纳米尺寸的物质可以通过多种途径进入生物体, 如呼吸道吸入途径、消化道吸收途径以及皮肤渗透途径等, 进而对生物体产生毒性损伤.通过空气媒介, 利用呼吸途径吸收纳米氧化锌颗粒物, 使其在生物体内循环, 并对靶细胞造成毒性, 是其可能的人体暴露途径之一.目前已知的纳米氧化锌颗粒的呼吸道毒性研究源于职业暴露氧化锌尘雾导致的肺部或全身性反应(Drinker et al., 1927; Martin et al., 1999).
关于纳米氧化锌的呼吸道毒性研究主要集中于肺部器官与相关癌细胞系.颗粒状的纳米材料极易通过呼吸被生物体吸入体内, 颗粒物被吸入后能够在动物的各段呼吸道以及肺泡内沉积(Maynard, 2006).有研究显示在肺泡区域沉积的纳米颗粒不能通过巨噬细胞有效吞噬的方式排出(Oberdrster et al., 2000; Semmler et al., 2004), 因此纳米颗粒就会蓄积在肺泡中, 激活多种信号通路, 从而导致肺部出现炎症反应、肉芽肿, 甚至发生纤维化等损伤(Hirsch et al., 2017; Huizar et al., 2013; Shvedova et al., 2005).然而目前针对纳米氧化锌诱导的呼吸道细胞毒性研究尚不广泛.尤其是针对纳米氧化锌对呼吸道细胞的毒性机理研究尚无明确定论.
本研究采用大鼠气管上皮细胞(Rat tracheal epithelial cells, RTE cell)作为研究靶细胞, 采用不同粒径的纳米氧化锌(30 nm和90 nm)为对象, 通过检测细胞内锌元素含量、细胞增殖抑制率、细胞凋亡率、凋亡相关caspase 3基因与蛋白相对表达量、金属硫蛋白活性、细胞内ROS和MDA含量、Ca2+-ATP酶和Na+/K+-ATP酶活性研究不同浓度和粒径纳米氧化锌对RTE细胞的毒性作用和差异, 并初步探究其作用机理.望能为纳米氧化锌生物安全性评估, 纳米毒理学研究以及纳米材料安全利用提供一定理论支持.
2 材料与方法(Material and methods)2.1 材料2.1.1 细胞株与试剂RTE细胞株购自北京北纳生物有限公司.纳米氧化锌粉体(平均粒径为30 nm和90 nm, 纯度为99.99%, 相对密度为5.610 g · cm3)购自上海阿拉丁试剂有限公司. DMEM高糖培养液、胰蛋白酶和胎牛血清购自美国Gibco公司;磷酸盐缓冲液(PBS)购自国药试剂有限公司;Cell Counting Kit 8试剂盒购自同仁化学研究所;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术研究所;Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司.
2.1.2 主要仪器SHELLAB二氧化碳细胞培养箱;Invitrogen COUNTESS自动细胞计数仪;Nikon90i全自动正置荧光显微成像系统;NiKonTS100倒置荧光显微成像系统;北京中科BCM-1600A生物超净台;百典HHS-21-8型水浴锅;利曼Prodigy 7电感耦合等离子光谱仪;美国Thermo公司902-ULTS超低温冰箱;THERMO Varioskan Flash全波长多功能酶标仪;Optima L-90K超速落地冷冻离心机;美国默克密理博公司guava easyCyte 8微流式细胞分析仪;CFX384多重实时荧光定量PCR仪(美国Bio-Rad); Mini-PROTEAN电泳系统以及Mini Trans-Blot转印系统(美国Bio-Rad); 水平脱色摇床(国产华利达).
2.2 方法2.2.1 细胞培养取出冻存的RTE细胞株于37 ℃水浴中快速融化, 在超净工作台中转移至装有2 mL DMEM高糖培养基(含10%胎牛血清、100 U · mL-1青霉素和100 μg · mL-1链霉素)无菌离心管中, 1000 r · min-1离心5 min, 弃上清, 并转移至含有5 mL完全培养基的细胞培养瓶中.培养箱条件为37 ℃, 饱和湿度, CO2体积分数为5%.用倒置显微镜观察, 待细胞的汇合率达到80%~90%时, 吸出细胞培养瓶中的旧培养基, 然后加入2 mL PBS漂洗, 加入1 mL 0.25%的胰酶对细胞进行消化, 细胞回缩成圆形时, 弃去胰酶, 加入2 mL完全培养基终止消化, 吹打细胞瓶壁, 使所有细胞完全悬浮, 按1 : 2比例传代接种细胞.
2.2.2 纳米氧化锌暴露分别配制30 nm和90 nm浓度为1 mg · mL-1的ZnO NPs悬液, 混匀后, 超声20 min (振幅80 mm · s-1, 间隔2 s), 然后高压灭菌30 min.在加入到细胞前, 先将ZnO NPs悬液在密封情况下用超声波清洗机超声20 min, 最后用细胞培养液DMEM配制实验所需浓度的ZnO NPs悬液.李小林等采用50 nm粒径的氧化锌颗粒物体外处理中国仓鼠肺(CHL)细胞24 h后, 发现纳米氧化锌颗粒物对CHL细胞的半数致死浓度为10.54 mg · L-1 (李小林等, 2012).本文参考上述研究设定浓度10 mg · L-1, 同时为探究低浓度暴露下纳米氧化锌诱导的RTE毒性与较高浓度暴露下的差异, 设定了浓度100 μg · L-1.因此实验浓度梯度为0、100、10000 μg · L-1.
2.2.3 ICP法检测细胞内锌浓度锌浓度的测定使用微波消解-电感耦合等离子光谱仪. 6孔板细胞90%覆盖时进行纳米氧化锌暴露12 h.去上清, 加入PBS漂洗1遍, 每孔加入0.25%的胰酶蛋白, 消化细胞加浓硝酸2 mL后定容至20 mL, 转移至微波消解管, 微波消解30 min, 120 ℃赶酸30 min, 取出定容至10 mL.配置0.5、1、10和20 mg · L-1锌标准溶液, 每个浓度设4个平行样.手动进样, RF功率为1200 kW, 提升时间为18 s, 蠕动泵提升速率为25 r · min-1, 冷却气为18 L · min-1, 雾化器为33 PSI, 积分时间为10 s, 锌元素分析谱线为:Zn 206.200.
2.2.4 细胞增殖抑制率检测取对数生长期RTE细胞, 0.25%胰酶消化, 调整细胞密度为4×104个· mL-1, 每孔200 μL接种于96孔板中, 置于37 ℃恒温箱, 孵育24 h.去上层培养基, 用PBS漂洗两次, 每孔分别加200 μL纳米颗粒物工作液, 37 ℃, 5% CO2的培养箱中, 孵育12 h后, 用CCK8酶标仪于450 nm波长处测定吸光度.每个浓度设6个平行孔.根据公式(1)计算细胞增殖抑制率.
 | (1) |
2.2.6 caspase 3基因相对表达量检测(1) 总RNA提取
对照组和处理组RTE细胞经离心收集(1500 r · min-1, 5 min), 置于预冷的PBS中, 加入1 mL TRIzol? Reagent, 剧烈振荡, 随后加入0.2 mL氯仿. 2~3 min之后, 离心(12000 g, 4 ℃, 15 min)转移上清液至新的1.5 mL离心管, 然后加入等体积70%乙醇, 振荡混匀.转移上清至Spin Cartridge (含套管), 离心(12000 g, 室温, 15 s), 弃废液.随后加入50 μL RNase-Free Dnase Buffer, 以彻底去除残余的基因组DNA, 加入700 μL Wash Buffer Ⅱ至SpinCartridge (含套管), 离心(12000 g, 室温, 15 s), 弃废液.再次加入500 μL Wash Buffer Ⅱ至Spin Cartridge (含套管), 离心(12000 g, 室温, 15 s), 重复上述操作一遍, 空转1 min.最后, 用RNase-Free Wate洗脱Spin Cartridge中心, 室温放置1 min后, 离心(12000 g, 室温, 2 min), 利用紫外分光光度计和电泳测定其含量、纯度及质量, 确保OD260与OD280的比值在1.8~2.0之间, 然后贮存在-80 ℃备用.逆转录实验:操作步骤及条件如表 1所示.
表 1(Table 1)
| 表 1 第一链反转录DNA合成反应体系及条件 Table 1 1st-Strand cDNA Synthesis reaction system and conditions | ||||||||||||
表 1 第一链反转录DNA合成反应体系及条件 Table 1 1st-Strand cDNA Synthesis reaction system and conditions
| ||||||||||||
(2) QRT-PCR检测
定量PCR引物设计用Primer Premier 6.0和Beacon designer 7.8软件进行, 然后由杭州浩基生物公司完成, 引物序列如表 2所示.
表 2(Table 2)
| 表 2 caspase 3和GAPDH基因引物序列 Table 2 Primer sequences of caspase 3 and GAPDH used in this study | |||||||||
表 2 caspase 3和GAPDH基因引物序列 Table 2 Primer sequences of caspase 3 and GAPDH used in this study
| |||||||||
(3) 构建QRT-PCR扩增体系和反应条件
总体系为20 μL, 包括:8 μL SDW, 10 μL Power SYBR? Green Master Mi, 0.5 μL Forward Primer (10 μmol · L-1), 0.5 μL Reverse Primer (10 μmol · L-1), 1 μL cDNA.反应条件:95 ℃, 1 min;40个循环(95 ℃, 15 s, 63 ℃, 25 s, 收集荧光) 55 ℃到95 ℃熔点曲线.
(4) 进行基因表达差异统计分析
每个样品重复3次, 每个浓度设4个平行孔.各个基因的相对表达水平以2Δ(C内参基因t-C内参基因t) 进行统计分析.
2.2.7 细胞内caspase 3蛋白相对表达量检测将细胞以5.0×105个·孔-1的密度接种到六孔板中, 并在暴露之前培养24 h.细胞用浓度为0、10、100、1000和10000 μg · L-1的纳米颗粒悬浮液处理12 h.细胞经漂洗、消化和离心收集处理后置于预冷的PBS中.利用总蛋白提取试剂盒进行样品总蛋白的提取, 然后采用BCA法进行蛋白定量(按照试剂盒说明书进行操作).随后以每个孔60 μg总蛋白进行上样, 每孔10~15 μL, 5%浓缩胶60 V, 8%~12%分离胶80 V进行电泳2 h左右.将PVDF膜甲醇中浸泡20 s, 然后转移到含5%甲醇的Tris-Glycine转移缓冲液中平衡至少5 min; SDS-PAGE凝胶在Tris-Glycine转移缓冲液平衡至少30 min; 在冷却条件下以100 V恒压全湿转膜2 h.转膜结束后, 放到T-TBS (含5%脱脂奶粉或BSA), 室温封闭1 h, 然后T-TBS漂洗(5 min × 3).一抗以一定比例溶于TBS溶液(含3%脱脂奶粉), 4 ℃孵育过夜, 后用T-TBS漂洗(5 min × 4).随后将羊抗鼠IgG二抗和羊抗兔IgG二抗以一定比例溶于T-TBS(含2%脱脂奶粉), 室温孵育1 h, 然后用T-TBS漂洗(5 min × 5).采用SuperSignal? West Dura Extended Duration Substrate进行信号检测, 按说明书操作, 用ECL工作液孵育转印膜, 最后去除多余ECL试剂, 保鲜膜密封后进行显影和定影.最后, 采用BandScan 5.0软件分析条带的光密度值, 结果以平均数±标准差表示, 对照组以β-actin表达.
2.2.8 金属硫蛋白ELISA检测金属硫蛋白ELISA法依据间接免疫定量技术, 微孔板中包被有MT特异单克隆抗体.当标准品或样品加入微孔板孔内, MT会同包被结合.再加入辣根过氧化物标记酶(HRP)可以特异性结合MT, MT被固定在微孔板上, 洗脱掉未结合的标记酶, 通过标记酶HRP的显色反应可间接得出MT的含量.将细胞吹打至脱落后, 4000 r · min-1离心10 min, 取上清.将50 μL的标准品及样品加入包被的酶标板孔内, 样品孔加入10 μL生物素.然后各孔中加入100 μL酶标记液, 将酶标板用封口胶密封后, 37 ℃孵育反应1 h.反应结束后用洗涤液充分清洗酶标板3 ~ 5次.待孔内彻底干透, 加入显色剂A、B液各50 μL, 室温下避光反应10 min.最后加50 μL终止液终止反应, 并在波长450 nm的酶标仪上读取各孔的OD值.每个浓度设4个平行孔.
2.2.9 细胞内ROS变化规律检测细胞内ROS变化由流式细胞仪测定.将细胞接种在细胞培养基(106个·孔-1)中的6孔板中, 待贴壁后暴露于颗粒物12 h (对照细胞用无血清培养基处理).去除上层培养基, 用PBS缓冲液漂洗两遍, 用胰酶蛋白消化细胞, PBS缓冲液重悬细胞于1.5 mL离心管中.对照组和处理组的RTE细胞经离心收集后, 过40 μm的细胞网筛, 悬浮置于预冷的PBS中, 随后加入DCFH-DA染料至终浓度为10 μmol · L-1, 室温避光孵育20 min.用Guava easyCyte 8 HT流式细胞仪Incyte模块检测ROS荧光强度变化规律.检测激发波长488 nm, 发射波长525 nm.每个浓度设6个平行孔.
2.2.10 微量丙二醛(MDA)含量检测MDA用于测定脂质过氧化反应的程度, 采用MDA分析试剂盒测定.将细胞以5.0 × 105个·孔-1的密度接种到6孔板中, 并在暴露之前培养24 h.细胞用浓度为0、100和10000 μg · L-1的纳米颗粒悬浮液处理12 h.然后用PBS冲洗细胞3次.使用MDA测定试剂盒分别测量MDA. 532 nm处的吸光度下进行检测, 并根据公式计算:MDA含量= [OD (样品对照) / OD (标准空白)] ×标准浓度(10 nmol · mL-1) ×稀释倍数. RTE细胞经消化离心收集后用超声破碎, 按照试剂盒说明书操作步骤进行测定.每个浓度设6个平行孔.
2.2.11 Ca2+-ATP酶和Na+/K+-ATP酶的测定ATP酶可分解ATP生成ADP和无机磷, 通过测定无机磷的含量来判断ATP酶活性的高低.将24孔培养板内细胞反复吹打, 至完全脱落, 3500 r · min-1离心10 min, 弃上清, 留下层细胞, 用不含磷D-Hank氏液重悬至1×106个· mL-1, -20 ℃反复冻融3次, 用BCA试剂盒测定蛋白, 并进行酶活检测.酶活检测包括酶促反应和定磷, 操作方法依照试剂盒说明书.波长636 nm, 光径0.5 cm, 测量各管吸光度.每个浓度组平行孔不少于3个.
3 结果(Results)3.1 ICP检测细胞内锌元素含量细胞内锌含量通过电感耦合等离子光谱仪进行测定.表 3为根据标准曲线计算得到不同纳米氧化锌处理后RTE细胞内锌含量, 每组平行孔不小于3个.细胞内锌浓度随着暴露浓度的增加而增加(p < 0.01), 且通过纳米氧化锌30 nm暴露组与90 nm暴露组同浓度平行比较发现, 细胞内锌浓度与粒径大小具有正相关关系.当90 nm纳米氧化锌高浓度暴露时, 其细胞内锌浓度为0.845 μg · L-1, 约为低浓度暴露组的4.7倍, 是30 nm低浓度暴露组的9倍.理论上, 当颗粒物密度相同时, 根据球体体积计算公式, 90 nm颗粒物中的锌含量应当是30 nm颗粒物的27倍.然而本研究比较30 nm和90 nm高浓度暴露组的细胞内锌离子浓度发现, 其差异不显著.由此可以推断, 粒径大小为30 nm的氧化锌颗粒物进入细胞内的数量远大于90 nm氧化锌颗粒物.
ICP检测细胞内锌浓度的结果显示, 纳米氧化锌颗粒能穿透细胞膜, 进入细胞体内, 并蓄积在细胞内, 且粒径为30 nm的氧化锌颗粒物比90 nm的颗粒物更易在细胞内蓄积.同时, 纳米氧化锌颗粒物进入细胞内的含量随着暴露浓度的增加而增加.
表 3(Table 3)
| 表 3 利用ICP检测RTE细胞内锌元素含量结果 Table 3 The content of zinc in RTE cells was detected by ICP | ||||||||||||||||||||||||||||||||||||||
表 3 利用ICP检测RTE细胞内锌元素含量结果 Table 3 The content of zinc in RTE cells was detected by ICP
| ||||||||||||||||||||||||||||||||||||||
3.2 纳米氧化锌诱导RTE细胞增殖抑制增加利用CCK8试剂盒检测了纳米氧化锌暴露对RTE细胞增殖活性的影响, 结果如图 1所示. RTE细胞分别暴露于30 nm和90 nm的氧化锌颗粒物, 暴露浓度为0、100 μg · L -1和10 mg · L-1.结果显示, 当暴露浓度为10 mg · L-1时, 其细胞增殖抑制率分别达到了71.9%和44.4%, 分别是暴露浓度为10 μg · L-1时的3.13和3.67倍, 差异显著(p < 0.01).当暴露浓度相同时, 30 nm处理组细胞增值抑制率均高于90 nm处理组.暴露浓度为100 μg · L -1时, 30 nm处理组的细胞增值抑制率约是90 nm处理组的2倍.
图 1(Fig. 1)
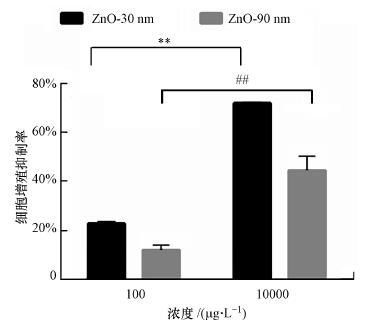 |
| 图 1 纳米氧化锌诱导RTE细胞增殖抑制率结果 (利用CCK8试剂盒检测暴露于30 nm和90 nm的氧化锌颗粒物的RTE细胞增值抑制率, 暴露浓度为100 μg · L-1和10 mg · L-1, 暴露时间为12 h.计算时采用无血清培养基为空白对照. **表示30 nm处理组与对照组比较有显著差异, p < 0.01; ##表示90 nm处理组与对照组比较有显著差异, p < 0.01(下同)) Fig. 1RTE cell proliferation inhibition percentages induced by ZnO NPs in RTE cells |
CCK8实验结果显示, RTE细胞增殖抑制率随着暴露浓度的增加而增加, 具有浓度-依赖效应.但是与暴露纳米颗粒物粒径呈负相关, 随着暴露颗粒物粒径的增大, 其细胞增殖抑制率下降.
3.3 纳米氧化锌诱导RTE细胞凋亡率上升利用流式细胞仪检测纳米氧化锌诱导RTE细胞凋亡率变化, 由图 2可知, 纳米氧化锌诱导的RTE细胞凋亡率变化具有显著的剂量和尺寸依赖效应.当粒径为30 nm, 处理组细胞凋亡率较对照组分别增加了2.9倍和3.8倍;当粒径为90 nm, 处理组细胞凋亡率较对照组分别增加了2.7倍和3.2倍.由细胞凋亡率实验结果可知, 随着暴露浓度的增加, RTE细胞凋亡率增加, 且随着暴露纳米氧化锌粒径的增加, 其细胞凋亡率减小.
图 2(Fig. 2)
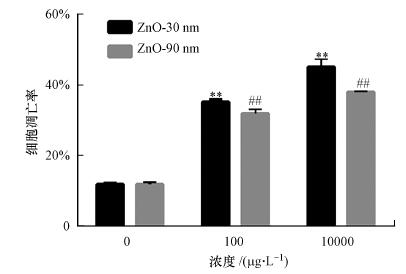 |
| 图 2 纳米氧化锌诱导RTE细胞凋亡率变化结果 (利用流式细胞仪检测暴露于30 nm和90 nm的氧化锌颗粒物的RTE细胞凋亡率, 暴露浓度为100 μg · L-1和10 mg · L-1, 暴露时间为12 h.采用无血清培养基为空白对照) Fig. 2Apoptosic cell percantages induced by ZnO NPs in RTE cells |
3.4 纳米氧化锌诱导RTE细胞caspase 3基因和蛋白相对表达量升高纳米氧化锌诱导的RTE细胞caspase 3基因和蛋白相对表达量上升(图 3).半胱氨酸天冬氨酸蛋白酶3 (caspase 3)在正常情况下是以酶原的形式存在于细胞浆中, 在细胞发生凋亡时, caspase 3被剪切激活(cleaved-caspase 3), 对靶蛋白进行水解.图 3a为pro-caspase 3、cleaved-caspase 3的蛋白条带结果.纳米氧化锌暴露下, Pro-caspase3的蛋白相对表达量随着浓度的增加而下调, 而cleaved caspase 3则相反, 具有显著差异(p < 0.01).同一浓度下, 30 nm暴露组的蛋白表达量均高于90 nm暴露组.
图 3 b是纳米氧化锌诱导RTE细胞caspase 3基因相对表达量的结果.粒径为30 nm暴露浓度为10 mg · L-1处理组的基因相对表达量约为对照组的5倍, 粒径为90 nm暴露浓度为10 mg · L-1处理组的caspase 3基因相对表达量约为对照组的8倍.同一浓度下, 90 nm暴露组的基因相对表达量高于30 nm暴露组.
图 3(Fig. 3)
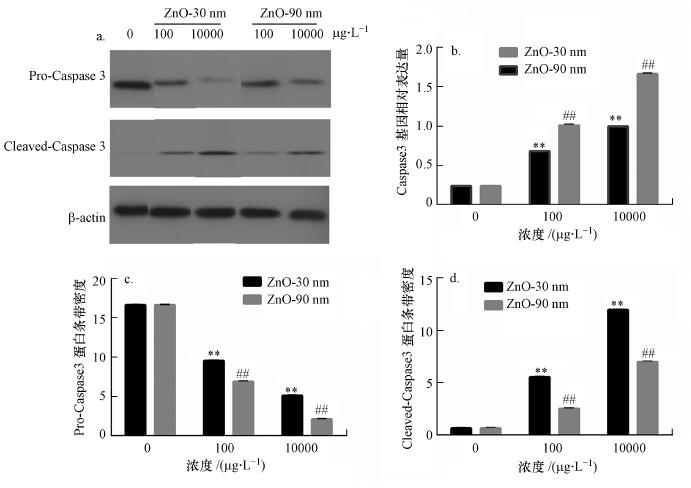 |
| 图 3 纳米氧化锌诱导RTE细胞caspase 3基因和蛋白相对表达量变化结果 (采用β-actin作为western bloting蛋白表达内参对照, 采用GAPDH作为QRT-PCR基因相对表达量内参对照. a. pro-caspase 3, cleaved-caspase 3和β-actin蛋白条带结果;b. caspase 3基因相对表达量结果;c. pro-caspase 3条带相对密度;d. cleaved-caspsae 3条带相对密) Fig. 3Relative protein and gene expressions of caspase 3 induced by ZnO NPs in RTE cells |
3.5 纳米氧化锌对RTE细胞内金属硫蛋白含量的影响利用ELISA酶联免疫法检测细胞内金属硫蛋白含量, 结果如图 4所示. RTE细胞分别暴路于30 nm和90 nm的氧化锌颗粒物, 暴露浓度为0、100 μg · L-1和10 mg · L-1. MT标准品线性良好, 回归方程为y = 0.0543 x2- 0.0766 x + 0.0887, R2= 0.999, 最低检出限为1 pg · mL-1, 标准品范围为0~1200 pg · mL-1, 回收率为94.9%.图 4结果显示, 纳米氧化锌颗粒暴露诱导细胞内MT含量升高, 其中30 nm氧化锌颗粒物处理时, 其细胞内MT含量分别为(1.385±0.084) μg · L-1和(1.457±0.002) μg · L-1;其中90 nm氧化锌颗粒处理时, 其细胞内MT含量分别为(1.466±0.001) μg · L-1和(1.686±0.02) μg · L-1, 而对照组的MT含量为(1.153±0.001) μg · L-1, 各粒径处理组与对照组均呈极显著差异(p < 0.01).且暴露浓度为10 mg · L-1的90 nm暴露组的MT增加量为0.533 μg · L-1, 增幅达到46%.
图 4(Fig. 4)
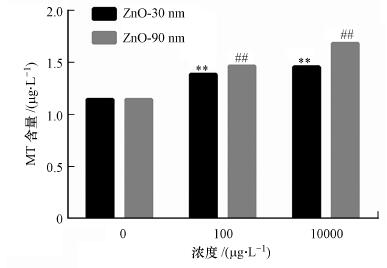 |
| 图 4 纳米氧化锌对RTE细胞内金属硫蛋白含量的影响 (暴露时间为12 h.采用无血清培养基为空白对照) Fig. 4Metallothionein contents in RTE cells induced by ZnO NPs |
MT结果显示, 纳米氧化锌诱导的RTE细胞内MT含量随着暴露浓度的增加而增加, 且同一暴露浓度下, 纳米氧化锌的尺寸越大, 其MT含量越上升.
3.6 纳米氧化锌诱导的RTE细胞内ROS含量上升由图 5可知, 随着暴露浓度的增加, 纳米氧化锌诱导细胞内ROS含量显著升高(p < 0.01).粒径为30 nm时, 其处理组ROS含量分别是对照组的1.8倍和2.7倍;粒径为90 nm时, 其处理组ROS含量分别是对照组的1.9倍和2.3倍.
图 5(Fig. 5)
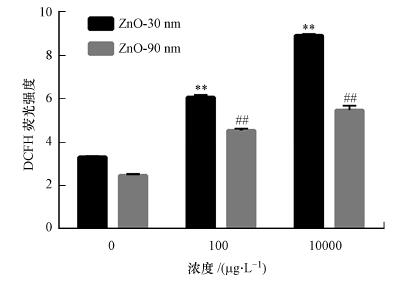 |
| 图 5 纳米氧化锌诱导RTE细胞内ROS含量的变化结果 (利用流式细胞仪检测暴露于30 nm和90 nm的氧化锌颗粒物的细胞内ROS含量, 暴露浓度为100 μg · L-1和10 mg · L-1, 暴露时间为12 h.采用无血清培养基为空白对照) Fig. 5Intracellular ROS content in RTE cells induced by ZnO NPs |
ROS检测结果显示, 纳米氧化锌诱导的RTE细胞内ROS含量上升具有显著的剂量和尺寸效应, 即当纳米氧化锌颗粒物粒径相同时, 随着暴露浓度的增加, 细胞内ROS含量升高;而同一浓度下, 纳米氧化锌的粒径越小, RTE细胞中ROS含量越高.
3.7 纳米氧化锌诱导RTE细胞内MDA含量上升纳米氧化锌诱导的RTE细胞内MDA含量显著上升(图 6, p < 0.001).粒径为30 nm暴露浓度为10 mg · L-1的处理组细胞内MDA含量较对照组极显著上升, 是对照组的17倍.粒径90 nm暴露浓度为10 mg · L-1的处理组细胞内MDA含量是对照组的6倍.
图 6(Fig. 6)
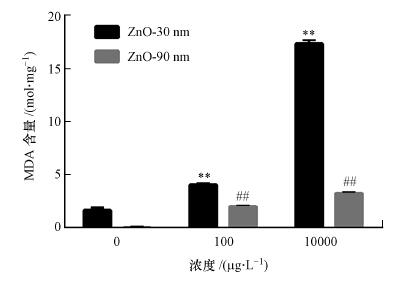 |
| 图 6 纳米氧化锌诱导RTE细胞内MDA含量的变化结果 (利用多功能酶标仪检测暴露于30 nm和90 nm的氧化锌颗粒物的细胞内MDA含量, 暴露浓度为100 μg · L-1和10 mg · L-1, 暴露时间为12 h.采用无血清培养基为空白对照) Fig. 6Intracellular MDA contents in RTE cells induced by ZnO NPs |
MDA检测结果显示, 纳米氧化锌诱导的RTE细胞内MDA含量上升具有显著的剂量和尺寸效应, 即随着暴露浓度的增加, 即当纳米氧化锌颗粒物粒径相同时, 随着暴露浓度的增加, 细胞内ROS含量升高;而同一浓度下, 纳米氧化锌的粒径越小, RTE细胞中ROS含量越高.
3.8 纳米氧化锌对RTE细胞内Ca2+-ATP酶活性的影响纳米氧化锌诱导的RTE细胞内Ca2+-ATP酶活性变化显著(图 7).当纳米氧化锌粒径为30 nm时, 对照组平均酶活力为0.510 mmol · mg-1, 是10 mg · L-1处理组的14倍, 差异显著(p < 0.01);而当暴露浓度为100 μg · L-1时, 其活性较对照组稍有下降, 但差异不显著(p > 0.05).当纳米氧化锌粒径为90 nm时, 对照组酶活力为0.080 mmol · mg-1, 当暴露浓度为100 μg · L-1时, 其酶活性显著增加(p < 0.01), 是对照组的12.4倍, 但是当暴露浓度为10 mg · L-1时, 其酶活性增加不显著(p > 0.05).
图 7(Fig. 7)
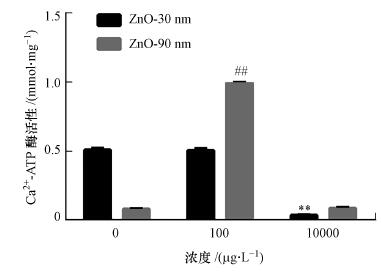 |
| 图 7 纳米氧化锌诱导RTE细胞Ca2+ ATPase活性变化结果 (暴露浓度为100 μg · L-1和10 mg · L-1, 暴露时间为12 h.采用无血清培养基为空白对照) Fig. 7Ca2+ ATPase activities in RTE cells induced by ZnO NPs |
实验结果显示, 粒径为30 nm氧化锌诱导的细胞内Ca2+-ATP酶活性随着暴露浓度的增加其活性下降, 具有浓度-依赖效应.而90 nm氧化锌颗粒物诱导的酶活性在暴露浓度为100 μg · L-1时显著增加.
3.9 纳米氧化锌诱导RTE细胞内Na+/K+-ATP酶活性下降纳米氧化锌诱导的RTE细胞内Na+/K+-ATP酶活性下降显著(图 8). 30 nm氧化锌颗粒物处理组, 其对照组酶活性为2.704 mmol · mg-1, 处理组酶活性分别是对照组的1.8倍和3.5倍, 差异显著(p < 0.01); 90 nm氧化锌颗粒物暴露组, 对照组活性为10.84 mmol · mg-1, 分别是对照组的1.72倍和2.45倍, 差异显著(p < 0.01).随着暴露浓度的增加, 纳米氧化锌诱导的细胞内Na+/K+-ATP酶活性下降, 具有浓度-依赖效应. 90 nm暴露组酶活性均高于30 nm暴露组.
图 8(Fig. 8)
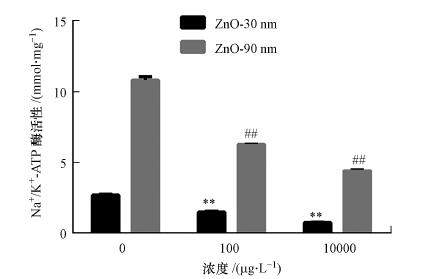 |
| 图 8 纳米氧化锌诱导RTE细胞Na+/K+-ATPase活性变化结果 (利用酶标仪检测暴露于30 nm和90 nm的氧化锌颗粒物的细胞内Na+/K+ -ATP酶活性, 暴露浓度为100 μg · L-1和10 mg · L-1, 暴露时间为12 h.采用无血清培养基为空白对照) Fig. 8Na+/K+-ATPase activities induced in RTE cells by ZnO NPs |
4 讨论(Discussion)纳米材料的广泛应用增加了其环境释放量, 促进了其在生态环境中的迁移与蓄积, 其安全性已经成为关注热点.纳米氧化锌通过空气媒介, 利用呼吸途径进入生物体, 并在其体内循环, 对靶细胞和器官造成毒性, 是其可能的致毒机制之一.但是目前针对纳米氧化锌诱导的呼吸道毒性, 尤其是除了肺部器官以外的呼吸道环节细胞毒性研究尚不广泛.本研究采用大鼠气管上皮细胞为靶细胞, 研究不同粒径和浓度的纳米氧化锌对RTE细胞的毒性及其作用机理.
纳米氧化锌进入细胞内的可能途径包括直接吞噬(Stearns et al., 2001;王龙, 2007)、通过细胞膜的微孔(Tonomura et al., 2010)或破坏细胞膜结构的完整性(Behrens et al., 2002), 通过离子通道途径吸收(Rimai et al., 2000)、被动传输等.本研究采用电感耦合等离子光谱仪检测了纳米氧化锌暴露下锌在细胞内的浓度变化.结果发现, 纳米氧化锌颗粒物进入细胞内的量随着暴露浓度的增加而增加.当暴露浓度为10 μg · L-1时, 90 nm暴露组细胞内锌离子含量约为30 nm组的2倍.根据球体体积计算公式推算发现, 高浓度暴露下, 颗粒尺寸越小, 进入细胞的纳米氧化锌颗粒物越多.纳米氧化锌颗粒物诱导的细胞毒性与进入细胞内的颗粒物数量有关, 与细胞内蓄积的锌含量无直接联系.
本研究采用CCK8法分别检测了不同浓度的30 nm、90 nm氧化锌颗粒对RTE细胞增殖的抑制影响.研究发现, 纳米氧化锌颗粒诱导的RTE细胞增殖抑制率具有浓度和尺寸依赖效应, 暴露浓度的升高, 其增殖抑制率增加;同一浓度时, 随着颗粒物粒径越大, 增殖抑制率越小.王琳等(2009)研究发现粒径为(45±27) nm的氧化锌颗粒暴露于A549细胞, 浓度为1 μmol · mL-1暴露时间为24 h, 其生长抑制率约为25% (Drinker et al., 1927). Sayes等利用L2大鼠肺上皮细胞暴露于粒径为90~283 nm的氧化锌颗粒发现, 当浓度为5.2和52 μg · cm-2时, 培养4 h和24 h后, 细胞活性明显被抑制(Sayes et al., 2008).除此之外, 纳米氧化锌颗粒对人角化细胞(HaCaT) (Horie et al., 2009)、小鼠胚胎成纤细胞(PMEF) (Sayes et al., 2008)、人胶质瘤细胞(U87) (Yang et al., 2009)等均具有不同程度的生长抑制作用.本研究进一步探究了纳米氧化锌诱导的细胞凋亡毒效应, 利用流式细胞仪、QRT-PCR和western bloting分别检测细胞凋亡率、凋亡相关基因caspase 3、相关蛋白pro-caspase 3和cleaved-caspase 3的相对表达量.结果发现, 随着暴露浓度的增加, 纳米氧化锌颗粒物诱导的细胞凋亡率增加. Caspase是促使细胞凋亡的最终途径. Caspase 3被认为是凋亡的关键蛋白酶, 一旦被激活, 即发生下游的级联反应, 使凋亡不可避免, 因而caspase 3被称为“死亡蛋白酶”(赵瑞杰等, 2010).正常情况下, 胞质中的caspase 3以无活性的酶原形存在, 细胞凋亡信号的出现可导致caspase 3在多种蛋白水解酶的作用下, 发生裂解而活化(Kuribayashi et al., 2006; Lockshin, 2005; Visconti et al., 2006). Caspase-3家族是直接导致凋亡细胞解体的蛋白酶系统, 在细胞凋亡机制网络中居中心地位.当凋亡启动时, caspase3基因表达升高, 转录形成pro-caspase3, pro-caspase3被剪切形成活化型caspase3 (cleaved-caspase3), 从而启动凋亡过程, 展现级联放大效应(Bava et al., 2005; Pradelli et al., 2014; Teissier et al., 2007).
研究发现, 纳米氧化锌可能通过破坏细胞锌代谢, 诱导细胞产生氧化应激, 进而导致细胞凋亡.锌在细胞内的吸收或转运主要受MT调节, MT是调控锌吸收的锌池.在高锌状态下, 锌诱导MT基因表达增加, 使过量锌与MT结合, 避免胞内锌浓度过高(张金洋&宋文华, 2010).本研究利用ELISA酶联免疫法检测细胞内金属硫蛋白活性, 结果发现随着暴露浓度的增加, 细胞内MT活性增强, 同时发现90 nm处理组的MT活性均高于30 nm暴露组.早期Cosma等(1992)的研究显示大鼠暴露2.5 mg · m-3氧化锌3 h后, 肺部MT基因的表达比对照组高8倍, 暴露1.0 mg · m-3氧化锌后提高3.5倍.与本研究结果相符.
本研究通过检测纳米氧化锌暴露下, 细胞内ROS和MDA含量的变化呈剂量和尺寸依赖性, 暴露浓度越大, 粒径越小, ROS和MDA含量越高. Hanley等(2008)的研究中, 暴露ZnO纳米颗粒24 h后, 正常人T细胞内ROS水平提高7倍, 癌变的T细胞内ROS水平提高14倍, 外周血单核细胞内提高25.1倍, ROS的产生在ZnO颗粒导致的细胞毒性中起重要作用.在Yang等(2009)的研究中, 纳米ZnO引起小鼠胚胎细胞内ROS水平显著升高, 并且产生的毒性与细胞内ROS水平之间具有显著的相关性. ZnO颗粒也能引起ROS的产生, 导致细胞内氧化应激、脂质过氧化、细胞膜泄露和DNA的氧化损伤(Armstead et al., 2016).本研究关于锌细胞内代谢和氧化应激的研究结果与前人的研究结果一致.
除了细胞锌代谢被破坏以及激活氧化应激以外, 也有研究发现纳米氧化锌还可以通过其他途径诱导细胞凋亡.本研究通过检测细胞内钙泵(Ca2+-ATPase)和钠钾泵(Na+/K+-ATPase)活性, 分析纳米氧化锌诱导的RTE细胞离子通道活性变化对细胞凋亡的影响.细胞膜上ATPase参与[Na+] i、[K+] I和[Ca2+] i的调节, [Na+] i、[K+] I和[Ca2+] i的相对稳定是细胞进行正常功能的基础(Tsong, 1992).粒径为30 nm氧化锌诱导的细胞内Ca2+-ATP酶活性随着暴露浓度的增加其活性下降, 具有浓度-依赖效应.而90 nm氧化锌颗粒物诱导的酶活性在暴露浓度为100 μg · L-1时, 显著增加.随着暴露浓度的增加, 纳米氧化锌诱导的细胞内Na+/K+-ATP酶活性下降, 具有浓度-依赖效应. 90 nm暴露组酶活性均高于30 nm暴露组.细胞膜上离子通道开放引起的电活动是一切细胞生理功能活动的基础. Ca2+-ATP酶是一种钙调蛋白(CaM)依赖性酶, 受胞浆内和内质网/肌质网腔内的Ca2+同时调控, 负责清除Ca2+维持稳态.本研究结果发现, 30 nm纳米氧化锌暴露降低了Ca2+-ATPase活性, 进而导致细胞内Ca2 +浓度升高, 这将进一步导致ROS的产生, 并由此促进细胞凋亡.赵景霞等通过利用海马神经元细胞暴露于纳米氧化锌中, 发现纳米氧化锌上调HVA Ca2+通道, 引起胞内Ca2+浓度升高, 并进一步诱导细胞凋亡(赵景霞, 2010).但在90 nm氧化锌颗粒物暴露浓度为100 μg · L-1时, Ca2+ -ATPase活性出现异常升高, 其原因需要进一步探究. Na+ / K+ -ATPase参与维持渗透压的平衡和细胞静息电位(RP)的维持(Liu et al., 1990).本研究结果证明, 纳米氧化锌能降低细胞膜Na+/K+ -ATP酶活性, 致使胞内K+外流, 胞质中K+减少而导致细胞凋亡. Zhao等(2009)采用全细胞膜片钳技术, 研究了ZnO纳米颗粒对大鼠海马趾CA3锥形神经元中Na+和K+离子电流的影响, 发现粒径为20~80 nm的ZnO颗粒可能涉及去极化导致的神经元损伤, ZnO颗粒通过激活电压门控的Na+通道导致Na+流入量升高, 细胞内Na+和Ca2+积累, 谷氨酸盐释放, 提高神经元的兴奋性;同时纳米ZnO还可能参与K+通道失调, 导致细胞质K+流出, 引发神经元凋亡的过程(Zhao et al., 2009).纳米氧化锌颗粒物诱导RTE细胞凋亡与离子通道失调关系密切, 但是其作用机制仍需要进一步研究.
5 结论(Conclusions)高浓度暴露时纳米氧化锌进入RTE细胞内的颗粒物粒径越小, 进入量越多.纳米氧化锌诱导的RTE细胞毒性具有剂量和尺寸依赖效应.纳米氧化锌颗粒物进入RTE细胞, 通过干扰细胞内锌代谢, 诱导细胞内ROS和MDA水平升高, 产生氧化应激, 进而诱导细胞凋亡是导致纳米氧化锌产生细胞毒性的主要原因之一.
另外, 纳米氧化锌会导致细胞内Ca2+-ATPase和Na+/K+-ATPase活性下降, 破坏细胞内离子平衡, 进一步造成细胞凋亡.但是关于离子通道破坏是通过何种具体机制诱导RTE细胞发生凋亡仍需要进一步深入研究.
参考文献
| Armstead A L, Simoes T A, Wang X, et al. 2017. Toxicity and oxidative stress responses induced by nano-and micro-CoCrMo particles[J]. Journal of Materials Chemistry B, 5(28): 5648–5657.DOI:10.1039/C7TB01372H |
| Bava S V, Puliappadamba V T, Deepti A, et al. 2005. Sensitization of taxol-induced apoptosis by curcumin involves down-regulation of nuclear factor-kappaB and the serine/threonine kinase Akt and is independent of tubulin polymerization[J]. Journal of Biological Chemistry, 280(8): 6301–6308.DOI:10.1074/jbc.M410647200 |
| Behrens I, Pena A I V, Alonso M J, et al. 2002. Comparative uptake studies of bioadhesive and non-bioadhesive nanoparticles in human intestinal cell lines and rats: the effect of mucus on particle adsorption and transport[J]. Pharmaceutical research, 19(8): 1185–1193.DOI:10.1023/A:1019854327540 |
| Cosma G, Fulton H, Defeo T, et al. 1992. Rat lung metallothionein and heme oxygenase gene expression following ozone and zinc oxide exposure[J]. Toxicol Appl Pharmacol, 117(1): 75–80.DOI:10.1016/0041-008X(92)90219-I |
| Drinker P, Thomson R M, Finn J L. 1927. Metal fume fever: Ⅱ. Resistance acquired by inhalation of zinc oxide on two successive days[J]. Journal of Industrial Hygiene, 9: 98–105. |
| Hanley C, Layne J, Punnoose A, et al. 2008. Preferential killing of cancer cells and activated human T cells using ZnO nanoparticles[J]. Nanotechnology, 19(29): 295103.DOI:10.1088/0957-4484/19/29/295103 |
| 何艳, 丁飞, 张前进, 等. 2016. 纳米氧化锌颗粒对大鼠肺及人支气管上皮细胞的毒性作用[J]. 江苏预防医学, 2016, 27(1): 14–17. |
| Hirsch C, Striegl B, Mathes S, et al. 2017. Multiparameter toxicity assessment of novel DOPO-derived organophosphorus flame retardants[J]. Archives of Toxicology, 91(1): 1–19.DOI:10.1007/s00204-016-1805-9 |
| Horie M, Nishio K, Fujita K, et al. 2009. Protein adsorption of ultrafine metal oxide and its influence on cytotoxicity toward cultured cells[J]. Chemical Research in Toxicology, 22(3): 543–553.DOI:10.1021/tx800289z |
| Huizar I, Malur A, Patel J, et al. 2013. The role of PPARγ in carbon nanotube-elicited granulomatous lung inflammation[J]. Respiratory Research, 14(1): 7.DOI:10.1186/1465-9921-14-7 |
| Kuribayashi K, Mayes P A, Eldeiry W S. 2006. What are caspases 3 and 7 doing upstream of the mitochondria?[J]. Cancer Biology & Therapy, 5(7): 763–765. |
| 李小林, 邱璐, 王艳, 等. 2012. 纳米氧化锌和超细氧化锌颗粒细胞毒性和DNA损伤作用比较研究[J]. 毒理学杂志, 2012, 26(6): 437–439. |
| Liu D S, Astumian R D, Tsong T Y. 1990. Activation of Na+ and K+ pumping modes of (Na, K)-ATPase by an oscillating electric field[J]. Journal of Biological Chemistry, 265(13): 7260–7267. |
| Lockshin R A. 2005. Programmed cell death: history and future of a concept[J]. Journal De La Société De Biologie, 199(3): 169–173.DOI:10.1051/jbio:2005017 |
| Martin C J, Le X C, Guidotti T L, et al. 1999. Zinc exposure in Chinese foundry workers[J]. American Journal of Industrial Medicine, 35(6): 574–580.DOI:10.1002/(ISSN)1097-0274 |
| Maynard A D. 2006. Nanotechnology: assessing the risks[J]. Nano Today, 1(2): 22–33.DOI:10.1016/S1748-0132(06)70045-7 |
| Oberd?rster G, Finkelstein J N, Johnston C, et al. 2000. Acute pulmonary effects of ultrafine particles in rats and mice[J]. Research Report, 96(96): 75–86. |
| Pradelli L A, Villa E, Zunino B, et al. 2014. Glucose metabolism is inhibited by caspases upon the induction of apoptosis[J]. Cell Death & Disease, 5(5). |
| Rimai D S, Quesnel D J, Busnaina A A. 2000. The adhesion of dry particles in the nanometer to micrometer-size range[J]. Colloids and surfaces A: Physicochemical and engineering aspects, 165(1/3): 3–10. |
| Sayes C M, Reed K L, Subramoney S, et al. 2008. Can in vitro assays substitute for in vivo studies in assessing the pulmonary hazards of fine and nanoscale materials?[J]. Journal of Nanoparticle Research, 11(2): 421–431. |
| Semmler M, Seitz J, Erbe F, et al. 2004. Long-term clearance kinetics of inhaled ultrafine insoluble iridium particles from the rat lung, including transient translocation into secondary organs[J]. Inhalation Toxicology, 16(6-7): 453–459.DOI:10.1080/08958370490439650 |
| Shvedova A A, Kisin E R, Mercer R, et al. 2005. Unusual inflammatory and fibrogenic pulmonary responses to single-walled carbon nanotubes in mice[J]. American Journal of Physiology Lung Cellular & Molecular Physiology, 289(5): L698–L708. |
| Stearns R C, Paulauskis J D, Godleski J J. 2001. Endocytosis of ultrafine particles by A549 cells[J]. American Journal of Respiratory Cell & Molecular Biology, 24(2): 108–115. |
| Teissier S, Ben K Y, Mori M, et al. 2007. A new E6/P63 pathway, together with a strong E7/E2F mitotic pathway, modulates the transcriptome in cervical cancer cells[J]. Journal of Virology, 81(17): 9368–9376.DOI:10.1128/JVI.00427-07 |
| Tonomura W, Yamamoto T, Saito T K, et al. 2010. Chemically modified MEMS probe driven by self-alignment mechanism for photooxidative cell membrane perforation[J]. Sensors & Actuators B Chemical, 148(1): 29–33. |
| Tsong T Y. 1992. Molecular recognition and processing of periodic signals in cells: study of activation of membrane ATPases by alternating electric fields[J]. Biochimica Et Biophysica Acta, 1113(1): 53–70.DOI:10.1016/0304-4157(92)90034-8 |
| Visconti R, D'Adamio L. 2006. Functional cloning of genes regulating apoptosis in neuronal cells[J]. Methods Mol Biol, 399(399): 125–131. |
| 王琳, 王莉娟, 张芳, 等. 2009. 纳米氧化锌对人肺腺癌细胞A549的毒性[J]. 中国科学院大学学报, 2009, 26(1): 83–90. |
| 王龙. 2007. 几种纳米材料的制备及其安全性评价[D]. 成都: 四川大学. 1-108 |
| Yang H, Liu C, Yang D, et al. 2009. Comparative study of cytotoxicity, oxidative stress and genotoxicity induced by four typical nanomaterials: the role of particle size, shape and composition[J]. Journal of Applied Toxicology Jat, 29(1): 69–78.DOI:10.1002/jat.v29:1 |
| Zhao J, Xu L, Zhang T, et al. 2009. Influences of nanoparticle zinc oxide on acutely isolated rat hippocampal CA3 pyramidal neurons[J]. Neurotoxicology, 30(2): 220.DOI:10.1016/j.neuro.2008.12.005 |
| 赵景霞. 2010. 纳米氧化锌对海马神经元电生理特性的影响及对PC12细胞生物学效应的机制研究[D]. 天津: 南开大学. 1-98 |
| 赵瑞杰, 李引乾, 王会, 等. 2010. Caspase家族与细胞凋亡的关系[J]. 中国畜牧杂志, 2010, 46(17): 73–78. |
| 张金洋, 宋文华. 2010. 纳米氧化锌的健康危害与生态安全性研究进展[J]. 生态毒理学报, 2010, 5(4): 457–468. |
