 , 全向春1
, 全向春1

1. 北京师范大学环境学院, 水环境模拟国家重点实验室, 北京 100875;
2. 北华航天工业学院建筑工程系, 廊坊市 065000
收稿日期: 2017-05-27; 修回日期: 2017-07-12; 录用日期: 2017-07-12
基金项目: 北京市自然科学基金(No.8152021)
作者简介: 司秀荣(1987-), 女, E-mail: hbsixiurong@126.com
通讯作者(责任作者): 全向春, E-mail: xchquan@bnu.edu.cn
摘要: 研究了小分子物质双(3-氨基丙基)胺对混合菌落生物膜形成抑制及解体效应机制,并探讨了利用双(3-氨基丙基)胺减缓膜表面生物污染的可行性.结果表明,双(3-氨基丙基)胺能有效抑制混合菌群微生物附着和生物膜形成,抑制作用随浓度的升高而增强.经过双(3-氨基丙基)胺处理(131 mg·L-1)24 h,生物膜形成抑制率达到74.61%.这种抑制效果不是通过杀菌方式产生而是通过抑制微生物中胞外多糖和eDNA含量产生.经双(3-氨基丙基)胺处理后,胞外多糖和eDNA分别下降了39.37%±2.68%和70.05%±2.93%.双(3-氨基丙基)胺对已经形成的生物膜也有一定解离作用.对于预培养12 h的生物膜,双(3-氨基丙基)胺(131 mg·L-1)处理10 h,解体率为23.59%.另外双(3-氨基丙基)胺可减缓膜过滤过程中膜孔堵塞速度,降低膜压,缓解由微生物引起的膜污染问题,在环境膜污染控制方面具有潜在应用价值.
关键词:双(3-氨基丙基)胺生物膜混合菌落抑制率
A small-molecule norspermidine inhibits biofilm formation for the mixed culture in wastewater
SI Xiurong1,2
 , QUAN Xiangchun1
, QUAN Xiangchun1

1. State Key Laboratory of Water Environment Simulation, School of Environment, Beijing Normal University, Beijing 100875;
2. Civil Engineering Department, North China Institute of Aerospace Engineering, Langfang 065000
Received 27 May 2017; received in revised from 12 July 2017; accepted 12 July 2017
Supported by the Beijing Natural Science Foundation of China (No. 8152021)
Biography: SI Xiurong(1987—), female, E-mail: hbsixiurong@126.com
*Corresponding author: QUAN Xiangchun, E-mail: xchquan@bnu.edu.cn
Abstract: This study investigated the effects of norspermidine on the formation and disassembly of biofilm of mixed culture and its mechanism, and also explored the feasibility to control membrane fouling using norspermidine. The results show that norspermidine could effectively inhibit the microbial attachment and biofilm formation, and the inhibition efficiency increased with the increase of norspermidine concentration. After treatment with norspermidine (131 mg·L-1) for 24 h, biofilm inhibition rate attained 74.61%. Norspermidine could retard bacterial adhesion and destruct biofilm matrix by reducing exopolysaccharides and extracellular DNA (eDNA) associated with bacteria instead of growth inhibition. Exopolysaccharides and eDNA associated with the suspended microorganisms were significantly reduced by 39.37%±2.68% and 70.05%±2.93% after treatment with norspermidine (131 mg·L-1). Norspermidine could promote the disassembly of pre-formed biofilm. After 10 h contacting with 131 mg·L-1 norspermidine, biofilm disassembly rate attained 23.59%. Furthermore, norspermidine can be used to retard membrane pore blocking during membrane filtration, reduce transmembrane pressure and membrane fouling resulted from microorganisms. Therefore, norspermidine also shows the potential application in environmental membrane fouling control.
Key words: norspermidinebiofilmsmulti-speciesinhibition rate
1 引言(Introduction)生物膜(Biofilm)是由附着于惰性或者活性固体材料表面的微生物和由微生物自身分泌的胞外聚合物(Extracellular polymeric substances, EPS)所形成的高度结构化微生物群落(Costerton et al., 1999).它的存在可引起一系列的环境问题, 如膜污染、管道堵塞、金属表面腐蚀和消毒效率降低等(Gino et al., 2010; Schwering et al., 2013).目前对其控制多采用杀菌剂、抗菌剂或其它大分子抑菌剂(Rosmaninho et al., 2007; Sim?es et al., 2010).但这些物质的释放无疑带来了新的环境风险, 长期使用抗生素或者杀菌剂还会导致细菌的抗药性增加, 耐药细菌蔓延(Davies, 2003).
利用化学信号小分子物质通过抑制微生物活性, 调节生物膜的发展过程是目前生物膜领域的研究热点.双(3-氨基丙基)胺是某些微生物自身产生的可以引起一些生物膜解体的信号分子(Qu et al., 2016), 探讨这种小分子物质的生物膜调控作用对于开发新兴生物膜控制技术具有重要意义.目前, 双(3-氨基丙基)胺对微生物附着的抑制研究较少且多集中于纯菌生物膜, 对混合菌落生物膜的抑制研究鲜有报道.实际环境中的生物膜多由混合菌群组成, 因此有必要研究双(3-氨基丙基)胺对混合菌落生物膜抑制及解聚效应.本研究将以双(3-氨基丙基)胺为目标物质, 考察这种小分子物质对混合菌落生物膜形成抑制及解体效应机制, 并进一步对其减缓膜表面生物污染的可行性进行探讨.该研究对于建立基于小分子物质的生物膜抑制及膜表面生物污染控制方法具有理论价值与实际指导意义.
2 材料与方法(Materials and methods)2.1 化学试剂和微生物双(3-氨基丙基)胺购自美国Sigma-Aldrich公司, 纯度为99%.其他化学试剂购于梦怡美生物科技有限公司(北京, 中国).
混合菌落来源于清河污水处理厂(北京, 中国)的活性污泥, 经过上海美吉生物医药科技有限公司通过MiSeq系统分析组成主要包括丛毛单胞菌属(Comamonas)、孢鱼菌科(Nakamurella)、肠杆菌科(Enterobacteriaceae)、梭状芽孢杆菌(Clostridium)、鞘脂单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)、固氮螺菌属(Azospira)、寡养单胞菌(Stenotrophomonas)和铁杆菌属(Ferribacterium).活性污泥首先用磷酸盐缓冲溶液(PBS)冲洗3遍以去除污泥溶液中的EPS及有机物, 然后将活性污泥重悬于合成废水中用于制备混合菌菌悬液(100 mg VSS·L-1)(大约108 CFU·mL-1).合成废水包含(mg·L-1):COD (以葡萄糖计算) 825;NH4Cl 192;KH2PO4 35.1;NaCl 100;MgSO4 100;CaCl2 10;pH=6.5~7.5.
2.2 双(3-氨基丙基)胺对混合菌群生物膜形成影响研究将含有不同浓度双(3-氨基丙基)胺的菌悬液加入到聚苯乙烯的12孔板中, 每孔4 mL, 双(3-氨基丙基)胺终浓度分别为0、2.62、6.55、13.10、26.20、65.50或131 mg·L-1, 每个浓度设置6个平行样以确保实验的准确性.将加完样品的12孔板置于30 ℃恒温培养箱中分别静止培养12 h和24 h.培养完成后附着的生物膜量利用结晶紫染色法相对定量(Xiong et al., 2013).本研究以活性污泥作为生物膜形成的混合菌来源, 随着生物膜的形成和发展, 其群落结构可能会与活性污泥有一些差别, 但本研究重点不是关注其群落结构演变过程, 而是以生物膜形式负载到基底材料表面生物量的变化, 并以其来评价生物膜形成抑制效应.
2.3 不同基底层上双(3-氨基丙基)胺对混合菌群附着影响抑制剂对微生物附着特性的影响和附着基底材料表面特性密切相关, 所以本研究进一步考察了双(3-氨基丙基)胺对微生物在不同材质基底层表面的附着影响.分别选择具有不同亲疏水性特性的聚苯乙烯(6孔板)、玻璃片和聚甲基丙烯酸甲酯3种材料为附着界面, 3种表面接触角分别为93.4°、22.0°和81.9°.分别将20 mm× 20 mm玻璃片或聚甲基丙烯酸甲酯片置于6孔板中进行附着实验, 每个孔板中加入6 mL污泥悬液, 再分别加入双(3-氨基丙基)胺终浓度为0或131 mg·L-1.污泥悬液、基质浓度及操作条件和上述的附着实验一致.培养24 h后, 将载玻片烘干, 染色并用Olympus相机进行拍照记录.
2.4 双(3-氨基丙基)胺对膜污染缓解效应研究将双(3-氨基丙基)胺投加到溶液通过和悬浮微生物作用之后, 微生物在膜表面的附着实验分别以静态附着和动态死端过滤形式考察.静态实验如下:将直径为3.5 cm的膜片置于6孔培养板, 加入10 mL混合菌液, 同时加入双(3-氨基丙基)胺使其终浓度分别为0或131 mg·L-1, 30 ℃恒温培养箱中静止培养24 h, 取出膜片放在15 mL PBS中超声使附着的微生物完全脱落后在旋涡混合器中快速混合15 s, 测定细菌OD600值(张利平等, 2011)(因结晶紫染料会和膜材料表面结合影响实验结果, 故采用混合涡旋脱离生物膜后直接测菌体光密度的方法).动态过滤采用恒流过滤模式, 使用一台蠕动泵将储水容器中混合菌液(含有或不含有131 mg·L-1的双(3-氨基丙基)胺)通过管道压入膜组件(膜直径4 cm), 电子天平收集溶液的质量数据, 当膜表面造成一定堵塞之后, 膜压增加, 压力表读数上升.通过压力表读数可间接评价膜污染发展状况.
2.5 双(3-氨基丙基)胺对混合菌群生物膜解体影响研究为了考察双(3-氨基丙基)胺对生物膜的解体性能, 需预先培养生物膜(12 h).然后将载玻片拿出洗掉未附着的微生物.然后放置于含有131 mg·L-1双(3-氨基丙基)胺的PBS溶液中, 另外的载玻片放入只含有PBS的溶液中作为对照, 30 ℃分别静置6、8、10或12 h后, 将载玻片拿出洗掉悬浮的微生物, 剩余生物量采用如上结晶紫染色法进行相对定量.
2.6 双(3-氨基丙基)胺对悬浮微生物EPS分布影响研究为了探讨双(3-氨基丙基)胺对生物膜形成抑制机理, 本研究进一步对悬浮混合菌群微生物的EPS进行考察.具体操作步骤如下:将含有一定浓度的污泥悬液和基质(如上)置于50 mL离心管中, 同时加入双(3-氨基丙基)胺使其最终浓度分别为0、131 mg·mL-1, 30 ℃放置一定时间, 测定EPS含量变化, 同时测定悬浮液的OD600变化.EPS的提取参考Xuan等(2010)的方法, 蛋白测定采用的Lowry法(Fr?lund et al., 1996), 多糖的测定采用的是硫酸-苯酚比色法(Dubois et al., 1956);eDNA的测定参考Allesen-Holm等(2006)的方法.
3 结果与讨论(Results and discussion)3.1 双(3-氨基丙基)对混合菌群生物膜形成影响不同浓度双(3-氨基丙基)胺对混合菌群微生物附着特性的影响结果如图 1所示.微生物经2.62~131 mg·L-1双(3-氨基丙基)胺处理12 h附着量下降了5.61%~67.93%, 处理24 h附着量下降了4.60%~74.61%.可见在选定的两个时间段对微生物附着的抑制作用均随着双(3-氨基丙基)胺浓度升高而增强.
图 1(Fig. 1)
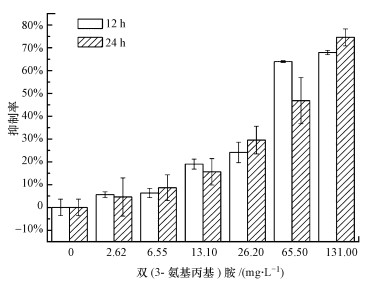 |
| 图 1 不同浓度双(3-氨基丙基)胺对混合菌落生物膜形成影响 Fig. 1Effects of different concentrations of norspermidine on mixed culture biofilm formation |
3.2 不同基底层上双(3-氨基丙基)胺对微生物附着影响微生物附着到载体表面是生物膜形成的第一步, 可以通过特异性或者非特异性的细菌-表面相互作用发生(Hochbaum et al., 2011).一些表面特性会影响微生物的附着, 且一些抑制剂对微生物附着抑制作用也会受到表面特性的影响.因此, 本研究对于不同基底层上双(3-氨基丙基)胺对微生物附着影响特性进行考察.双(3-氨基丙基)胺存在的情况下, 附着到基底材料的生物量经结晶紫染色记录, 如图 2所示.结果显示无论是在疏水性的聚苯乙烯表面还是亲水性的聚甲基丙烯酸甲酯和玻璃表面, 双(3-氨基丙基)胺对微生物的附着均有很好地抑制作用.说明这种物质可以广泛应用于不同材质材料表面生物膜的控制.
图 2(Fig. 2)
 |
| 图 2 不同基底层表面双(3-氨基丙基)胺对微生物附着影响 Fig. 2Inhibitory effect of norspermidine on biofilm development adhered on different substrate surfaces |
3.3 双(3-氨基丙基)胺对膜污染缓解效应研究另外, 为了进一步探讨双(3-氨基丙基)胺控制膜表面生物污染的可能性, 将双(3-氨基丙基)胺投加到溶液通过和悬浮微生物作用之后, 考察微生物在膜表面的附着形态, 分别以静态附着和动态过滤形式考察.静态形式培养条件下, 微生物经过不同浓度的双(3-氨基丙基)胺作用后在聚酰胺膜表面的附着量如图 3所示.结果显示, 微生物经过双(3-氨基丙基)胺处理在膜表面的附着量明显降低, 而且双(3-氨基丙基)胺浓度越高, 附着量越少.例如, 经过26.2、65.5及131.0 mg·L-1双(3-氨基丙基)胺处理后, 微生物在膜表面附着量分别降低了18.38%、31.03%和69.15%.双(3-氨基丙基)胺显著抑制了微生物在膜表面的附着, 而且这种抑制效果和双(3-氨基丙基)胺浓度成正相关.此结果也在SEM中得到证实, 对照组膜表面形成的微生物群落比较致密, 生物膜连成片, 而实验组膜表面附着的微生物相当稀疏, 有大量的空白区域, 实验组膜表面附着的生物量要明显少于对照组膜表面附着的微生物量.
图 3(Fig. 3)
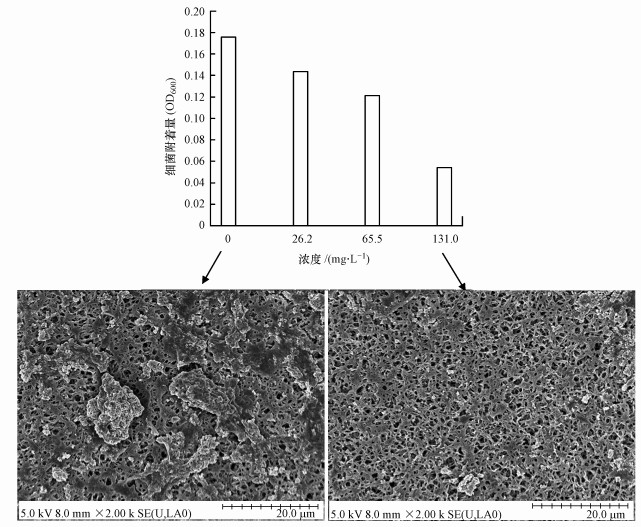 |
| 图 3 双(3-氨基丙基)胺对混合菌落微生物在聚酰胺膜表面的附着影响 Fig. 3Effect of norspermidine onmulti-species microbial attachment on polyamide membrane surfaces |
对于生物膜动态过滤培养过程, 膜过滤过程中膜压随过滤液质量及时间变化如图 4所示.由图可以看出, 当过滤重量为359.71 g, 过滤时间170 min时, 对照组膜孔(即过滤液中没有双(3-氨基丙基)胺)发生了一定程度的堵塞, 此时膜压为10 kPa, 但实验组(即过滤液中加有双(3-氨基丙基)胺)中的膜压仍然为0, 表明膜孔径并没有像对照组膜堵塞严重;当过滤液质量为628.55 g, 过滤时间为300 min时, 实验组中的膜压力开始上升, 膜压为12.5 kPa, 约为过滤时间175 min时的对照组膜压, 而此时对照组中的膜压已经为50 kPa.这表明双(3-氨基丙基)胺可减缓膜过滤过程中膜孔堵塞速度, 降低膜压, 缓解由微生物引起的膜污染问题.
图 4(Fig. 4)
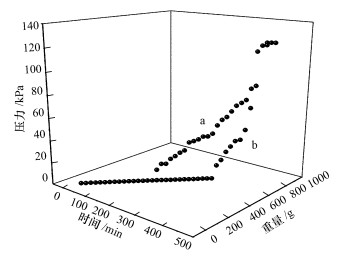 |
| 图 4 膜过滤过程膜压随过滤质量和过滤时间变化图 (a.对照组; b.实验组) Fig. 4The change of pressure as function of filtration weight and time during the membrane filtration process (a. the control group, b. the test group) |
3.4 双(3-氨基丙基)胺对混合菌群生物膜解体影响一些传统的物理化学方法, 如冲刷、消毒剂及紫外线消毒等常被用作生物膜去除, 但由于生物膜中细菌受EPS的保护作用使其对这些常规方法具有一定抗性, 即使高浓度的杀菌剂也很难将生物膜去除.例如, 500 mg·L-1的常规剥离剂也难以剥离成熟的生物膜, 紫外线对生物膜中微生物杀灭能力明显弱于对悬浮微生物的杀灭作用(王海峰等, 2010).本研究进一步对小分子物质双(3-氨基丙基)胺能否引起成熟生物膜解体进行探讨.131.0 mg·L-1双(3-氨基丙基)胺对于预培养12 h的生物膜解体效果如图 5所示.由图得出, 双(3-氨基丙基)胺处理生物膜6~12 h后, 生物膜量相对于对照组下降了3.87%~23.59%, 由此可以说明双(3-氨基丙基)胺对生物膜解体有一定的促进作用.这对于控制生物膜, 降低微生物安全风险具有重要的意义.
图 5(Fig. 5)
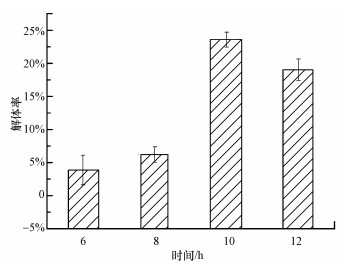 |
| 图 5 双(3-氨基丙基)胺对成熟生物膜的解体作用 Fig. 5The disintegration effect of norspermidine on mature biofilms |
3.5 双(3-氨基丙基)胺对微生物EPS分泌的影响为了进一步探究双(3-氨基丙基)胺对微生物的作用机制, 本研究进一步考察了双(3-氨基丙基)胺对微生物生长及其EPS(胞外蛋白、多糖和DNA)的影响.结果如图 6所示, 131 mg·L-1双(3-氨基丙基)胺对微生物12 h生长量的抑制率为0.36%±0.54%, 没有抑制微生物生长;对照组中胞外蛋白、多糖和eDNA的含量分别是(8.48±0.46) mg·g-1 MLVSS、(3.04±0.20) mg·g-1 MLVSS和(18.33±2.55) μg·g-1 MLVSS, 经过双(3-氨基丙基)胺处理之后, 胞外多糖和eDNA均有下降, 分别为(1.85±0.08) mg·g-1 MLVSS, (5.49±0.54) μg·g-1 MLVSS, 下降了39.37%±2.68%和70.05%±2.93%, 而胞外蛋白含量几乎没有变化, 均保持在8.02~8.98 mg·g-1 MLVSS.本课题组进一步通过激光共聚焦观察及定量计算显示双(3-氨基丙基)胺对生物膜处理后使多糖减少了53%(Wu et al., 2016).由此可以推断双(3-氨基丙基)胺对微生物附着及生物膜形成的抑制作用并不是通过杀菌产生, 对微生物EPS中胞外多糖和eDNA分泌有一定的抑制作用, 但对胞外蛋白没有影响.
图 6(Fig. 6)
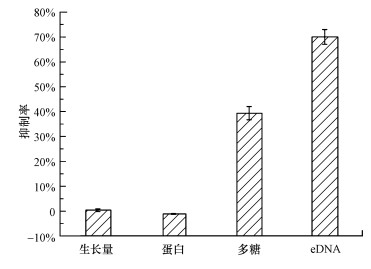 |
| 图 6 双(3-氨基丙基)胺对微生物生长及EPS产量的影响 Fig. 6Effect of norspermidine on microbial growth and EPS production of suspended microorganisms |
据报道, 双(3-氨基丙基)胺结构中含有的氨基可以直接和一些带负电荷的基团或者是胞外多糖中一些带有极性基团的糖类相互作用(Kropec et al., 2005; Sutherland, 2001), 这可能是其引起二者浓度降低的重要原因.众所周知, EPS(蛋白、多糖和eDNA)对于微生物附着及其生物膜形成起着至关重要的作用, 它促使微生物在生物和非生物表面的初始附着.将EPS完全去除以后, 微生物的附着性能显著降低.胞外多糖是生物膜形成的诱导因子, 可使表面预处理化附着更容易发生, 甚至可以作为细菌碳源(Beauregard et al., 2013);eDNA对于微生物在亲水性和疏水性表面的附着都起着重要的作用(Das et al., 2010), 它通过多种方式调控生物膜的发展过程, 如为其他细菌提供基质、它是生物膜结构的重要成分、可促进基因物质的交换(Wu et al., 2009)及调控结合性摄取系统等(Petersen et al., 2005).另外, EPS中的蛋白组大多为带正电荷的疏水性物质、多糖为带负电荷的亲水性物质及eDNA为带负电荷的疏水性物质(Sheng et al., 2010), 三者之间的相互作用维持了细菌的表面特性, 当这三者组成发生变化时会造成细菌表面特性的变化, 而细菌表面特性(亲疏水性和表面电荷)和微生物的附着密切相关(Harimawan et al., 2011).所以本研究中双(3-氨基丙基)胺通过抑制微生物中EPS某些成分的特性或者分泌, 进而影响微生物附着和生物膜形成, 并且导致一小部分的生物膜可以从EPS的包裹中释放出来解体为悬浮态细菌, 即引起生物膜解体.已有一些报道也发现当EPS中蛋白、多糖和eDNA浓度降低时, 微生物附着量相应下降(Lv et al., 2014; Xu et al., 2011).
4 结论(Conclusions)1) 双(3-氨基丙基)胺能有效抑制混合菌群微生物附着和生物膜形成, 随着浓度的升高抑制作用增强, 且其抑制效果较为稳定, 抑制率不会随着时间延长而降低.
2) 双(3-氨基丙基)胺对成熟生物膜解体有一定的促进作用.这对于控制生物膜, 降低微生物安全风险具有重要的意义.
3) 双(3-氨基丙基)胺在生物膜形成有效抑制浓度(26.2~131.0 mg·L-1)范围内并没有对于微生物生长产生显著作用, 因此不是通过杀菌方式抑制生物膜形成, 而是通过抑制微生物中EPS含量, 可以避免传统杀菌剂产生的抗药性问题, 因此为生物膜抑制提供了新方法.
4) 双(3-氨基丙基)胺可减缓膜过滤过程中膜孔堵塞速度, 降低膜压, 缓解由微生物引起的膜污染问题, 这对环境中膜污染控制具有潜在的指导意义.
参考文献
| Allesen-Holm M, Barken K B, Yang L, et al. 2006. A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms[J]. Molecular microbiology, 59(4): 1114–1128.DOI:10.1111/mmi.2006.59.issue-4 |
| Beauregard P B, Chai Y, Vlamakis H, et al. 2013. Bacillus subtilis biofilm induction by plant polysaccharides[J]. Proceedings of the National Academy of Sciences, 110(17): 1621–1630.DOI:10.1073/pnas.1218984110 |
| Costerton J, Stewart P S, Greenberg E. 1999. Bacterial biofilms:a common cause of persistent infections[J]. Science, 284(5418): 1318–1322.DOI:10.1126/science.284.5418.1318 |
| Das T, Sharma P K, Busscher H J, et al. 2010. Role of extracellular DNA in initial bacterial adhesion and surface aggregation[J]. Applied and Environmental Microbiology, 76(10): 3405–3408.DOI:10.1128/AEM.03119-09 |
| Davies D. 2003. Understanding biofilm resistance to antibacterial agents[J]. Nature Reviews Drug Discovery, 2(2): 114–122.DOI:10.1038/nrd1008 |
| Dubois M, Gilles K A, Hamilton J K, et al. 1956. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 28(3): 350–356.DOI:10.1021/ac60111a017 |
| Fr?lund B, Palmgren R, Keiding K, et al. 1996. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 30(8): 1749–1758.DOI:10.1016/0043-1354(95)00323-1 |
| Gino E, Starosvetsky J, Kurzbaum E, et al. 2010. Combined chemical-biological treatment for prevention/rehabilitation of clogged wells by an iron-oxidizing bacterium[J]. Environmental Science & Technology, 44(8): 3123–3129. |
| Harimawan A, Rajasekar A, Ting Y P. 2011. Bacteria attachment to surfaces-AFM force spectroscopy and physicochemical analyses[J]. Journal of Colloid and Interface Science, 364(1): 213–218.DOI:10.1016/j.jcis.2011.08.021 |
| Hochbaum A I, Kolodkin-Gal I, Foulston L, et al. 2010. Inhibitory effects of D-amino acids on Staphylococcus aureus biofilm development[J]. Journal of Bacteriology, 193(20): 5616–5622. |
| Kropec A, Maira-Litran T, Jefferson K K, et al. 2005. Poly-N-acetylglucosamine production in Staphylococcus aureus is essential for virulence in murine models of systemic infection[J]. Infection and Immunity, 73(10): 6868–6876.DOI:10.1128/IAI.73.10.6868-6876.2005 |
| Lv J, Wang Y, Zhong C, et al. 2014. The microbial attachment potential and quorum sensing measurement of aerobic granular activated sludge and flocculent activated sludge[J]. Bioresource Technology, 151: 291–296. |
| Petersen F C, Tao L, Scheie A A. 2005. DNA binding-uptake system:a link between cell-to-cell communication and biofilm formation[J]. Journal of Bacteriology, 187(13): 4392–4400.DOI:10.1128/JB.187.13.4392-4400.2005 |
| Qu L, She P, Wang Y. 2016. Effects of norspermidine on Pseudomonas aeruginosa biofilm formation and eradication[J]. MicrobiologyOpen, 5(3): 1–11. |
| Rosmaninho R, Santos O, Nylander T, et al. 2007. Modified stainless steel surfaces targeted to reduce fouling-evaluation of fouling by milk components[J]. Journal of Food Engineering, 80(4): 1176–1187.DOI:10.1016/j.jfoodeng.2006.09.008 |
| Schwering M, Song J, Louie M, et al. 2013. Multi-species biofilms defined from drinking water microorganisms provide increased protection against chlorine disinfection[J]. Biofouling, 29(8): 917–928.DOI:10.1080/08927014.2013.816298 |
| Sheng G P, Yu H Q, Li X Y. 2010. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J]. Biotechnology Advances, 28(6): 882–894.DOI:10.1016/j.biotechadv.2010.08.001 |
| Sim?es M, Simoes L C, Vieira M J. 2010. A review of current and emergent biofilm control strategies[J]. LWT-Food Science and Technology, 43(4): 573–583.DOI:10.1016/j.lwt.2009.12.008 |
| Sutherland I W. 2001. Biofilm exopolysaccharides:a strong and sticky framework[J]. Microbiology, 147(1): 3–9.DOI:10.1099/00221287-147-1-3 |
| 王海峰, 徐冉, 李风亭. 2010. 饮用水系统生物膜形成和控制研究[J]. 给水排水, 2010(4): 17–22. |
| Wu Y, Quan X, Si X, et al. 2016. A small molecule norspermidine in combination with silver ion enhances dispersal and disinfection of multi-species wastewater biofilms[J]. Applied Microbiology and Biotechnology, 100: 1–11.DOI:10.1007/s00253-015-7019-x |
| Wu J, Xi C. 2009. Evaluation of different methods for extracting extracellular DNA from the biofilm matrix[J]. Applied and Environmental Microbiology, 75(16): 5390–5395.DOI:10.1128/AEM.00400-09 |
| Xiong Y, Liu Y. 2013. Importance of extracellular proteins in maintaining structural integrity of aerobic granules[J]. Colloids and Surfaces B:Biointerfaces, 112: 435–440.DOI:10.1016/j.colsurfb.2013.07.060 |
| Xuan W, Bin Z, Zhiqiang S, et al. 2010. The EPS characteristics of sludge in an aerobic granule membrane bioreactor[J]. Bioresource Technology, 101(21): 8046–8050.DOI:10.1016/j.biortech.2010.05.074 |
| Xu H, Liu Y. 2011. Reduced microbial attachment by d-amino acid-inhibited AI-2 and EPS production[J]. Water Research, 45(17): 5796–5804.DOI:10.1016/j.watres.2011.08.061 |
| 张利平, 王爽, 周向葛, 等. 2011. 群体感应抑制剂溴化呋喃酮对牙龈卟啉单胞菌生物膜形成影响的研究[J]. 华西口腔医学杂志, 2011, 29(5): 469–472. |
