全文HTML
--> --> --> 双酚A(bisphenol A, BPA)是一种被列入内分泌干扰物(endocrine disrupting chemicals, EDCs)名单的重要工业原料,在塑料、阻燃、涂料等产品中广泛使用并最终进入自然环境,因此,BPA在河流、湖泊、海洋等地表水体和地下水中被频繁检出[1]。目前,污水处理厂常规的物理和生物处理法对BPA的去除效果均有限。因此,需开发高效降解BPA的技术,以解决水体BPA的污染问题[2]。过一硫酸盐(PMS)在被激发后可释放出超氧自由基(O2·?)、羟基自由基(·OH)、硫酸根自由基(SO4·?)等多种强氧化性自由基,这些自由基降解污染物的能力强且反应速度快,因此,基于PMS的高级氧化技术已引起广泛关注[3-7]。与均相反应相比,基于半导体催化剂的非均相反应具有稳定、激发效率高的优势,更适用于多种水质[8],且半导体催化剂中可变价的过渡金属离子会产生氧化还原电对,通过金属离子与PMS间发生电子转移的方式来促进PMS的激发,产生SO4·?或O2·?进而实现对污染物的降解[9]。目前已有大量研究采用半导体催化剂激发PMS[10-11],也有研究利用半导体催化剂的良好光吸收效率,将半导体光催化与PMS的催化氧化耦合联用,通过多种途径激发PMS[11];同时,PMS的加入会促进半导体催化剂光生电荷的转移和分离[8]。因此,太阳光/半导体催化剂/PMS联用的高级氧化技术极具前景和可行性[12-14]。目前的大量相关研究主要是利用氧化电势较高的SO4·?或·OH实现对污染物的降解[10-11];而O2·?具有相对低的氧化电势,同时具有更强的对污染物的选择性,但基于O2·?的PMS催化氧化研究尚处于初级阶段[15-16]。
层状双氢氧化物(layered double hydroxides, LDHs),是一类易于制备的阴离子粘土或水滑石类材料,具备特殊的层状结构和较大的比表面积。LDHs是由构成板层的金属阳离子和层间阴离子构成,其阳离子包括二价和三价离子,且当三价离子所占摩尔比在0.25~0.33时,LDHs结构稳定且结晶度高[17-18]。LDHs的二维层状结构可以在一定程度上诱导电子的转移,抑制电子-空穴对的复合[19];LDHs中存在大量活性位点,可以充分接触并激发PMS;当阳离子中含过渡金属元素时,LDHs会具有更强的电子转移能力和催化能力[20]。目前已有研究者将LDHs作为复合催化剂的一部分,运用光催化与过硫酸盐高级氧化耦合的技术,实现对污染物的降解[9];但半导体与LDHs复合的催化剂的合成常需多步反应完成,而一步水热反应合成的LDHs则具有合成简单高效的优势。
本研究选取了Cu、Mn、Fe 3种元素作为LDHs的金属阳离子,通过水热法合成了Cu/Mn-Fe LDHs,确定了Cu、Mn、Fe的最佳摩尔比,进行多种表征并测试了其催化性能;探究了催化剂投加量和PMS浓度对BPA降解效果的影响并得到降解BPA的最佳反应参数;在不同反应条件下测试了BPA的降解效率,比较了LDHs光催化、PMS催化氧化及二者耦合联用条件下BPA的降解效果;探究了水质指标(包括溶液pH,常见阴离子的种类及浓度)对BPA降解效果的影响;通过活性成分掩蔽实验及电子顺磁共振(ESR)测试进一步验证了反应中的活性成分的种类及不同的活性成分对BPA降解贡献率的大小。
1.1. 材料
过一硫酸盐(2KHSO5 · KHSO4 · K2SO4,PMS)、碳酸氢钾(KHCO3)、磷酸二氢钾(KH2PO4)、氯化钾(KCl)、无水碳酸钠(Na2CO3)、二水合乙二胺四乙酸钠(EDTA·2Na)、对苯醌(C6H4O2,DBQ)、双酚A(BPA)购于阿拉丁试剂(上海)有限公司;九水合硝酸铁(Fe(NO3)3·9H2O)、四水合硝酸锰(Mn(NO3)2·4H2O)、三水合硝酸铜(Cu(NO3)2·3H2O)、无水硫酸钾(K2SO4)、无水硝酸钾(KNO3)、叔丁醇(2-甲基-2-丙醇,C4H10O, TBA)、L-组氨酸(C6H9N3O2)购于上海麦克林生化科技有限公司;氢氧化钠(NaOH)、氢氧化钾(KOH)、甲醇(CH3OH,MeOH)、硫酸(H2SO4)购于国药集团。除甲醇为色谱纯,所有试剂均为分析纯。实验中的用水均为超纯水。1.2. 催化剂的制备
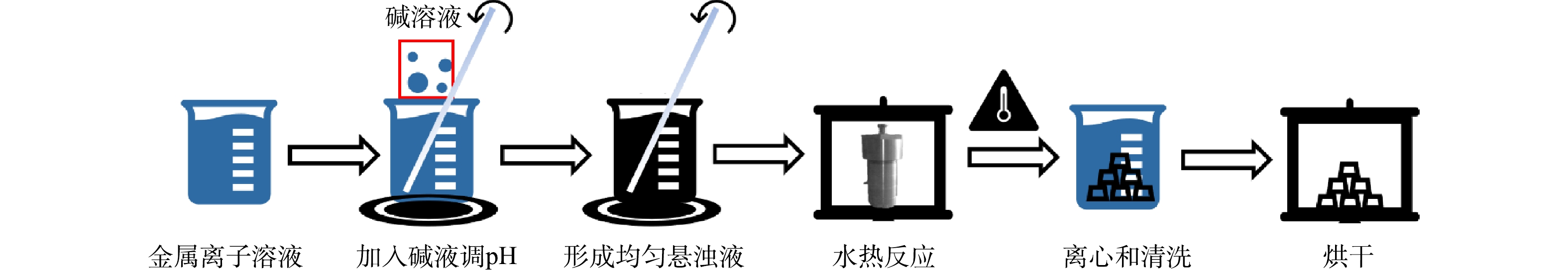
如图1所示,本实验采用水热法制备LDHs。精确称取1 mmol硝酸铁,并根据Cu、Mn、Fe的比例,称取一定质量的硝酸铜和硝酸锰,将三者溶解于50 mL水并置于100 mL的聚四氟乙烯反应釜中,搅拌30 min后,保持高速搅拌并缓慢滴加2 mol·L?1的氢氧化钠和0.6 mol·L?1的碳酸钠溶液至溶液pH至9.1,继续搅拌2 h,将反应釜置于80 ℃下加热24 h,自然冷却到室温,将产物以5 000 r·min?1的速度离心,并用超纯水将所得黑色固体清洗至pH呈中性,最后置于60 ℃下烘干。1.3. 催化剂的表征
通过45 kV和200 mA 的X射线衍射光谱(XRD,Rigaku Smartlab))对LDHs的晶体结构进行表征;由以KBr为背景的ALPHA光谱仪(Bruker)的傅里叶变换红外光谱(FT-IR)采集LDHs的表面官能团信息;催化剂的形貌特征由配有能量色散X射线谱仪(EDS)的扫描电子显微镜(SEM,EM-30 PLUS,COXEM)和加速电压为200 kV的透射电子显微镜(TEM,G2 F20,FEI)获取;催化剂的比表面积由ASAP2020氮吸附装置开展Bruauer-Emmett-Teller(BET)测得;使用以BaSO4作为参考的UV 3600 Plus分光光度计进行紫外可见漫反射光谱(UV-vis DRS)的检测;LDHs的元素组成由以Al Ka射线为激发源的EscaLab Xi +光谱仪X射线光电子能谱(XPS)测得;使用电子自旋共振(ESR)光谱仪(E500,Bruke)测得反应体系中的自由基和其他活性成分。1.4. 实验及分析方法
称取一定量的催化剂加入到浓度为20 mg·L?1的BPA溶液中,并缓慢地搅拌;待吸附解吸平衡后加入0.2~0.8 mmol·L?1的PMS溶液并打开模拟太阳光照射的氙灯光源(光强为60 mA·cm?2),反应过程中在特定时间取样,加入等量甲醇进行淬灭并使用0.45 μm滤膜过滤样品,使用高效液相色谱(HPLC, Agilent)检测样品,HPLC使用C18色谱柱(250 mm×4.6 mm×5 μm)和紫外检测器(280 nm),在流速为1 mL·min?1、甲醇相与水相比例为70∶30的条件下,BPA的出峰时间位于2.26 min,利用积分所得峰面积确定BPA的浓度。通过液相色谱-质谱联用(LC-MS (Q-Exactive), Agilent)确定反应的降解产物。2.1. 最佳铜锰铁比例的确定
LDHs的三价离子在摩尔占比为0.25~0.33时具有稳定的晶体结构[17]。为确定三价离子的最佳比例,在Cu∶Mn(摩尔比) = 1∶1的条件下,通过XRD表征对不同Fe3+占比的LDHs结晶度进行了测试,结果如图2(a)所示。当Fe元素占比为0.29时,LDHs的XRD响应峰强度最高且半峰宽最小,说明此LDHs结晶度最高;而当Fe3+占比为0.25和0.33时,LDHs的相对晶化度仅为Fe3+占比为0.29的LDHs的69.3%和74.6%。因此,Fe3+的最佳摩尔比例为0.29。在铁离子摩尔占比为0.29的条件下,为确定最佳铜锰摩尔比,使用了不同摩尔比(1∶0、3∶1、2∶1、1∶1、1∶2、1∶3、0∶1)的Cu、Mn元素合成Cu/Mn-Fe LDHs,并应用UV-vis DRS对太阳光的吸收效率进行了检测,结果如图2(b)所示。当Cu∶Mn(摩尔比)为0∶1时,Mn-Fe LDHs具有很强的紫外波段(200~400 nm)光的吸收能力,但几乎不吸收可见波段(400~800 nm)光;而Cu∶Mn(摩尔比)为 1∶0的Cu-Fe LDHs在紫外、可见波段均表现出较弱的光吸收能力,且光吸收能力随波长增大而减弱。随着Cu、Mn的同时加入,LDHs紫外波段具有更强吸收能力,而Cu元素占比的提高会使LDHs的光吸收曲线更加平滑。铜锰摩尔比为1∶1时,所得的Cu/Mn-Fe LDHs具有最强的太阳光(360~800 nm)吸收能力;而其他铜锰摩尔比的LDHs则在各波段的吸收能力均明显弱于摩尔比为1∶1的LDHs。因此,当铜锰摩尔比为1∶1时,太阳光利用效率最高。如图2(c)所示,其禁带宽度为2.32 eV,能够有效利用波长小于534.5 nm的光,相比于图2(d)和图2(e)中的Cu-Fe LDHs(2.62 eV)和Mn-Fe LDHs(2.42 eV)有所降低。此外,我们也对不同铜锰摩尔比的Cu/Mn-Fe LDHs光催化活化PMS降解BPA的性能进行了考察,结果如图2(f)所示。随着铜锰摩尔比的降低,BPA的去除率会呈现出先升高后降低的趋势,当铜锰摩尔比达到1∶1时(此时Cu∶Mn∶Fe = 1.2∶1.2∶1),催化剂的催化效果最佳。对20 mg·L?1的BPA溶液,0.6 g·L?1的铜锰摩尔比为1:1的Cu/Mn-Fe LDHs(简称1∶1 CMF)可吸附去除26.3%的BPA;加入PMS并进行光照后,BPA的去除速率为0.177 min?1,经过15 min的降解反应后,BPA去除率可达到93.5%。因此,综合考虑光吸收效率及催化能力,将1∶1 CMF作为催化降解BPA能力最强的LDHs,并对其进行表征测试。
2.2. 催化剂的表征
1) XRD分析。通过XRD对所制备的LDHs的组成及纯度信息进行了分析,结果如图3所示。在2θ 为24.2°、31.4°、37.6°、41.5°、45.1°和51.8°处观察到衍射峰,分别对应于(012)、(104)、(110)、(113)、(202)、(018)晶面[21];相比于Cu-Fe LDHs和Mn-Fe LDHs,1∶1 CMF的(002)、(104)、(110)峰宽小,强度高且几乎无杂峰,因此,具有更高的结晶度和纯度。Mn-Fe LDHs在21.1°和54.0°出现了衍射峰,对应MnOOH标准图谱(JCPDS 012-0733)的(110)和(221)晶面;而Cu-Fe LDHs在14.7°、17.4°和57.9°的衍射峰,分别对应于Cu(OH)2CO3标准图谱(JCPDS 004-0309)的(020)、(120)和(002)晶面。此外,Cu-Fe LDHs及Mn-Fe LDHs的衍射峰较宽,说明其结晶度低,其中Cu-Fe LDHs的峰形宽且杂峰多,这与Cu元素的姜-泰勒效应(Jahn-Teller effect)有关。2) SEM和TEM分析。如图4(a)和图4(c)所示,Cu-Fe LDHs和Mn-Fe LDHs具有明显的二维层状堆积结构,其中Cu-Fe LDHs堆积更加密集,且片状堆积过程中呈现出一定的卷曲趋势;如图4(b)和图4(d)所示,在Cu-Fe LDHs和Mn-Fe LDHs层状结构表面具有一定的杂质晶粒,这也与XRD表征的结果相同。而当Cu、Mn元素同时作为LDHs的二价元素时,1∶1 CMF仍具有LDHs特有的层状与片状结构,但呈现出如图4(e)所示的絮状与片状共存的状态。相比于Cu-Fe LDHs和Mn-Fe LDHs,如图4(f)所示,1∶1 CMF晶体的单片面积减小,同时堆积更加紧密。1∶1 CMF呈现出小面积薄片的二维堆积结构,堆积层数更多,因此,也增大了LDHs的比表面积。BET测试结果表明,1∶1 CMF的BET比表面积可达264.60 m2·g?1,约为普通LDHs的2.2倍[18],因此,1∶1 CMF具有大量的催化活性点位和较强的吸附性能。
TEM分析结果如图5(a)~(c)所示。1∶1 CMF呈现出规则的片状结构,整体堆积较为均匀,在堆叠密集区域呈现出更深的颜色,因此,1∶1 CMF可堆叠多层。1∶1 CMF的晶格如图5(d)所示,其0.282 nm的晶格间距与XRD的(104)晶面相对应[21]。
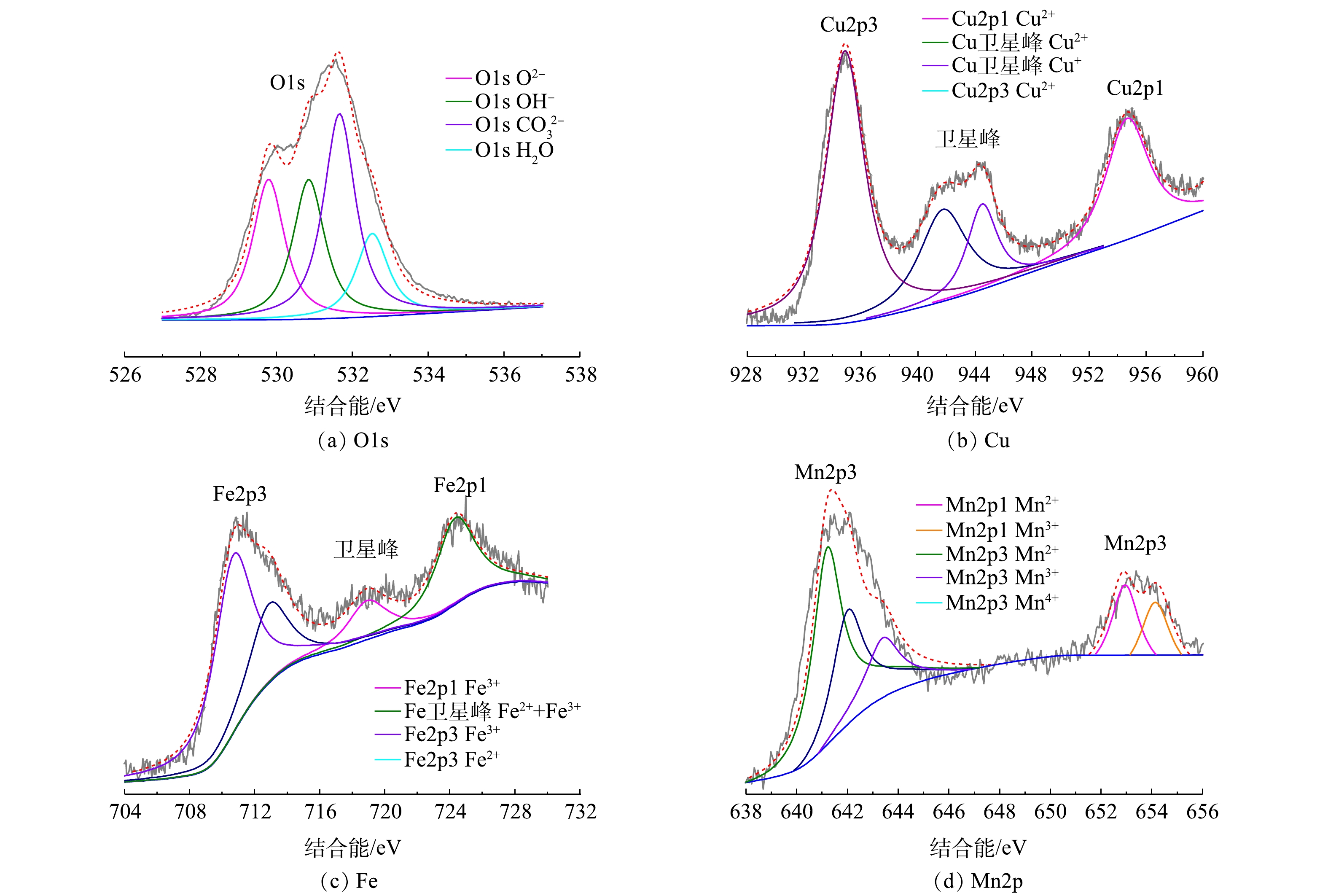
3) XPS分析。1∶1 CMF的XPS分析结果如图6所示。由图6(a)可以看出,O1s可以分为位于529.80、530.90、531.70和532.50 eV的4个峰,其中位于529.80 eV的峰代表了晶格中氧离子(O2?)与金属元素(Cu2+、Fe3+、Mn2+)的结合键,可被认定为M—O或M—O—M[22-23];位于530.90 eV的峰属于表面羟基基团[22];位于531.70 eV的峰代表了层间碳酸根基团[24];而位于532.50 eV的峰是由层间水分子引起的[22, 24]。由图6(b)可知,Cu2p谱图可分为4处峰,934.90 eV和954.70 eV分别代表2p3/2和2p1/2,在962.90 eV处存在卫星峰,证明Cu主要以二价形式存在[24-25];而在两峰之间位于941.80 eV和944.50 eV的两峰之间存在卫星峰,这说明了催化剂表面同时存在Cu+和Cu2+[26]。由图6(c)可知,Fe2p谱图可以分为位于711.50 eV和724.50 eV的2p1/2和2p3/2 主峰:其中2p3/2峰可分为代表Fe2+和Fe3+,加之在Fe2p3/2与Fe2p1/2之间的718.90 eV处存在卫星峰,证明了表面Fe2+与Fe3+同时存在[27],而2p1/2位于724.50 eV,证明Fe主要以三价形式存在[26]。由图6(d)可知,Mn2p谱图可以分为分别代表2p3/2和2p1/2的位于641.90 eV和653.40 eV的2个主峰,其中2p3/2处可进一步分为3个峰,根据结合能由小到大排列分别为641.20、642.10和643.50 eV,依次代表Mn2+、Mn3+和Mn4+[28],证明Mn是以多种价态混合物的形式存在。且从峰强可以看出,Mn的主要存在形式为Mn2+,而Mn3+和Mn4+的含量很低[29]。由此可见,1∶1 CMF是以碳酸根作为层间阴离子,Cu、Mn、Fe的主要存在形式分别是Cu(Ⅱ)、Mn(Ⅱ)和Fe(Ⅲ)。
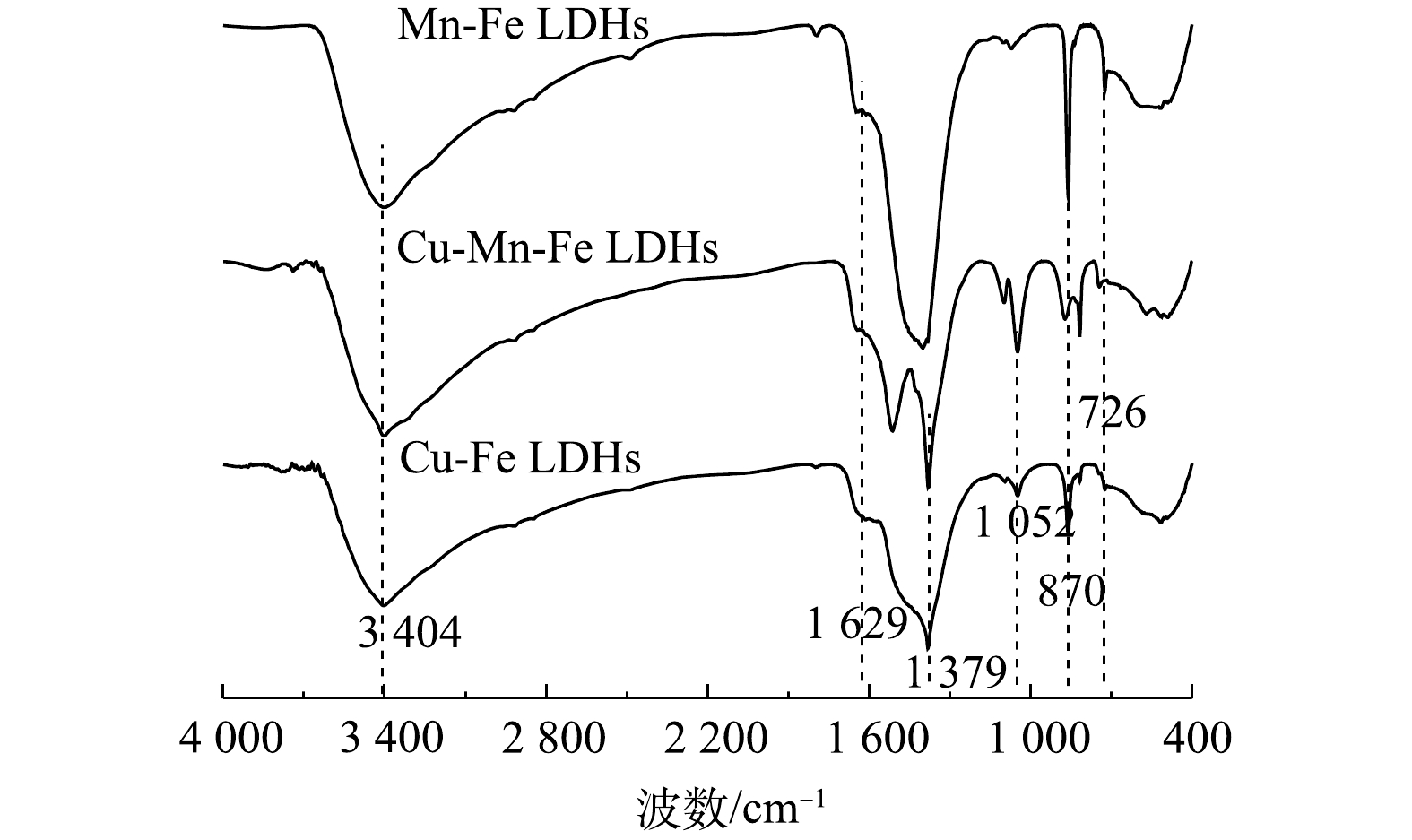
4) FT-IR分析。Mn-Fe LDHs、Cu-Fe LDHs和1∶1 CMF的FT-IR表征结果如图7所示。位于3 404 cm?1处的强宽峰源于羟基(—OH)基团的伸缩振动,这主要来自于水滑石表面的羟基或水分子中的羟基[30];1 629 cm?1处的吸收峰表明了LDHs层间水分子的存在[31];位于1 379 cm?1的峰源于C=O的反对称伸缩振动峰[32],而870 cm?1处的峰是由C—O伸缩振动产生,加上在1∶1 CMF的1 514 cm?1处产生了吸收强度较高的C—O不对称分裂峰,证明合成的LDHs为碳酸根型LDHs。位于1 052 cm?1处的峰对应于金属原子与氧原子基团间的弯曲振动(M—O—M);而450~700 cm?1的宽峰则是由金属与羟基间发生的晶格振动(M—O或M—OH)而产生[17, 32]。因此,以上结果证明所合成的1∶1 CMF具有碳酸根型LDHs的典型特征。
2.3. 最佳降解条件的确定
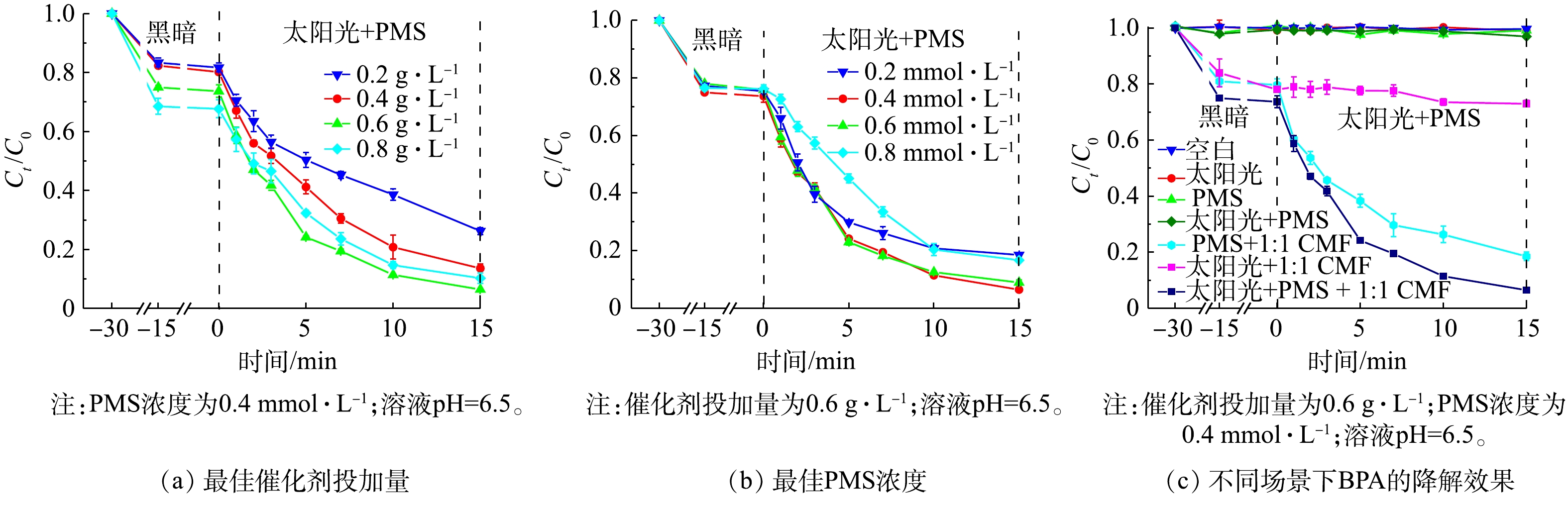
确定了太阳光/1∶1 CMF/PMS体系降解BPA的最佳反应条件,包括最佳的催化剂投加量和PMS浓度,并研究了在最佳反应条件下不同体系中的BPA去除效果,结果如图8所示。1)催化剂投加量的优化。如图8(a)所示,随着催化剂质量浓度由0.2 g·L?1增加到0.6 g·L?1,吸附去除BPA的比例逐渐提高,BPA的总去除率在催化剂质量浓度为0.6 g·L?1时达到93.5%,且降解速率也由0.079 min?1提高至0.177 min?1。这是由于随着催化剂质量浓度的提高,反应体系吸收光子的能力提高,带来了更多激发PMS的活性点位[33]。但随着催化剂质量浓度由0.6 g·L?1提高到0.8 g·L?1时,反应速率降至0.137 min?1。这可能是由于过量的催化剂本身发生团聚效应,减少了催化剂的活性点位,从而降低了催化效果[34];或是过量的催化剂使得溶液对光的透射减弱,使得催化剂的光利用效率有所降低[9]。因此,最佳催化剂的投加量选为0.6 g·L?1。
2) PMS投加量的优化。如图8(b)所示,当PMS浓度由0.2 mmol·L?1提高到0.4 mmol·L?1时,反应速率由0.118 min?1提高至0.177 min?1,降解效果达到最佳。这是由于适量浓度的PMS有助于产生更多的活性自由基,包括SO4·?、·OH、O2·?等;而进一步提高PMS浓度至0.8 mmol·L?1时,降解速率降至0.110 min?1,降解率也有大幅度下降。如式(1)~式(3)所示,过量的PMS会与生成的强活性自由基(SO4·?、·OH、O2·?等),生成氧化电势仅为1.1 V的SO5·?自由基,导致降解速率的降低[35]。因此,本研究确认最佳PMS的浓度为0.4 mmol·L?1。
3)不同反应场景下BPA的降解效率。图8(c)反映了不同反应条件下BPA的去除效果。BPA几乎不能被模拟太阳光降解[36],虽然1∶1 CMF可以吸收太阳光的能量,但仅产生少量光生空穴,因此,在太阳光/1∶1 CMF的反应体系中,BPA去除速率仅为0.004 min?1;在单独向BPA溶液中投加PMS的情况下,由于PMS稳定不会自激发[37],无法产生活性成分降解BPA;而由于模拟太阳光对PMS的激发能力有限[15],光/PMS的反应体系中几乎不会产生强氧化性自由基,降解BPA的效果几乎可以忽略不计。当向溶液中加入1∶1 CMF及PMS时,LDHs中的大量活性点位会激发PMS产生多种活性自由基,BPA的去除速率达0.112 min?1,去除率可在15 min时达到81.5%;在1∶1 CMF/PMS体系中加以太阳光照,则会进一步提高其催化活性,最终可达到0.177 min?1的反应速率,并在15 min达到93.5%的去除率。这说明将光催化与PMS催化耦合联用会大幅提高BPA的降解速率并达到较高的去除率。
2.4. 水质指标对BPA降解效果的影响
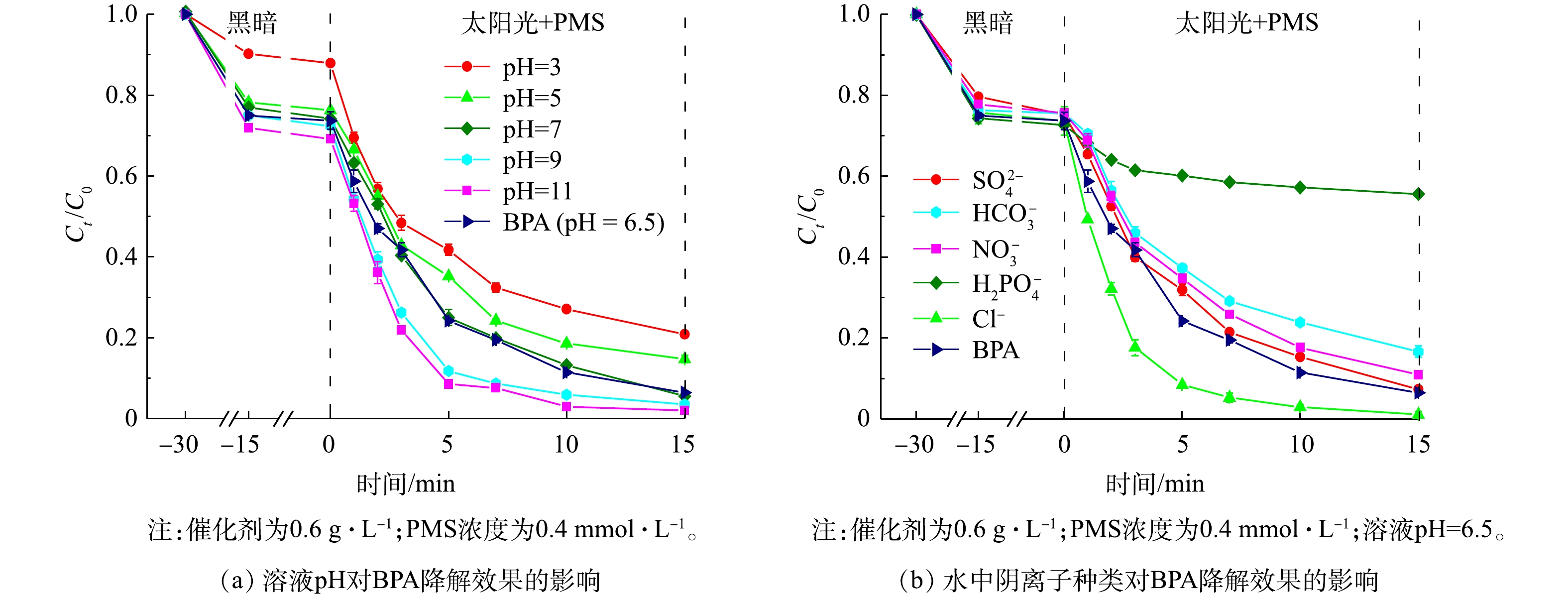
1)溶液pH的影响。我们研究了水质指标对太阳光/1∶1 CMF/ PMS体系降解BPA效果的影响。溶液pH对BPA降解效果的影响如图9(a)所示。太阳光/1∶1 CMF/ PMS体系在较宽的初始溶液pH范围内均表现出良好的光催化活性,且在较宽的pH范围内保留较好的降解性能,即使是在溶液pH为3时也可在15 min达到79.3%的降解率,此时的降解速率为0.114 min?1。随着溶液pH的增大,BPA的降解效果逐渐变好,在溶液pH为11时可达到0.279 min?1的速率,并达到99.5%以上的去除率。PMS在激发产生O2·?时会生成H+,碱性条件可以通过清除H+促进PMS的激发[38-39],因此,碱性条件会提高反应体系降解BPA的能力;而酸性条件会降低反应体系的降解能力。这一现象的原因有3点:首先,当pH较低时,PMS的主要存在形式为难被激发的H2SO5 (pKa = 9.4) [40];其次,在酸性条件下,LDHs组分易产生浸出,不利于LDHs对BPA的吸附[9],例如溶液pH=3的条件下,吸附解吸平衡后LDHs仅吸附了12.1%的BPA,仅为pH=7时的一半,不利于反应的进行;最后,溶液中存在的大量H+会清除体系中产生的多种活性自由基,包括·OH、SO4·?、O2·?,如式(4)~式(6)所示[41]。因此,在pH=3时,BPA的降解速率会下降至0.114 min?1。2)溶液中阴离子的影响。溶液中阴离子的种类对降解效果的影响如图9(b)所示。当离子浓度为1 mmol·L?1时,SO42?对降解BPA的反应几乎无影响;Cl?会促进降解反应的进行,使反应速率由0.177 min?1提高到0.318 min?1;而H2PO4?、HCO3?和NO3?均会抑制降解反应的进行,分别使反应速率由0.177 min?1降至0.023、0.113和0.139 min?1。水中氯离子的存在会使得·OH和SO4·?氧化Cl?形成Cl·, 其生成途径如式(7)~式(9)所示[42],而Cl·对BPA具有更快的响应和氧化速度[43],因此,氯离子的存在会促进BPA降解。
如式(10)~式(11)所示,H2PO4?会掩蔽·OH和SO4·?等自由基产生H2PO4·,且H2PO4?还会与催化剂的表面活性位点结合,从根本上抑制了PMS的活化和自由基的产生[44]。同样,HCO3?[45]和NO3?[46]会与SO4·?、·OH等强氧化性自由基反应,释放出氧化能力更弱的CO3·?和NO3·自由基(式(12)~式(15)),从而降低了反应速率。
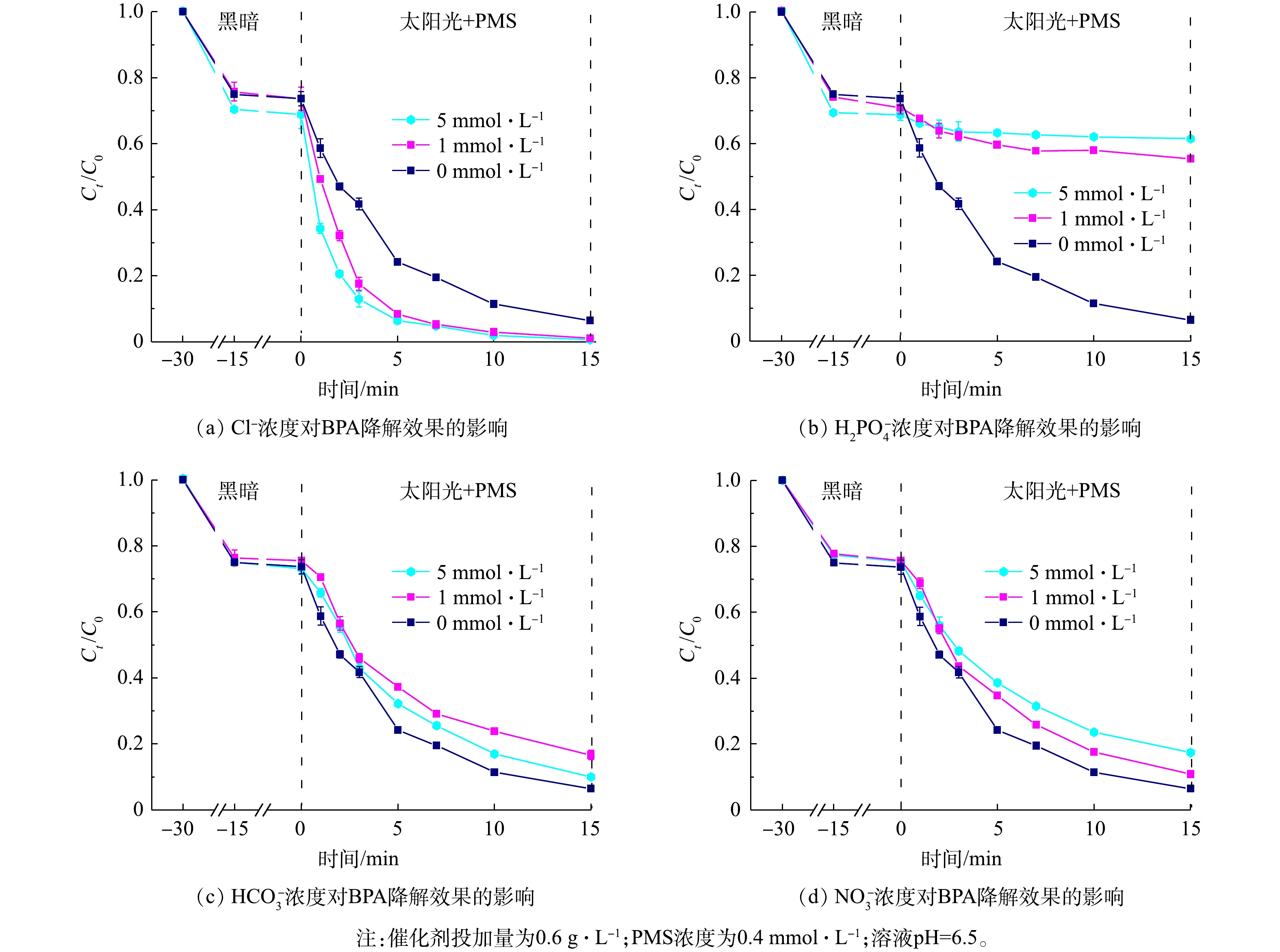
进一步研究了上述4种离子对降解效果的影响,结果如图10所示。随着硝酸根、磷酸二氢根离子、氯离子浓度由1 mmol·L?1增大到5 mmol·L?1,其对BPA降解效果的抑制或促进作用会更为显著。但当碳酸氢根的离子浓度提高到5 mmol·L?1时,其抑制作用反而会有所降低。这是由于,当碳酸氢根离子浓度提高时,会导致pH有所升高,促进了PMS的活化;另一方面,因PMS分子具有不对称性,易受到具有亲核性的HCO3?、CO32?等分子的攻击,从而激发产生SO4·?[47]。
2.5. 1∶1 CMF催化剂的重复利用性及金属的反应浸出
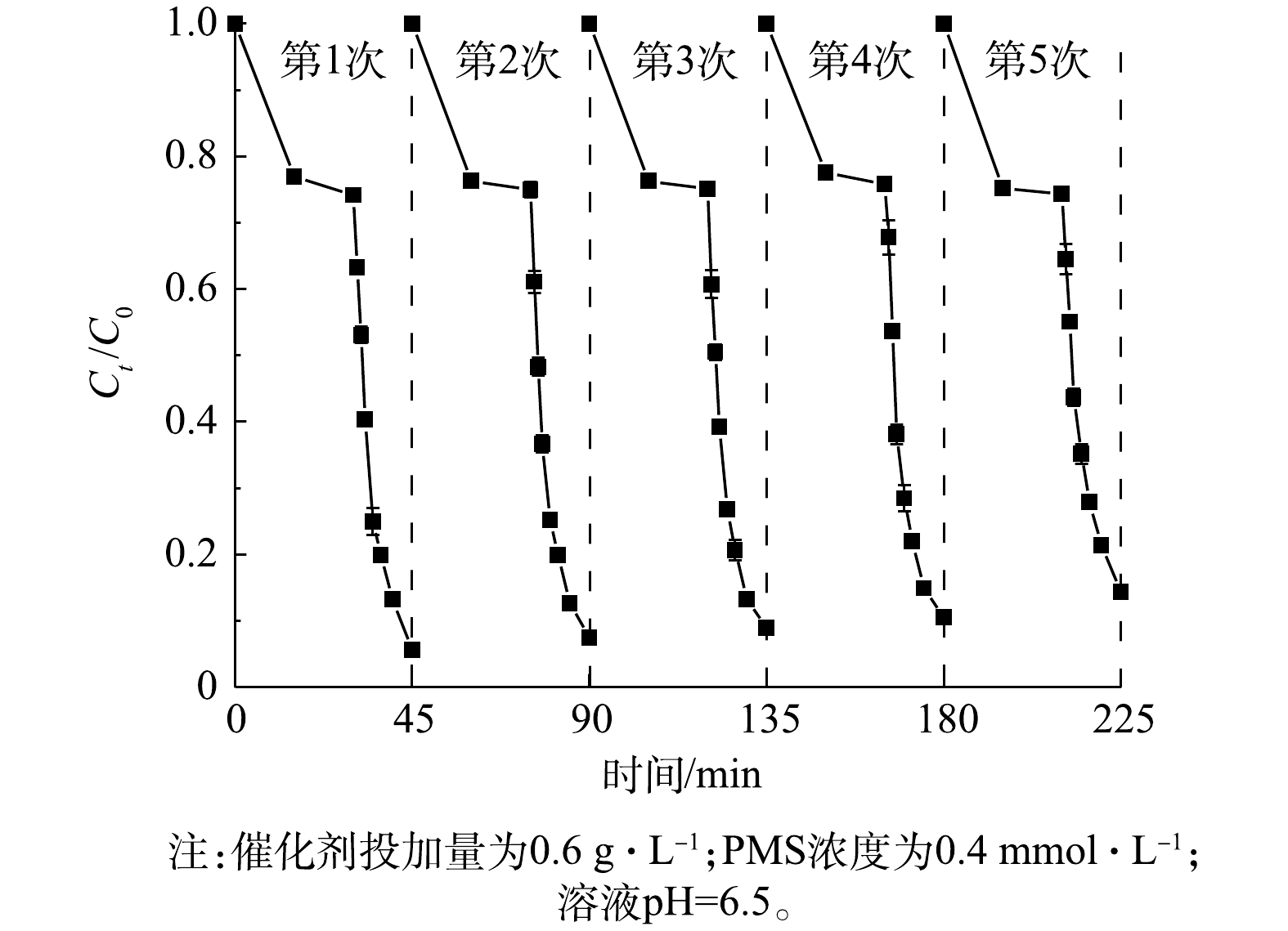
通过连续5轮的降解实验,证实了1∶1 CMF催化剂具有良好的稳定性。如图11所示,在4次循环实验之内,LDHs的催化性能几乎没有减弱;当进行第5轮循环反应时,BPA的去除率在反应15 min后仍可达到85.7%,相较于第1轮反应仅降低了7.8%,这也说明1∶1 CMF具有较好的稳定性及可重复利用性。通过ICP-MS对反应后溶液中的过渡金属元素进行了检测,Cu元素的质量浓度为340.08 μg·L?1,Mn元素的质量浓度为33.02 μg·L?1,Fe元素的质量浓度为160.20 μg·L?1,均小于饮用水水质标准的要求(Cu、Mn、Fe的限量标准分别是1、0.1和0.3 mg·L?1)。由此可见,该催化剂的应用较为安全。2.6. 反应机理
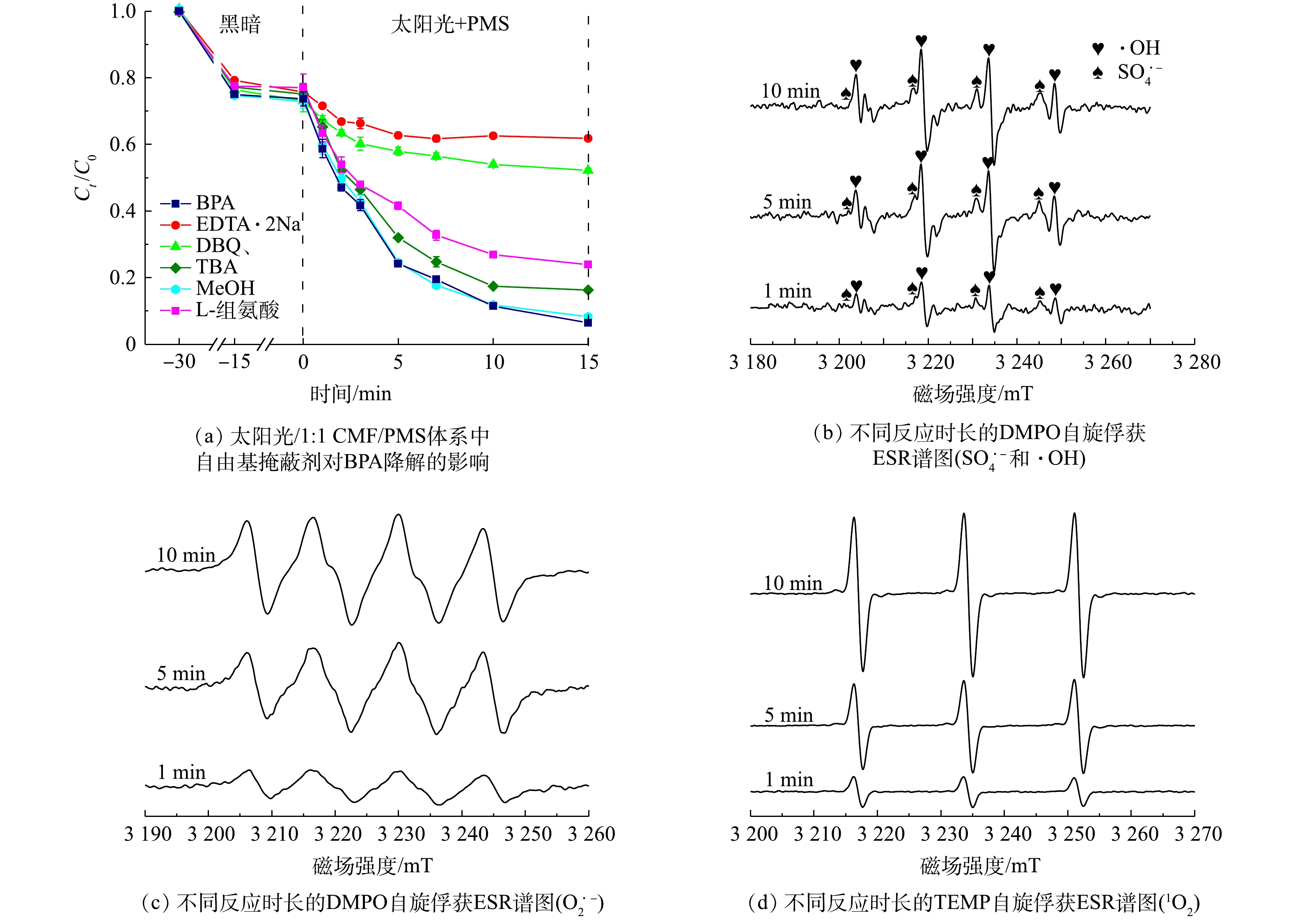
1)反应体系中活性成分的生成和贡献。为确定太阳光/1∶1 CMF/PMS中的作用活性基对降解BPA的贡献率,通过掩蔽实验确定了各活性成分在BPA降解反应中的贡献率,并通过ESR对该体系中存在的活性成分进行验证,并据此判断反应中的主要作用活性成分。在掩蔽实验中,EDTA-2Na是h+的掩蔽剂,叔丁醇是常用的·OH掩蔽剂,甲醇是SO4·?的掩蔽剂,对苯醌是O2·?的掩蔽剂,L-组氨酸是1O2的掩蔽剂。为确认太阳光/1∶1 CMF/PMS体系中的反应活性成分,分别使用这5种掩蔽剂进行掩蔽实验,结果如图12(a)所示。反应活性成分对BPA降解的作用从大到小的顺序为h+>O2·?>1O2>·OH>SO4·?,其中h+和O2·?在反应中起到了最重要的作用。这与已有研究结果相似[48]:当h+被掩蔽时,15 min时BPA的降解率由67.3%降低至13.9%;而当O2·?被掩蔽时,15 min时BPA的降解率降低至21%,这也说明了h+和O2·?是降解BPA的主要反应活性成分;当·OH、1O2在被掩蔽时,反应15 min时BPA降解率分别降低了9.9%和17.5%,说明他们在反应体系中具有一定的贡献率;而SO4·?的掩蔽对降解反应几乎无影响,因此,可视其为非主要活性自由基。
为了确认反应中起作用的主要自由基种类,通过使用5,5-dimethylpyrroline-oxide (DMPO)作为捕获剂,使用ESR检测了SO4·?、·OH和O2·?;使用TEMP作为捕获剂检测了1O2,结果如图12(b)~(d)所示。图12(b)表明,在光照条件下加入PMS和催化剂,该反应体系中会同时产生·OH和SO4·?,但SO4·?含量较低且不会随时间增加而增加,而代表着·OH的1∶2∶2∶1峰的峰强逐渐升高;如图12(c)和图12(d)所示,随着时间的延长,代表着O2·?和1O2的DMPO-O2·?、TEMP-1O2的响应强度会逐渐增加[16, 38],说明了O2·?和1O2在体系中可大量产生。因此,ESR测试证明,O2·?,·OH和1O2在太阳光/1∶1 CMF/PMS体系中可大量产生且随时间的延长而增多,故其是反应中发挥作用的自由基,这与掩蔽实验的结果一致。相对地,SO4·?的产生较少且含量稳定,说明了SO4·?在反应体系中不是主要的反应活性成分。
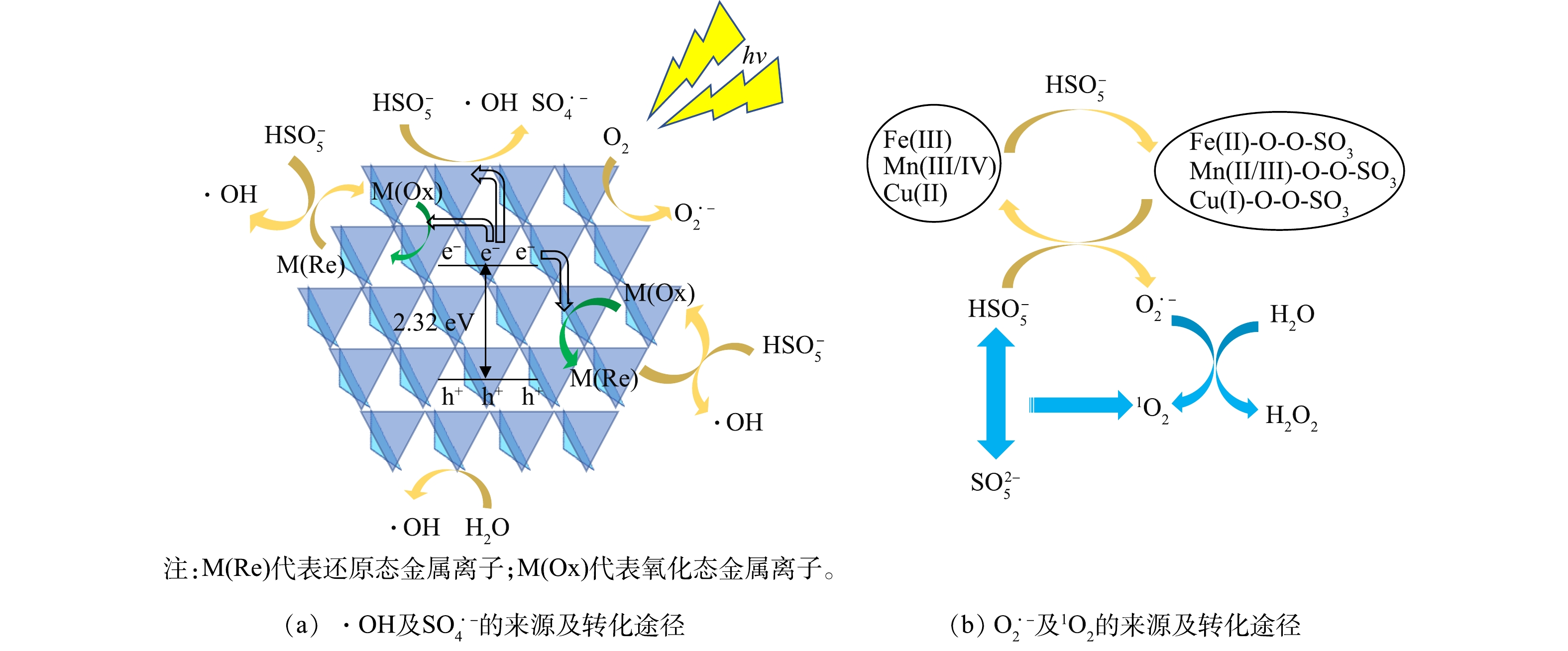
2)反应机制推测。由掩蔽实验和ESR的结果可知,该体系中的主要活性成分为h+和O2·?,降解BPA的过程中,活性成分的贡献率由高到低依次是h+、O2·?、·OH、1O2、SO4·?。如图13(a)所示,在光照过程中,1∶1 CMF会吸收光子后并发生电子的定向迁移,进而产生自由电子e?和空穴h+,但如果不加入PMS仅进行1∶1 CMF的光催化,仅有少量光生h+产生,故反应速率较慢。体系中同时存在1∶1 CMF与PMS时,如式(16)所示,PMS将获得1∶1 CMF的e?被激发,产生SO4·?和·OH,促进1∶1 CMF中h+的产生[38, 49-50];且由于1∶1 CMF中存在多组氧化还原电对(Fe3+和Fe2+,Mn4+和Mn3+,Mn3+和Mn2+,Cu2+和Cu+)(式(17)~(19)),他们会与HSO5?发生电子转移反应从而激发PMS产生·OH[9]。在碱性条件下,PMS激发后的主要产物SO4·?会很快转化为·OH,因此, 在该反应体系中几乎不存在SO4·?[51]。如图13(b)所示,在反应过程除溶解氧吸收电子产生的O2·?外[38],如式(20)~式(27)所示,过渡金属离子通过与HSO5?进行络合反应形成M-SO5中间体,并通过与HSO5?分子的进一步反应产生O2·?[37-38],这也是反应体系中O2·?的主要来源。如式(28)~(29)所示,1O2可源于HSO5?与SO52?分子间的直接作用,或通过O2·?与水的反应产生[16, 38]。最终,这些活性成分会氧化降解BPA。
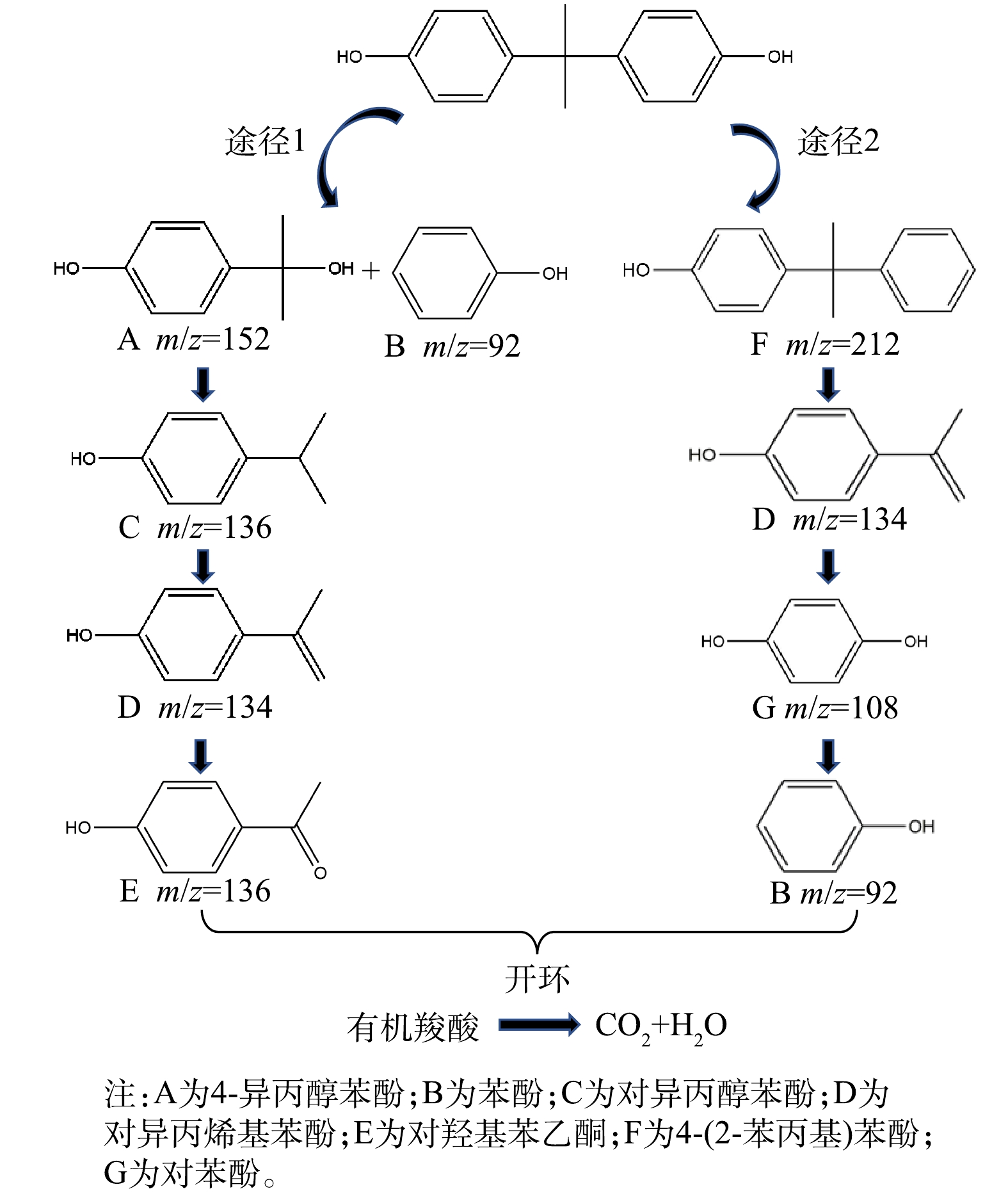
3)反应中的降解产物及途径。为确定BPA降解产物及其降解途径,使用LC-MS检测了反应产物,结果如图14所示。BPA的降解途径主要有以下2条:首先,反应活性成分攻击异丙基与苯环的C—C键,进而生成4-异丙醇苯酚(A)和苯酚(B),前者发生脱羟基反应产生对异丙醇苯酚(C),然后通过脱氢反应和光促羰基化反应,生成对异丙烯基苯酚(D)和对羟基苯乙酮(E);其次,反应活性成分攻击C—O键,产生4-(2-苯丙基)苯酚(F),然后攻击富电子基团产生对异丙烯基苯酚(D),D进一步发生氧化作用产生对苯酚(G),并借由反应活性成分攻击C—O键产生苯酚(B)。最后,所有中间产物将进一步被氧化为乙酸、草酸等小分子物质,最终被矿化为CO2和H2O。
2) 1∶1 CMF具有良好的晶格结构和絮状外观的层状结构,且单层的薄片面积小于Cu-Fe LDHs或Mn-Fe LDHs,具有较大的比表面积和吸附能力;1∶1 CMF中金属元素存在多组氧化还原电对,使1∶1 CMF有更强的电子转移能力,因此,具有较强的催化活性。
3)在太阳光/1∶1 CMF/PMS反应体系中,在PMS最佳浓度为0.4 mmol·L?1和催化剂最佳投加量为0.6 g·L?1时, BPA的去除率在15 min内达到93.5%,该降解反应的过程符合一级反应动力学。
4)在酸性条件下,H2PO4?、NO3?和HCO3?会抑制太阳光/1∶1 CMF/PMS体系对BPA的降解,而碱性条件和Cl?会增强其降解BPA的能力。
5)反应体系中起主要作用的自由基为O2·?,活性成分的作用强弱依次为h+>O2·?>1O2>·OH>SO4·?。h+由1∶1 CMF受光照产生,而PMS会促进h+的产生;O2·?则主要来源于LDHs中过渡金属离子与PMS分子间的两级转化。
6) BPA的降解途径共有2条:途径一的降解中间产物依次为双酚A、4-异丙醇苯酚和苯酚、对异丙醇苯酚、对异丙烯基苯酚、对羟基苯乙酮;途径二的降解中间产物依次为4-(2-苯丙基)苯酚、对异丙烯基苯酚、对苯酚、苯酚。最后,所有中间产物进一步被氧化为乙酸、草酸等小分子物质,最终被矿化为CO2和H2O。
参考文献



 下载:
下载: 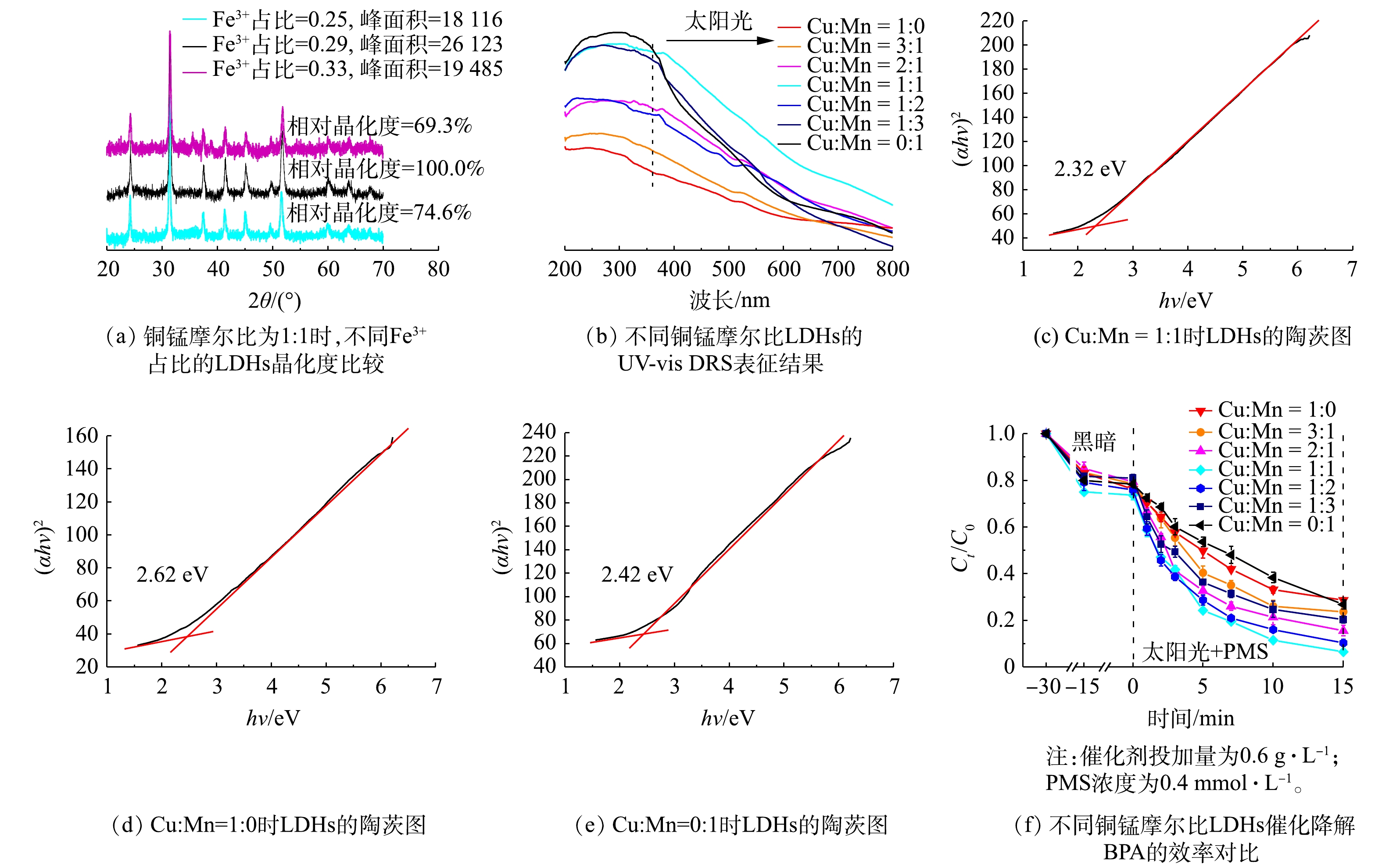



 点击查看大图
点击查看大图