天津市生态环境科学研究院,天津 300191
Tianjin Academy of Eco-Environmental Sciences, Tianjin 300191, China
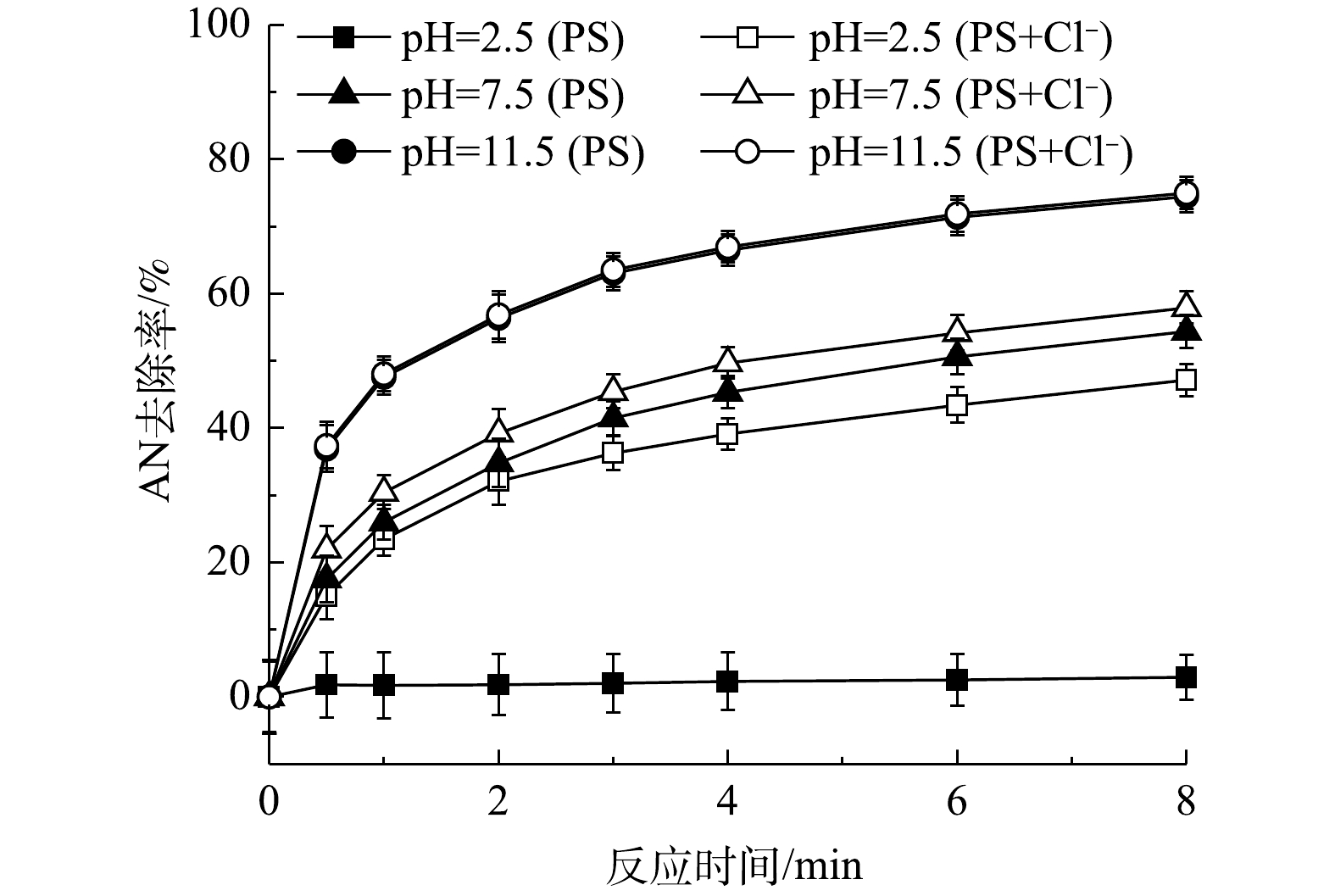
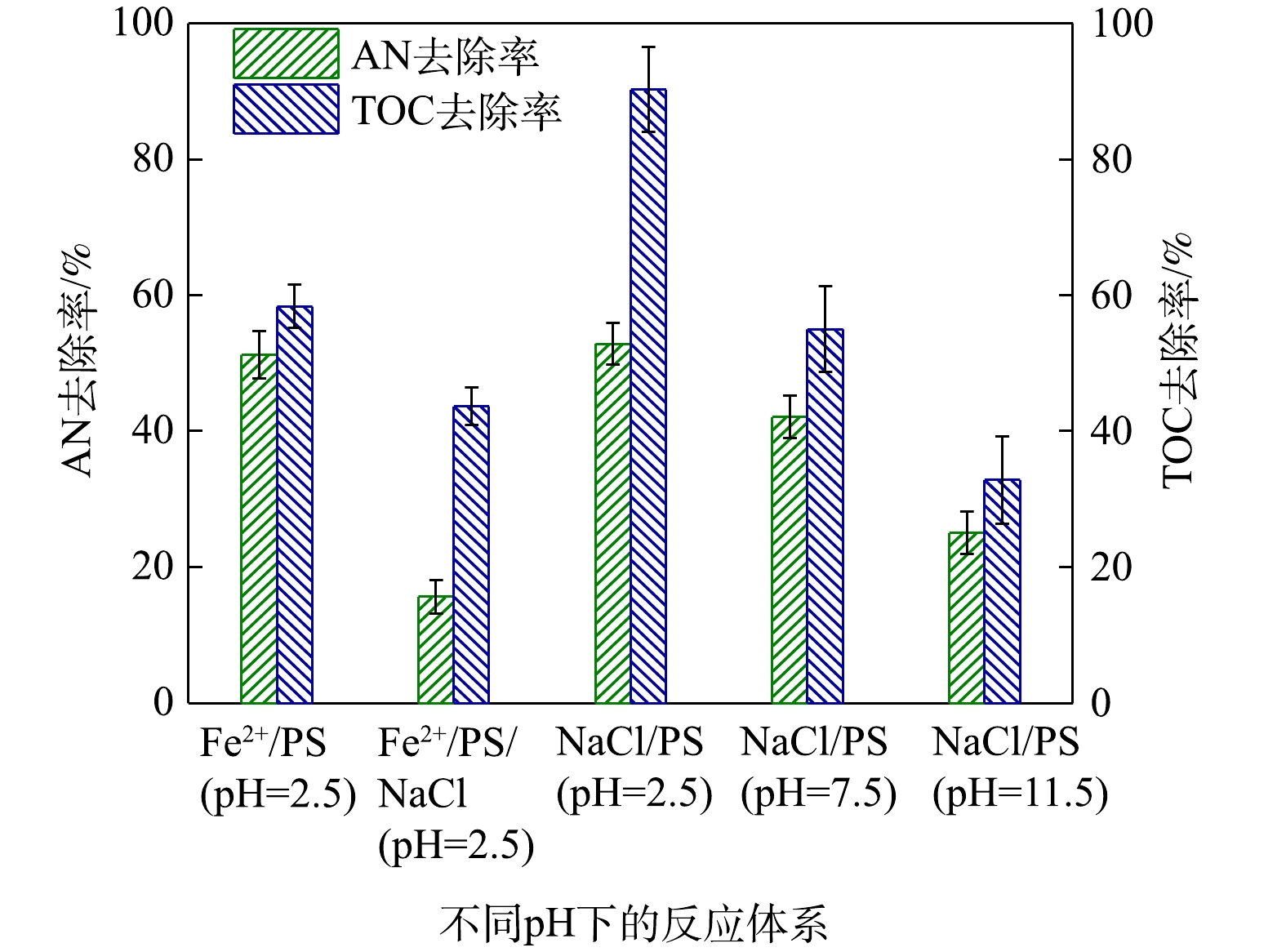
后,AN的去除率升高了47.82%,但TOC去除率仅提高了9.78%,且会生成2, 4, 6-三氯苯胺等有害的氯代副产物;相反,在中性(pH=7.5)或碱性条件(pH=11.5)下PS自身能够有效矿化AN,AN的去除率分别提高了57.90%和74.96%,此时TOC去除率分别升高了44.98%和67.15%,而Cl
对苯胺去除的贡献率分别为51.36%、11.25%和9.79%。对NaCl/PS体系中的产物进行鉴定,检测到7种中间产物,并在此基础上探讨了PS氧化降解AN的可能途径。以上研究结果有助于更好地理解和优化与PS相关的高级氧化技术在实际应用中的污染控制。
The formation of halogenated disinfection by-products (DBPs) during organic pollutants degradation in advanced oxidation process (AOPs) has raised growing concerns. However, the detailed roles of chlorine ions (Cl
) in pollutant degradation by persulfate (PS) remain controversial so far. Herein, the degradation mechanisms of Cl
on PS at different pH were investigated, and the pathway of reaction process was proposed in the presence/absence of Cl
. The results showed that at acidic condition (pH=2.5), PS could not directly react with AN but could active Cl
to generate HClO. The removal rate of AN increased from 2.95% to 47.82% when 10 mmol·L
was added in PS solution. This process would be helpful to degrade AN, but it cannot completely mineralize AN, and will produce 2, 4, 6-Trichlorobenzenamine and other chlorinated by-products. At neutral (pH=7.5) or alkaline condition (pH=11.5), PS alone can effectively mineralize AN and the impact of Cl
became negligible, the corresponding removal rates of AN increased by 57.90% and 74.96%, of TOC increased by 44.98% and 67.15%, respectively. By adding radical scavengers, we proved that the degradation of AN occurred as a result of reactions initiated by
at alkaline condition, and HO· played the dominant role in the degradation process. When the removal rate of AN was 74.96%, the respective contributions of HO·,
to AN removal were 51.36%, 11.25% and 9.79%, respectively. Based on the analysis of GC-MS, 7 major intermediate products were identified in NaCl/PS systems. Tentative pathways for the degradation of AN were proposed. Our findings may benefit an improved understanding and optimization of PS-associated AOPs for pollution control in real environmental towards high sustainability and ecological security.
.
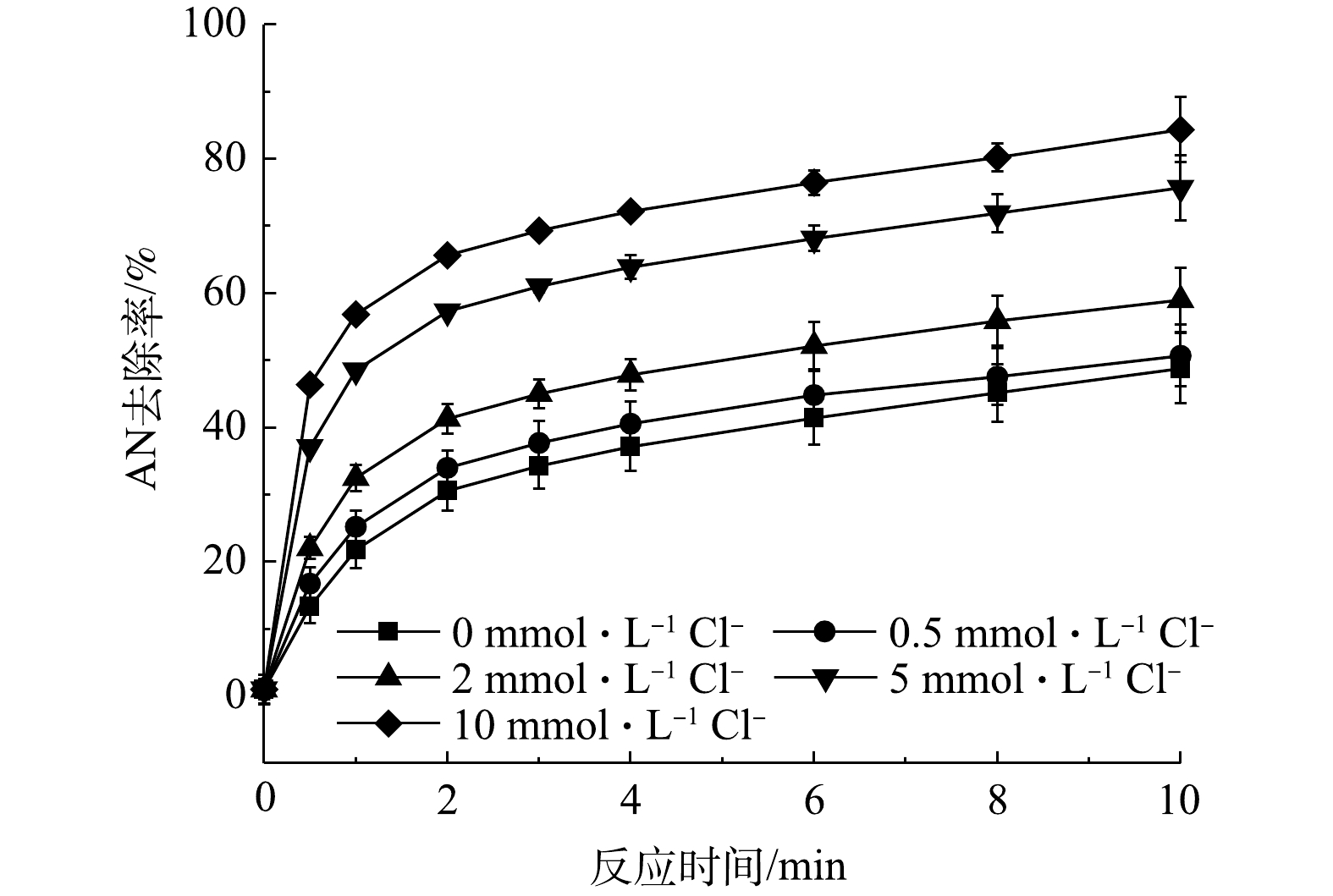
/NaCl和PS/NaCl对AN去除的影响
/NaCl and PS/NaCl on AN removal efficiency
Effect of pH on AN removal efficiency in NaCl/PS system
Yield of free chlorine at different pH
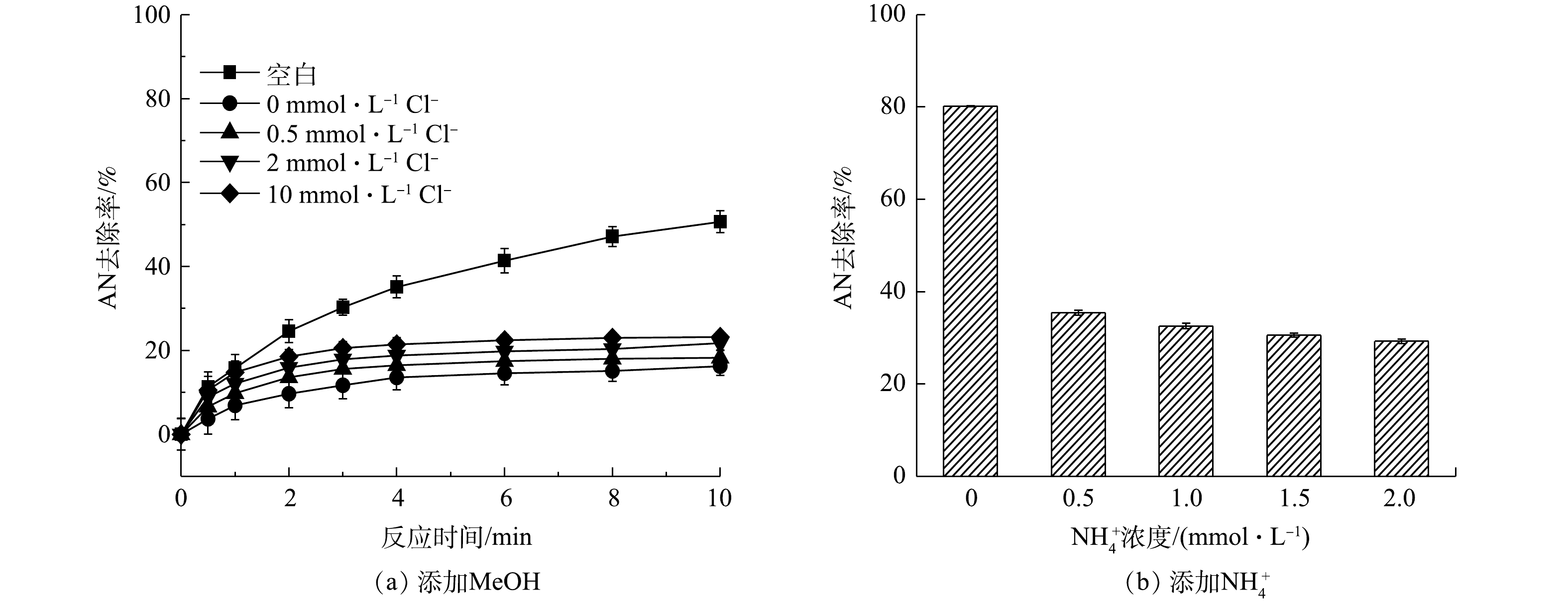
不同自由基淬灭剂对PS/NaCl去除AN的影响
Effect of various radical scavengers on the AN removal efficiency in PS/NaCl system
Degradation of AN by different reaction system
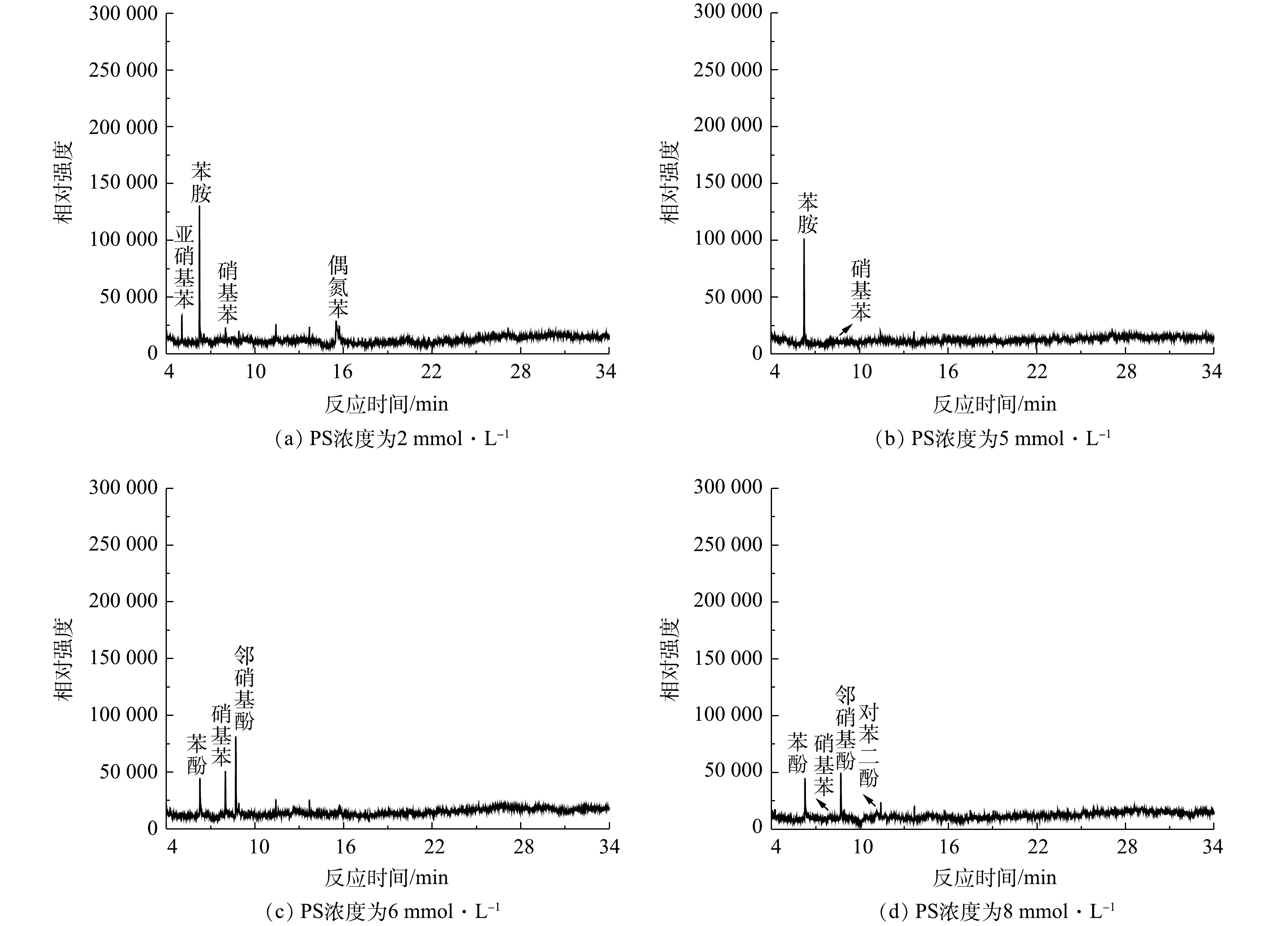
利用GC/MS对NaCl/PS降解AN的产物分析
Degradation product analysis of AN in the NaCl/PS systems by GC/MS
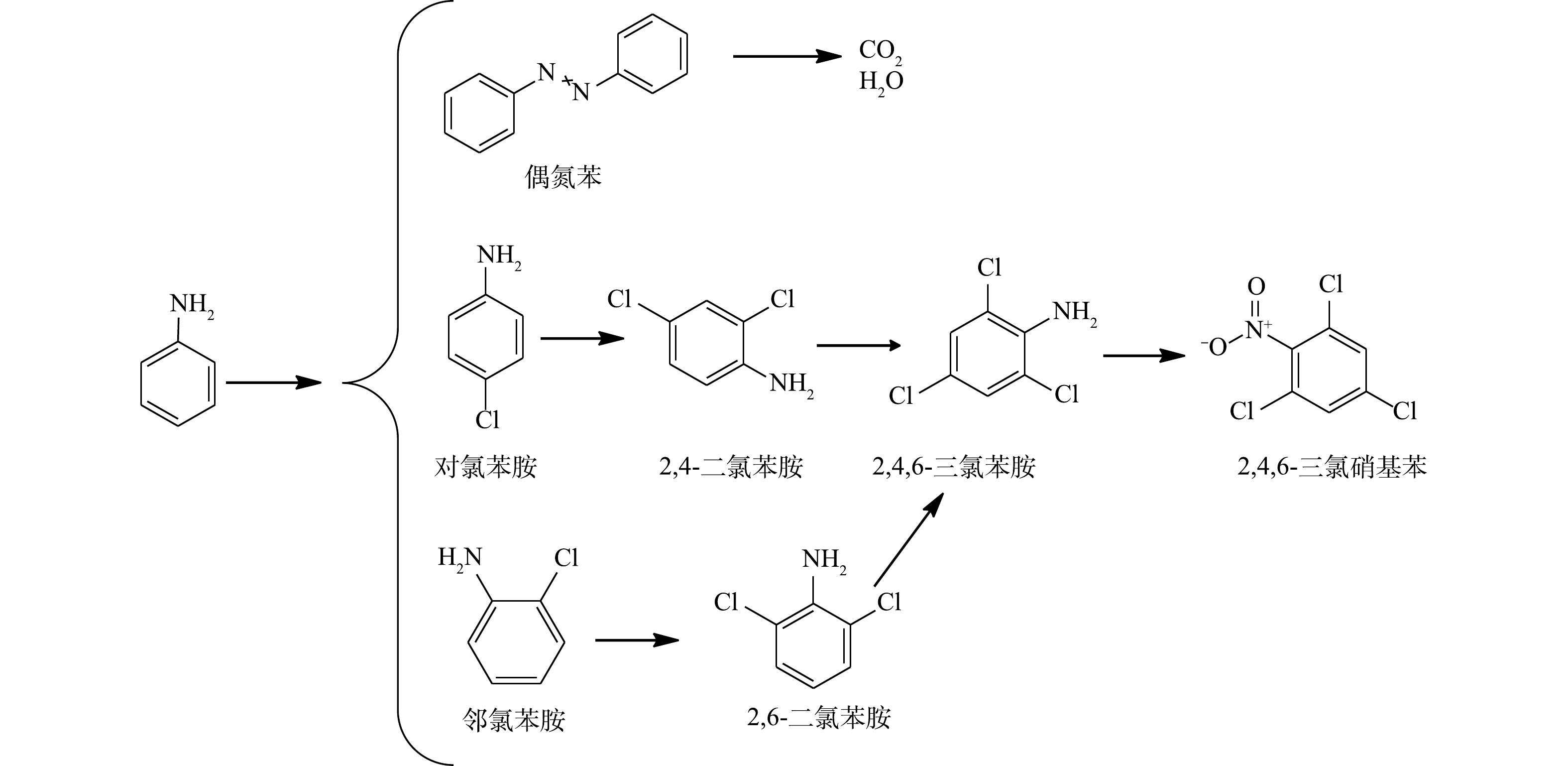
NaCl /PS降解AN的反应过程路径推断
Proposed degradation pathway of AN in the NaCl/PS system
| [1] | DONG H, HE Q, ZENG G, et al. Degradation of trichloroethene by nanoscale zero-valent iron (nZVI) and nZVI activated persulfate in the absence and presence of EDTA[J]. Chemical Engineering Journal, 2017, 316: 410-418. doi: 10.1016/j.cej.2017.01.118 |
| [2] | QI C, LIU X, LIN C, et al. Activation of peroxymonosulfate by microwave irradiation for degradation of organic contaminants[J]. Chemical Engineering Journal, 2017, 315: 201-209. doi: 10.1016/j.cej.2017.01.012 |
| [3] | KIM C, THAO T, KIM J, et al. Effects of the formation of reactive chlorine species on oxidation process using persulfate and nano zero-valent iron[J]. Chemosphere, 2020, 250: 1262-1266. |
| [4] | DAS T N. Reactivity and role of ${\rm{SO}}_5^{ \cdot - }$ radical in aqueous medium chain oxidation of sulfite to sulfate and atmospheric sulfuric acid generation[J]. The Journal of Physical Chemistry A, 2001, 105(40): 9142-9155. doi: 10.1021/jp011255h radical in aqueous medium chain oxidation of sulfite to sulfate and atmospheric sulfuric acid generation[J]. The Journal of Physical Chemistry A, 2001, 105(40): 9142-9155. doi: 10.1021/jp011255h |
| [5] | LAAT D J, LE G T, LEGUBE B. A comparative study of the effects of chloride, sulfate and nitrate ions on the rates of decomposition of H2O2 and organic compounds by Fe(II)/H2O2 and Fe(III)[J]. Chemosphere, 2004, 55: 715-723. doi: 10.1016/j.chemosphere.2003.11.021 |
| [6] | YU X, BARKER J R. Hydrogen peroxide photolysis in acidic aqueous solutions containing chloride ions. I. Chemical mechanism[J]. Journal of Physical Chemistry A, 2003, 107: 1313-1324. doi: 10.1021/jp0266648 |
| [7] | CHEN Y, DENG P, XIE P, et al. Heat-activated persulfate oxidation of methyl-and ethyl-parabens: Effect, kinetics, and mechanism[J]. Chemosphere, 2017, 168: 1628-1636. doi: 10.1016/j.chemosphere.2016.11.143 |
| [8] | MA J, YANG Y, JIANG X, et al. Impacts of inorganic anions and natural organic matter on thermally activated persulfate oxidation of BTEX in water[J]. Chemosphere, 2018, 190: 296-306. doi: 10.1016/j.chemosphere.2017.09.148 |
| [9] | PENG J, LU X, JIANG X, et al. Degradation of atrazine by persulfate activation with copper sulfide (CuS): Kinetics study, degradation pathways and mechanism[J]. Chemical Engineering Journal, 2018, 354: 740-752. doi: 10.1016/j.cej.2018.08.038 |
| [10] | DURAN A, MONTEAGUDO J M, MARTIN I S, et al. Mineralization of aniline using hydroxyl/sulfate radical-based technology in a waterfall reactor[J]. Chemosphere, 2017, 186: 177-184. doi: 10.1016/j.chemosphere.2017.07.148 |
| [11] | GAO H, CHEN J, ZHANG Y, et al. Sulfate radicals induced degradation of Triclosan in thermally activated persulfate system[J]. Chemical Engineering Journal, 2016, 306: 522-530. doi: 10.1016/j.cej.2016.07.080 |
| [12] | WANG Y, ZHAO M, DONG X, et al. Potential of the base-activated persulfate for polymer-plugging removal in low temperature reservoirs[J]. Journal of Petroleum Science and Engineering, 2020, 189: 107000. doi: 10.1016/j.petrol.2020.107000 |
| [13] | LUTZE H V, KERLIN N, SCHMIDT T C. Sulfate radical-based water treatment in presence of chloride: Formation of chlorate, inter-conversion of sulfate radicals into hydroxyl radicals and influence of bicarbonate[J]. Water Research, 2015, 72: 349-360. doi: 10.1016/j.watres.2014.10.006 |
| [14] | FANG G, DIONYSIOU D D, WANG Y, et al. Sulfate radical-based degradation of polychlorinated biphenyls: Effects of chloride ion and reaction kinetics[J]. Journal of Hazardous Materials, 2012, 227: 394-401. |
| [15] | YUAN R, RAMJAUN S N, WANG Z H, et al. Effects of chloride ion on degradation of acid orange 7 by sulfate radical-based advanced oxidation process: Implications for formation of chlorinated aromatic compounds[J]. Journal of Hazardous Materials, 2011, 196: 173-179. doi: 10.1016/j.jhazmat.2011.09.007 |
| [16] | LEI Y, CHEN C S, AI J, et al. Selective decolorization of cationic dyes by peroxymonosulfate: Non-radical mechanism and effect of chloride[J]. RSC Advances, 2015, 6(2): 866-871. |
| [17] | TSITONAKI A, PETRI B, CRIMI M, et al. In situ chemical oxidation of contaminated soil and groundwater using persulfate: A review[J]. Critical Reviews in Environmental Science and Technology, 2010, 40: 55-91. doi: 10.1080/10643380802039303 |
| [18] | CHEN H, ZHANG Z, FENG M, et al. Degradation of 2,4-dichlorophenoxyacetic acid in water by persulfate activated with FeS (mackinawite)[J]. Chemical Engineering Journal, 2017, 313: 498-507. doi: 10.1016/j.cej.2016.12.075 |
| [19] | CHOI J, CUI M, LEE Y, et al. Hydrodynamic cavitation and activated persulfate oxidation for degradation of bisphenol A: Kinetics and mechanism[J]. Chemical Engineering Journal, 2018, 338: 323-332. doi: 10.1016/j.cej.2018.01.018 |
| [20] | QIANG Z, ADAMS C D. Determination of monochloramine formation rate constants with stopped-flow spectrophotometry[J]. Environmental Science & Technology, 2004, 38: 1435-1444. |
| [21] | WANG Z Y, SHAO Y, GAO N, et al. Degradation kinetic of phthalate esters and the formation of brominated byproducts in heat-activated persulfate system - ScienceDirect[J]. Chemical Engineering Journal, 2019, 359: 1086-1096. doi: 10.1016/j.cej.2018.11.075 |
| [22] | 葛勇建, 蔡显威, 林翰, 等. 碱活化过一硫酸盐降解水中环丙沙星[J]. 环境科学, 2017, 38(12): 5116-5223. |
| [23] | 朱杰, 罗启仕, 郭琳, 等. 碱热活化过硫酸盐氧化水中氯苯的试验[J]. 环境化学, 2013, 32(12): 2256-2262. doi: 10.7524/j.issn.0254-6108.2013.12.005 |
| [24] | 吴楠, 王三反, 李乐卓, 等. 碱热活化过硫酸盐降解柴油精制废水中的有机硫化合物[J]. 环境污染与防治, 2019, 41(4): 435-444. |
| [25] | LOU X Y, GUO Y G, XIAO D, et al. Rapid dye degradation with reactive oxidants generated by chloride-induced peroxymonosulfate activation[J]. Environmental Science Pollution Research, 2013, 20: 6317-6323. doi: 10.1007/s11356-013-1678-x |
| [26] | FURMAN O S, TEEL A L, WATTS R J. Mechanism of base activation of persulfate[J]. Environmental Science & Technology, 2010, 44(16): 6423-6428. |
| [27] | QI C D, LIU X T, MA J, et al. Activation of peroxymonosulfate by base: Implications for the degradation of organic pollutants[J]. Chemosphere, 2016, 151: 280-288. doi: 10.1016/j.chemosphere.2016.02.089 |
| [28] | FURMAN O S, TEEL A L, AHMAD M, et al. Effect of basicity on persulfate reactivity[J]. Journal of Environmental Engineering, 2011, 137: 241-247. doi: 10.1061/(ASCE)EE.1943-7870.0000323 |
| [29] | CHEN J, ZHANG L, HUANG T, et al. Decolorization of azo dye by peroxymonosulfate activated by carbon nanotube: Radical versus non-radical mechanism[J]. Journal of Hazardous Materials, 2016, 320: 571-580. doi: 10.1016/j.jhazmat.2016.07.038 |
| [30] | ANIPSITAKIS G P, DIONYSIOU D D, GONZALEZ M A. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds: Implications of chloride ions[J]. Environmental Science & Technology, 2006, 40(3): 1000-1007. |
| [31] | WALDEMER R H, TRATNYEK P G, JOHNSON R L, et al. Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products[J]. Environmental Science & Technology, 2007, 41(3): 1010-1015. |
| [32] | XIE X, ZHANG Y, HUANG W, et al. Degradation kinetics and mechanism of aniline by heat-assisted persulfate oxidation[J]. Journal of Environmental Sciences, 2012, 24(5): 821-826. doi: 10.1016/S1001-0742(11)60844-9 |
| [33] | BRILLAS E, MUR E, SAULEDA R, et al. Aniline mineralization by AOPs: Anodic oxidation, photocatalysis, electro-Fenton and photoelectro-Fenton processes[J]. Applied Catalysis B: Environmental, 1998, 16(1): 31-42. doi: 10.1016/S0926-3373(97)00059-3 |
| [34] | CHEN W S, HUANG C P. Mineralization of aniline in aqueous solution by electro-activated persulfate oxidation enhanced with ultrasound[J]. Chemical Engineering Journal, 2015, 266: 279-288. doi: 10.1016/j.cej.2014.12.100 |
| [35] | MADSEN H T, S?GAARD E G, MUFF J. Study of degradation intermediates formed during electrochemical oxidation of pesticide residue 2, 6-dichlorobenzamide (BAM) in chloride medium at boron doped diamond (BDD) and platinum anodes[J]. Chemosphere, 2015, 120: 756-763. doi: 10.1016/j.chemosphere.2014.10.058 |












































































































































































































 下载:
下载: 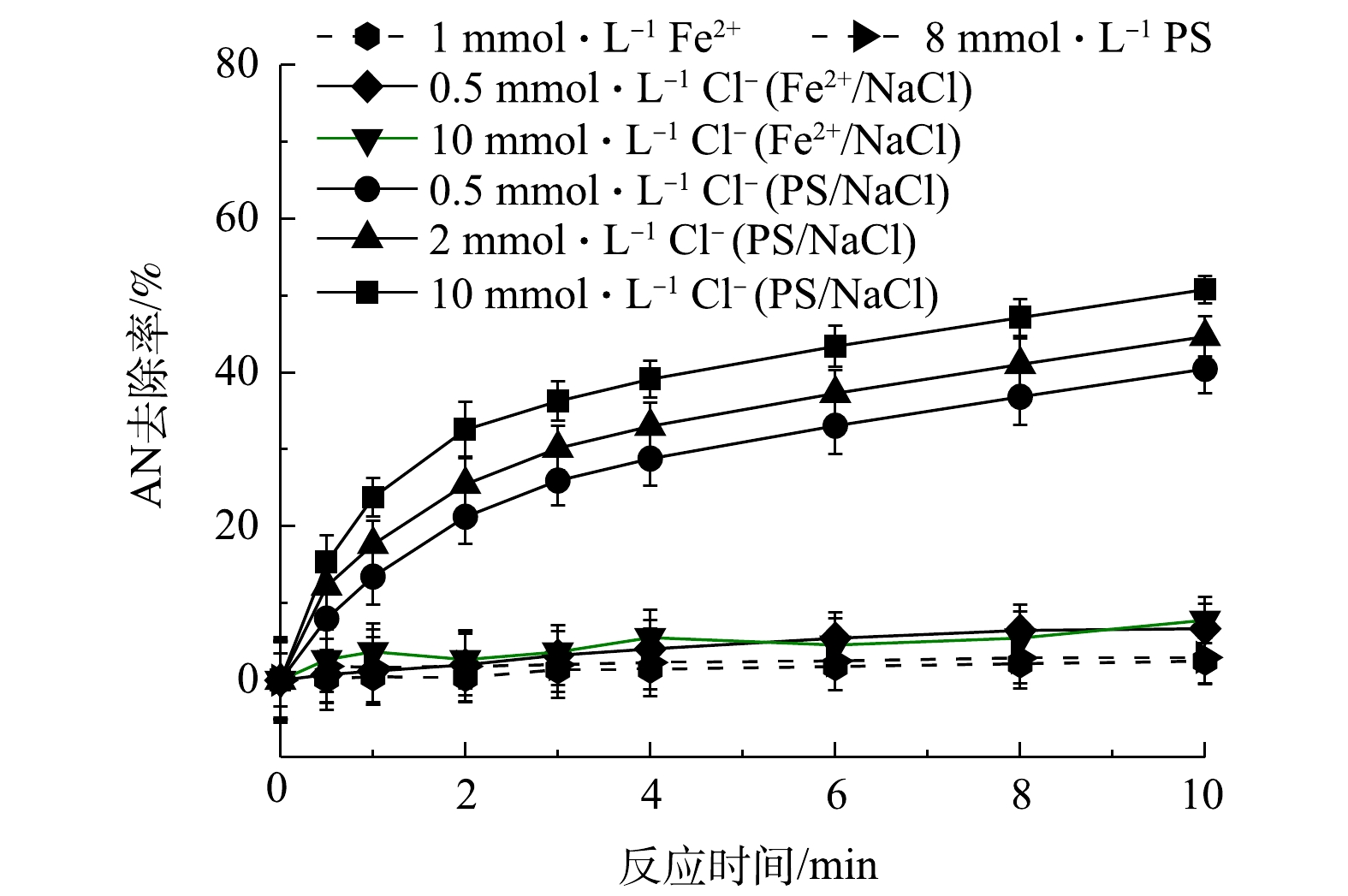








 点击查看大图
点击查看大图