全文HTML
--> --> --> 伴随着我国工业化进程的加快和社会经济的迅速发展,产生了大量含有难降解和具生物毒性的典型污染物的工业废水,其中包括:印染、造纸、海水利用等众多工业领域产生的浓度越来越高的含盐废水[1];制革工业产生的重金属污染种类排名第2的含铬废水[2];生产四环类抗生素的制药厂所产生的含四环素废水[3]。污水处理厂的设计本身不具备处理这类污染物的能力,此类工业废水进入城镇污水处理系统后,势必会对生物脱氮系统带来负面影响[4-5]。目前,工业废水中一些典型污染物对反硝化过程的影响的相关研究已经取得了一定的进展。YU等[6]在研究苯酚胁迫对高硝酸盐厌氧反硝化的影响中提到,一定浓度的苯酚会减少硝酸盐的去除率,积累亚硝酸盐,增加微生物群落的多样性和丰富度;FENG等[7]研究了锌、铜、铅、镉等重金属对膜生物反应器硝化反硝化性能的影响,发现微生物在低浓度或高浓度重金属处理后反硝化率降低显著,可减小污泥颗粒粒径并增加胞外聚合物;GUI等[8-9]研究发现,盐度和重金属均会抑制好氧反硝化细菌去除硝酸盐氮,盐度和重金属会影响反硝化功能基因的表达。据报道,某些从天然环境如河床[10]、海域[11]、活性污泥[12]中筛选得到的好氧反硝化细菌不仅具有高效好氧反硝化能力,还具备良好的耐盐耐重金属或耐低温特性,反硝化过程基本不受污染物的影响。
好氧反硝化技术为实现同步硝化反硝化提供了良好的基础,部分好氧反硝化细菌甚至可以耐受污染物的生物毒性,在接纳工业废水的城镇污水厂的生物脱氮系统中具有极大的应用潜力。但目前污染物抑制好氧反硝化作用的研究多集中于反硝化率和相关基因表达的影响方面,对污染物长期胁迫下细胞胞外多聚物,尤其是微生物群落结构的变化等方面的研究相对较少。本研究以活性污泥作为接种源,富集筛选好氧反硝化菌群,持续投加氯化钠、六价铬、盐酸四环素(tetracycline hydrochloride,TC),对富集菌群进行驯化,最后比较了驯化前后菌群微生物的反硝化速率、EPS含量、群落多样性以及napA基因丰度,以揭示典型工业污染物对好氧反硝化菌群的影响。
1.1. 菌群来源和培养基
本研究所用样品取自南昌市某城市污水处理厂二沉池的活性污泥。富集培养基/富集测试培养基:无水乙酸钠3 g·L?1,NH4Cl 0.306 g·L?1,KNO3 1 g·L?1,KH2PO4 0.15 g·L?1,K2HPO4 0.252 g·L?1,MgSO4·7H2O 0.1 g·L?1,FeSO4·7H2O 0.006 g·L?1,CaCl2 0.01 g·L?1。去离子水溶解,pH 7.0~7.3。
驯化测试培养基:无水乙酸钠6 g·L?1,NH4Cl 0.612 g·L?1,KNO3 2 g·L?1,KH2PO4 0.15 g·L?1,K2HPO4 0.252 g·L?1,MgSO4·7H2O 0.1 g·L?1,FeSO4·7H2O 0.006 g·L?1,CaCl2 0.01 g·L?1。去离子水溶解,pH 7.0~7.3。
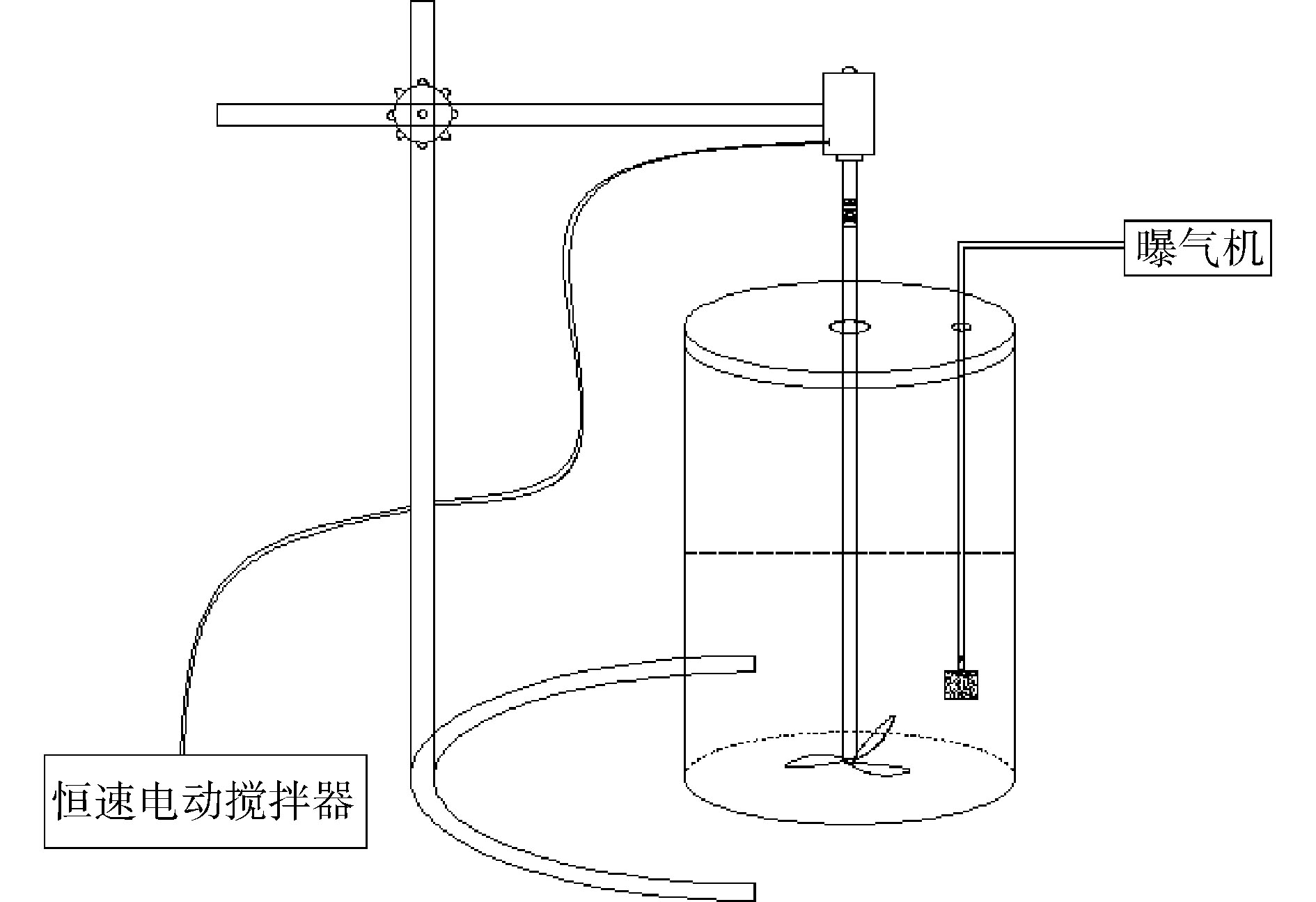
1.2. 实验装置
富集过程在自制的SBR中进行,反应器内部容积为3 L,反应器中部接有恒速电动搅拌器,内部接有可调式空气泵的气石。驯化过程和反硝化测试实验在250 mL的蓝盖瓶中进行,瓶盖不密封,用透气膜封口。反应装置如图1所示。1.3. 菌群的富集
取200 g污泥于SBR中,倒入2 L富集培养基,设置60 r·min?1的电动搅拌,打开气泵开始运行。运行周期约为24 h,好氧反应时间22~23 h,每天监测三氮(氨氮、硝氮、亚硝氮)浓度,至出水检测不到硝氮且无亚硝氮积累后,以富集测试培养基对富集前后的活性污泥进行反硝化性能测试。反硝化测试方法:取20 mL的污泥或菌群至蓝盖瓶中,各加入200 mL测试培养基,混匀后测定MLVSS,将蓝盖瓶放置在30 ℃、150 r·min?1的恒温振荡箱中,来回振荡24 h,定期取样测定三氮浓度。
1.4. 菌群的驯化
以富集得到的好氧反硝化菌群为样品,分别取20 mL混匀后的样品于4个蓝盖瓶中,各加入200 mL富集培养基。向其中3个蓝盖瓶分别加入氯化钠、重铬酸钾和盐酸四环素,置于恒温振荡箱中以30 ℃、150 r·min?1的条件振荡,周期与富集过程相同。根据硝氮去除效果,梯度浓度提高硝酸盐氮和抑制物(氯化钠、重铬酸钾和盐酸四环素)的浓度负荷共分为4个阶段。其中,A阶段中NaCl、Cr(Ⅵ)和TC浓度分别为10 g·L?1、1 mg·L?1和5 mg·L?1;B阶段为30 g·L?1、2 mg·L?1和10 mg·L?1;C阶段为50 g·L?1、5 mg·L?1和25 mg·L?1;D阶段为70 g·L?1、10 mg·L?1和50 mg·L?1。驯化结束后,以驯化测试培养基对驯化前后的菌群进行反硝化性能测试,测试方法同1.3节。不同的是,投加NaCl、K2Cr2O4和TC驯化后的菌群中测试培养基分别含70 g·L?1的NaCl、10 mg·L?1的Cr(Ⅵ)和50 mg·L?1的TC,并以驯化前的菌群作为对照,同时进行反硝化测试。
1.5. EPS分析
对接种源、富集过程和驯化过程结束后取出的菌群样品进行EPS的提取和测定。提取采用超声波提取法[13]。取4 mL的菌群样品,在5 500 r·min?1下离心20 min,倾去上清液,补充0.9%生理盐水至原体积,振荡均匀,重复2次。将清洗后的污泥样品,冰浴下40 W超声2 min。再将样品在8 000 r·min?1下离心30 min,上清液经0.22 μm纤维素滤膜过滤得到EPS样品。蛋白质(PN)采用考马斯亮蓝法[14]测定;多糖(PS)采用苯酚-硫酸法[15]测定。1.6. 群落结构分析
取1 mL污泥或菌群样品,采用细菌DNA提取试剂盒(申能博彩,上海)提取细菌的基因组DNA,最后用100 μL TAE洗脱。琼脂糖凝胶电泳检测合格后,采用高通量测序技术对提取的DNA样品进行微生物群落结构及多样性分析。1.7. q-PCR分析
对提取的DNA样品进行q-PCR分析,目的基因为napA,是在有氧条件下转化硝酸盐所必需的周质硝酸盐还原酶Nap的编码基因[16]。napA基因丰度的qPCR采用Stepone plus型荧光定量PCR仪(ABI)进行分析,使用的引物[17]和扩增条件见表1。反应体系20 μL,包括2.0 μL的DNA模板、10 μL的SybrGreen qPCR Master Mix(2X)、0.4 μL的上游引物和下游引物(10 μmol·L?1)和7.2 μL的双蒸水。1.8. 分析方法
硝酸盐氮:紫外分光光度法[18];氨氮:纳氏试剂光度法[19];亚硝酸盐氮:N-(1-萘)-乙二胺光度法[20];六价铬:二苯碳酰二肼分光光度法[21];pH、DO:玻璃电极法。MLVSS:重量法。2.1. 富集前后好氧反硝化性能
经过一段时间的间歇曝气,反应器出水基本检测不到硝酸盐氮,且能在7 d内保持稳定,视为富集得到好氧反硝化菌群,此时菌群中参与反硝化作用的主要是好氧反硝化细菌。由图2可知,好氧条件下,接种污泥基本无法去除硝酸盐氮,而富集得到的菌群在12 h内能将140 mg·L?1左右的硝酸盐氮完全去除,硝酸盐氮的比去除速率达到11.67 mg·(L·h)?1。在去除硝酸盐氮的过程中,存在亚硝酸盐氮的积累,在8 h时达到峰值15.16 mg·L?1,但随后逐渐被降解。2.2. 菌群的驯化
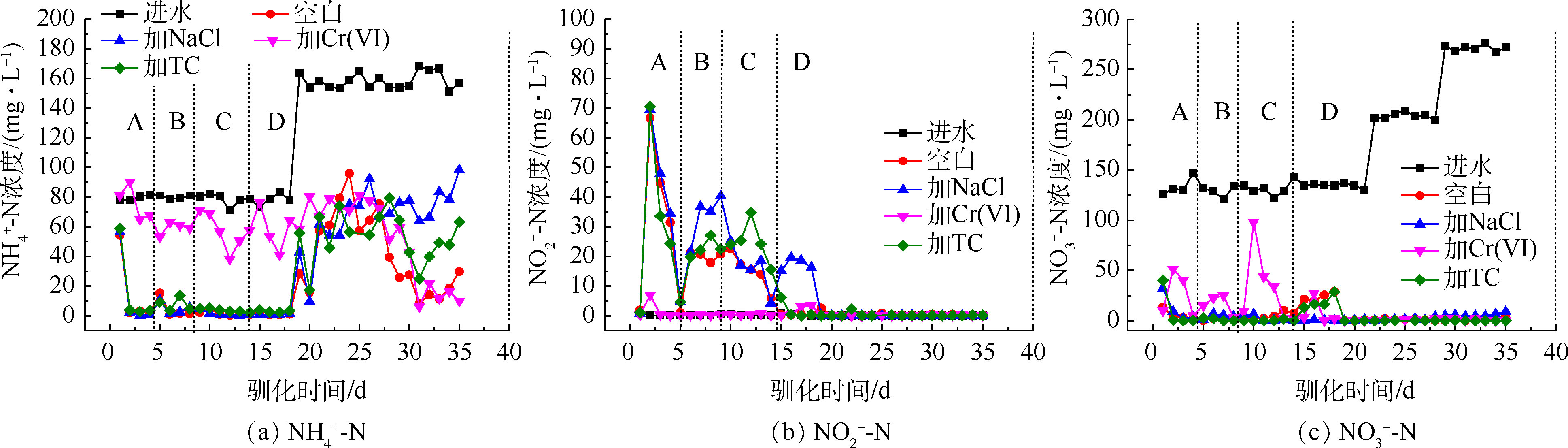
1)驯化过程中的三氮变化。从图3(a)和图3 (b)可以看出,NaCl和TC的胁迫基本不影响氨氮的去除和亚硝酸盐氮的积累量,Cr(Ⅵ)的胁迫显著抑制了氨氮的去除,氨氮去除率仅有为对照组的25%~50%,并减少了亚硝酸盐氮的积累,这可能是因为Cr(Ⅵ)影响了菌群中硝化细菌的活性。汪敏刚等[22]在研究低浓度铬对SBR中微生物作用的影响中提到,Cr(Ⅵ)的毒性作用使菌群中的硝化细菌无法维持正常的生长和工作,减少了氨氮的去除效果,影响程度与铬浓度具有相关性。从图3(c)可以看出,梯度投加NaCl和TC对硝酸盐氮的去除没有产生抑制作用;而梯度投加Cr(Ⅵ)的过程中减少了硝酸盐氮的去除,当Cr(Ⅵ)浓度提升到5 mg·L?1的时候,硝酸盐氮的去除被抑制得最明显,对硝酸盐氮的去除率降为32%,但在持续投加Cr(Ⅵ)后,抑制作用在5 d内逐渐降低,直至消失。HE等[11]研究发现,铜绿假单胞菌PCN-2在有氧条件可同时去除硝酸盐氮和Cr(Ⅵ),且两者能同时作为电子受体而相互竞争。菌群中可能存在兼具铬还原和反硝化作用的好氧反硝化细菌,这类细菌在驯化过程中逐渐成为优势菌种,削弱了Cr(Ⅵ)对反硝化过程的抑制作用。
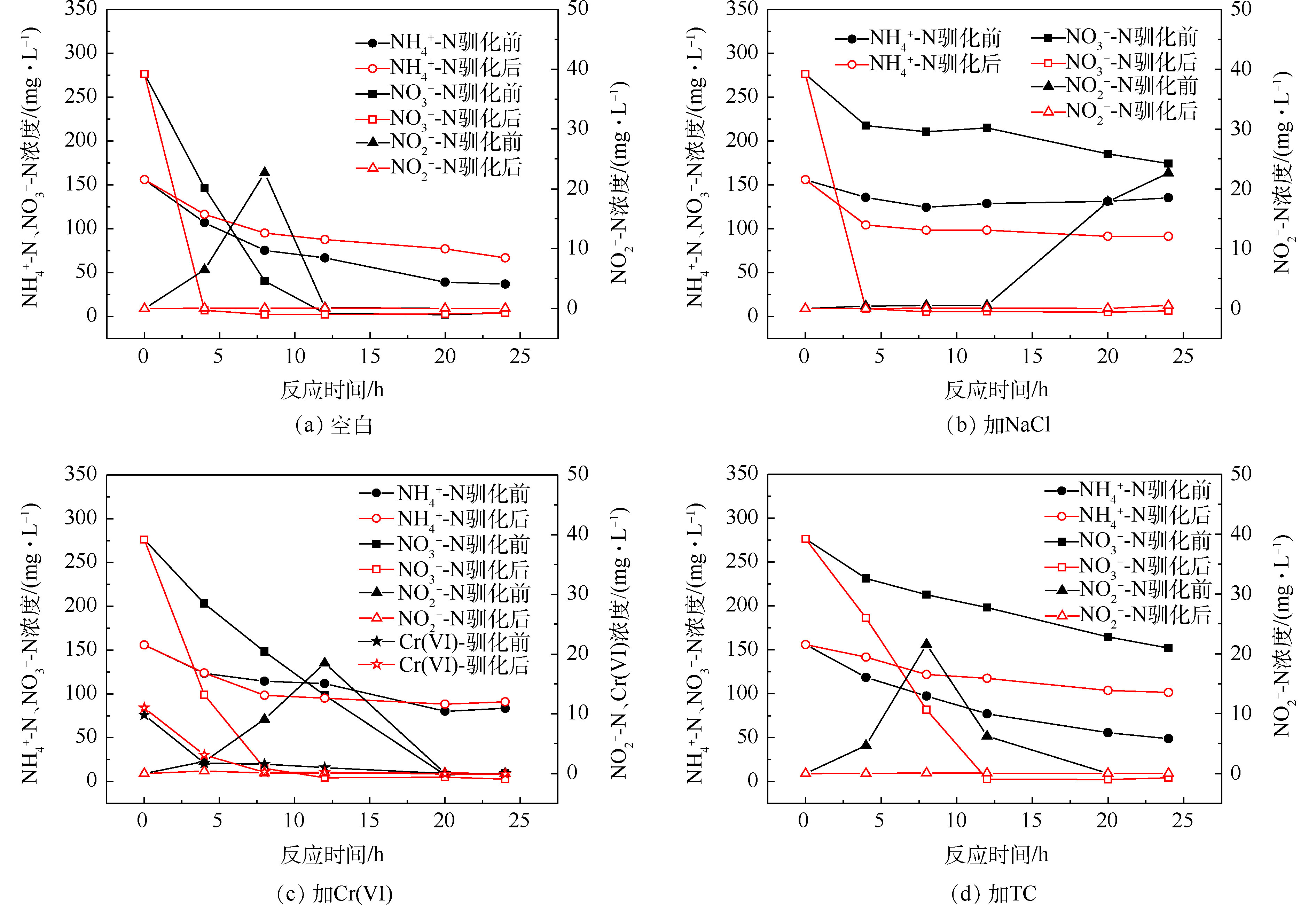
2)污染物对驯化前后菌群脱氮性能的影响。驯化前后反硝化测试结果见图4和表2。结果表明,NaCl、Cr(Ⅵ)和TC均会影响驯化前的菌群去除硝酸盐氮的效果,反硝化速率仅为空白组的19%、62%和23%,可见NaCl和TC对好氧反硝化过程的抑制效果更为突出,高盐和含高浓度四环素的工业废水对好氧反硝化细菌的生物脱氮有很大负面影响;驯化后的菌群在NaCl、Cr(Ⅵ)和TC的胁迫下,24 h内可快速去除280 mg·L?1的
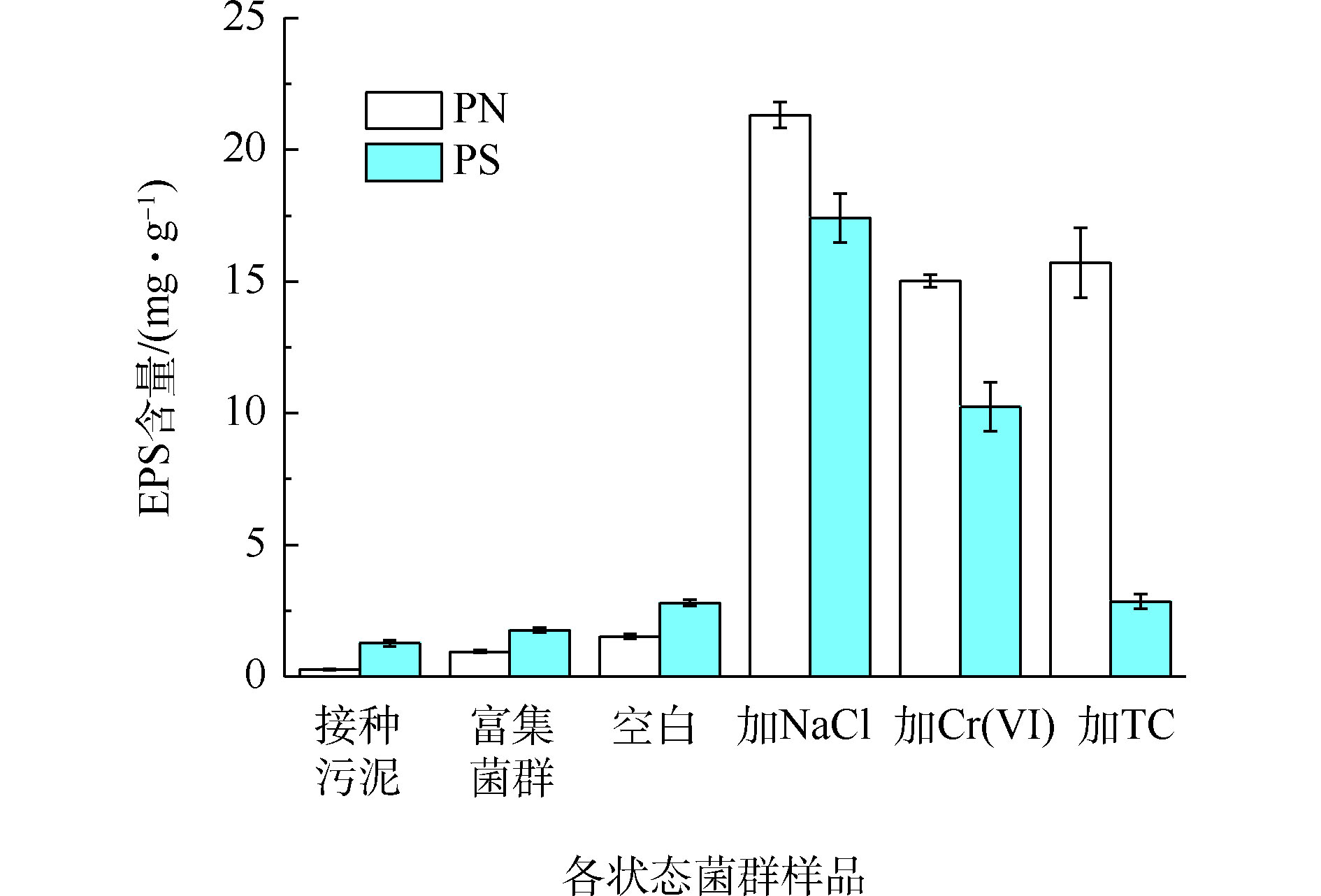
2.3. 菌群EPS分析
EPS作为细菌与环境介质间的缓冲层,有助于降低环境因素对菌体的损害[23],污染物的胁迫可能影响菌群EPS的产量和组分构成。从图5可以看出,污染物的长期胁迫大幅提高了菌群EPS的产量,相比之下,培养基中的氮素和其他无机盐对菌群EPS产生量影响甚微。未加污染物的菌群的PN和PS含量较低,随着氮负荷的提升呈现缓慢增加的趋势。这可能是因为在颗粒污泥解体为絮状污泥的过程中,由于有机负荷低使微生物内源代谢水平升高,造成细胞的自溶,从而导致EPS含量的增加[24]。与空白组相比,NaCl、Cr(Ⅵ)和TC胁迫下的菌群PN含量增长8.7~12.8倍,NaCl、Cr(Ⅵ)胁迫下的菌群PS含量增长2.6~5.2倍,PS含量未受TC影响。盐度的增加会导致细胞内外离子浓度差异增大,迫使细胞分泌出大量的蛋白酶,增强扩散和主动运输的能力,同时产生多糖分子来限制细胞中水分的流动以适应渗透压的变化[25]。许睿骁等[26]发现,逐渐提高盐度至3.5%,污泥EPS含量较稳定,当盐度提高到5%,EPS含量增长明显。为了降低重金属毒性,细胞可以分泌出更多的蛋白物质和糖类物质,通过这些物质的官能团来络合重金属离子[27],因此,四环素的胁迫致使系统产生过量的EPS与水中的四环素结合,这主要是EPS中产生的一些蛋白类物质的参与导致的[28]。
2.4. 群落多样性及群落结构分析
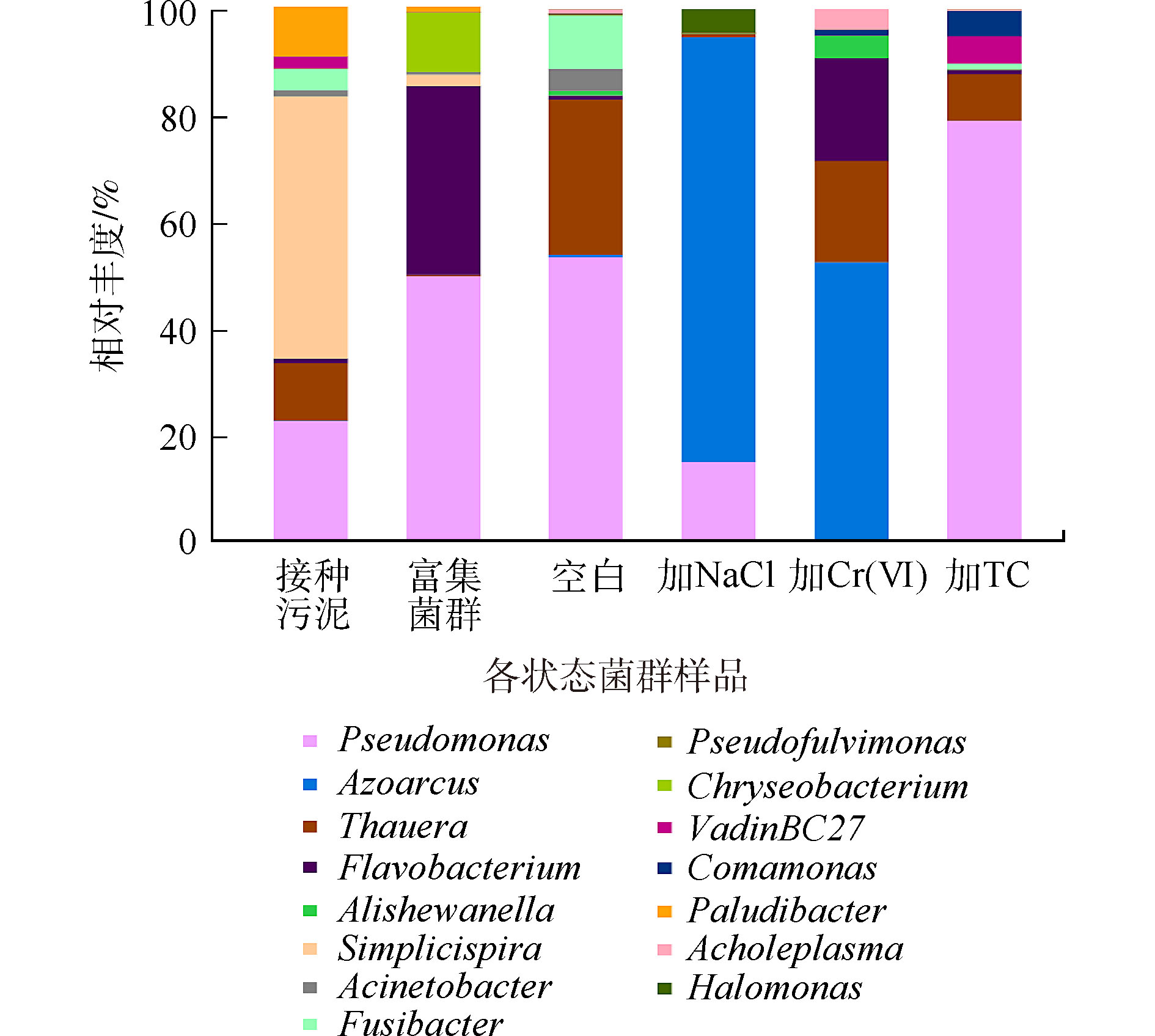
以16S rRNA基因序列97%相似度水平归类OUT统计菌群群落的α-多样性结果见表3。从表3可知,原污泥群落多样性最丰富,好氧反硝化细菌的富集显著减少了菌群群落多样性,加Cr(Ⅵ)和TC的菌群多样性低于相应空白组。这说明Cr(Ⅵ)和TC的胁迫进一步造成了群落多样性的降低,相反,NaCl的胁迫提高了菌群的群落多样性。由此可知,菌群中对铬污染和四环素污染耐受能力强的好氧反硝化细菌较少,耐高盐的好氧反硝化细菌较多;部分嗜盐菌在高盐条件下甚至繁殖更快[29],如果该菌群应用到高盐含氮废水的治理中,菌群多样性的增加可能使生物系统的稳定性更高。图6是各菌群群落结构在属水平上的相对丰度。接种污泥中优势菌种主要为专性厌氧的简单螺旋菌属(Simplicispira),富集后,假单胞菌属(Pseudomonas)成为优势菌种,这可能是导致富集前后菌群好氧反硝化能力差异的主要原因。空白组的优势菌种为假单胞菌属(Pseudomonas)和陶厄氏菌属(Thauera),相对丰度为55%和28%,陶厄氏菌(Thauera)具有较高的反硝化活性[30],高浓度的硝酸盐氮环境可能促进了陶厄氏菌的繁殖。加NaCl驯化后的菌群优势菌种为固氮弧菌属(Azoarcus)和假单胞菌属(Pseudomonas),相对丰度为79%和15%,其中还有约4%的盐单胞菌属(Halomonas),它们都具有一定的耐盐特性[31],其中固氮弧菌属(Azoarcus)有高效生物脱氮的功能[32],是驯化菌群在高盐环境实现高效反硝化的主要功能菌。加铬驯化后优势菌种主要为固氮弧菌属(Azoarcus)和陶厄氏菌属(Thauera),相对丰度分别为52%和18%。固氮弧菌(Azoarcus)能够在苯酚、甲苯等有机碳源下还原Cr(Ⅵ)[33],驯化菌群能够同时还原硝酸盐氮和Cr(Ⅵ),很可能是固氮弧菌(Azoarcus)丰度增加造成的结果;陶厄氏菌(Thauera)在低浓度Cr(Ⅵ)下活性不高,但在高浓度Cr(Ⅵ)环境的反硝化过程中发挥主要作用[34]。加TC驯化后的菌群的优势菌属与空白组相同,假单胞菌属(Pseudomonas)相对丰度增长至79%。这与ZOU等[35]的研究结果一致,在四环素的胁迫下,假单胞菌属(Pseudomonas)为反硝化过程的主要功能菌。TC对菌群脱氮性能的抑制可能与反硝化活性高的陶厄氏菌丰度下降有关。
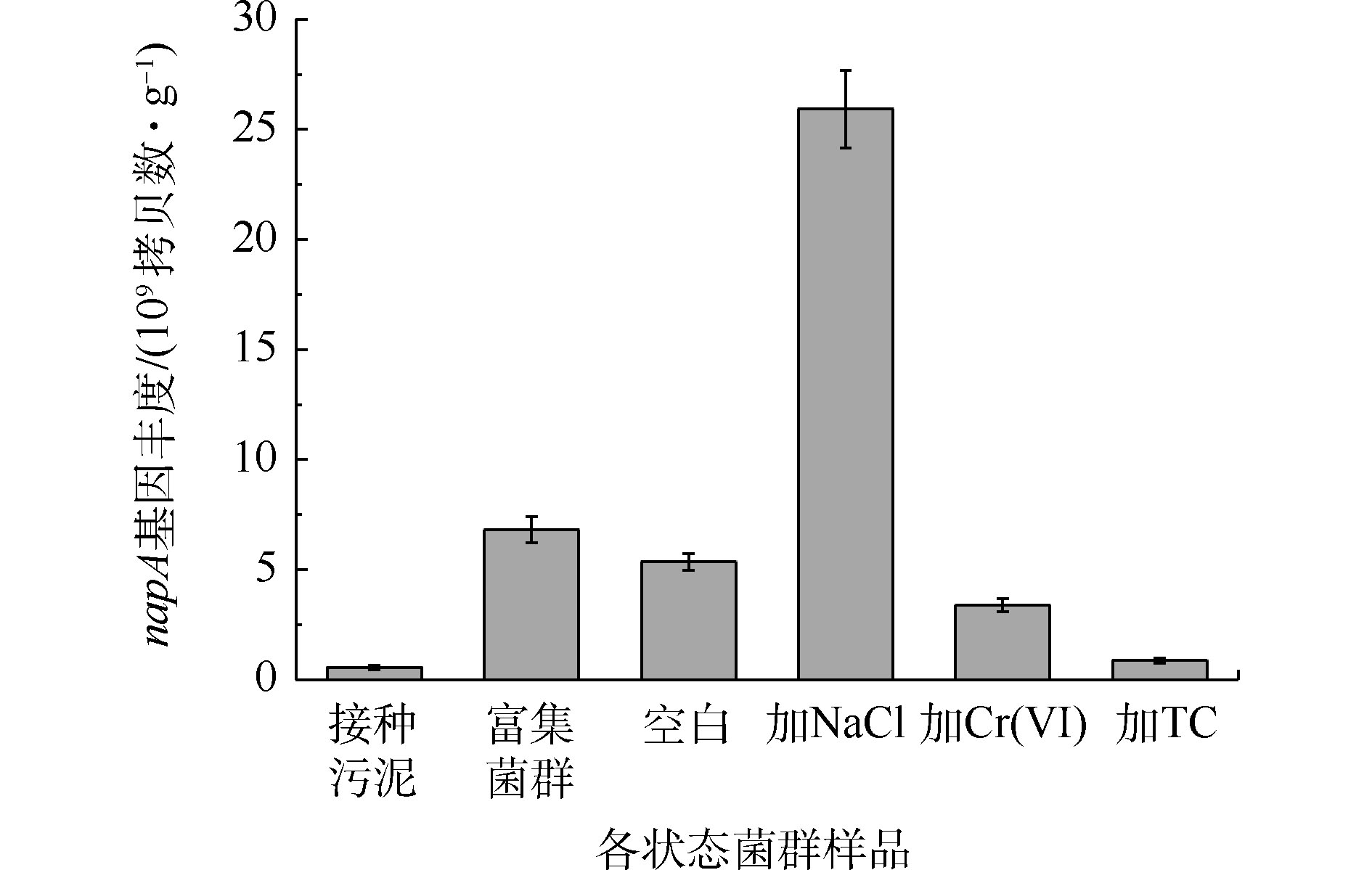
2.5. 功能基因napA丰度
由图7可知,富集过程使菌群napA基因丰度从5.54×108拷贝数·g?1提高到6.82×109 拷贝数·g?1,提高了1个数量级。Cr(Ⅵ)和TC的长期胁迫减少了菌群napA基因丰度,而NaCl的胁迫增加了菌群napA基因丰度,达到 2.59×1010 拷贝数·g?1。结果表明,Cr(Ⅵ)和TC会导致菌群中具有好氧反硝化能力的细菌数量的减少,这与Cr(Ⅵ)和TC能够抑制好氧反硝化性能的结果一致。其中,TC对napA基因丰度的影响更大,其原因可能是和四环素相关的耐药基因与napA基因相互作用所致[36]。然而,高盐环境虽然促进了嗜盐好氧反硝化细菌的繁殖,但有氧条件下的硝酸盐氮的去除效果仍低于空白组,其原因可能是细菌在NaCl的胁迫下改变了Na+/H+反向转运蛋白的活性,从而提高了napA基因的丰度,但这些基因未能正常表达[37-38]。2)好氧反硝化菌群在污染物环境中会提高胞外蛋白和胞外多糖的产量,其目的可能是降解或者隔离污染物,减少污染物对细菌细胞的毒害作用。对于胞外多聚物如何保护细胞抵御生物毒性作用是后续工作需要完善的内容。
3)典型污染物会显著影响好氧反硝化菌群群落多样性和种群结构。Cr(Ⅵ)和TC的长期胁迫会降低好氧反硝化菌群的群落多样性并减少napA基因丰度,NaCl胁迫的结果与其相反;NaCl和Cr(Ⅵ)的胁迫使固氮弧菌属(Azoarcus)替代假单胞菌属(Pseudomonas)和陶厄氏菌属(Thauera)成为好氧反硝化菌群中的优势菌种,TC不影响假单胞菌属(Pseudomonas)和陶厄氏菌属(Thauera)的优势地位,但会改变两者在群落中的相对丰度。
参考文献

 下载:
下载: 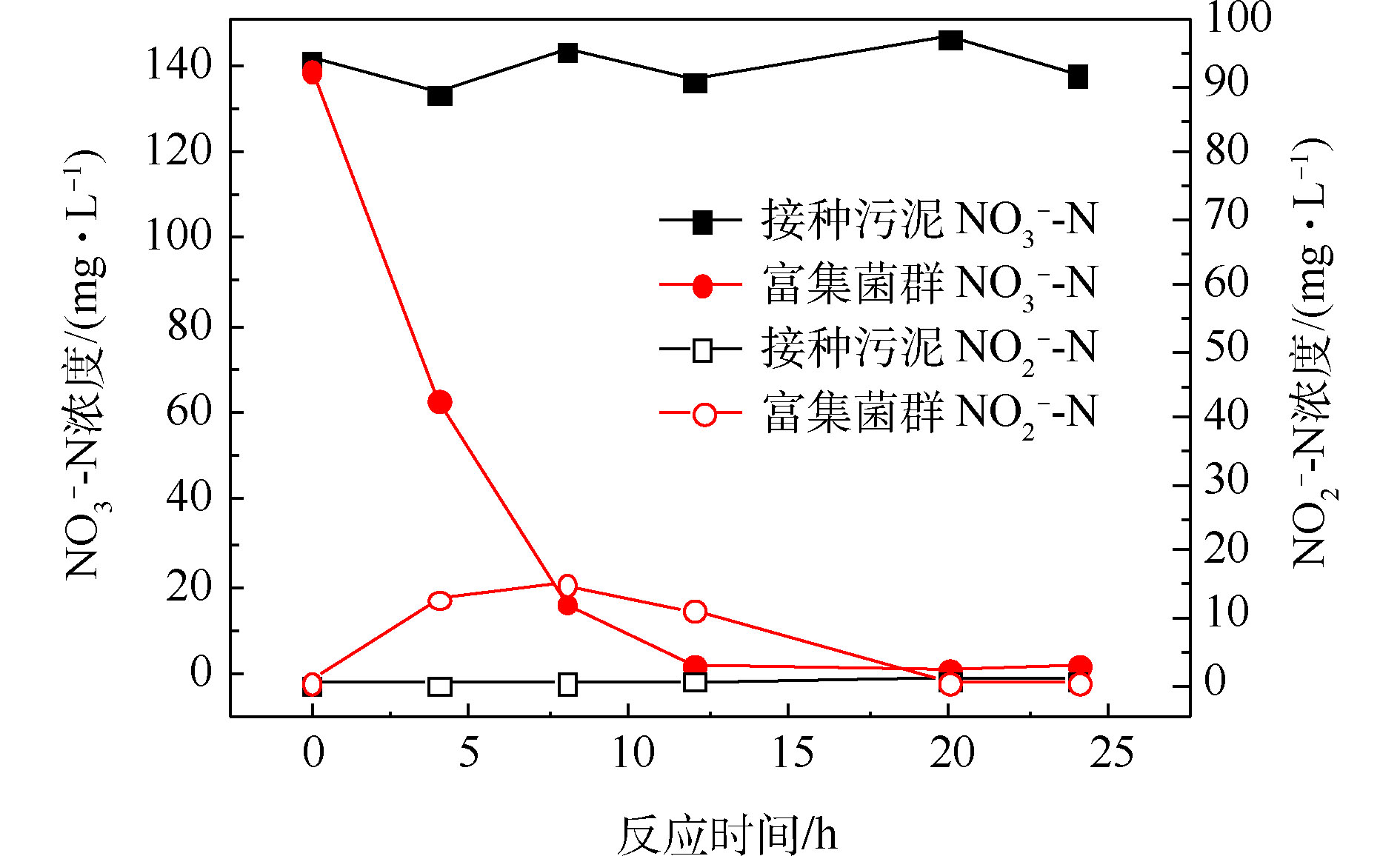
 点击查看大图
点击查看大图