 , 黄家杰1, 吴尚文2, 覃尼1, 许华莉1
, 黄家杰1, 吴尚文2, 覃尼1, 许华莉1 1. 防城港市中医医院影像科, 广西 防城港 538021;
2. 防城港市中医医院检验科, 广西 防城港 538021
2020-10-30 收稿, 2021-03-10 录用
*通讯作者: 林栋
摘要: 本文探讨了磁共振体素不相干运动扩散加权成像(IVIM-DWI)参数鉴别诊断卵巢良/恶性肿瘤的价值。选取卵巢肿瘤患者108例,比较良/恶性肿瘤表观扩散系数(ADC)、慢扩散系数(Dslow)等参数。结果显示,恶性肿瘤的IVIM-DWI参数(ADC值、Dslow和快扩散系数分数f值)低于良性肿瘤(P < 0.05);ADC值、Dslow和f值诊断恶性卵巢肿瘤的ROC曲线下面积分别为0.816、0.915和0.852(P < 0.05);ADC值、Dslow与糖类抗原125(CA125)呈负相关(r=-0.457和-0.553,P < 0.05);临床分期Ⅲ~Ⅳ患者的IVIM-DWI参数ADC值明显低于Ⅰ~Ⅱ患者(P < 0.05)。本文结果证明IVIM-DWI技术参数在卵巢肿瘤鉴别诊断中有一定应用价值,其参数ADC、Dslow水平与恶性肿瘤患者CA125水平有关,ADC值与临床分期有关。
关键词: 磁共振体素不相干运动扩散加权成像卵巢肿瘤糖类抗原125临床病理
The Diagnostic Efficiency of IVIM-DWI in Benign and Malignant Ovarian Tumors and the Correlation with Tumor Markers and Clinicopathological Factors
LIN Dong1
 , HUANG Jiajie1, WU Shangwen2, QIN Ni1, XU Huali1
, HUANG Jiajie1, WU Shangwen2, QIN Ni1, XU Huali1 1. Department of Imaging, Fangchenggang Hospital of Traditional Chinese Medicine, Fangchenggang 538021, Guangxi, P. R. China;
2. Department of Laboratory Medicine, Fangchenggang Hospital of Traditional Chinese Medicine, Fangchenggang 538021, Guangxi, P. R. China
*Corresponding author: LIN Dong
Abstract: The aim of this study was to investigate the value of introvoxel incoherent motion diffusion-weighted magnetic resonance imaging (IVIM-DWI) in the diagnosis of benign and malignant ovarian tumor. There were 108 patients with ovarian tumors who were selected to compare the differences of IVMI-DWI parameters between benign and malignant tumors. The results showed that the IVIM-DWI parameters including apparent diffusion coefficient (ADC), slow diffusion coefficient (Dslow) and fast diffusion coefficient score (f value) of malignant tumor were lower than that of benign tumor (P < 0.05). The area under ROC curve of ADC, Dslow and f value in the diagnosis of malignant ovarian tumor were 0.816, 0.915 and 0.852, respectively (P < 0.05). ADC and Dslow were negatively correlated with carbohydrate antigen 125(CA125) (r=-0.457 and -0.553, P < 0.05). The ADC in patients with clinical stage Ⅲ-Ⅳ was significantly lower than that of patients Ⅰ-Ⅱ (P < 0.05). In a word, IVIM-DWI parameters have a certain application value in the diagnosis of benign and malignant ovarian tumors, and the ADC, Dslow levels are correlated with CA125 and clinical stage of patients with malignant tumors.407
Key words: introvoxel incoherent motion diffusion-weighted magnetic resonance imaging (IVIM-DWI)ovarian tumorcarbohydrate antigen 125clinicopathology
卵巢肿瘤是危害妇女健康的常见肿瘤,发病率为4.35%~23.9%,其中恶性肿瘤约占10%,且死亡率较高[1]。尽早确定卵巢肿块的性质,不仅可以减轻患者不必要的焦虑,还可以帮助临床医生制定最佳的治疗计划。目前常用的鉴别方法主要是影像学检查和血清肿瘤标志物含量检测。血清糖类抗原125(carbohydrate antigen 125,CA125)和CA199是临床公认的恶性卵巢肿瘤的主要相关抗原,可以用作恶性卵巢肿瘤诊断的血清标志物[2, 3]。磁共振体素不相干运动扩散加权成像(introvoxel incohe-rent motion diffusion-weighted magnetic resonance imaging,IVIM-DWI)是一种定量磁共振成像技术,可以从多个角度反映病变微循环、灌注、异质性等特征[4, 5]。为了探讨IVIM-DWI参数在卵巢良/恶性肿瘤诊断中的价值及与肿瘤标志物、临床病理因素的关系,本文做了如下研究。
1 资料与方法1.1 一般资料选取2018年1月~2020年2月在我院就诊的卵巢肿瘤患者108例,年龄29~78岁,平均年龄(47.80±8.20)岁。其中恶性肿瘤63例、良性肿瘤45例。纳入标准:具有病理学明确诊断;在我院行MRI检查;肿瘤实性成分最小径>0.5 cm;临床资料完整。排除标准:有放化疗等治疗史;伴有肝肾功能障碍、子宫腺肌症、盆腔炎等疾病。
1.2 IVIM-DWI检查使用1.5T MR超导扫描仪(新光纤Brivo MR,美国GE),使用8通道人体线圈。患者取仰卧位,扫描范围从髂总动脉延伸至耻骨联合的下缘。首先常规MRI扫描,包括:(1)轴向矢状和冠状快速恢复FSE序列T2WI:TR 453.00 ms,TE 98.00 ms,切片厚度5.0 mm,间距1.0 mm,矩阵288×288,FOV 380 mm×380 mm,NEX为2;(2)轴向FSE序列T1WI:TR 452.0 ms,TE 6.1 ms,层厚度5.0 mm,层间距2.0 mm,矩阵320×320,FOV 320 mm×320 mm,NEX为2。然后进行IVIM扫描,参数:TR 2600 ms,TE 70.5 ms,层厚度5 mm,层间距2.0 mm,FOV 320 mm×256 mm。扩散加权系数b的值从低到高分别为0、50、100、200、400、600、800、1000、1500、2000 s/mm2,相应的激发次数为1、1、1、1、1、2、3、3、4、6。IVIM后,使用葡萄糖酸戊二醇酯(Gd-DTPA)0.2 mL/kg作为造影剂,通过轴向矢状和冠状快速体积采集序列TIWI进行常规增强扫描:TR 4.4 ms,TE 2.0 ms,层厚4.0 mm,间距-2.0 mm,矩阵288×288,FOV 380 mm×380 mm。
1.3 图像分析由2名具有放射科主任医师用单盲法观察,意见不一致时通过协商达成一致。IVIM序列应用GE AW4.5 T工作站Functool-MADC模型处理表观扩散系数(apparent diffusion coefficient,ADC)、慢扩散系数(slow diffusion coefficient,Dslow)、快扩散系数(fast diffusion coefficient,Dfast)及快扩散系数分数(fast diffusion coefficient fraction,f)参数图。在常规T2WI和增强图像的参照下取ROI区域,测量3次后取均值。
1.4 CA199和CA125检查患者入院后次日抽取4 mL空腹静脉血,3000 r/min离心5 min,分离血清,使用Cobas6000全自动生化分析仪及配套试剂盒检测CA125和CA199水平。
1.5 统计学处理数据统计分析采用SPSS 22.0软件,计量资料用均数±标准差表示,组间比较使用t检验;诊断效能采用ROC曲线分析;相关性分析采用Pearson方法。检验水准α为0.05。
2 结果2.1 良/恶性卵巢肿瘤IVIM-DWI参数比较与良性肿瘤比较,卵巢恶性肿瘤的ADC值、Dslow和f值较低(P<0.05)。见表 1。
表1
| 表 1 良/恶性肿瘤IVIM-DWI参数比较 |
2.2 IVIM-DWI参数鉴别诊断良恶性卵巢肿瘤的价值ADC值诊断恶性卵巢肿瘤的ROC曲线下面积为0.816,截断值为1.10×10-3 mm2·s-1,灵敏性和特异性分别为85.00%和72.00%;Dslow诊断恶性卵巢肿瘤的ROC曲线下面积为0.915,截断值为0.88×10-3 mm2·s-1,灵敏性和特异性分别为81.00%和92.50%;f值诊断恶性卵巢肿瘤的ROC曲线下面积为0.852,截断值为0.45,灵敏性和特异性分别为76.00%和88.00%。
2.3 IVIM-DWI参数与CA199和CA125的关系恶性卵巢肿瘤患者的CA199为(680.54±121.41) U·mL-1,CA125为(520.46±103.36) U·mL-1。将IVIM-DWI参数与CA199和CA125进行Pearson相关分析,结果显示:ADC值、Dslow与CA125呈负相关(P<0.05);Dfast及f与CA125无明显相关(P>0.05);CA199与ADC、Dslow、Dfast及f无明显相关性(P>0.05)。ADC值、Dslow与CA125的相关性见图 1。
图 1
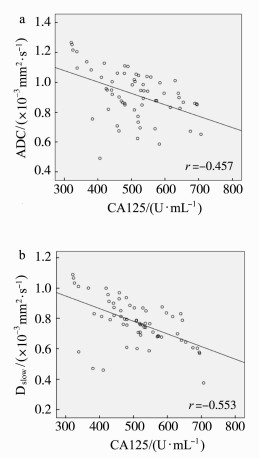 | 图 1 ADC值、Dslow与CA125水平的相关性 a. ADC值;b. Dslow |
2.4 不同临床特征的恶性卵巢肿瘤患者IVIM-DWI参数比较不同年龄、病理类型、肿瘤直径的恶性卵巢肿瘤患者,其ADC值、Dslow、Dfast和f值比较,差异无统计学意义(P>0.05);临床分期Ⅲ~Ⅳ患者IVIM-DWI参数ADC明显低于Ⅰ~Ⅱ患者(P<0.05);不同临床分期患者Dslow、Dfast和f值比较差异无统计学意义(P>0.05)。见表 2。
表2
| 表 2 不同临床特征的恶性卵巢肿瘤患者IVIM-DWI参数比较 |
3 讨论卵巢癌的恶性程度较高,进展期患者治疗难度较大,生存率降低,因此治疗的最有效方法是提高早期卵巢癌的检出率,早发现早治疗[6]。目前临床上对于卵巢癌诊断主要依靠影像检测资料和血清学标志物。常规DWI的ADC值受分子扩散和微循环或血液灌注的影响发生变化[7, 8],IVIM模型进行双极曲线拟合分析,减轻了微循环和灌注效应,可以反映真实组织水分子扩散情况[9]。既往研究显示IVIM参数中的ADC、Dslow和f值鉴别恶性肿瘤具有较高的敏感性和特异性[10-12]。本研究结果显示,恶性卵巢肿瘤的ADC值、Dslow和f值明显低于良性肿瘤,并且诊断恶性卵巢肿瘤的灵敏性和特异性均处于较高水平。分析原因可能是恶性肿瘤的细胞异型性增加,使得结构更加复杂,减少了肿瘤组织中的游离水和细胞外空间,这与先前研究的结果一致[13]。f值与血流量和灌注量有关,间接反映了组织血管化的程度,本研究中恶性组f值较良性组低,原因可能是恶性肿瘤细胞增值较快,肿瘤血管生成因子过度表达,新血管的功能和结构异常,导致具有灌注功能的血管比例下降。两组患者良/恶性肿瘤Dfast值比较差异无统计学意义,这可能是由于Dfast对噪声具有高度敏感性,受心动周期影响,重现性较差。
CA125是一种与卵巢癌相关的抗原,正常情况下CA125会少量合成并储存在卵巢上皮细胞中,血清中含量很少。然而在恶性肿瘤发生发展过程中,由于细胞密度增加,彼此之间的压力增加,加上各种炎症因子相互作用,基膜结构被破坏,大量的CA125释放到血液和各种体液中,导致体内CA125的水平显著增加。但是在黏液性卵巢肿瘤中CAl25通常不会升高[14-16]。血清CA199是非浆液性卵巢癌,尤其是黏液性卵巢癌的良好标志物,特异性为93.55%[17]。本研究中将IVIM-DWI参数与CA199、CA125进行Pearson相关分析,结果显示ADC值、Dslow与CA125呈负相关,分析原因可能是CA125与卵巢癌的级别密切相关,并且CA125的水平随着病变恶性程度增加而持续增加。本研究临床分期Ⅲ~Ⅳ患者IVIM-DWI参数ADC明显低于Ⅰ~Ⅱ患者,是因为ADC值与肿瘤恶性程度密切相关,肿瘤组织侵袭性越强,扩散越快速,细胞密度越大,ADC值越低,但Dslow、Dfast和f值比较差异无统计学意义,可能与本研究样本量较少有关,实验结果可能会存在一定误差。
已有研究证实IVIM-DWI技术在卵巢占位性病变的定性诊断中具有重要作用,通过结合临床病史等信息,可提供可靠的临床诊断、治疗依据[18-20]。但对于IVIM-DWI技术参数与恶性肿瘤血清标志物及临床病理分期之间关系的研究较少,因此本研究通过比较不同临床病理类型恶性卵巢肿瘤患者IVIM-DWI参数,并分析IVIM-DWI参数与CA199、CA125的关系,证实其诊断卵巢良恶性肿瘤有一定价值,值得临床进一步研究。
综上所述,IVIM-DWI技术参数在卵巢良恶性肿瘤诊断中有一定应用价值,其参数ADC、Dslow水平与恶性肿瘤患者CA125水平具有相关性,ADC值与临床分期具有相关性。
参考文献
| [1] | 崔云惠, 朱绍成, 李泓享, 等. IVIM对上皮源性卵巢肿瘤良恶性鉴别的诊断价值及与ki67表达的相关性[J]. 磁共振成像, 2020, 11(1): 55-59. |
| [2] | 郑凤英, 靳国荣, 刘亚非, 等. 糖类抗原199、癌胚抗原和甲胎蛋白联合检测诊断卵巢癌的价值[J]. 海南医学, 2018, 29(1): 74-76. DOI:10.3969/j.issn.1003-6350.2018.01.023 |
| [3] | Fakhar H B, Rezaie-Tavirani M, Zali H, et al. Comparison of serum human epididymis protein (HE4), carbohydrate antigen 125(CA125) and risk of ovarian malignancy algorithm (ROMA) as markers in ovarian cancer: a systematic review and a meta-analysis[J]. Indian Journal of Gynecologic Onco-logy, 2018, 16(1): 10-11. DOI:10.1007/s40944-017-0174-5 |
| [4] | 高飞, 周辉, 董江宁, 等. 体素内不相干运动扩散加权成像对良恶性骨肿瘤的鉴别诊断价值[J]. 临床放射学杂志, 2019, 38(4): 695-699. |
| [5] | 莫树群, 曹惠霞, 韩立新, 等. 体素内不相干运动扩散加权成像对前列腺癌的诊断价值[J]. 放射学实践, 2018, 33(6): 603-607. |
| [6] | Abramowicz J S, George C, Dirk T. Ovarian mass-differentiating benign from malignant. Why the international ovarian tumour analysis rules should be implemented in Australasia[J]. Australasian Journal of Ultrasound in Medicine, 2018, 21(3): 121-124. DOI:10.1002/ajum.12108 |
| [7] | Hao X Q, Liu G, Hai F Y, et al. Differentiation between orbital malignant and benign tumors using intravoxel incoherent motion diffusion-weighted imaging: correlation with dynamic contrast-enhanced magnetic resonance imaging[J]. Medicine, 2019, 98(12): 14897-14898. DOI:10.1097/MD.0000000000014897 |
| [8] | 钱洛丹, 吴慧, 高阳, 等. DWI不同模型在卵巢肿瘤诊断中的应用[J]. 磁共振成像, 2019, 10(10): 797-800. DOI:10.12015/issn.1674-8034.2019.10.017 |
| [9] | 任继鹏, 孟楠, 周凤梅, 等. 多模型体素不相干运动联合血清CA125对卵巢肿瘤的诊断价值[J]. 中国CT和MRI杂志, 2018, 16(3): 79-82. DOI:10.3969/j.issn.1672-5131.2018.03.025 |
| [10] | 魏毅, 高菲菲, 黄子星, 等. 基于全体素测量磁共振扩散加权成像单指数模型及体素内不相干运动模型参数对肝癌术前病理分级诊断价值[J]. 中华医学杂志, 2018, 98(31): 2460-2465. DOI:10.3760/cma.j.issn.0376-2491.2018.31.002 |
| [11] | 于庆, 靳海英. 基于IVIM的MR扩散加权成像(DWI)对卵巢癌分型的诊断价值[J]. 中国CT和MRI杂志, 2020, 18(6): 124-126. DOI:10.3969/j.issn.1672-5131.2020.06.039 |
| [12] | Shi H, Quan X, Liang W, et al. Evaluation of placental perfusion based on intravoxel incoherent motion diffusion weighted imaging (IVIM-DWI) and its predictive value for late-onset fetal growth restriction[J]. Geburtshilfe Und Frauenheilkunde, 2019, 79(4): 396-401. DOI:10.1055/a-0717-5275 |
| [13] | Wei Z, Wenguang L, Huaping L, et al. Preoperative prediction of microvascular invasion of hepatocellular carcinoma with IVIM diffusion-weighted MR imaging and Gd-EOB-DTPA-enhanced MR imaging[J]. PloS One, 2018, 13(5): 197488-197489. |
| [14] | Migda M, Bartosz M, Migda M S, et al. Diagnostic value of the gynecology imaging reporting and data system (GI-RADS) with the ovarian malignancy marker CA-125 in preoperative adnexal tumor assessment[J]. Journal of Ovarian Research, 2018, 11(1): 92-93. DOI:10.1186/s13048-018-0465-1 |
| [15] | Moro F, Pasciuto T, Djokovic D, et al. Role of CA125/CEA ratio and ultrasound parameters in identifying metastases to the ovaries in patients with multilocular and multilocular-solid ovarian masses[J]. Ultrasound in Obstetrics & Gynecology, 2018, 53(1): 116-123. |
| [16] | Asya P, Jalid S, Desislava D, et al. Preoperative CA-125 value as a predictive factor for postoperative outcome in first relapse of platinum-sensitive serous ovarian cancer[J]. Anticancer Research, 2018, 38(8): 4865-4870. DOI:10.21873/anticanres.12799 |
| [17] | Lena S D, Lavie O, Auslander R. CA19-9 in Evaluation of adnexal mass: retrospective cohort analysis and review of the literature[J]. International Journal of Biological Markers, 2018, 30(3): 333-340. |
| [18] | Gao P, Liu Y, Shi C, et al. Performing IVIM-DWI using the multifunctional nanosystem for the evaluation of the antitumor microcirculation changes[J]. Magnetic Resonance Materials in Physics, Biology and Medicine, 2020, 33(4): 517-526. DOI:10.1007/s10334-019-00814-7 |
| [19] | Sungsik K, Soochi K, Jinhyun K, et al. Evaluating tumor evolution via genomic profiling of individual tumor spheroids in a malignant ascites from a patient with ovarian cancer using a laser-aided cell isolation technique[J]. Scientific Reports, 2018, 8(1): 12724-12725. DOI:10.1038/s41598-018-31097-y |
| [20] | Yao S, Li L, Su X T, et al. Development and evaluation of novel tumor-targeting paclitaxel-loaded nano-carriers for ovarian cancer treatment: in vitro and in vivo[J]. Journal of Experimental & Clinical Cancer Research, 2018, 37(1): 29-30. |
