 , 程钢1
, 程钢1 1. 北京老年医院 放射科, 北京 100095;
2. 北京市昌平区医院 检验科, 北京 102200
2020-08-28 收稿, 2020-11-18 录用
*通讯作者: 李迎
摘要: 回顾性选取肺癌患者86例为肺癌组,同期肺良性结节患者86例为对照组,患者均行双源CT双能量、血清miR-126、miR-204水平检测,发现静脉期标准化碘浓度(NIC)、动脉期NIC、miR-204、miR-126水平在肺癌组中呈异常表达,并与肺癌组病理类型、临床分期、淋巴结转移存在一定相关性,三者联合对肺癌具有一定诊断价值。同时经Kaplan-Meier生存分析可知,肺癌组静脉期NIC、动脉期NIC高水平患者生存率低于低水平患者,而miR-126、miR-204高水平患者生存率高于低水平患者(P < 0.05)。早期采用双源CT双能量、血清miR-126、miR-204联合诊断,可为临床诊治、预后评估提供循证指导。
关键词: 双源CT双能量微小核糖核酸-126微小核糖核酸-204肺癌临床病理特征受试者工作特征曲线
The Diagnostic Value of Dual-source CT Dual-energy Parameters Combined with Serum miR-126 and miR-204 Detection in Lung Cancer and Its Correlation with Clinicopathological Characteristics
ZHENG Wei1, LI Ying2
 , CHENG Gang1
, CHENG Gang1 1. Department of Radiology, Beijing Geriatric Hospita, Beijing 100095, P. R. China;
2. Department of Laboratory Medicine, Changping District Hospital, Beijing 102200, P. R. China
*Corresponding author: LI Ying
Abstract: A total of 86 patients with lung cancer were retrospectively selected as the lung cancer group, and 86 patients with benign pulmonary nodules as the control group during the same period. Dual-source CT dual energy, serum miR-126, miR-204 levels were detected in all patients. It was found that the normalized iodine concentration (NIC) in the venous phase, NIC in the arterial phase, serum miR-204, miR-126 levels were abnormally expressed in the lung cancer group, and there was a certain correlation with the pathological type, clinical stage, and lymph node metastasis of the lung cancer group. The combination of the three had certain diagnostic value for lung cancer. At the same time, Kaplan-Meier survival analysis showed that the survival rate of patients with high levels of NIC in the venous phase and arterial phase in the lung cancer group was lower than that of patients with low levels. The survival rates of patients with high levels of serum miR-126 and miR-204 were higher than those with low levels (P < 0.05). It can be seen that the early combined diagnosis of dual-source CT dual-energy, serum miR-126, and miR-204 can provide evidence-based guidance for clinical diagnosis and treatment and prognosis evaluation.
Key words: dual source CT dual energymicro-ribonucleic acid-126micro-ribonucleic acid-204lung cancerclinicopathological characteristicsreceiver operating characteristic curve
肺癌具有病情发展迅速、恶性程度高等特点,5年生存率仍仅为17%,位居全球癌症死亡主要原因的榜首[1]。正电子发射断层显像/X线计算机体层成像(PET/CT)、肺灌注成像等影像学技术是既往诊断肺癌的重要手段[2],但其费用较高、辐射剂量大。近年来,双源CT双能量利用双能量碘图成像系统获得癌灶增强扫描不同时间段净增加值,可为鉴别癌症不同类型病理学特征提供技术支持[3]。此外,随基因组学与蛋白质组学的深入发展,微小核糖核酸(miRNA)的发现为癌症诊断与治疗效果预测提供了新方法[4, 5]。但关于双源CT双能量、血清miR-126、miR-204联合对肺癌的诊断价值少有报道。本研究分析双源CT双能量参数联合血清miR-126、miR-204检测对肺癌的诊断价值及与临床病理特征的关联性。
1 资料和方法1.1 一般资料回顾性选取2015年2月~2018年3月我院肺癌患者86例为肺癌组,同期肺良性结节患者86例为对照组,纳入标准:肺癌组均符合肺癌诊断标准[6],并经细胞病理和组织病理学确诊;对照组符合肺良性结节相关标准[7],经磁共振成像、X线片等影像学检查发现局灶性、类圆形、密度高阴影;本研究经我院医学伦理委员会批准。排除标准:近期有放化疗及免疫治疗史者;合并肝肾等重要脏器器质性病变者;近14 d内有影响血小板、凝血因子等药物服用史者;癌细胞远处转移者;精神行为异常者。肺癌组:男60例、女26例;年龄45~65岁,平均(55.96±3.77)岁;对照组:男58例、女28例;年龄47~66岁,平均(56.13±4.02)岁。两组基本资料(年龄、性别)均衡可比(P>0.05)。
1.2 方法1.2.1 双源CT双能量检查(1) 主要仪器:采用64层双源CT设备(SOMATOM Definition)、双筒高压注射器、Siemens Syngo Multi Modality工作站双能卡,均购自德国西门子公司。
(2) 检查方法:检查前碘过敏试验呈阴性。嘱患者检查中保持平静呼吸,配合屏气,曝光时严禁说话、吞咽。取仰卧位,两手放于头顶。首先实施常规CT平扫,采用单源扫描技术自胸廓入口至膈肌水平扫描,参数如下:层厚8 mm,层距8 mm,管电压120 kV,管电流110 mA,0.5 s/r,实时动态曝光剂量调节CARE Dose 4D,准直器宽度32 mm×0.6 mm,螺距1.0。随后,选择双源Liver VNC序列,A、B球管同时采集图像。参数如下:矩阵512×512,A、B球管电压分别140 kV、100kV,电流分别为80 mA、160 mA;启动实时动态曝光剂量调节CARE Dose 4D,螺距0.7,探测器宽度32 mm×0.6 mm。重建参数:层厚1.5 mm,层距1.0 mm,重建函数D26f。扫描获取3组图像,分别为100 kV、140 kV及线性融合。以双筒高压注射器经肘正中静脉注射80 mL碘海醇实施增强CT扫描,流速为3.0 mL/s,注射完成后以3.0 mL/s注射30 mL生理盐水。通过对比剂团注跟踪软件触发启动扫描,动脉期触发阈值100 HU,分别于注射造影剂25 s、30 s后开始扫描, 采集动、静脉期图像。
(3) 图像分析:通过系统自动计算获取40、80、120、160 keV条件下4组融合图像,同时将扫描所得双能量增强扫描数据传输至系统专用软件,测定动脉期、静脉期40~160 keV不同能量图像上肺部肿块CT值及标准化碘浓度(normalized iodine concentration,NIC),得出能谱曲线。所有数据均由2名经验丰富影像科医师评估。
1.2.2 血清miR-126、miR-204水平检测所有研究对象均于入院第2 d空腹采集外周血样5 mL,使用EDTA-K2抗凝剂,离心分离血浆,将血浆分装至试管(500 μL),置于-80 ℃保存待检。低温保存的血浆样本(500 μL)在冰上与3倍血浆TRIzol试剂充分混合。室温条件下反应15 min,加入氯仿0.5 mL震荡混匀,室温下静置5 min。4 ℃下将混合液14000 r/min离心15 min,转移上层水相液体至新管中,并混入无水乙醇(1.5倍体积)。采用ABI-7900HT实时荧光定量仪检测血清miR-126、miR-204水平,严格参照美国Thermo Fisher Scientific公司提供的仪器说明书操作。
1.2.3 治疗方法肺癌组根据不同病理类型、临床分期、有无淋巴结转移等临床病理特征实施针对性治疗方案。
1.3 统计学方法采用统计学软件SPSS 22.0处理数据,计量资料以(x±s)描述,计数资料用n(%)表示、χ2检验,相关性分析采用Spearman相关系数模型,采用受试者工作特征曲线(ROC)诊断双源CT双能量参数、血清miR-126、miR-204水平对肺癌的诊断价值。采用卡普兰-迈耶曲线(Kaplan-Meier,K-M)分析肺癌组双源CT双能量参数、血清miR-126、miR-204不同水平患者生存情况,以Log-Rank检验。均采用双侧检验,α=0.05。
2 结果2.1 两组双源CT双能量参数、血清miR-126、miR-204水平比较肺癌组静脉期NIC、动脉期NIC高于对照组,血清miR-126、miR-204水平低于对照组(P<0.05)。见表 1。
表1
| 表 1 两组双源CT双能量参数、血清miR-126、miR-204水平对比 |
2.2 各指标对肺癌的诊断效能ROC曲线显示,4项指标静脉期NIC、动脉期NIC、血清miR-126、miR-204联合诊断AUC最高,为0.905(P<0.001)。详见表 2、图 1。
表2
| 表 2 各指标对肺癌的诊断效能 |
图 1
 | 图 1 静脉期NIC、动脉期NIC、血清miR-126、miR-204水平单一及联合诊断肺癌效能 |
2.3 肺癌组不同临床病理特征患者各指标水平不同性别、年龄肺癌患者静脉期NIC、动脉期NIC、血清miR-126、miR-204水平比较,差异无统计学意义(P>0.05)。临床病理类型为腺癌、临床分期Ⅲ~Ⅳ期、有淋巴结转移肺癌患者静脉期NIC、动脉期NIC高于鳞癌、Ⅰ~Ⅱ期、无淋巴结转移患者,而血清miR-126、miR-204水平低于鳞癌、Ⅰ~Ⅱ期、无淋巴结转移患者(P<0.05)。见表 3。
表3
| 表 3 肺癌组不同临床病理特征患者各指标水平对比 |
2.4 各指标与肺癌患者临床病理特征的关联性静脉期NIC、动脉期NIC、血清miR-126、miR-204水平与肺癌患者性别、年龄无明显相关性(P>0.05)。静脉期NIC、动脉期NIC与肺癌患者病理类型、临床分期、淋巴结转移呈正相关,而血清miR-204、miR-126水平与肺癌患者病理类型、临床分期、淋巴结转移呈负相关(P<0.05)。见表 4。
表4
| 表 4 各指标与肺癌患者临床病理特征关联性 |
2.5 不同预后肺癌患者各指标水平肺癌2年死亡患者静脉期NIC、动脉期NIC高于生存患者,而血清miR-126、miR-204水平低于生存患者(P<0.05)。见表 5。
表5
| 表 5 不同预后肺癌患者各指标水平对比 |
2.6 各指标不同水平肺癌患者生存情况以静脉期NIC、动脉期NIC、血清miR-126、miR-204的截断值为界,将肺癌患者分为静脉期NIC、动脉期NIC、血清miR-126、miR-204高水平、低水平患者,经Kaplan-Meier生存分析发现,静脉期NIC(χ2=5.482、P=0.019)、动脉期NIC(χ2=4.449、P=0.035)高水平患者生存率低于低水平患者,血清miR-126(χ2=4.270、P=0.039)、血清miR-204(χ2=5.435、P=0.020)高水平患者生存率高于低水平患者。见图 2~图 5。
图 2
 | 图 2 静脉期NIC高低水平患者生存曲线 |
图 3
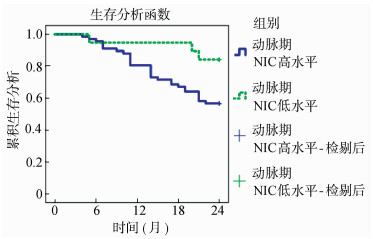 | 图 3 动脉期NIC高低水平患者生存曲线 |
图 4
 | 图 4 血清miR-126高低水平患者生存曲线 |
图 5
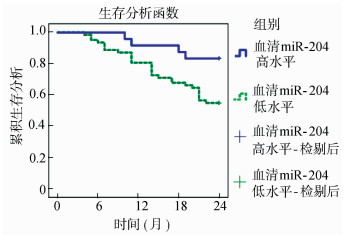 | 图 5 血清miR-204高低水平患者生存曲线 |
3 讨论肺癌CT扫描强化程度越强,其癌灶内微血管密度越大[8],而组织微血管内碘对比剂充盈是双源CT病理基础[9],能客观反映病变血供特点,全面反映各个组织灌注情况,进而为肿块良恶性诊断提供丰富影像学信息。有研究[10]认为,肺癌癌灶肺间质弹性纤维分布及癌灶微血管密度均与肺癌扫描最大衰减值存在正相关性,肺癌CT净增值越高,其对应强化越强,相应碘含量越多。本研究显示,肺癌患者静脉期NIC、动脉期NIC呈异常高表达趋势,并与肺癌患者病理类型、临床分期、淋巴结转移存在正相关性。肺癌组织内新生微血管增多,内皮细胞连接疏松,基底膜完整性损坏,通透性升高,对比剂易漏至细胞间隙,使其强化明显,进而相应增加碘浓度,而碘浓度升高可增强肿瘤转移淋巴结与正常淋巴结质量吸收系数差别,增大CT值差别,丰富肿瘤血供,最终形成恶性循环。
miR-126通过对其靶基因的调节,可调控细胞增殖、分化与凋亡,在肿瘤发生、侵袭及转移中发挥重要作用[11]。本研究通过对比研究发现,血清miR-126水平在肺腺癌患者中过度下调,并随临床分期增加、淋巴结转移出现下降趋势,与张玉洁等[12]研究结果相似。可能是因为miR-126通过抑制sprouty相关蛋白及磷脂酰肌醇-3激酶(PI3K)调节亚基P85β等血管内皮生长因子通路,负调控血管完整性及血管形成。通过ROC曲线分析可知,血清miR-126具有成为早期诊断肺癌敏感指标的潜力,可为临床个性化诊疗提供新方向。此外,本研究中肺癌2年死亡患者血清miR-126低于生存患者,可能与miR-126具有抑癌基因作用有关。
既往研究发现,miR-204不仅对Bcl-2蛋白表达具有负向调控作用,还能诱导化疗药物氟尿嘧啶激发细胞凋亡[13]。通过许有忠等[14]对qRT-PCR检测结果可知,miR-204在肺癌组织中表达水平低于癌旁组织,其表达下调与临床分期、肿瘤淋巴结转移等具有负相关性,支持本研究观点。这可能归因于miR-204具有抑制A549细胞增殖能力,同时其还能靶向调控Bcl-2蛋白表达,进而影响肺癌增殖、迁移及凋亡。此外,本研究数据表明,血清miR-204水平下降可能提高肺癌2年死亡风险,这可能与血清miR-204水平下降对抑制A549细胞增殖能力、靶向调控Bcl-2产生一定负性作用有关。
综上,静脉期NIC、动脉期NIC、血清miR-126、miR-204与肺癌患者临床病理特征存在一定相关性,早期采用双源CT双能量、血清miR-126、miR-204联合诊断,可为临床诊治、预后评估提供循证指导。
参考文献
| [1] | Abu-Duhier F M, Javid J, Sughayer M A, et al. Clinical significance of circulatory miRNA-21 as an efficient non-invasive biomarker for the screening of lung cancer patients[J]. Asian Pacific Journal of Cancer Prevention Apjcp, 2018, 19(9): 2607-2611. |
| [2] | Zaporozhchenko I A, Morozkin E S, Ponomaryova A A, et al. Profiling of 179 miRNA expression in blood plasma of lung cancer patients and cancer-free individuals[J]. Scientific Reports, 2018, 8(1): 6348. DOI:10.1038/s41598-018-24769-2 |
| [3] | 彭丹丹, 邓东, 胡小丽, 等. 双源CT双能量成像标准化碘浓度与肺癌TNM分期的关系[J]. 放射学实践, 2018, 33(3): 265-269. |
| [4] | Kontarakis Z, Rossi A, Ramas S, et al. miR-126 is a conserved modulator of lymphatic development[J]. Developmental Biology, 2018, 437(2): 120-130. DOI:10.1016/j.ydbio.2018.03.006 |
| [5] | Liu X, Gao X, Zhang W, et al. MicroRNA-204 deregulation in lung adenocarcinoma controls the biological behaviors of endothelial cells potentially by modulating Janus kinase 2-signal transducer and activator of transcription 3 pathway[J]. IUBMB Life, 2018, 70(1): 81-91. DOI:10.1002/iub.1706 |
| [6] | 支修益, 石远凯, 于金明. 中国原发性肺癌诊疗规范(2015年版)[J]. 中华肿瘤杂志, 2015, 37(1): 67-78. |
| [7] | 中华医学会呼吸病学分会肺癌学组, 中国肺癌防治联盟专家组. 肺部结节诊治中国专家共识[J]. 中华结核和呼吸杂志, 2015, 38(4): 249-254. DOI:10.3760/cma.j.issn.1001-0939.2015.04.004 |
| [8] | 陈小华, 李佳音, 李莉明, 等. 感兴趣区选择对胃癌能谱CT测量结果可重复性的影响及与微血管密度的关系[J]. 中华放射学杂志, 2018, 52(1): 24-29. DOI:10.3760/cma.j.issn.1005?1201.2018.01.006 |
| [9] | 吴芳, 杜祥颖, 张苗, 等. 第三代双源CT早期鉴别诊断急性缺血性脑卒中患者血管内治疗后颅内出血灶与碘对比剂[J]. 中国医学影像技术, 2018, 34(5): 770-774. |
| [10] | 周锦, 汤泊, 张银, 等. 非小细胞肺癌淋巴结转移与肿瘤原发灶最大径及18F-FDGPET/CT代谢参数的相关性[J]. 中国医学影像学杂志, 2019, 27(3): 188-192. |
| [11] | Jia Z, Zhang Y, Xu Q, et al. miR-126 suppresses epithelial-to-mesenchymal transition and metastasis by targeting PI3K/AKT/Snail signaling of lung cancer cells[J]. Oncology Letters, 2018, 15(5): 7369-7375. |
| [12] | 张玉洁, 王微微, 商安全, 等. 非小细胞肺癌患者血清miR-22和miR-126的检测及其临床意义[J]. 中国肿瘤生物治疗杂志, 2017, 24(12): 1403-1408. DOI:10.3872/j.issn.1007-385X.2017.12.011 |
| [13] | 杨建华, 郭晓娟, 牛广旭, 等. 胃癌患者血清miR-7、miR-204表达及其与临床病理特征、预后的关系[J]. 山东医药, 2019, 59(34): 74-77. |
| [14] | 许有忠, 田作春, 李才. MicroRNA-204在非小细胞肺癌患者组织中的表达及对癌细胞增殖和凋亡的影响[J]. 中国现代医学杂志, 2018, 28(4): 57-61. |
