 ,1,*
,1,*Regulatory Mechanism of Salicylic Acid on Seed Germination Under Salt Stress in Kale
Dongdong Cao1,3, Shanyu Chen1, Yebo Qin2, Huaping Wu3, Guanhai Ruan1, Yutao Huang ,1,*
,1,*通讯作者:
责任编辑: 白羽红
收稿日期:2019-03-14接受日期:2019-07-26网络出版日期:2020-01-01
| 基金资助: |
Corresponding authors:
Received:2019-03-14Accepted:2019-07-26Online:2020-01-01

摘要
关键词:
Abstract
Keywords:
PDF (2910KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
曹栋栋, 陈珊宇, 秦叶波, 吴华平, 阮关海, 黄玉韬. 水杨酸调控盐胁迫下羽衣甘蓝种子萌发的机理. 植物学报, 2020, 55(1): 49-61 doi:10.11983/CBB19047
Cao Dongdong, Chen Shanyu, Qin Yebo, Wu Huaping, Ruan Guanhai, Huang Yutao.
盐渍是限制作物生长与产量形成的非生物胁迫因子之一。目前, 土壤盐碱化日益加剧, 已成为全球重大环境与农业问题。全球盐碱地总面积达1.0×109 hm2, 占耕地面积的60%, 且每年增长1.5×106 hm2以上(Zhang et al., 2010)。据统计, 中国次生盐碱地超过6×106 hm2, 且呈逐年增加趋势(蔡晓锋等, 2015)。大面积的盐碱土壤已成为限制农业生产和植物栽培非常严峻的问题之一(Ci and Yang, 2010)。
盐胁迫对植物的危害主要表现在渗透胁迫、离子毒害、膜透性变化与生理代谢紊乱等多方面。植物主要通过渗透调节、抗氧化酶与激素代谢等途径响应盐胁迫, 以减轻盐胁迫的伤害(Maathuis et al., 2014)。高盐环境易造成渗透胁迫, 游离脯氨酸、可溶性糖与可溶性蛋白等渗透调节物质的积累是植物响应渗透胁迫的重要保护机制。盐胁迫下植物易产生大量活性氧(ROS), 造成膜脂过氧化, 影响细胞的正常生理代谢(Sharma and Dubey, 2007)。ROS酶类保护系统主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)与过氧化氢酶(CAT), 能有效清除过量ROS, 从而保障植物自身正常的生长发育。此外, 脱落酸(ABA)、多胺(PA)与水杨酸(salicylic acid, SA)等植物激素的调节也在植物响应盐胁迫过程中发挥重要作用(Shu et al., 2017; Fariduddin et al., 2018; Ke et al., 2018)。
水杨酸即邻羟基苯甲酸, 是一种广泛分布在高等植物中的小分子酚类物质。此外, SA也是一种重要的植物激素, 可以通过复杂的信号转导网络参与植物对逆境的响应过程(Ma et al., 2017)。研究表明, 外源施用一定浓度的水杨酸可提高多种植物的耐盐性(Hayat et al., 2010)。对模式植物拟南芥(Arabidopsis thaliana)突变体的研究表明, 水杨酸在增强植物抗盐性方面发挥作用(Hao et al., 2012)。一般认为, SA在植物体内的合成途径主要是莽草酸-苯丙氨酸途径(Yalpani et al., 1993)。苯丙氨酸经苯丙氨酸裂解酶(PAL)催化转化为苯丙烯酸是高等植物SA生物合成的关键步骤。研究发现, 氨基茚磷酸(2-aminoindano-2-phosphonic acid, AIP)是一种高度专一的PAL抑制剂, 外源AIP处理可以显著降低植物PAL活性与内源SA积累(Solecka and Kacperska, 2013)。
羽衣甘蓝(Brassica oleracea var. acephala)属十字花科芸薹属甘蓝种。近年来, 羽衣甘蓝因其较高的观赏与食用价值而备受关注(赵秀枢等, 2009)。但种子萌发和生长期常受到土壤盐碱化等逆境的影响, 是羽衣甘蓝生产中面临的突出问题。通过遗传育种增强羽衣甘蓝耐盐性是一项重要措施, 但由于缺乏种质资源, 往往费时费力, 效率较低。而施用外源调节物质是提高羽衣甘蓝种子萌发期耐盐性的有效方法。因此, 本研究以羽衣甘蓝为材料, 通过施用外源水杨酸及其合成抑制剂, 探究盐胁迫下水杨酸及其抑制剂对羽衣甘蓝种子萌发、生长发育和生理特性的调节效应。本研究旨在初步揭示羽衣甘蓝的盐害机制, 探明外源调节物质缓解盐胁迫的作用机理, 以期为羽衣甘蓝的生产提供理论指导与实践参考。
1 材料与方法
1.1 实验材料
以羽衣甘蓝(Brassica oleracea var. acephala L.)名古屋种子为实验材料。水杨酸与氨基茚磷酸均购自上海阿拉丁试剂有限公司。1.2 水杨酸与氨基茚磷酸种子引发处理
将羽衣甘蓝种子按1:20 (m/v)的配比分别浸泡在0.5 mmol·L-1水杨酸溶液、2.0 mmol·L-1氨基茚磷酸溶液与纯水中。用充气泵持续通气, 20°C黑暗条件下引发12小时。引发结束后取出种子, 用自来水快速冲洗, 再用吸水纸吸干种子表面浮水, 室温下回干至种子原始水分。1.3 盐胁迫处理与发芽实验
盐溶液由NaCl (分析纯)和纯水配置而成, 盐浓度筛选实验设置5个梯度浓度, 即0、50、100、150和200 mmol·L-1。种子引发处理完成后, 经0.1%次氯酸钠溶液消毒15分钟后采用纸上发芽。发芽盒(12 cm×12 cm)内放2层发芽纸, 分别加入相应的NaCl处理液10 mL, 充分润湿后, 均匀放入100粒种子。实验设4次重复。
种子置于25oC恒温培养箱中发芽, 光周期为12小时光照/12小时黑暗。实验过程中每隔24小时换1次处理液以保证各处理盐浓度的一致性。以种子胚根突破种皮2 mm为发芽标准, 每隔12小时记录发芽数, 在发芽第3天和第5天分别计算发芽势(germination energy, GE)和发芽率(germination percentage, GP) (张万萍等, 2008)。在发芽5天后, 随机选取具有代表性的10株幼苗, 测量其幼苗长度。
发芽指数(germination index, GI)=∑(Gt/Tt)
其中, Gt是t天内的发芽数, Tt为相应天数。
活力指数(vigor index, VI)=GI×苗干重(g)。
1.4 水杨酸含量与苯丙氨酸裂解酶活性测定
水杨酸含量测定采用高效液相色谱(HPLC)法。采用高效液相色谱仪(Waters 600, Waters 717自动进样器, Waters, Milford, USA)测定SA含量。利用荧光检测器(Waters 474)、C18反相柱(Waters Nova-Pak)和流动相进行检测。流动相包含90% 0.2 mmol·L-1乙酸钠缓冲液(pH5.5)和10%甲醇。流动相的流速为0.8 mL∙min-1。激发和发射波长分别为305和407 nm。苯丙氨酸裂解酶活性测定方法如下: 取0.5 g新鲜样品在液氮中研磨均匀, 加入2 mL 0.1 mmol·L-1 Tris-HCl缓冲液(pH7.2)进行提取; 之后将混合液在14 000 ×g条件下离心20分钟, 取上清液作为酶活测定的粗酶液。以290 nm下变化0.01吸光值作为一个酶活性单位, 酶活性以U·mg-1 protein·h-1表示。
1.5 离子含量测定
采用焰色反应法测定K+和Na+含量。用原子吸收光谱法测定Ca2+和Mg2+含量。1.6 渗透调节物质含量测定
采用蒽酮法测定各处理的可溶性糖含量。采用考马斯亮蓝G-250染色法测定可溶性蛋白含量。采用茚三酮法测定脯氨酸含量。可溶性糖含量(mg·g-1 FW)=(从标准曲线上算得葡萄糖质量(mg)×稀释倍数)/样品重(g)
蛋白质含量(mg·g-1 FW)=(从蛋白质标准曲线上算得蛋白质质量(µg)×稀释倍数)/1 000
脯氨酸含量(µg·g-1 FW)=(从脯氨酸标准曲线上算得脯氨酸质量(µg)×稀释倍数)/样品重(g)
1.7 过氧化氢与超氧阴离子含量测定
H2O2含量测定: 取新鲜样品0.3 g, 加3 mL丙酮匀浆, 12 000 × g离心15分钟, 取上清液1 mL, 加入0.1 mL硫酸钛溶液(5%)和0.2 mL氨水(25%)。12 000 × g离心15分钟, 去上清液, 沉淀物用3 mL硫酸(2 mmol·L-1)溶解。随后用分光光度计测定415 nm处吸光值。O2-.含量测定: 取0.3 g新鲜样品, 用3 mL 65 mmol·L-1磷酸钾缓冲液研磨成匀浆。5 000 ×g离心15分钟, 收集2 mL上清液, 加入0.5 mL 50 mmol·L-1磷酸钾缓冲液和0.1 mL 10 mmol·L-1盐酸羟胺溶液, 25°C水浴20分钟。然后加入1 mL 58 mmol·L-1磺胺和1 mL 7 mmol·L-1 α-萘胺, 摇匀, 25°C水浴20分钟, 加入等体积(3 mL)色素萃取液三氯甲烷, 5 000 ×g离心3分钟, 取粉红色水相(上层), 测定530 nm处吸光值。
1.8 抗氧化酶活性测定
采用紫外吸收法测定过氧化氢酶(CAT)活性。采用愈创木酚染色法测定过氧化物酶(POD)活性。采用氮蓝四唑(NBT)比色法测定超氧化物歧化酶(SOD)活性。1.9 基因表达量检测
用植物RNA提取试剂盒提取种子总RNA。利用Nano Drop 1000分光光度计(NanoDrop Technologies, Wilmington, USA)检测RNA的纯度和浓度。采用PrimerScriptTM RT reagent Kit试剂盒(TaKaRa, Japan)进行RNA反转录实验。采用RT-PCR检测系统(Roche, Hercules, USA)进行实时定量PCR反应。在96孔板上利用SYBR Premix Ex TaqTM II (TaKaRa)法以cDNA为模板进行PCR反应。每个样品做3次重复。PCR反应体系为20 μL, 包括SYBR Premix Ex Taq TM II, 0.6 mmol·L-1正反向引物和1 μL cDNA。PCR反应程序为: 95°C30秒; 95°C5秒, 56°C20秒, 40个循环。在60°C时收集荧光信号。每循环结束后进行溶解曲线分析, 以线性方式从65°C升温至95°C。以18srRNA为内参基因, 采用2-ΔΔCt法计算BoPAL1、BoPAL2、BoCAT1、BoCAT2、BoSOD1、BoSOD3、BoPOD2和BoPOD3的表达量。所用引物见表1。Table 1
表1
表1qRT-PCR反应所用引物序列
Table 1
| Gene name | No. of accession | Primer sequence (5'-3') |
|---|---|---|
| 18srRNA | NC_016118.1 | F: GGAAGGACTTGTACGGTAACATTG R: TGGACCTGCCTCATCATACTCA |
| BoPAL1 | XM_013781025.1 | F: TCGATCTTCCACAAGATTGGT R: TCCACTTCGTCAGGAAGCA |
| BoPAL2 | XM_013749252.1 | F: AATCAGCTGAGCAACATAACCA R: GACGTTTTGCGAGACGAGA |
| BoCAT1 | XM_013742034.1 | F: ATCCTCGTGGTTTTGCTGTC R: TGCCAACAAGATCAAAGTTCC |
| BoCAT2 | XM_013774413.1 | F: ATGGAAGGCTCAGGTGTCAA R: CGTAGTGAGCTTTTCCGGATT |
| BoSOD1 | XM_013783393.1 | F: ACATCATTGTTGGAGATGATGG R: GAGGGATCTGGCAGTCAGTG |
| BoSOD3 | XM_013750980.1 | F: TGGTGATCCTGATGACCTTG R: CCTGCGTTTCCTGTTGATTT |
| BoPOD2 | XM_013729485.1 | F: GGTGGTTTCTTGCGCTGA R: CCATGGTCCGTTGATCACTA |
| BoPOD3 | XM_013728218.1 | F: CGTCAGGAAACACGGAGAA R: CCTCAATGAAGCCAAATCCT |
新窗口打开|下载CSV
1.10 统计分析
所得数据用SAS软件进行统计分析, 多重比较采用LSD (α=0.05)。百分率数据在分析前进行反正弦转换(y=arcsin [sqrt (x/100)])。2 结果与讨论
2.1 盐胁迫处理对种子发芽的影响
NaCl处理对羽衣甘蓝种子活力产生了不同程度的抑制作用(图1A)。在0-24小时, 所有处理种子均未发芽。50 mmol·L-1 NaCl处理羽衣甘蓝种子在0-96小时的发芽率与对照组(0 mmol·L-1 NaCl)无显著差异。随着NaCl浓度的升高, 盐胁迫对羽衣甘蓝种子发芽速率与发芽率的抑制作用逐渐加重。相比于对照, 100、150与200 mmol·L-1 NaCl处理组在36-96小时的发芽速率显著降低。在96小时, 100、150与200 mmol·L-1 NaCl处理组的发芽率分别为79.3%、53.7%与15.7%, 仅为清水对照的92.3%、66.0%与18.4% (图1B)。结果表明, 100、150与200 mmol·L-1 NaCl对羽衣甘蓝种子的发芽分别造成轻度、中度与重度抑制作用。因此, 我们选取150 mmol·L-1作为后续实验盐胁迫的处理浓度。图1
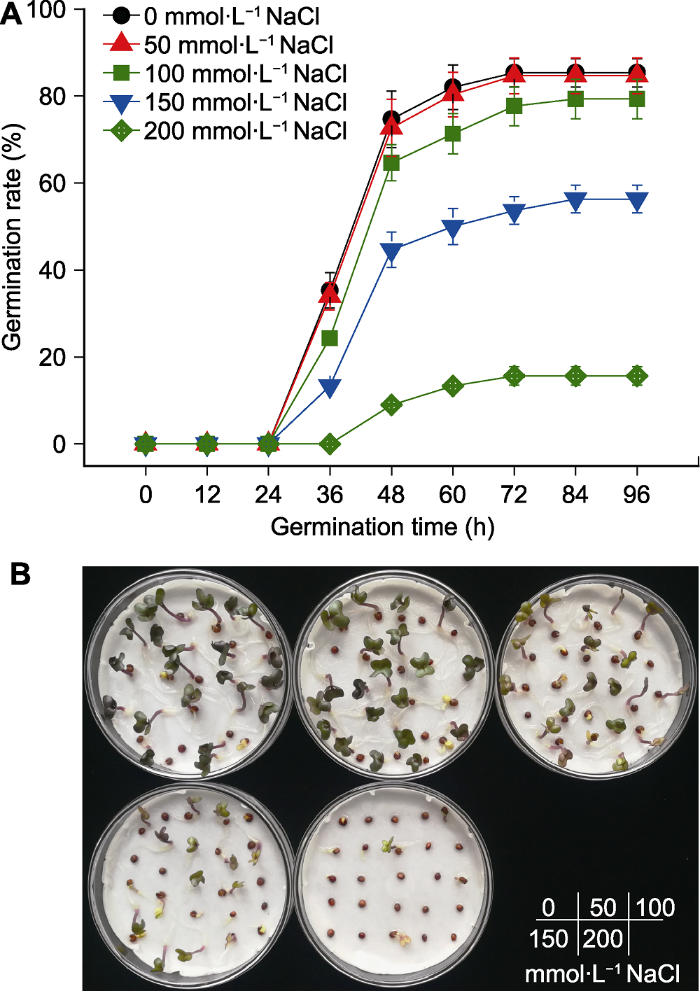 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1盐胁迫对羽衣甘蓝种子萌发的影响
(A) 盐胁迫下种子萌发进度曲线; (B) 盐胁迫96小时种子萌发情况
Figure 1Effects of salt stress on seed germination of kale
(A) Time course of seed germination under salt stress; (B) Seed germination after 96 hours of NaCl treatments with different concentration
2.2 盐胁迫下水杨酸及其抑制剂对种子发芽过程中吸水率的影响
羽衣甘蓝种子的发芽过程中, 种子的快速吸水期在0-8小时, 缓慢吸水期在8-36小时; 而在36-48小时, 种子的吸水速率有小幅增长(表2)。盐胁迫处理显著抑制羽衣甘蓝种子发芽48小时内各时间段的吸水速率。外源SA处理显著提高盐胁迫下羽衣甘蓝种子在发芽0-8与16-48小时期间的吸水速率; 相反地, 外源AIP (SA合成抑制剂)处理显著降低了盐胁迫下羽衣甘蓝种子在发芽0-4、8-16与24-48小时期间的吸水速率(表2)。Table 2
表2
表2盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对羽衣甘蓝种子萌发过程中吸水率的影响
Table 2
| Treatments | Water uptake rate (%) | |||||
|---|---|---|---|---|---|---|
| 0-4 h | 4-8 h | 8-16 h | 16-24 h | 24-36 h | 36-48 h | |
| Control-1 | 47.18±3.52 a | 42.56±2.19 a | 19.14±0.81 a | 18.33±2.04 a | 18.21±1.33 a | 27.26±2.67 a |
| Control-2 | 37.11±4.31 b | 31.67±3.15 c | 14.62±1.09 b | 12.62±0.09 c | 10.21±1.02 b | 17.64±0.08 b |
| SA | 42.27±2.89 a | 37.75±3.09 b | 14.31±1.59 b | 14.24±0.15 b | 16.77±1.44 a | 25.81±1.77 a |
| AIP | 32.12±2.71 c | 30.41±4.93 c | 13.41±1.07 c | 12.78±0.21 c | 8.21±0.06 c | 7.55±1.23 c |
新窗口打开|下载CSV
2.3 盐胁迫下水杨酸及其抑制剂对种子发芽与幼苗生长的影响
盐胁迫显著降低羽衣甘蓝种子的发芽指标与幼苗质量。外源SA处理显著提高了羽衣甘蓝种子在盐胁迫下的发芽势、发芽率、发芽指数与活力指数。在发芽5天后, 羽衣甘蓝幼苗长度与干重在SA处理与对照之间无显著差异。另一方面, 外源AIP处理显著降低了羽衣甘蓝种子在盐胁迫下的发芽势、发芽率、发芽指数与活力指数。同时, AIP处理后幼苗地上部分长度及根长与干重亦显著低于对照组(表3; 图2)。Table 3
表3
表3盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对羽衣甘蓝种子发芽的影响
Table 3
| Treatments | Germination energy (%) | Germination percentage (%) | Germination index | Vigor index | Seedling length (cm) | Seedling dry weight (g) |
|---|---|---|---|---|---|---|
| Control-1 | 85.333±3.270 a | 85.333±3.272 a | 15.742±0.742 a | 1.610±0.892 a | 8.241±0.711 a | 0.083±0.010 a |
| Control-2 | 53.667±3.208 c | 56.333±4.044 c | 8.231±0.810 c | 0.908±0.071 c | 7.822±0.635 b | 0.076±0.008 b |
| SA | 62.333±4.615 b | 68.667±4.730 b | 10.558±0.556 b | 1.167±0.064 b | 7.837±0.706 b | 0.079±0.009 b |
| AIP | 41.000±3.331 d | 46.667±2.516 d | 7.267±0.597 d | 0.762±0.079 d | 7.156±0.523 c | 0.064±0.004 c |
新窗口打开|下载CSV
图2
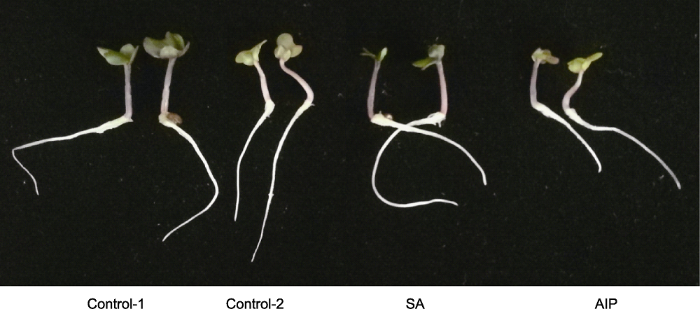 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对羽衣甘蓝发芽5天幼苗生长的影响
Control-1、Control-2、SA和AIP同
Figure 2Effects of salicylic acid (SA) and SA synthesis inhibitor (2-aminoindano-2-phosphonic acid, AIP) on kale seedling growth at 5 days post-germination under salt stress
Control-1, Control-2, SA and AIP are the same as
2.4 盐胁迫下水杨酸及其抑制剂对种子发芽过程中内源SA代谢的影响
羽衣甘蓝种子内源SA含量随着发芽过程的推进逐渐增加。盐胁迫处理显著抑制了羽衣甘蓝种子萌发过程中内源SA含量的积累。盐胁迫下, 外源SA处理显著提高了羽衣甘蓝种子萌发初期(12-48小时)内源SA含量; 相反地, 外源AIP处理显著降低了羽衣甘蓝种子内源SA含量。相比于对照, 在发芽12、24、36与48小时, SA处理后的羽衣甘蓝种子内源SA含量分别上调了1.84、1.97、1.35与1.38倍, 而AIP处理组内源SA含量分别下调了2.43、2.12、1.69与1.25倍(图3A)。图3
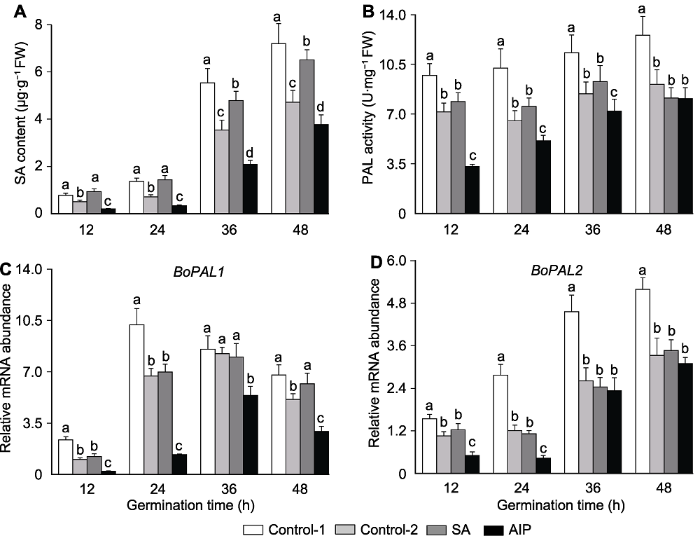 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对萌发的羽衣甘蓝种子中水杨酸含量(A)、苯丙氨酸裂解酶活性(B)及其合成基因表达量(C, D)的影响
PAL: 苯丙氨酸裂解酶。Control-1、Control-2、SA和AIP同
Figure 3Effects of salicylic acid (SA) and SA synthesis inhibitor (2-aminoindano-2-phosphonic acid, AIP) on SA content (A), PAL activity (B) and BoPAL1-2 expression (C, D) in kale seeds during germination under salt stress
PAL: Phenylalanine ammonia-lyase. Control-1, Control-2, SA and AIP are the same as
此外, 盐胁迫下羽衣甘蓝种子苯丙氨酸裂解酶活性显著低于未经胁迫处理的种子。盐胁迫下, 外源SA与AIP处理对羽衣甘蓝种子苯丙氨酸裂解酶活性的影响不同。外源SA处理小幅提高了发芽过程中羽衣甘蓝种子苯丙氨酸裂解酶活性, 而外源AIP处理显著降低羽衣甘蓝种子在发芽12、24与36小时的苯丙氨酸裂解酶活性(图3B)。在转录水平上, 苯丙氨酸裂解酶合成基因BoPAL1与BoPAL2的表达量并未受到外源SA处理的影响, 而外源AIP处理则显著降低BoPAL1与BoPAL2的表达水平。在发芽12与24小时, AIP处理羽衣甘蓝种子中BoPAL1表达量仅分别为对照的23.3%与20.7% (图3C), BoPAL2表达量仅分别为对照的49.5%与37.7% (图3D)。
2.5 盐胁迫下水杨酸及其抑制剂对种子发芽过程中离子吸收的影响
相比于未胁迫处理, 盐胁迫下羽衣甘蓝种子在发芽过程中Na+含量显著增加, K+、Ca2+与Mg2+含量显著降低。盐胁迫下, 外源SA处理显著降低发芽12、24与36小时羽衣甘蓝种子的Na+含量, 提高发芽12、24、36与48小时种子的K+与Mg2+含量, 但对Ca2+含量无显著影响。而外源AIP处理显著提高了盐胁迫下羽衣甘蓝种子K+与Mg2+含量, 对Na+与Ca2+含量无显著影响(表4)。Table 4
表4
表4盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对羽衣甘蓝种子发芽过程中离子含量的影响
Table 4
| Germination time (h) | Treatments | Ion content (mg·g-1 FW) | |||
|---|---|---|---|---|---|
| Na+ | K+ | Ca2+ | Mg2+ | ||
| 12 | Control-1 | 2.553±0.219 c | 1.471±0.134 a | 0.221±0.018 a | 0.431±0.026 a |
| Control-2 | 3.711±0.431 a | 1.227±0.203 b | 0.192±0.012 b | 0.313±0.033 c | |
| SA | 3.292±0.331 b | 1.435±0.053 a | 0.183±0.009 b | 0.372±0.042 b | |
| AIP | 3.809±0.504 a | 1.170±0.077 c | 0.211±0.018 a | 0.211±0.018 d | |
| 24 | Control-1 | 3.951±0.412 c | 1.682±0.117 a | 0.148±0.017 a | 0.477±0.033 a |
| Control-2 | 5.587±0.581 a | 1.427±0.109 b | 0.123±0.017 b | 0.385±0.049 b | |
| SA | 5.108±0.432 b | 1.623±0.152 a | 0.112±0.006 b | 0.462±0.053 a | |
| AIP | 5.717±0.367 a | 1.301±0.083 c | 0.118±0.008 b | 0.321±0.019 c | |
| 36 | Control-1 | 3.762±0.319 c | 1.677±0.092 a | 0.176±0.074 a | 0.597±0.055 a |
| Control-2 | 6.193±0.419 a | 1.486±0.106 c | 0.093±0.012 b | 0.511±0.022 b | |
| SA | 5.654±0.384 b | 1.583±0.201 b | 0.101±0.004 b | 0.590±0.044 a | |
| AIP | 6.202±0.609 a | 1.472±0.013 c | 0.095±0.011 b | 0.367±0.048 c | |
| 48 | Control-1 | 4.188±0.381 b | 1.769±0.208 a | 0.132±0.008 a | 0.646±0.054 a |
| Control-2 | 5.772±0.720 a | 1.311±0.011 c | 0.073±0.003 c | 0.491±0.060 c | |
| SA | 5.790±0.364 a | 1.422±0.015 b | 0.072±0.009 c | 0.582±0.015 b | |
| AIP | 5.831±0.519 a | 1.226±0.064 d | 0.094±0.014 b | 0.401±0.008 d | |
新窗口打开|下载CSV
2.6 盐胁迫下水杨酸及其抑制剂对种子发芽过程中渗透调节物质含量的影响
盐胁迫下, 羽衣甘蓝种子在发芽12-48小时的可溶性糖、可溶性蛋白与游离脯氨酸含量均显著增加。外源SA处理提高了盐胁迫下羽衣甘蓝种子发芽过程中可溶性糖含量, 其中在发芽12、24与36小时达到显著水平。在发芽12与24小时, SA处理组的可溶性蛋白含量也显著高于对照。然而, SA处理对盐胁迫下羽衣甘蓝种子游离脯氨酸含量的调控作用没有一致的规律。在发芽12与36小时, SA处理组的游离脯氨酸含量显著高于对照; 而在发芽24与48小时, SA处理组的游离脯氨酸含量显著低于对照。此外, 外源AIP处理显著降低了盐胁迫下羽衣甘蓝种子的可溶性糖与可溶性蛋白含量。在发芽12、24与48小时, AIP处理组可溶性糖与可溶性蛋白含量显著低于对照。此外, AIP处理对盐胁迫下游离脯氨酸含量的调控作用也没有一致性规律。在发芽12与48小时, AIP处理显著促进游离脯氨酸含量的积累; 而在发芽24与36小时, SA处理显著降低游离脯氨酸含量(表5)。
Table 5
表5
表5盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对羽衣甘蓝种子发芽过程中渗透调节物质含量的影响
Table 5
| Germination time (h) | Treatments | Osmotic adjustment substance | ||
|---|---|---|---|---|
| Soluble sugar (mg·g-1 FW) | Soluble protein (mg·g-1 FW) | Free proline (μg·g-1 FW) | ||
| 12 | Control-1 | 13.56±0.81 d | 3.57±0.40 d | 108.19±1.23 c |
| Control-2 | 23.19±1.73 b | 8.11±0.71 b | 143.77±1.35 b | |
| SA | 29.28±2.00 a | 12.17±1.03 a | 156.53±1.17 a | |
| AIP | 19.13±1.23 c | 6.59±0.33 c | 157.11±0.90 a | |
| 24 | Control-1 | 17.11±0.92 c | 6.17±0.55 c | 115.64±0.87 c |
| Control-2 | 26.35±1.74 b | 9.27±0.49 b | 167.59±2.11 a | |
| SA | 33.27±4.02 a | 13.56±0.84 a | 142.13±1.33 b | |
| AIP | 25.77±3.19 b | 6.59±0.30 c | 122.64±2.16 c | |
| 36 | Control-1 | 23.85±1.39 d | 6.12±0.41 c | 117.26±1.55 c |
| Control-2 | 37.50±2.47 b | 11.73±1.23 a | 141.33±1.46 b | |
| SA | 43.59±4.33 a | 12.19±1.19 a | 172.57±1.15 a | |
| AIP | 30.66±2.20 c | 9.13±0.52 b | 109.33±0.82 c | |
| 48 | Control-1 | 22.74±3.10 c | 5.80±0.37 b | 133.52±0.81 c |
| Control-2 | 34.19±2.79 a | 8.62±0.79 a | 167.29±1.31 b | |
| SA | 36.82±2.12 a | 8.93±0.64 a | 128.19±1.55 c | |
| AIP | 26.70±2.34 b | 6.18±0.56 b | 186.53±2.08 a | |
新窗口打开|下载CSV
2.7 盐胁迫下水杨酸及其抑制剂对种子发芽过程中活性氧积累的影响
盐胁迫显著提高了羽衣甘蓝种子发芽过程中H2O2与O2-. 的积累。150 mmol·L-1 NaCl处理下羽衣甘蓝种子H2O2含量是未经胁迫处理的1.60-2.04倍, O2-.含量是未经胁迫处理的1.35-1.88倍。外源SA处理显著降低了发芽12、36与48小时羽衣甘蓝种子H2O2与O2-.含量, 而SA合成抑制剂AIP处理显著上调了H2O2与O2-.含量(图4)。图4
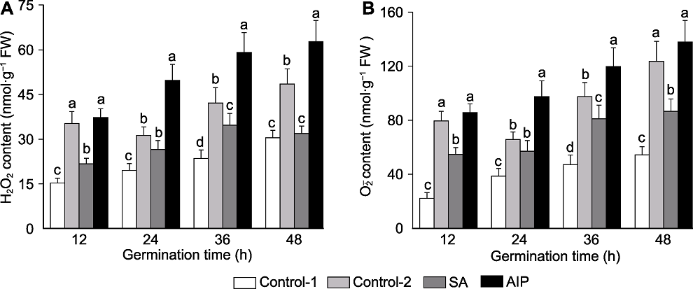 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对萌发的羽衣甘蓝种子中过氧化氢(A)与超氧阴离子(B)含量的影响
Control-1、Control-2、SA和AIP同
Figure 4Effects of salicylic acid (SA) and SA synthesis inhibitor (2-aminoindano-2-phosphonic acid, AIP) on H2O2 (A) and O2-. (B) contents of kale seed during germination under salt stress
Control-1, Control-2, SA and AIP are the same as
2.8 盐胁迫下水杨酸及其抑制剂对种子发芽过程中抗氧化酶系统的影响
盐胁迫显著提高了羽衣甘蓝种子发芽过程中抗氧化酶活性(图5)。相比于未经胁迫处理, 在盐胁迫下羽衣甘蓝种子过氧化氢酶(CAT)、超氧化物歧化酶(SOD)与过氧化物酶(POD)活性分别上调了1.14-1.67、1.15-1.47与1.17-1.89倍。此外, SA处理显著提高了盐胁迫下发芽24和36小时羽衣甘蓝种子CAT与SOD活性。相反地, AIP处理显著降低了发芽12、24与48小时种子CAT活性及发芽12与36小时种子SOD活性(图5A, B)。然而, SA与AIP处理对盐胁迫下羽衣甘蓝种子POD活性均无显著影响(图5C)。图5
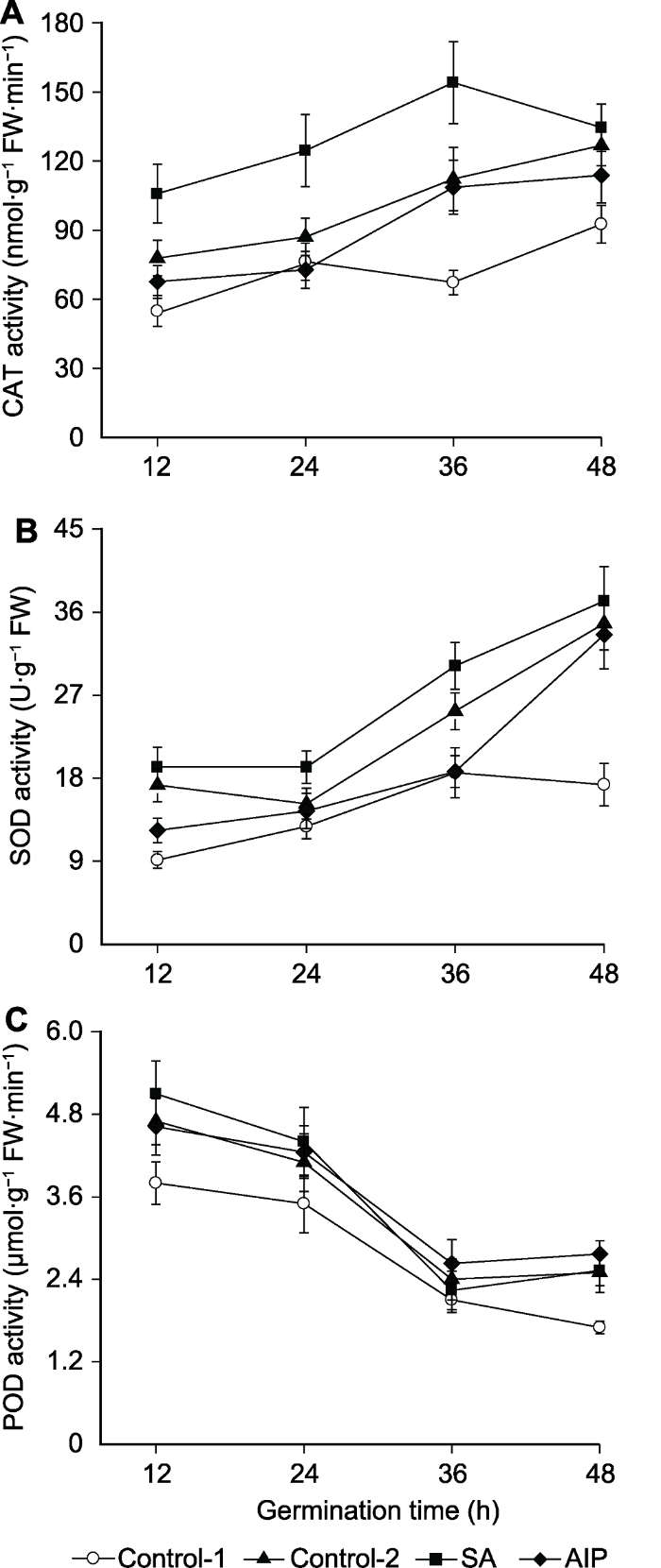 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对萌发的羽衣甘蓝种子中过氧化氢酶(CAT) (A)、超氧化物歧化酶(SOD) (B)与过氧化物酶(POD) (C)活性的影响
Control-1、Control-2、SA和AIP同
Figure 5Effects of salicylic acid (SA) and SA synthesis inhibitor (2-aminoindano-2-phosphonic acid, AIP) on the activities of catalase (CAT) (A), superoxide dismutase (SOD) (B), and peroxidase (POD) (C) in kale seeds during germination under salt stress
Control-1, Control-2, SA and AIP are the same as
荧光定量PCR结果表明, 盐胁迫下羽衣甘蓝种子在发芽过程中抗氧化酶合成相关基因表达受到正调控(图6)。在发芽24、36与48小时, 盐胁迫处理组BoCAT1 (图6A)、BoSOD1 (图6C)与BoSOD3 (图6D)表达量均显著升高。同时, 盐胁迫也显著提高了发芽36和48小时BoPOD2 (图6E)与发芽24和36小时 BoPOD3 (图6F)的表达量。
图6
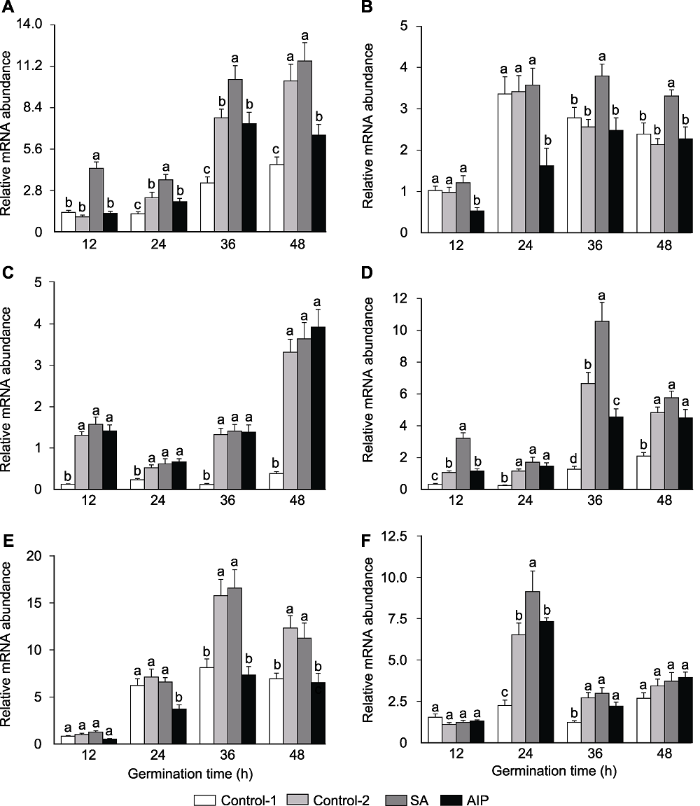 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6盐胁迫下水杨酸(SA)及其抑制剂氨基茚磷酸(AIP)对羽衣甘蓝种子发芽过程中BoCAT1 (A)、BoCAT2 (B)、BoSOD1 (C)、BoSOD3 (D)、BoPOD2 (E)和BoPOD3 (F)表达量的影响
Control-1、Control-2、SA和AIP同
Figure 6Effects of salicylic acid (SA) and SA synthesis inhibitor (2-aminoindano-2-phosphonic acid, AIP) on gene expression of BoCAT1 (A), BoCAT2 (B), BoSOD1 (C), BoSOD3 (D), BoPOD2 (E), and BoPOD3 (F) during seed germination of kale under salt stress
Control-1, Control-2, SA and AIP are the same as
盐胁迫下, 外源SA处理显著提高了羽衣甘蓝种子发芽过程中抗氧化酶合成相关基因的表达量。发芽12小时, BoCAT1与BoSOD3表达量在SA处理下分别上调4.26与3.01倍(图6A, D); 发芽36小时, BoCAT1、BoCAT2与BoSOD3表达量在SA处理下分别上调1.34、1.41与1.59倍(图6A, B, D)。同时, SA处理也显著提高了发芽24小时BoPOD3的表达量(图6F)。相反地, 外源AIP处理显著降低了发芽24小时BoCAT2、BoPOD2与发芽48小时BoCAT1、BoPOD2的表达量(图6A, B, E)。
2.9 讨论
种子是农业生产中最基本的生产资料, 种子的正常萌发与幼苗形成对植物后期的生长与产量形成至关重要。种子萌发是一个受内源与外源因素联合控制的复杂过程(Rajjou et al., 2012)。在种子发育成熟、无种被障碍和发芽抑制物质存在的条件下, 外界不良环境条件是抑制种子萌发的重要因素。其中, 盐胁迫是限制作物种子萌发的主要非生物胁迫之一。本研究表明, 羽衣甘蓝种子在50与100 mmol·L-1 NaCl处理下仍能保持较高的活力, 而在150与200 mmol·L-1 NaCl胁迫下羽衣甘蓝种子的发芽速率与发芽率显著降低。与此结果一致, 沙汉景等(2017)和郭君洁等(2018)研究表明, 盐胁迫显著抑制了水稻(Oryza sativa)与羽衣甘蓝种子的萌发过程。其主要原因是盐胁迫使种子遭受脱水胁迫与离子毒害, 盐胁迫诱导的高渗条件抑制种子吸水, 进而影响萌发过程中各类生理代谢的激活。水杨酸(SA)是在植物体内广泛分布的植物激素,参与多种生长发育过程, 如诱导植物开花、促进果实成熟和抑制细胞衰老(Rajjou et al., 2006)。朱广龙等(2018)发现外源SA可有效缓解盐胁迫对甜高粱(Sorghum bicolor)种子萌发的抑制作用。与此结果一致, 本研究表明, 外源SA引发处理显著提高盐胁迫下羽衣甘蓝种子的萌发指标与幼苗质量。相反, SA生物合成专一抑制剂(AIP)处理则显著抑制盐胁迫下羽衣甘蓝种子的萌发过程。为了进一步探索SA代谢与羽衣甘蓝种子耐盐性的关系, 我们对内源SA含量、PAL活性以及相关基因表达量进行了检测。结果表明, 盐胁迫显著降低了羽衣甘蓝种子萌发过程中内源SA 含量, 由此表明SA代谢与羽衣甘蓝种子盐胁迫下萌发能力密切相关。而外源SA处理可以增强苯丙氨酸裂解酶活性, 进而促进内源SA的积累, 表明外源SA处理可以促进羽衣甘蓝种子盐胁迫下内源SA合成代谢。然而, SA处理对苯丙氨酸裂解酶基因表达量无显著影响, 说明SA可能在转录后水平调控PAL活性。相反, AIP处理显著抑制了BoPAL1-2表达量与PAL活性, 降低内源SA水平。与此结果一致, 王洋(2014)研究表明, 外源AIP处理亦显著降低了ZmPAL表达量、PAL活性与内源SA含量, 并减弱了甜玉米(Zea mays)幼苗的低温抗性。这说明AIP处理的羽衣甘蓝种子中显著降低的SA含量可能是盐胁迫下种子活力低下的重要原因。
种子从吸水膨胀到萌发是一个连续渐进的过程, 根据其萌发特征常将这个过程分为吸胀、萌动和发芽3个阶段。在种子吸胀过程中, 由于种子中大量的亲水胶体使其快速吸水。在萌动阶段, 种子进入缓慢吸水状态, 其内部生理生化活动变得旺盛。而在种子发芽后, 种子重新进入大量吸水状态(胡晋等, 2014)。本研究中, 种子的快速吸水期在0-8小时, 缓慢吸水期在8-36小时, 而在36小时之后, 种子的吸水速率又快速增长。这表明8-36小时可能是种子萌动阶段, 而36小时之后种子进入发芽阶段, 这与种子发芽的时间(36小时)保持一致(图1)。盐胁迫显著降低了各阶段种子的吸水速率, 外源SA处理显著提高了吸胀与萌动期间的吸水速率, 而AIP处理明显抑制了种子的吸水进程。这表明显著提高的种子吸水速率可能是SA促进羽衣甘蓝种子萌发的重要原因, 而盐胁迫下羽衣甘蓝种子萌发过程中吸水速率受外源SA调控的生理机制还需进一步研究。
盐胁迫下高浓度Na+可以置换质膜和细胞内膜系统所结合的Ca2+, 使膜结构完整性受到破坏, 诱导细胞内K+和Mg2+外渗(Liu et al., 2014)。在本研究中, 盐胁迫下Na+在种子内的富集抑制了种子对K+、Ca2+和Mg2+的吸收。Farooq等(2017)和Nimir等(2017)研究表明, 盐胁迫下细胞内离子平衡的破坏可能进一步诱导单盐毒害作用。对高内源SA拟南芥突变体的研究表明, SA可以通过水杨酸基因转录共激活蛋白(NPR1)调控Na+在细胞间的转运(Jayakannan et al., 2015)。本研究结果表明, 外源SA处理显著降低发芽过程中Na+含量, 提高K+与Mg2+含量; 而AIP处理表现出相反的作用。这说明SA参与盐胁迫下羽衣甘蓝种子发芽过程中Na+、K+和Mg2+的平衡。渗透调节能力强是植物耐盐的基本特征之一。盐胁迫下, 植物在细胞内合成大量渗透调节物质以降低细胞的渗透势。其中, 可溶性糖、可溶性蛋白和脯氨酸的积累在植物响应盐胁迫反应中发挥重要作用(Zhu, 2001)。本研究中, 盐胁迫下羽衣甘蓝种子可溶性糖、可溶性蛋白与游离脯氨酸含量均显著增加, 而外源SA则进一步提高了盐胁迫下可溶性糖和可溶性蛋白含量。然而, 外源SA与AIP处理对种子脯氨酸含量的作用无一致的规律, 说明脯氨酸代谢在SA提高盐胁迫下羽衣甘蓝种子萌发机制中的作用尚不明确, 而可溶性糖、可溶性蛋白可能参与SA对羽衣甘蓝种子耐盐性的调控作用。
此外, 在盐胁迫下, 植物体ROS代谢系统的平衡受到影响, ROS含量剧增, 引发膜脂过氧化反应(Wang et al., 2011)。100 mmol·L-1 NaCl胁迫下, 羽衣甘蓝幼苗中抗氧化酶活性显著升高(李伟等, 2017)。本研究中, 盐胁迫下羽衣甘蓝种子发芽过程中H2O2与O2-.含量显著增加, 与之对应, 其过氧化氢酶、超氧化物歧化酶及过氧化物酶活性与相关合成基因的表达量也显著上调, 由此表明萌发过程中的羽衣甘蓝种子抗氧化酶系统可以在转录与酶活水平上对盐胁迫产生响应。此外, 外源SA处理通过诱导BoCAT1、BoCAT2与BoSOD3的表达提高CAT与SOD活性, 进而降低种子内H2O2与O2-.的积累。然而, POD酶活性及其合成基因表达量未受到外源SA的调控, 说明CAT与SOD是外源SA调控盐胁迫下种子萌发过程中羽衣甘蓝抗氧化酶系统的关键酶。相反, AIP处理则显著下调盐胁迫下羽衣甘蓝种子萌发过程中的H2O2与O2-.含量、抗氧化酶活性与相关合成基因的表达量。Nimir等(2015)、Singh等(2015)和Torun (2019)的研究也得出类似的结果。
3 结论
盐胁迫通过抑制水分吸收、破坏细胞内离子平衡和加剧ROS积累抑制羽衣甘蓝种子的萌发。外源SA引发处理可以通过促进种子吸水、调节离子平衡、增加渗透调节物质含量、减少ROS积累等途径缓解盐害。本研究揭示了羽衣甘蓝的盐害机制与外源水杨酸缓解盐胁迫的作用机制, 表明外源水杨酸具有应用于羽衣甘蓝耐盐生产的潜力。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
博士论文.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
植物盐胁迫抗性的分子机制研究进展
1
2015
... 盐渍是限制作物生长与产量形成的非生物胁迫因子之一.目前, 土壤盐碱化日益加剧, 已成为全球重大环境与农业问题.全球盐碱地总面积达1.0×109 hm2, 占耕地面积的60%, 且每年增长1.5×106 hm2以上(
盐胁迫下过表达BoRACK1基因对羽衣甘蓝种子萌发的影响
1
2018
... 种子是农业生产中最基本的生产资料, 种子的正常萌发与幼苗形成对植物后期的生长与产量形成至关重要.种子萌发是一个受内源与外源因素联合控制的复杂过程(
1
2014
... 种子从吸水膨胀到萌发是一个连续渐进的过程, 根据其萌发特征常将这个过程分为吸胀、萌动和发芽3个阶段.在种子吸胀过程中, 由于种子中大量的亲水胶体使其快速吸水.在萌动阶段, 种子进入缓慢吸水状态, 其内部生理生化活动变得旺盛.而在种子发芽后, 种子重新进入大量吸水状态(
H2O2对盐胁迫下羽衣甘蓝幼苗生长的影响
1
2017
... 此外, 在盐胁迫下, 植物体ROS代谢系统的平衡受到影响, ROS含量剧增, 引发膜脂过氧化反应(
外源水杨酸、脯氨酸和γ-氨基丁酸对盐胁迫下水稻产量的影响
1
2017
... 种子是农业生产中最基本的生产资料, 种子的正常萌发与幼苗形成对植物后期的生长与产量形成至关重要.种子萌发是一个受内源与外源因素联合控制的复杂过程(
水杨酸对不同耐寒型玉米种子和幼苗抗寒性的调控作用研究
1
2014
... 水杨酸(SA)是在植物体内广泛分布的植物激素,参与多种生长发育过程, 如诱导植物开花、促进果实成熟和抑制细胞衰老(
H2O2浸种对羽衣甘蓝种子萌发及幼苗的影响
1
2008
... 种子置于25oC恒温培养箱中发芽, 光周期为12小时光照/12小时黑暗.实验过程中每隔24小时换1次处理液以保证各处理盐浓度的一致性.以种子胚根突破种皮2 mm为发芽标准, 每隔12小时记录发芽数, 在发芽第3天和第5天分别计算发芽势(germination energy, GE)和发芽率(germination percentage, GP) (
观赏羽衣甘蓝高频再生体系的建立
1
2009
... 羽衣甘蓝(Brassica oleracea var. acephala)属十字花科芸薹属甘蓝种.近年来, 羽衣甘蓝因其较高的观赏与食用价值而备受关注(
外源生长调节物质对甜高粱种子萌发过程中盐分胁迫的缓解效应及其生理机制
1
2018
... 水杨酸(SA)是在植物体内广泛分布的植物激素,参与多种生长发育过程, 如诱导植物开花、促进果实成熟和抑制细胞衰老(
1
2010
... 盐渍是限制作物生长与产量形成的非生物胁迫因子之一.目前, 土壤盐碱化日益加剧, 已成为全球重大环境与农业问题.全球盐碱地总面积达1.0×109 hm2, 占耕地面积的60%, 且每年增长1.5×106 hm2以上(
Ameliorative role of salicylic acid and spermidine in the presence of excess salt in Lycopersicon esculentum
1
2018
... 盐胁迫对植物的危害主要表现在渗透胁迫、离子毒害、膜透性变化与生理代谢紊乱等多方面.植物主要通过渗透调节、抗氧化酶与激素代谢等途径响应盐胁迫, 以减轻盐胁迫的伤害(
Effects, tolerance mechanisms and management of salt stress in grain legumes
1
2017
... 盐胁迫下高浓度Na+可以置换质膜和细胞内膜系统所结合的Ca2+, 使膜结构完整性受到破坏, 诱导细胞内K+和Mg2+外渗(
Salicylic acid-altering Arabidopsis mutants response to salt stress
1
2012
... 水杨酸即邻羟基苯甲酸, 是一种广泛分布在高等植物中的小分子酚类物质.此外, SA也是一种重要的植物激素, 可以通过复杂的信号转导网络参与植物对逆境的响应过程(
Effect of exogenous salicylic acid under changing environment: a review
1
2010
... 水杨酸即邻羟基苯甲酸, 是一种广泛分布在高等植物中的小分子酚类物质.此外, SA也是一种重要的植物激素, 可以通过复杂的信号转导网络参与植物对逆境的响应过程(
The NPR1-dependent salicylic acid signaling pathway is pivotal for enhanced salt and oxidative stress tolerance in Arabidopsis
1
2015
... 盐胁迫下高浓度Na+可以置换质膜和细胞内膜系统所结合的Ca2+, 使膜结构完整性受到破坏, 诱导细胞内K+和Mg2+外渗(
Melatonin mitigates salt stress in wheat seedlings by modulating polyamine metabolism
1
2018
... 盐胁迫对植物的危害主要表现在渗透胁迫、离子毒害、膜透性变化与生理代谢紊乱等多方面.植物主要通过渗透调节、抗氧化酶与激素代谢等途径响应盐胁迫, 以减轻盐胁迫的伤害(
Effects of 24-epibrassinolide on plant growth, osmotic regulation and ion homeostasis of salt-stressed canola
1
2014
... 盐胁迫下高浓度Na+可以置换质膜和细胞内膜系统所结合的Ca2+, 使膜结构完整性受到破坏, 诱导细胞内K+和Mg2+外渗(
Salicylic acid alleviates the adverse effects of salt stress on Dianthus superbus(Caryophyllaceae) by activating photosynthesis, protecting morphological structure, and enhancing the antioxidant system
1
2017
... 水杨酸即邻羟基苯甲酸, 是一种广泛分布在高等植物中的小分子酚类物质.此外, SA也是一种重要的植物激素, 可以通过复杂的信号转导网络参与植物对逆境的响应过程(
Regulation of Na+ fluxes in plants
1
2014
... 盐胁迫对植物的危害主要表现在渗透胁迫、离子毒害、膜透性变化与生理代谢紊乱等多方面.植物主要通过渗透调节、抗氧化酶与激素代谢等途径响应盐胁迫, 以减轻盐胁迫的伤害(
Comparative effects of gibberellic acid, kinetin and salicylic acid on emergence, seedling growth and the antioxidant defence system of sweet sorghum (Sorghum bicolor) under salinity and temperature stresses
1
2015
... 此外, 在盐胁迫下, 植物体ROS代谢系统的平衡受到影响, ROS含量剧增, 引发膜脂过氧化反应(
Effect of foliar application of GA3, kinetin, and salicylic acid on ions content, membrane permeability, and photosynthesis under salt stress of sweet sorghum [Sorghum bicolor(L.) Moench]
1
2017
... 盐胁迫下高浓度Na+可以置换质膜和细胞内膜系统所结合的Ca2+, 使膜结构完整性受到破坏, 诱导细胞内K+和Mg2+外渗(
Proteomic investigation of the effect of salicylic acid on Arabidopsis seed germination and establishment of early defense mechanisms
1
2006
... 水杨酸(SA)是在植物体内广泛分布的植物激素,参与多种生长发育过程, 如诱导植物开花、促进果实成熟和抑制细胞衰老(
Seed germination and vigor
1
2012
... 种子是农业生产中最基本的生产资料, 种子的正常萌发与幼苗形成对植物后期的生长与产量形成至关重要.种子萌发是一个受内源与外源因素联合控制的复杂过程(
Involvement of oxidative stress and role of antioxidative defense system in growing rice seedlings exposed to toxic concentrations of aluminum
1
2007
... 盐胁迫对植物的危害主要表现在渗透胁迫、离子毒害、膜透性变化与生理代谢紊乱等多方面.植物主要通过渗透调节、抗氧化酶与激素代谢等途径响应盐胁迫, 以减轻盐胁迫的伤害(
Salt stress represses soybean seed germination by negatively regulating GA biosynthesis while positively mediating ABA biosynthesis
1
2017
... 盐胁迫对植物的危害主要表现在渗透胁迫、离子毒害、膜透性变化与生理代谢紊乱等多方面.植物主要通过渗透调节、抗氧化酶与激素代谢等途径响应盐胁迫, 以减轻盐胁迫的伤害(
Role of salicylic acid-seed priming in the regulation of chromium (VI) and UV-B toxicity in maize seedlings
1
2016
... 此外, 在盐胁迫下, 植物体ROS代谢系统的平衡受到影响, ROS含量剧增, 引发膜脂过氧化反应(
Phenylpropanoid deficiency affects the course of plant acclimation to cold
1
2013
... 水杨酸即邻羟基苯甲酸, 是一种广泛分布在高等植物中的小分子酚类物质.此外, SA也是一种重要的植物激素, 可以通过复杂的信号转导网络参与植物对逆境的响应过程(
Time-course analysis of salicylic acid effects on ROS regulation and antioxidant defense in roots of hulled and hulless barley under combined stress of drought, heat and salinity
1
2019
... 此外, 在盐胁迫下, 植物体ROS代谢系统的平衡受到影响, ROS含量剧增, 引发膜脂过氧化反应(
Changes in photosynthetic properties and antioxidative system of pear leaves to boron toxicity
1
2011
... 此外, 在盐胁迫下, 植物体ROS代谢系统的平衡受到影响, ROS含量剧增, 引发膜脂过氧化反应(
Pathway of salicylic acid biosynthesis in healthy and virus-inoculated tobacco
1
1993
... 水杨酸即邻羟基苯甲酸, 是一种广泛分布在高等植物中的小分子酚类物质.此外, SA也是一种重要的植物激素, 可以通过复杂的信号转导网络参与植物对逆境的响应过程(
Mechanisms of sodium uptake by roots of higher plants
1
2010
... 盐渍是限制作物生长与产量形成的非生物胁迫因子之一.目前, 土壤盐碱化日益加剧, 已成为全球重大环境与农业问题.全球盐碱地总面积达1.0×109 hm2, 占耕地面积的60%, 且每年增长1.5×106 hm2以上(
Plant salt tolerance
1
2001
... 盐胁迫下高浓度Na+可以置换质膜和细胞内膜系统所结合的Ca2+, 使膜结构完整性受到破坏, 诱导细胞内K+和Mg2+外渗(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
