0 引言
【研究意义】细菌和真菌等病原微生物引起的生物胁迫以及干旱、高盐和低温等引起的非生物胁迫给作物的产量和品质造成的损失越来越引起人们的关注,这些环境因素严重影响了作物的生长和发育。植物在长期适应环境变化的过程中进化出自己的防御系统,主要是通过改变其基因表达和代谢途径来抵抗外界环境的变化。因此,研究植物的抗逆机制、培育抗逆新品种对提高作物产量有着重要的意义[1]。【前人研究进展】转录因子在植物抵抗生物及非生物胁迫的过程中发挥着至关重要的作用。锌指蛋白转录因子在其蛋白内部含有一个具有手指状的结构域,该结构域由若干个半胱氨酸残基组成,并通过与Zn2+结合折叠成稳定的手指状结构,锌指转录因子蛋白通过该区域实现与DNA的结合[2]。bZIP类转录因子识别DNA顺式作用元件的核心序列为ACGT,一些受ABA及光诱导的基因的启动子区域都含有这些元件[3],CHOI等[4]和FUJITA等[5]报道bZIP类转录因子能够激活启动子中含有ABRE元件的基因的表达。锌指蛋白也广泛存在于植物体中,且在植物体中拥有庞大的家族。1996年,BERG等[6]依据锌指蛋白的序列以及功能的不同将其分为9类,分别为C4、C6、C8、CCCH、C2H2、C2HC、C2HC5、C3HC4和C4HC3(C和H分别代表半胱氨酸和组氨酸),其中关于C2H2类锌指蛋白的研究最多。锌指蛋白在植物体中参与许多重要的调控过程,如花粉发育[7]、花形态建成以及胚发育等。近年来,越来越多的文章报道锌指蛋白在植物抵抗非生物胁迫过程中发挥着重要的作用。例如,将马绊草(Aeluropus littoralis)锌指蛋白基因AISAP在烟草中过表达可增强转基因烟草的耐旱性,并且在干旱条件下转基因烟草能够存活并完成整个生活史,产生可育的种子,然而野生型烟草却不能在干旱条件下存活[8,9];在水稻中过表达水稻锌指蛋白基因ZFP245,能增强转基因水稻对干旱胁迫的抵抗能力[10,11]。郭书巧等[12]和HUANG等[13]从水稻中得到2个锌指蛋白基因RZF71和ZFP18,二者属于C2H2型锌指蛋白,研究中通过组织特异性分析显示RZF71和ZFP182在根、茎、叶以及幼穗中均有表达,ZFP182能够被高盐、干旱、低温和ABA诱导上调表达,而RZF71的表达只被高盐和干旱诱导,不被低温和ABA诱导。将ZFP182转入烟草或水稻都能增强转基因植株的耐盐性。【本研究切入点】大豆(Glycine max L. Merr)是中国重要的油料作物之一,近年来,干旱等一些非生物胁迫严重影响中国大豆的产量和品质。目前,ZIP家族基因功能挖掘的研究已成为热点。ZIP家族基因在水稻、玉米等作物受到胁迫时的研究机理比较深入,对于大豆ZIP基因在干旱胁迫下如何发挥功能还未形成完整的体系。通过对大豆抗逆机制研究,挖掘大豆抗逆相关基因,应用基因工程培育大豆新品种对解决中国粮食安全具有重要的意义。【拟解决的关键问题】本研究从大豆干旱转录组数据中发现一个被干旱诱导上调表达的锌指蛋白转录因子GmbZIP16,并从大豆cDNA中克隆出GmbZIP16,通过对过表达拟南芥和过表达大豆毛状根复合体植株的表型鉴定,确定该基因具有增强植物体抵抗非生物胁迫的功能,为进一步研究验证GmbZIP16在植物抵抗干旱过程中的作用奠定基础。1 材料与方法
1.1 植物及菌株材料
植物材料:普通大豆(Glycine max L. Merr)William 82栽培品种及野生型拟南芥(Col-0)是由中国农业科学院作物科学研究所提供。文中WT(Wild Type)代表野生型拟南芥(Col-0)。菌株材料:农杆菌感受态GV3101由北京博迈德生物科技有限公司提供,K599发根农杆菌由中国农业科学院作物科学研究所张辉课题组提供。1.2 大豆干旱转录组测序
剪取生长2周龄的William82大豆幼苗叶片1—2 g,将叶片放在滤纸上模拟干旱处理4 h。同时剪取正常生长下的大豆叶片作为对照,样品利用液氮速冻保存。样品由华大基因公司进行测序。后续对转录组测序结果进行差异表达基因聚类分析和代谢通路分析。1.3 大豆GmbZIP16的扩增
利用Trizol方法,提取大豆叶片的总RNA,按照反转录试剂盒(TaKaRa,北京)说明书的具体操作步骤,合成大豆cDNA。通过Primer Premier 5软件设计GmbZIP16的特异性引物(bZIP16-F:5′-ATCCAATC TTCACTCACTCTCTAAT-3′;bZIP16-R:5′-CAATAA TAAGAAAAGAAGCCAAGGA-3′)。以大豆cDNA为模板,PCR扩增得到GmbZIP16。1.4 过表达载体的构建
酶切载体:选择限制性内切酶NcoⅠ对载体pCAMBIA1302进行酶切,用限制性内切酶NcoⅠ和BsTEⅡ对载体pCAMBIA3301进行酶切,并对酶切后的产物进行胶回收,合成含有载体酶切位点上端15 bp和下端15 b的载体序列的引物序列bZIP16-1302F:5′-GGGACTCTTGACCATGATGAGTAGTGTTTTTTCA-3′;bZIP16-1302R:5′-TCAGATCTACCCATGGC TACATCAGTAATTCATT-3′;bZIP16-3301F:5′-GGA CTCTTGACCATGATGAGTAGTGTTTTTTCA-3′;bZIP16-3301R:5′-ATTCGAGCTGGTCACCCTACAT CAGTAATTCATT-3′,通过DNA聚合酶的作用将载体酶切位点两端的序列插入到GmbZIP16的两端,并对其PCR产物进行胶回收,将回收的目的基因片段及酶切的载体片段进行连接、转化后挑取单克隆进行测序,筛选阳性克隆,并通过DNAMAN软件比对验证重组质粒pCAMBIA1302-GmbZIP16和pCAMBIA3301-GmbZIP16连接正确。1.5 转GmbZIP16拟南芥的获得
将重组的质粒pCAMBIA1302-GmbZIP16转入农杆菌GV3101感受中,并通过拟南芥花序侵染法侵染野生型拟南芥。收取T0代种子后利用具有潮霉素抗性的MS培养基筛选阳性株系。阳性株生长4周后,提取其叶片的RNA反转录为cDNA,以WT的模板为对照,设计引物(GmbZIP16dl-F:5′-GCACAAGTACCT TCCCCACA-3′:GmbZIP16dl-R:5′-AGTAATGAAAC CGGCGAGGG-3′)进行PCR检测,确定GmbZIP16能够在转基因拟南芥中超表达。继续繁殖到T3代。1.6 转GmbZIP16拟南芥的表型鉴定
将T3代转基因拟南芥的种子和野生型经过清洗和春化后,移入MS培养基上,在正常条件下生长9 d左右,将拟南芥幼苗移入含有不同浓度PEG(6% PEG和8% PEG)的MS固体培养基上继续生长1周,观察转基因拟南芥和野生型拟南芥在不同PEG浓度处理下的表型,并对其生物量进行测定分析。将T3代转基因拟南芥的种子和野生型经过清洗和春化后,移入MS培养基上,在正常条件下生长2周左右,将拟南芥幼苗移入土中继续生长1周后。控水处理1周,观察转基因拟南芥和野生型拟南芥的表型,记录控水1周后的存活率。并剪取转基因拟南芥和野生型拟南芥叶片测量其相对电导率。
1.7 叶片相对电导率的测定
剪取上述试验中控水1周和在正常条件下生长的转基因拟南芥和野生型拟南芥的叶片0.2 g,将其冲洗干净后,剪成0.5 cm左右的小长条,放入到含有6 mL去离子水的试管中,待室温静置25 min后,用电导仪分别测量6 mL去离子水的电势即为V0及含有叶片的去离子水试管中的电势即为Vm,再用沸水将含有叶片的去离子水煮沸30 min,待冷却至室温后在测量含有叶片的离心管中的电势即为Vn。相对电导率的计算公式为:(Vm-V0)×100/(Vn-V0)。1.8 转GmbZIP16拟南芥中胁迫响应基因的表达
选取正常生长4周龄的转GmbZIP16拟南芥和野生型,用清水冲洗根部后,放到滤纸上分别在速旱0 h和4 h时进行取样,利用Trizol方法,提取大豆叶片的总RNA,将其反转录为cDNA。以上述不同时间段不同样品cDNA为模板,对胁迫响应基因进行qRT-PCR分析。1.9 转GmbZIP16大豆复合体植株的产生
将大豆种子种入土中大约生长1周龄左右对大豆幼苗进行农杆菌侵染。在大豆种子萌发生长期间准备农杆菌材料。将方法1.4中构建的重组载体pCAMBIA3301-GmbZIP16及空载体pCAMBIA3301通过液氮冷冻的方法转入发根农杆菌K599的感受态细胞中,并将其涂于含有卡那霉素和链霉素的二抗固体培养基中让其生长2—3 d。用注射器针头挑取在上述培养基中生长的农杆菌菌落,并将其扎入大豆子叶节中,将已转入农杆菌的大豆幼苗在黑暗中培养12 h,黑暗培养过后,将已侵染的大豆幼苗放置在高温高湿的环境中生长,大约生长1周左右,覆土至盖过大豆的侵染部位,充分浇水,至大豆毛状根生长至5—10 cm,采取少许的大豆毛状根,提取总RNA并反转录cDNA,对其进行qRT-PCR检测分析。确定GmbZIP16能够在大豆毛状根中过表达。将大豆幼苗取出,剪去侵染部位以下的大豆真根,并将剩余地含有大豆毛状根复合体植株继续移入土中,生长1周,待大豆植株能够恢复正常生长时,进行后续试验。1.10 转GmbZIP16大豆复合体植株的表型鉴定及生理指标的测定
使用25% PEG处理上述方法中得到的大豆复合体(转GmbZIP16大豆复合体植株和转空载体大豆复合体植株),处理2周,观察其在25% PEG处理下的表型。在25% PEG处理1周时,采取大豆复合体的叶片,并通过试剂盒对大豆叶片的脯氨酸、丙二醛及叶绿素进行提取,并通过酶标仪测量其在不同波长下的吸光值。通过计算得出在不同处理下的叶片中脯氨酸、丙二醛及叶绿素的含量。2 结果
2.1 干旱胁迫处理条件下大豆的转录组数据分析
将干旱处理的大豆与在正常生长条件生长的大豆进行转录组测序分析,聚类分析结果显示,当大豆植株遇到干旱胁迫时,其体内许多转录因子家族出现差异表达(图1-A),在这些差异表达的转录因子数据库中,进行了数据统计分析结果显示有60种类型的转录因子在干旱胁迫下出现了差异表达(图1-B),数据统计显示,大量MYB和AP2-EREBP类型的转录因子的在干旱处理前后表达量发生了改变,在转录组数据中发现了与激素ABA合成相关的一些转录因子的表达量同样发生了变化,如ABI3。在这些转录因子中,报道最多的与干旱胁迫相关的转录因子家族有WRKY类型转录因子、MYB类型转录因子、AP2/EREBP类型的转录因子及bZIP家族类型的转录因子。以上多种转录因子在植物抵抗非生物胁迫过程中扮演着重要角色。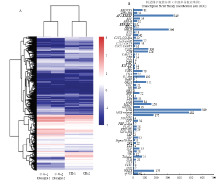 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1转录组数据中差异表达的转录因子家族的聚类统计分析 A:转录组数据中差异表达的转录因子家族的聚类分析;B:转录组数据中差异表达的转录因子家族的统计分析
-->Fig. 1Cluster statistical analyses of differential expressions of the transcription factor families A: Cluster analyses of differential expressions of the transcription factor families; B: Statistical analyses of differential expressions of the transcription factor families
-->
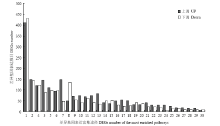
将这些差异表达转录因子及其所在的调控网络途径进行统计发现,这些转录因子主要富集于30种植物调控网络途径中(图2),在这30种途径中,涉及到植物激素信号传导途径的转录因子最多,其次是涉及甘油脂代谢和生物周期节律途径的转录因子。在这些转录因子家族中,锌指蛋白类转录因子GmbZIP16在干旱胁迫下表达量在干旱处理前后的log2(FoldChange)值达到10左右。说明,GmbZIP16在大豆干旱处理下诱导表达倍数较高(电子附表1,其中加粗为GmbZIP16,表中提供部分转录组数据内容,且按照差异表达量由高到低的顺序依次排列)。因此,将锌指转录因子GmbZIP16作为进一步研究的对象。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2差异表达的转录因子基因所富集的途径1:植物激素信号转导Plant hormone signal transduction;2:甘油酯代谢Glycerolpid metabolism;3:昼夜节律Circadian rhythm-plant;4:糖酵解/糖质新生Glycolysis/Gluconeogenesis;5:过氧物酶体Peroxisome;6:甘油磷脂代谢Glycerophospholipid metabolism;7:卟啉和叶绿素代谢Porphyrin and ChlorophyII metabolism;8:调节自噬Regulation of autophagy;9:鞘脂类代谢Sphingolipid metabolism;10:果糖和甘露糖Fructose and mannose metabolism;11:类黄酮生物合成Flavonoid biosynthesis;12:磷酸戊糖途径Pentose phosphate pathway;13:脂肪酸代谢Fatty acid metabolism;14:亚麻酸代谢Alpha-Linolenic acid metabolism;15:醚脂类代谢Ether lipid metabolism;16:角质、软木脂和蜡合成Cutin, Suberine and wax biosynthesis;17:鞘糖脂生物合成-神经节Glycosphingolipid biosynthesis-ganglio series;18:脂肪酸生物合成Fatty acid biosynthesis;19:异黄酮生物合成Isoflavonoid biosynthesis;20:黄酮和黄酮醇生物合成Flavone and flavonol biosynthesis;21:脂肪酸延伸Fatty acid elongation;22:叶酸生物合成Folate biosynthesis;23:柠檬烯和松萜降解Limonene and pinene degradation;24:光合作用-天线蛋白Photosynthesis-antenna proteins;25:生物素代谢Biotin metabolism;26:牛磺酸和亚牛磺酸代谢Taurine and hypotaurine metabolism;27:花青素生物合成Anthocyanin biosynthesis;28:葡萄糖鞘脂类Glycosphingolipid biosynthesis-globo series;29:单萜类合成Monoterpenoid biosynthesis;30:酮体的合成和降解Synthesis and degradation of ketone bodies
-->Fig.2The predominantly enriched pathways of differential expressions of the transcription factor families
-->
2.2 转GmbZIP16拟南芥的获得
通过对转基因拟南芥T1代苗期取样进行RT-PCR检测(图3-A)。并通过荧光定量PCR进行阳性株系相对表达量进行定量(图3-B)。说明外源的GmZIP16成功转化到野生型拟南芥中,相对表达量最高达到10倍左右。继续种子繁殖,得到T3代纯合植株,进行后续试验。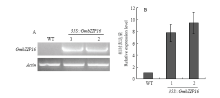 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3转GmbZIP16拟南芥的筛选及鉴定 A:转GmbZIP16基因的半定量PCR鉴定;B:转GmbZIP16基因拟南芥株系相对表达量检测
-->Fig. 3Screening and identification of transgenic GmbZIP16 in ArabidopsisA: Identification of transgenic GmbZIP16 Arabidopsis by semi quantitative PCR; B: The relative expression of GmbZIP16 gene in Arabidopsis
-->
2.3 转GmbZIP16拟南芥的表型鉴定
对T3代转基因拟南芥和野生型使用不同浓度PEG处理进行表型鉴定(图4)。结果显示,在6% PEG和8% PEG处理条件下,转基因拟南芥的长势要优于野生型拟南芥。PEG处理条件下转基因拟南芥的总根长要长于野生型拟南芥,分别增长了39.6%(6% PEG,2个株系的平均值)和74.2%(8% PEG,2个株系的平均值);鲜重分别增加了35.4%(6% PEG,2个株系的平均值)和57.9%(8% PEG,2个株系的平均值)。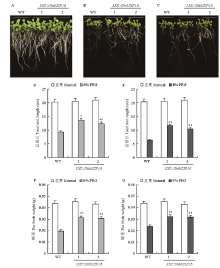 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4转GmbZIP16拟南芥的在PEG处理下的表型鉴定A:转GmbZIP16拟南芥和野生型拟南芥在正常生长条件下的表型;B:转GmbZIP16拟南芥和野生型拟南芥在6% PEG处理下的表型;C:转GmbZIP16拟南芥和野生型拟南芥在8% PEG处理下的表型;D和E:转GmbZIP16拟南芥和野生型拟南芥在PEG处理下的总根长;F和G:转GmbZIP16拟南芥和野生型拟南芥在PEG处理下的鲜重。*:差异显著(P<0.05);**:差异极显著(P<0.05)。下同
-->Fig. 4The phenotype identifications of transgenic GmbZIP16 Arabidopsis and WT plants under PEG treatment. A: The phenotype identifications of transgenic GmbZIP16 Arabidopsis and WT plants under normal condition; B: The phenotype identifications of transgenic GmbZIP16 Arabidopsis and WT plants under 6% PEG treatment; C: The phenotype identifications of transgenic GmbZIP16 Arabidopsis and WT plants under 8% PEG treatment; D and E: The total root lengths of transgenic GmbZIP16 Arabidopsis and WT plants under PEG treatment; F and G: The fresh weights of transgenic GmbZIP16 Arabidopsis and WT plants under PEG treatment. *: Indicate significant difference (P<0.05); **: Indicate significant difference (P<0.01). The same as below
-->
将T3代纯合的转基因拟南芥和野生型拟南芥的种子经过清洗和春化后转移至MS0培养基上生长2周,将其转移至土中继续培养1周后对拟南芥的进行控水处理,结果显示,在控水前转基因拟南芥和野生型拟南芥的生长并无差异(图5-A),但是控水1周后80%以上的转基因拟南芥能够存活,然而只有20%左右的野生型拟南芥能够存活(图5-C)。采取控水1周后的转基因拟南芥和野生型拟南芥的叶片,对叶片的相对电导率进行了测定,结果显示在干旱处理1周后,转基因拟南芥的相对电导率要低于野生型的相对电导率(图5-D)。
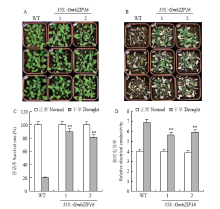 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5转GmbZIP16拟南芥的在干旱处理下的存活率和相对电导率 A:转GmbZIP16拟南芥和野生型拟南芥在处理前的表型;B:转GmbZIP16拟南芥和野生型拟南芥在干旱处理7 d后的表型;C:转GmbZIP16拟南芥和野生型拟南芥在干旱处理下的存活率;D:转GmbZIP16拟南芥和野生型拟南芥在干旱处理下的相对电导率
-->Fig. 5The survival rates and the relative electrical conductivities of transgenic GmbZIP16 Arabidopsis and WT plants under drought treatmentA: The phenotypes of transgenic GmbZIP16 Arabidopsis and WT plants before drought treatment; B: The phenotypes of transgenic GmbZIP16 Arabidopsis and WT plants after 7 d of drought treatment; C: The phenotype survival rates of transgenic GmbZIP16 Arabidopsis and WT plants under drought treatment; D: The relative electrical conductivities of transgenic GmbZIP16 Arabidopsis and WT plants under drought treatment
-->
2.4 大豆GmbZIP16增强了拟南芥胁迫响应基因的表达
通过提取干旱处理0和4 h的4周龄的T3代纯合转基因拟南芥和野生型拟南芥幼苗的总RNA,并将其反转录cDNA。通过qRT-PCR检测胁迫响应基因的表达。结果显示,在正常生长条件下,转基因拟南芥植株中的胁迫响应基因DREB2A、RD29B和P5CS的表达量与在野生型拟南芥中的表达量相比有所提高,特别是在干旱处理4 h后,这些胁迫响应基因在转基因拟南芥植株中的表达量显著高于在野生型拟南芥中的表达量(图6)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6胁迫响应基因在转基因拟南芥和野生型拟南芥植株中的qRT-PCR分析
-->Fig. 6Expression pattern analyses of stress responsive genes transgenic GmbZIP16 Arabidopsis and WT plants by qRT-PCR
-->
2.5 转GmbZIP16大豆毛状根复合体的表型鉴定及生理指标的测定
为了进一步分析大豆GmbZIP16能够增强植物的抗旱性,对过表达大豆复合体中毛状根进行qRT-PCR检测(图7-A),结果表明,在过表达复合体毛状根中,GmbZIP16表达水平是空载对照复合体毛状根的4倍以上。表明GmbZIP16已在大豆毛状根中超表达。通过对大豆毛状根复合体植株的表型鉴定,在25%PEG处理2周后,转空载体大豆毛状根复合体植株叶片的黄化程度要大于转基因大豆毛状根复合体植株(图7-C),通过对处理1周的大豆毛状根复合体植株的叶片脯氨酸、丙二醛及叶绿素的提取分析,得出在25% PEG处理1周后,转GmbZIP16大豆毛状根复合体的丙二醛含量显著低于对照(图7-D),且脯氨酸和叶绿素含量均高于对照组(图7-E和图7-F)。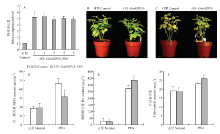 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7转GmbZIP16大豆毛状根复合体的表型鉴定及生理指标的测定A:转GmbZIP16大豆毛状根复合体不同株系表达量检测;B:转GmbZIP16大豆毛状根复合体及对照在25% PEG处理前的表型;C:转GmbZIP16大豆毛状根复合体及对照在25% PEG处理2周后的表型;D:转GmbZIP16大豆毛状根复合体及对照在25% PEG处理1周后的叶片丙二醛含量;E:转GmbZIP16大豆毛状根复合体及对照在25% PEG处理1周后的叶片脯氨酸含量;F:转GmbZIP16大豆毛状根复合体及对照在25% PEG处理1周后的叶片叶绿素含量
-->Fig. 7The phenotype identification and physiological indexes of transgenic GmbZIP16 soybean hairy root and control plants after 25% PEG treatment A: The relative expression of transgenic GmbZIP16 soybean in different lines; B: The phenotypes of transgenic GmbZIP16 soybean hairy root and control plants before 25% PEG treatment; C: The phenotypes of transgenic GmbZIP16 soybean hairy root and control plants after two weeks of 25% PEG treatment; D: The MDA contents of transgenic GmbZIP16 soybean hairy root and control plants after 7 days of 25% PEG treatment; E: The proline contents of transgenic GmbZIP16 soybean hairy root and control plants after 7 days of 25% PEG treatment; F: The chlorophyll contents of transgenic GmbZIP16 soybean hairy root and control plants after 7 days of 25% PEG treatment
-->
3 讨论
全球气候的不断变化,使植物的生长受到了严峻考验。为了适应环境的变化,植物体通过对自身信号传导及能量代谢等途径的调控来增强对外界不良环境的抵抗[14]。在这一系列复杂的过程中,转录因子发挥着重要的调控作用。植物体通过信号的逐级传导使与抗逆相关的转录因子的活性增加,从而调控胁迫相关基因的表达来增强植物体对外界环境的抵抗[15]。因此,研究转录因子的功能,对提高植物的抗逆性具有重要的意义。锌指蛋白转录因子广泛存在真核生物体中[16],且具有广泛的生物学功能,在生物体中参与很多重要的代谢途径,如影响植物细胞的生长发育、调控植物的光周期以及参与植物抵抗非生物胁迫等等[17]。本研究通过对大豆干旱转录组数据分析,发现一个受到干旱诱导高表达的锌指转录因子,并将其命名为GmbZIP16。并从大豆的转录本中成功的将其克隆。近年来越来越多文章报道大豆锌指转录因子参与植物抵抗非生物胁迫的过程。LIAO等[18]报道在拟南芥中过表达大豆GmbZIP132增强了转基因拟南芥对盐的抗性,而这种耐盐性仅仅体现在种子的萌发阶段;然而在拟南芥中过表达GmbZIP44、GmbZIP62和GmbZIP78,发现这3个大豆锌指转录因子负调控ABA信号途径,减弱了转基因拟南芥对ABA的敏感性,增强了转基因拟南芥对低温和高盐的抗性[19]。GAO等[20]发现一个大豆锌指转录因子GmbZIP1,并将其过表达与拟南芥和小麦中,结果显示,大豆GmbZIP1在拟南芥和小麦中过表达提高了转基因植株对多种非生物胁迫的抵抗。本文将大豆GmbZIP16在拟南芥及大豆毛状根中过表达,并通过对转基因拟南芥及转基因大豆毛状根复合体植株的表型鉴定,发现在植物中过表达大豆GmbZIP16提高了转基因植株的抗旱性(图4、图5和图7)。这些结果表明大豆GmbZIP16在大豆的抗旱性方面发挥着重要的作用。
当非生物胁迫来临时,植物体中的锌指转录因子蛋白以二聚体的形式与DNA顺式作用元件相结合,从而调控下游与胁迫相关的靶基因的表达[20]。利用qRT-PCR技术,对转GmbZIP16拟南芥植株与野生型拟南芥中的DREB2A、RD29B和P5CS表达量进行了实时检测。拟南芥DREB2A被报道与拟南芥抵抗非生物胁迫过程中扮演这重要的角色,将DREB2A在拟南芥中过表达能够增强拟南芥植株中RD29A、RD29B及Cor15等胁迫响应基因的表达[21]。在拟南芥中,AtP5CS是一个与脯氨酸合成相关的关键基因[22],而脯氨酸是植物抵抗非生物胁迫过程中一个重要的渗透保护物质[23]。结果显示,在过表达大豆GmbZIP16拟南芥的植物体中,DREB2A、RD29B和P5CS的表达量会有显著提高,特别是在干旱处理4 h后,它们的表达量会有明显的提高(图6),这些结果表明大豆GmbZIP16在拟南芥中过表达,增强了胁迫基因的表达从而增强了转基因植株对干旱的抵抗能力。
4 结论
获得大豆GmbZIP16,并确定GmbZIP16能够增强转基因植株对干旱的抵抗能力,在拟南芥中过表达GmbZIP16可以增强拟南芥中与胁迫响应相关的基因的表达,从而增强转基因植株的抗逆性。(责任编辑 李莉)
The authors have declared that no competing interests exist.
