0 引言
【研究意义】盐穗木(Halostachys caspica(M.B.)C. A. Mey.),属黎科(Chenopodiaceae),盐穗木属(Halostachys C. A. Mey.),主要分布于中国新疆和甘肃等地,在新疆主要分布于阿克苏地区、和田地区、巴音郭楞蒙古自治州和吐鲁番等地区[1]。盐穗木是生长在荒漠及半荒漠的盐碱地的优良植物,同时也是反刍动物的主要饲料之一。在粗饲料资源匮乏的新疆南疆地区,盐穗木是良好的饲用牧草,其适口性很好,粗蛋白含量接近于苜蓿,山羊、驴、绵羊和骆驼都喜食[2]。【前人研究进展】合理利用饲草资源的最好方法是,适时刈割将其制成青贮。乳酸菌在青贮过程中起关键性作用,在厌氧条件下其能产生乳酸,使青贮饲料的pH迅速降低,促进饲料发酵,抑制有害微生物生长,从而使饲料得以长期保存[3,4]。乳酸菌是指能发酵碳水化合物,产生乳酸,革兰氏染色呈阳性,过氧化氢酶呈阴性的一类细菌的总称。根据菌种形态的不同,可将乳酸菌分为乳酸杆菌和乳酸球菌[5]。根据其新陈代谢和发酵形式的不同可分为同型发酵型乳酸菌和异型发酵型乳酸菌[6]。【本研究切入点】目前对于盐穗木的研究涉及药物化学、形态学、生理学等方面的内容较多,对于盐穗木青贮饲料的发酵品质和青贮中微生物的研究鲜见报道。【拟解决的关键问题】本研究利用新疆阿克苏地区盐穗木制作实验室自然发酵小剂量青贮,发酵完成后测定青贮营养成分和发酵品质,并通过实验室纯培养结合16S rDNA基因序列分析方法,对盐穗木青贮中的乳酸菌进行分离鉴定。以期为提高饲料资源利用率和改善青贮饲料发酵品质提供优质乳酸菌资源。1 材料与方法
1.1 材料
1.1.1 样品来源 2016年10月从新疆阿克苏地区随机采集花果期盐穗木样品,新鲜原料除去泥土杂质平铺自然晾干,使水分含量达到65%—70%。将其切短至1—2 cm,装入青贮罐中压实并密封,每罐2 kg,共制作3罐,置于18—23 ℃条件下,自然发酵150 d。由塔里木大学畜牧科技重点实验室草食家畜营养研究室制作,并保藏备用。同时测定原料的化学成分,结果见表1。Table 1
表1
表1青贮前盐穗木的化学成分(%,以干物质为基础)
Table 1The chemical composition of Halostachys caspica before ensiling
| 干物质 DM | 粗蛋白 CP | 可溶性糖 WSC | 中性洗涤纤维 NDF | 酸性洗涤纤维 ADF |
|---|---|---|---|---|
| 24.995±0.12 | 14.875±0.11 | 5.776±0.10 | 26.780±0.15 | 11.926±0.14 |
新窗口打开
1.1.2 主要试剂和仪器 主要试剂:细菌提取试剂盒、质粒小提试剂盒、T4连接盒和通用型DNA纯化回收试剂盒,均购自天根生化科技有限公司;引物FA-27F: 5′-GCAGAGTTCTCGGAGTCACGAAGAGT TTGATCCTGGCTCAG-3′,RA-1495R: 5′-AGCGGAT CACTTCACACAGGACTACGGGTACCTTGTTACGA-3′,均购自北京英俊生物技术公司。
主要仪器:超净工作台(SW-CJ-2FD,上海博迅实业有限公司);电子天平(XP603S,瑞士梅特勒-托利多中国公司);高压灭菌锅(SX-500,上海法润科学仪器有限公司);电热恒温培养箱(DNP9162,上海精宏实验设备有限公司);紫外可见光分光光度计(T6,北京普析通用仪器有限责任公司);PCR仪(Eppendorf,德国);离心机(Eppendorf,德国);旋涡混合器(HMS-350,金坛市科析仪器有限公司);电泳仪(JY-300C,北京君意东方电泳设备有限公司);凝胶成像仪(GEL DOC XR,北京赛百奥科技有限公司);pH计(PHSJ-5,上海仪电科学仪器有限公司);超低温冰箱(海尔集团公司)。
1.1.3 培养基 Man, Rogasa and Sharpe (MRS)固体培养基[7]:蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖20 g,柠檬酸二铵2 g,硫酸镁0.05 g,磷酸氢二钾2 g,乙酸钠5 g,吐温-80 1 g,硫酸锰0.05 g,碳酸钙1 g,琼脂15 g,溶于1 L去离子水,121 ℃灭菌20 min。
PYG培养基[7]:蛋白胨0.5 g、胰蛋白胨0.5 g、酵母粉1.0 g、盐溶液 4.0 mL(4℃保存)、葡萄糖3 g、吐温80 0.05 mL、琼脂0.6 g、溴甲酚紫0.14 mL,溶于100 mL去离子水,121 ℃灭菌15 min。
1.2 方法
1.2.1 盐穗木青贮饲料营养成分分析及发酵品质测定 青贮中的营养成分按常规方法[8]测定:pH采用四分法取各青贮罐中的样品,用pH计测定样品pH;干物质采用烘干法测定;粗蛋白采用凯氏定氮法测定;中性洗涤纤维和酸性洗涤纤维采用范式纤维分析法测定;氨态氮采用分光光度计法测定;可溶性糖采用硫酸-蒽酮比色法测定[9];用高效液相色谱仪测定乳酸、乙酸、丙酸和丁酸的含量[10]。1.2.2 乳酸菌的分离 在超净工作台中分别称取3罐青贮,每罐10 g盐穗木青贮样品放入90 mL无菌蛋白胨水中,密封,置于摇床上以120 r/min摇动2 h,吸取1 mL上清液加入到9 mL无菌蛋白胨水中,漩涡振荡,以此稀释成10-5、10-6、10-7、10-8等 4个梯度,分别取4个梯度的菌液100 μL涂布于固体 MRS平板培养基上,30 ℃培养48—72 h,根据菌落颜色、大小、光泽、是否有透明圈等挑取单菌落,在MRS固体培养基上划线,恒温培养30 ℃,48—72 h,重复划线分离培养3次,得到纯化的单菌株。用MRS液体培养基富集(30 ℃,24 h),与等体积的甘油混合,封装,-70 ℃保存备用[11]。
1.2.3 测定生长曲线 将乳酸菌菌液以6.0%的接种量接种于MRS液体培养基中,37 ℃恒温培养。每隔2 h测其OD值,波长600 nm,每次测三组平行样,测定时间为0—24 h。测定完成后取3组平行试验所测结果,计算平均值绘制统计图[14]。
1.2.4 产酸速率测定 将乳酸菌菌悬液以3.0%的接种量接种到pH 6.5的MRS液体培养基中,培养温度37 ℃,恒温培养时间 24 h。每隔2 h测定发酵液pH,每次测3组平行样并计算平均值,根据不同发酵时间对应的发酵pH平均值的变化绘制产酸速率曲线[14]。
1.3 乳酸菌的鉴定
1.3.1 生理生化鉴定 将保存备用的菌株活化24 h,进行革兰氏染色,观察菌落的颜色、形态和大小等,参照《伯杰氏细菌鉴定手册》和 《乳酸细菌分类鉴定及实验方法》进行乳酸菌生理生化特性鉴定[7,11-13];葡萄糖发酵产酸产气试验和碳源发酵试验采用细菌微量生化反应进行鉴定;耐盐试验、耐酸试验和温度生长试验参考文献[7,11]进行。1.3.2 提取细菌DNA和PCR扩增 用细菌提取试剂盒提取细菌DNA,并用PCR仪对各个菌株的DNA进行扩增,扩增引物为27F和1495R,所使用扩增反应的体系为50 μL,体系如下:5 μL 10×Buffer,4 μL dNTP Mixture,0.5 μL Taq酶,2 μL DNA模板,上下游引物(10 μmol/L)各1 μL,无菌超纯水补足至50 μL后进行PCR扩增反应。反应条件:95 ℃,3 min;94 ℃,1 min;53 ℃,1 min;72 ℃延伸90 s,30个循环,72 ℃延伸8 min,用1%的琼脂糖凝胶电泳对扩增的PCR产物进行检测。将PCR 产物回收后,连接 p MD-18T 载体并转化 E.coli DH5α,经蓝白斑筛选为阳性克隆后送武汉华大基因科技有限公司测序。
1.3.3 16S rDNA基因序列分析与系统发育树的构建 利用核酸 Blast技术,将所测序列与NCBI 网站的GenBank数据库进行对比,选择与所测序列同源性最高的已知分类地位的菌种。从GenBank数据库中下载已知菌株的16S rDNA基因序列,与所测菌株的16S rDNA序列一起,采用 Clustal 进行比对,并用MEGA5.0绘制系统发育树,确定各菌株分类地位[15]。
2 结果
2.1 盐穗木青贮的营养成分和发酵品质分析
自然发酵盐穗木青贮发酵第150天后的化学组成如表2所示。与青贮前相比,发酵后盐穗木青贮的干物质和可溶性糖含量均降低,粗蛋白、中性洗涤纤维和酸性洗涤纤维含量均呈上升状态。Table 2
表2
表2青贮后盐穗木的化学成分(%,以干物质为基础)
Table 2The chemical composition of Halostachys caspica after ensiling
| 干物质 DM | 粗蛋白 CP | 可溶性糖 WSC | 中性洗涤纤维 NDF | 酸性洗涤纤维 ADF |
|---|---|---|---|---|
| 20.125±0.016 | 20.128±0.011 | 3.706±0.13 | 42.075±0.014 | 14.409±0..020 |
新窗口打开
自然发酵盐穗木青贮发酵品质如表3所示。150 d开罐时盐穗木青贮的pH为4.254—4.268,属于优良品质青贮饲料pH 3.8—4.5的范围。
Table 3
表3
表3盐穗木青贮的发酵品质(mg·mL-1)
Table 3Fermentation characteristics of Halostachys caspica silage
| pH | 氨态氮 NH3-N | 乳酸 LA | 乙酸 AA | 丙酸 PA | 丁酸 BA |
|---|---|---|---|---|---|
| 4.270±0.016 | 3.996±0.01 | 61.103±0.18 | 1.962±0.20 | 5.754±0.22 | - |
新窗口打开
发酵期结束后,青贮中乳酸含量较高,且未检测到丁酸。
2.2 乳酸菌菌株形态特征分析
本试验根据菌落特征筛选出12株符合特征的乳酸菌,编号为H1—H12,挑取单菌落经革兰氏染色后镜检,再根据菌体特征和接触酶反应,初步确定9株菌为乳酸菌,其中杆菌5株,球菌4株,结果如表4所示。Table 4
表4
表4盐穗木青贮中乳酸菌的形态特征
Table 4Morphological characteristics of lactic acid bacteria fertilizer in Halostachys caspica
| 菌株编号Strains number | 菌落特征 Colony characteristics | 菌体特征 Bacterial characteristics | 革兰氏 染色 Gram reaction | 触酶实验 Catalase | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 形状 Shape | 表面状态 Surface condition | 菌落颜色 Colony color | 边缘情况 Edge cases | 质地 Texture | 透明度 Transparency | 形态 Form | 排列 Arrange | |||
| H1 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 球状 Spherality | 单个 Single | 紫色 Purple | 阴性 Feminine |
| H2 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 杆状 Rhabditiform | 成对 Didymous | 紫色 Purple | 阴性 Feminine |
| H3 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 杆状 Rhabditiform | 单个 Single | 紫色 Purple | 阴性 Feminine |
| H5 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 球状 Spherality | 单个 Single | 紫色 Purple | 阴性 Feminine |
| H8 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 杆状 Rhabditiform | 单个 Single | 紫色 Purple | 阴性 Feminine |
| H9 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 杆状 Rhabditiform | 单个 Single | 紫色 Purple | 阴性 Feminine |
| H10 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 杆状 Rhabditiform | 成对 Didymous | 紫色 Purple | 阴性 Feminine |
| H11 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明 Opaque | 球状 Spherality | 链状 Chain | 紫色 Purple | 阴性 Feminine |
| H12 | 圆形 Circular | 光滑 Smooth | 白色 White | 整齐 Neat | 粘稠 Viscous | 不透明Opaque | 球状 Spherality | 单个 Single | 紫色 Purple | 阴性 Feminine |
新窗口打开
2.3 乳酸菌菌株的生理生化特性
产酸速率和生长速率是筛选优良乳酸菌的重要指标,从图1中可见,本试验分离得到的9株乳酸菌的产酸能力较强,在24 h之内菌液的pH值均能降到4.5以下,其中菌株H10和H2产酸能力较强,pH降至3.649和3.676。菌株H1、H11和H12产酸能力最弱,pH降至4.344、4.351和4.348。菌株H3和H8在16 h时pH达到3.8左右后,随着培养时间的延长,菌液pH不再下降且有回升趋势。因此,可看出各菌株产酸能力强弱依次为H10、H2、H9、H8、H3、H5、H1、H12和H11。从图2中可见,在培养2 h后各菌株均进入对数生长期,其中菌株H10、H2和H9生长速率最快且在培养至24 h时没有出现迟滞期。菌株H3和H8在2—16 h生长较快,但在16 h以后就进入了衰亡期。整体上,菌株H1、H5、H11和H12的生长较慢。因此,可以看出各菌株繁殖速率强弱依次为H10、H2、H9、H3、H8、H5、H11、H1和H12。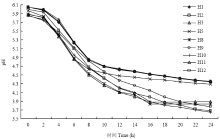 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1乳酸菌菌株产酸速率曲线
-->Fig. 1Acid-producing rate curve of lactic acid bacterium strains
-->
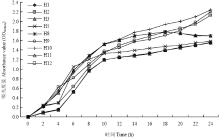 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2乳酸菌菌株生长曲线
-->Fig. 2Growth curve of lactic bacterium strains
-->
9株乳酸菌生理生化指标及碳源利用方式鉴定结果见表5和表6。由表5可看出,产气试验中6株乳酸菌发酵葡萄糖均不产气,为同型发酵乳酸菌,菌株H3和H8发酵葡萄糖产生气体,为异型发酵乳酸菌,9株菌均能发酵葡萄糖并产酸。在5℃菌株H2和H10能良好生长,H1、H5、H11和H12 4株菌生长较弱,菌株H3、H8和H9不能生长;在10、40和45℃,9株乳酸菌生长良好;NaCl浓度为3%和6.5%时9株菌均能生长;在pH3条件下菌株H1、H5、H11和H12株不能生长,其余菌株生长良好;在pH值为4—7时9株菌均生长良好;在pH8时乳酸菌H1、H5、H11和H12不能生长。
Table 5
表5
表5乳酸菌生理生化鉴定
Table 5Physiological and biochemical property of lactic acid bacterium strains
| 鉴定项目 Identification project | H1 | H2 | H3 | H5 | H8 | H9 | H10 | H11 | H12 |
|---|---|---|---|---|---|---|---|---|---|
| 产酸 Acid production | + | + | + | + | + | + | + | + | + |
| 产气 Aerogenesis | - | - | + | - | + | - | + | - | - |
| 发酵类型 Fermentation type | 同型 Same-type fermentation | 同型 Same-type fermentation | 异型 Hetero- type fermentation | 同型 Same-type fermentation | 异型 Hetero- type fermentation | 同型Same-type fermentation | 异型Hetero- type fermentation | 同型Same-type fermentation | 同型Same-type fermentation |
| 5℃ | W | + | - | W | - | - | + | W | W |
| 10℃ | + | + | + | + | + | + | + | + | + |
| 40℃ | + | + | + | + | + | + | + | + | + |
| 45℃ | + | + | + | + | + | + | + | + | + |
| 3%NaCl | + | + | + | + | + | + | + | + | + |
| 6.5%NaCl | + | + | + | + | + | + | + | + | + |
| pH3 | - | + | + | - | + | + | + | - | - |
| pH4 | + | + | + | + | + | + | + | + | + |
| pH5 | + | + | + | + | + | + | + | + | + |
| pH6 | + | + | + | + | + | + | + | + | + |
| pH7 | + | + | + | + | + | + | + | + | + |
| Ph8 | - | + | + | - | + | + | + | - | - |
新窗口打开
Table 6
表6
表6乳酸菌碳源发酵试验
Table 6Carbon source tests for lactic acid bacteria fermentation
| 鉴定项目 Identification project | H1 | H2 | H3 | H5 | H8 | H9 | H10 | H11 | H12 |
|---|---|---|---|---|---|---|---|---|---|
| D-葡萄糖 D-Glucose | + | + | + | + | + | + | + | + | + |
| D-麦芽糖 D-Maltose | + | + | + | + | + | + | - | + | + |
| 乳糖 Lactose | + | + | - | + | - | + | - | + | + |
| D-甘露糖 D-Mannose | + | + | + | + | + | + | + | + | + |
| D-半乳糖 D-Galactose | + | + | + | + | + | + | - | + | + |
| L-山梨糖 L-Yamanashi sugar | - | - | - | - | - | - | - | - | - |
| D-松二糖 D-Turanose | - | - | - | - | - | - | - | - | - |
| D-松三糖 D-Melezitose | + | - | + | + | + | + | + | + | + |
| 纤维二糖 Cellobiose | + | + | + | + | + | + | + | + | + |
| 木糖醇 Xylitol | - | - | - | - | - | - | - | - | - |
| D-棉籽糖 D-Raffinose | - | - | - | - | - | + | - | - | - |
| D-甘露醇 D-Mannitol | + | + | + | + | + | + | + | + | + |
| D-核糖 D- Ribose | - | + | - | - | - | - | - | - | - |
| D-果糖 D-Fructose | + | + | + | + | + | + | + | + | + |
| 蔗糖 Sucrose | + | + | + | + | + | + | + | + | + |
| L-鼠李糖 L-Rhamnose | - | + | - | - | - | - | - | - | - |
| D-木糖 D-Xylose | + | - | + | + | + | - | + | + | + |
| D-山梨醇 D-Sorbitol | + | + | + | + | + | + | + | + | + |
| 苦杏仁苷 Laetrile | + | + | + | + | + | + | + | + | + |
| D-蜜二糖 D-Melibiose | + | + | + | + | + | + | + | + | + |
新窗口打开
由表6可知:9株菌均可利用D-葡萄糖、D-甘露糖、纤维二糖、D-甘露醇、D-果糖、蔗糖、D-山梨醇、苦杏仁苷和D-蜜二糖;H1、H5、H11和H12菌株均不能发酵L-山梨糖、D-松二糖、木糖醇、D-棉籽糖、D-核糖和L-鼠李糖;H3和H8菌株均不能利用乳糖、L-山梨糖、D-松二糖、木糖醇、D-棉籽糖、D-核糖和L-鼠李糖;菌株H2不能发酵L-山梨糖、D-松二糖、D-松三糖、木糖醇、D-棉籽糖和D-木糖;菌株H9不能利用L-山梨糖、D-松二糖、木糖醇、D-核糖、L-鼠李糖和D-木糖;菌株H10不能利用D-麦芽糖、乳糖、D-半乳糖、L-山梨糖、D-松二糖、木糖醇、D-棉籽糖、D-核糖和L-鼠李糖。
2.4 分子生物学鉴定
对筛选出的9株乳酸菌提取基因组DNA,采用细菌通用引物对其16S rDNA序列扩增,片段大小为1 500 bp左右。测序获得的细菌序列通过BLAST与GenBank数据库中已知序列进行比对分析见图3,菌株H1、H11和H12与数据库中的Enterococcus faecium同源性为99%,菌株H5与数据库中Enterococcus lactis的同源性为99%,菌株H3和H8与数据库中的Bacillus cereus同源性为99%,菌株H2与数据库中的Lactobacillus pentosus有100%的同源性,菌株H9与数据库中的Lactobacillus plantarum subsp. plantarum同源性为100%,菌株H10与数据库中的Lactobacillus buchneri有100%的同源性。依据16S rDNA基因序列的同源性分析,确定菌株H1、H11和H12为粪肠球菌(Enterococcus faecium),菌株H5为屎肠球菌(Enterococcus lactis),菌株H3和H8为蜡状芽孢杆菌(Bacillus cereus),菌株H2为戊糖乳杆菌(Lactobacillus pentosus),菌株H9为植物乳杆菌(Lactobacillus plantarum),菌株H10为布氏乳杆菌(Lactobacillus buchneri)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3乳酸菌基于16S rDNA的系统发育树
-->Fig. 3Phylogenetic tree of the lactic bacterium strains according to 16S rDNA sequences
-->
3 讨论
现有研究对于盐穗木青贮后营养成分和发酵品质的报道几乎未见,本研究采集阿克苏地区花果期盐穗木,自然发酵150 d后测定其营养成分和发酵品质。结果显示,青贮后盐穗木干物质和可溶性糖的含量低于青贮前,造成这种结果可能的原因是,青贮饲料在发酵过程中乳酸菌发酵利用原料中的糖类物质,在青贮发酵初期乳酸菌将原料中的可溶性糖转化为乳酸,使乳酸含量急剧增加,降低青贮pH,抑制有害微生物生长,从而减少青贮过程中的营养损失[16,17,18]。与青贮前的原料相比,发酵期结束后盐穗木的中性洗涤纤维和酸性洗涤纤维含量高于原料中的含量,可能是由于在青贮发酵过程中盐穗木茎秆中难降解的水溶性碳水化合物被乳酸菌降解为中性洗涤纤维,导致其含量升高。综上所述,本试验制作的小剂量盐穗木青贮品质良好,可为筛选优质乳酸菌提供原料,并为盐穗木青贮的研究提供基础数据。乳酸菌的快速繁殖和青贮中pH的迅速降低是保证青贮成功的关键,要制作品质良好的青贮,筛选优质的乳酸菌就显得尤为重要。本研究从自制盐穗木青贮中筛选出的粪肠球菌、屎肠球菌、蜡状芽孢杆菌、戊糖乳杆菌、植物乳杆菌和布氏乳杆菌能够利用多种碳源,产酸速率和生长速率较好,尤其是菌株戊糖乳杆菌、植物乳杆菌和布氏乳杆菌在24 h内pH降至3.8以下,并且在pH3条件下生长旺盛,说明这3株菌都具有很强的产酸和耐酸能力,可成为青贮饲料添加乳酸菌的备用菌株。
研究表明同型发酵乳酸菌对饲料具有保鲜作用,异型乳酸菌能有效防止饲料二次发酵,将同型发酵乳酸菌与异型发酵乳酸菌混合使用不仅可以提高青贮的有氧稳定性,还有利于饲料中养分的保存,对青贮饲料长期保存十分有利[19,20]。本试验从青贮150 d的盐穗木样品中分离出6株同型发酵乳酸菌和3株异型发酵乳酸菌,适当组合并优化乳酸菌发酵工艺使其可以更好的用于优质青贮的制作中。
国内外****认可的饲用微生物有很多,包括本试验分离出的粪肠球菌、屎肠球菌、戊糖乳杆菌、植物乳杆菌和布氏乳杆菌。研究表明,在动物饲料中添加一定量的粪肠球菌或屎肠球菌可促进畜禽对碳水化合物的消化,并且不会对瘤胃发酵产生负面影响[21],本研究从盐穗木青贮中分离出4株生长性能良好的肠球菌,期待其能成为对反刍动物有利的微生物添加剂。对于戊糖乳杆菌和植物乳杆菌的发酵条件的研究较为深入,将戊糖乳杆菌或植物乳杆菌与芽孢杆菌制成复合菌液,添加到饲料中可增强动物胃肠的消化能力,提高饲料利用率和产奶量[22,23]。本研究后期将会对此次分离出的植物乳杆菌、戊糖乳杆菌和其他优质菌株进行优化组合,期待其能成为对动物有益的复合菌液。MANGWE[24]等的研究表明,向青贮饲料中添加布氏乳杆菌,可以显著提高饲料的有氧稳定性,增加青贮中单宁的含量,提高了饲料的适口性。本研究分离出的布氏乳杆菌生长速率快、耐酸耐盐性强,在5—45℃可良好生长,这与杜志琳[25]的研究结果基本一致,可将其作为青贮发酵剂。
4 结论
本研究首次测定分析了盐穗木青贮后的营养成分和发酵品质,结果显示将盐穗木制成青贮后其营养成分和发酵品质均处于良好水平。同时从自制自然发酵青贮中分离出9株乳酸菌,经生理生化鉴定和16S rDNA序列分析,最终筛选出3株粪肠球菌,1株屎肠球菌,2株蜡状芽孢杆菌,1株戊糖乳杆菌,1株植物乳杆菌和1株布氏乳杆菌,其中戊糖乳杆菌和布氏乳杆菌可在pH3—8,5—45℃温度范围条件下较好生长。后期将对戊糖乳杆菌、布氏乳杆菌和植物乳杆菌的发酵条件、抑菌能力及在青贮中的使用效果进行进一步研究,使其能更好的应用于青贮饲料的制作中。The authors have declared that no competing interests exist.
