0 引言
【研究意义】葡萄果皮色泽是葡萄果实重要的外观品质性状之一,也是决定葡萄酒质量的关键因素[1],而果皮颜色主要由花色苷含量及组成成分决定[2]。花色苷的生物合成受结构基因和调节基因的控制,是一个非常复杂的过程;而且不同种葡萄乃至同品种群不同品种的着色特性不同[1]。因此,研究花色苷的合成调控机制,对提高葡萄品质以及葡萄酒质量具有重要意义。【前人研究进展】花色苷具有抗氧化、抗肿瘤、抗紫外线和防治冠状动脉心脏疾病等作用[3-5],而且因其具有色泽鲜亮、水溶性好、安全性高等特点,有取代人工色素的趋势[6]。葡萄果实中花色苷的生物合成途径已经形成了比较清晰的轮廓[7-8]。二氢黄酮醇4-还原酶(dihydroflavonol-4-reductase,DFR,EC:1.1.1.219)是花青素合成下游阶段的关键酶,催化二氢黄酮醇或转变成橙色到砖红色的天竺葵素糖苷,或红色的矢车菊素糖苷,或蓝色到紫色的飞燕草素糖苷[9],但是葡萄DFR的立体结构特点,使其不能催化合成天葵色素花色苷[7-8]。因此,DFR决定着花色苷的种类,从而影响果皮的颜色[10-12]。类黄酮葡萄糖基转移酶(UDPG-flavonoid-3-O-glycosyltranferase,UFGT,EC:2.4.1.115)是花色苷(anthocyanins)合成前体酶,催化花色素糖基化过程,形成稳定的花色素-3-单糖苷[13-14]。研究表明,UFGT的活性跟花色苷含量的积累有密切的关系[15-16],如在苹果、红色砂梨、葡萄果实中,UFGT活性与花色苷的含量模式基本一致[16-18]。BOSS等[19]和KOBAYASHI[14,20]研究结果也证实UFGT是花色苷合成的关键酶。VvMYBA1通过调节UFGT的组织特异性和时空特异性的表达从而参与花色苷生物合成的调控[21-22]。【本研究切入点】研究表明,VvMYBA1、VvUFGT、VvDFR与花色苷的合成密切相关,但是对VvMYBA1转录因子与VvUFGT、VvDFR这两个结构基因之间的结合方式以及结合位点尚不明确。【拟解决的关键问题】本文采用Real time PCR、酵母双杂交、酵母单杂交等技术,阐明VvMYBA1、VvUFGT、VvDFR与花色苷合成的相关性以及VvMYBA1编码的蛋白与VvUFGT、VvDFR结合方式和结合位点,为明确葡萄果实花色苷生物合成提供理论依据。1 材料与方法
试验于2016—2017年在山西省园艺实验教学示范中心进行。1.1 植物材料与菌株、试剂
选用2007年的‘赤霞珠’葡萄(Vitis vinifera L. cv. Cabernet Sauvignon)为试材。花后20 d开始,选取长势一致的植株东西两侧的上、中、下三个部位各1穗果穗,3个重复,共30穗;每隔10 d取一次,共取10次样。将采摘的果穗去除有机械伤害、病虫害及发育异常果粒后,液氮速冻,-80℃保存备用。试验相关的所有引物均由北京华大基因合成(表1),大肠杆菌E.coli DH5α化学感受态、高保真酶购于北京全式金生物技术有限公司,酵母表达载体、菌株和酵母培养基购于Clontech公司,质粒提取试剂盒、PCR胶回收试剂盒购于Omega公司,T4 DNA连接酶、克隆载体PMD-18T vector、反转录试剂等其他生物学试剂购于TaKaRa公司。
Table 1
表1
表1引物序列
Table 1Primers sequence
| 基因名 Gene name | 引物序列 Primers sequence | 产物长度(bp) Product length (bp) | 登录号 GenBank |
|---|---|---|---|
| VvUbiquitin | F: 5′-GTGGTATTATTGAGCCATCCTT-3′ | 182 | BN000705 |
| R: 5′-AACCTCCAATCCAGTTATCTAC-3′ | |||
| VvMYBA1 | F: 5'-TAGTCACCACTTCAAAAAGG-3' | 105 | AB097923.1 |
| R: 5'-GAATGTGTTTGGGGTTTATG-3' | |||
| VvDFR | F: 5′-GCATGGAAGTATGCCAAGGAAA-3′ | 118 | X75964.1 |
| R: 5′-TCGGGGAAAGAGCAGTTATGAG-3′ | |||
| VvUFGT | F: 5'-AGGATGTTTTGGAGATTGGAGTG-3' | 120 | AF000372 |
| R: 5'-TCAGATTTTCCCTCAGTTTCTTCC-3' | |||
| VvMYBA1 | F: 5'-CCGGAATTCATGGAGAGCTTAGGAGTT-3' | 753 | AB097923.1 |
| R1: 5'-ACGCGTCGACTCAGATCAAGTGATTTACTTG-3' | |||
| R2: 5'- CGAGCTCTCAGATCAAGTGATTTACTTG-3' | |||
| VvDFR | F: 5'-CCGGAATTCATGGGTTCACAAAGT-3' | 1014 | X75964.1 |
| R: 5'- CGAGCTCCTAGGTCTTGCCAT-3' | |||
| VvUFGT | F: 5'-CCGGAATTCATGTCTCAAACCAAC-3' | 1371 | X75968.1 |
| R: 5'-CGGGATCCCTAGTAGACATCCTTTGG-3' |
新窗口打开
1.2 总RNA提取及实时荧光定量PCR分析
采用改良的CTAB法[23]提取葡萄总RNA,用1%的琼脂糖检测质量及完整性后按照TaKaRa反转录合成试剂盒说明书,500 ng的RNA被用来反转录,再将反转录获得的cDNA稀释至100 ng∙µL-1待用。以葡萄持家基因(VvUbiquitinl,登录号:BN000705)为内参,使用premier5.0设计引物(表1),利用real-time PCR仪分析葡萄果实发育过程中VvMYBA1(登录号:AB097923.1)、VvDFR(登录号:X75964.1)和VvUFGT(登录号:X75968.1)的表达模式。反应体系为20 µL,其中含有SYBR Premix Ex Taq(2x)10 µL,cDNA 1 µL,上、下游引物各0.8 µL(0.4 µmol∙L-1),ROX 0.4 µL,ddH2O 7 µL。反应条件为预变性95℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,40个循环。设置在72℃ 1 min处收集荧光信号,试验重复3次。1.3 花色苷含量的测定
花色苷提取参照田莉[24]的方法,分析方法参照刘晓静等[25]的方法,将在520和540 nm波长下吸光值的差作为花色苷含量,差值按每0.01为一个单位(U)设定。1.4 酵母载体构建
根据VvMYBA1、VvDFR和VvUFGT核苷酸序列和pGBKT7、pGADT7多克隆酶切位点设计引物(表1)。以实验室前期获得的含‘赤霞珠’葡萄VvMYBA1、VvDFR、VvUFGT CDS序列的克隆质粒为模版进行PCR扩增,1%琼脂糖凝胶电泳分析及测序验证PCR产物。将获得的阳性克隆扩繁提取质粒,用相应的内切酶将获得的阳性克隆载体和pGBKT7、pGADT7进行双酶切并回收,用T4 DNA连接酶16℃条件下过夜连接,获得重组质粒pGBKT7-MYBA1、pGBKT7-DFR、pGBKT7-UFGT、pGADT7-MYBA1,然后转化Trans-5α化学感受态细胞。经菌液PCR和双酶切验证正确的菌液送往华大科技公司测序。从葡萄基因组数据库(http://www.genoscope.cns. fr/externe/GenomeBrowser/Vitis/)中获得UFGT、DFR启动子序列,用启动子分析软件PLANTCARE预测启动子上的作用元件(http://bioinformatics.psb.ugent. be/webtools/plantcare/html/),获得与MYB结合的MBS顺式作用元件,将MBS顺式作用元件串联获得诱饵元件序列,MBS顺式作用元件突变为阴性对照(UFGT-MBS:TAGGGCAACATTGAGACAACTGC AGGTTAAGGTCTGTTTGATAACTGTTTTATAAAACAGTTATAGATGACAACCCCCATGCAGTTGCCACTCTCACAAC;UFGT-Mutant:TAGGGCAACATTG AGAACCATGCAGGTTAAGGTCTGTTTGAATTCCCTTTTATAAAAGGGAATTAGATGACAACCCCCATGCCGAACCCACTCTCACAAC;DFR-MBS:GACC GTAGCTCACCGTGGCAACTGGCCGATGGTGGCTCGTGGGTTCAGTTGTCACTTTTGACACACCACCAACAGTTGCCCGTCTAAACG;DFR-Mutant:GACCG TAGCTCACCGTGGACCATGGCCGATGGTGGCTCGTGGGTTCCGAACTCACTTTTGACACACCACCAACCGAACCCCGTCTAAACG),由上海生物工程有限公司合成重组诱饵载体pMBS(UFGT)-AbAi、p[Mutant(UFGT)]-AbAi(阴性对照)、pMBS(DFR)-AbAi、p[Mutant(DFR)]-AbAi(阴性对照)。
1.5 转录激活功能分析及毒性检测
选取验证正确的重组质粒pGBKT7-MYBA1、pGBKT7-DFR、pGBKT7-UFGT,采用PEG/LiAC法将pGBKT7-MYBA1、pGBKT7-DFR、pGBKT7-UFGT质粒分别转入酵母感受态AH109细胞中,以转入pGBKT7空质粒为阴性对照,pGBKT7-P53为阳性对照,分别均匀涂于SD/-Trp单缺陷平板上,结合菌液PCR筛选转化子,再涂于SD/-Trp/X-α-Gal显色平板上,30℃倒置培养2—4 d,观察颜色变化。1.6 酵母双杂交
参照Clotech产品说明书,采用PEG/LiAC法将pGBKT7-DFR/pGADT7-MYBA1、pGBKT7-UFGT/ pGADT7-MYBA1、pGBKT7-T/pGBKT7-53、pGBKT7- DFR/pGADT7、pGBKT7-UFGT/pGADT7质粒分别共转入酵母感受态AH109细胞中,1/2均匀涂于SD/-Trp-leu二缺性平板上,1/2均匀涂于SD/-Trp-leu- His-Ade四缺性平板上,30℃倒置培养2—4 d,待菌落长出后转入含有X-α-Gal显色四缺平板上作进一步验证。1.7 酵母单杂交
将用BstB I酶线性化后的pMBS(试验)-AbAi [pMBS(UFGT)-AbAi、pMBS(DFR)-AbAi]、pMBS(阴)-AbAi{p[Mutant(UFGT)]-AbAi、p[Mutant(DFR)]-AbAi}、p53-AbAi质粒采用PEG/LiAC法转入酵母菌株Y1H-gold感受态细胞中,在转化了Y1H-gold [pMBS(试验)-AbAi]的平板分别挑取一株状态较好菌落于10 µL ddH2O中混匀,取1 µL菌液滴加在SD/-Ura、SD/-Ura/50 mmol∙L-1 Aba、SD/-Ura/100 mmol∙L-1 Aba、SD/-Ura/200 mmol∙L-1 Aba平板上,30℃倒置培养3—5 d,观察生长状态。观察发现Y1H-gold [pMBS(试验)-AbAi]在SD/-Ura/100 mmol∙L-1 Aba平板上不再生长,表明可在此条件下展开下步验证试验。从上述平板上分别挑取Y1H-gold [pMBS(试验)-AbAi]、Y1H-gold [pMBS(阴)-AbAi]、Y1H-gold[p53- AbAi]单菌落(直径2—3 mm),分别于YPDA培养基中扩繁,并获得其感受态细胞,再将pGADT7- MYBA1、pGADT7-MYBA1、pGAD-Rec-p53质粒分别转化到上述感受态细胞中。将转化后菌液各取100 µL分别涂布SD/-Ura/-Leu/100mM Aba,30℃倒置培养3—5 d,观察生长情况。
2 结果
2.1 葡萄果实发育过程中VvMYBA1、VvUFGT、VvDFR表达规律
葡萄果实发育过程中,VvMYBA1、VvUFGT、VvDFR的转录表达规律如图1所示。在整个果实发育过程中,VvMYBA1、VvUFGT、VvDFR的表达量整体呈现先上升后下降的趋势,均在转色期(花后60—80 d)表达量较高。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1葡萄果实发育过程中MYBA1、UFGT、DFR表达模式
-->Fig. 1The expression pattern of MYBA1, UFGT, DFR during development of grape berry
-->
2.2 葡萄果实发育过程中花色苷积累规律
花色苷在赤霞珠葡萄果实发育过程中积累表现为幼果期无积累,转色后快速积累,在花后80 d达到最大值,之后略微下降,但趋于平稳(图2)。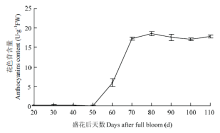 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2葡萄果实发育过程中花色苷含量的变化
-->Fig. 2The content of anthocyanins during development of grape berry
-->
2.3 相关性分析
VvMYBA1、VvUFGT、VvDFR的表达水平与花色苷的积累量呈显著正相关,且VvUFGT、VvDFR的表达与VvMYBA1的表达呈显著正相关(表2)。表明‘赤霞珠’果实发育过程中,VvUFGT、VvDFR表达与VvMYBA1表达密切相关。VvMYBA1异位表达导致红色素积累和UFGT表达上调[26],VvMYBA1可能对VvUFGT、VvDFR表达具有调控作用;而且花色苷的积累是在VvMYBA1、VvUFGT、VvDFR调控下完成。Table 2
表2
表2相关性分析
Table 2Correlation analysis
| MYBA1表达量 Expression of MYBA1 | 花色苷积累量 Content of anthocyanins | |
|---|---|---|
| MYBA1表达量 Expression of MYBA1 | 1 | 0.737* |
| UFGT表达量 Expression of UFGT | 0.736* | 0.661* |
| DFR表达量 Expression of DFR | 0.651* | 0635* |
新窗口打开
2.4 VvMYBA1、VvUFGT、VvDFR转录激活功能分析以及毒性检测
分别将pGBKT7-MYBA1、pGBKT7-DFR、pGBKT7-UFGT、pGBKT7-P53(阳性对照)、pGBKT7 (阴性对照)转入酵母感受态细胞AH109中,将其分别涂于SD/-Trp单缺陷性平板上均能生长且长势基本一致,说明所有质粒成功转入酵母菌株AH109中,且VvMYBA1、VvUFGT、VvDFR无毒性。将含有上述质粒的转化子涂于SD/-Trp/X-α-Gal显色平板上进行显色反应,结果表明,含阳性对照和pGBKT7-MYBA1的转化子均能显现明显的蓝色,阴性对照和pGBKT7-DFR、pGBKT7-UFGT的转化子未显蓝色,表明MYBA1编码的蛋白具有转录激活功能,UFGT、DFR编码的蛋白不具有转录激活功能(图3)。2.5 酵母双杂交分析
以pGADT7-MYBA1分别与pGBKT7-DFR、pGBKT7-UFGT共转化入酵母AH109感受态细胞中为试验组,pGBKT7-T与pGBKT7-53共转化入酵母中为阳性对照,pGADT7分别与pGBKT7-DFR、pGBKT7-UFGT共转化入酵母菌中为阴性对照,并将其涂于SD/-Trp-leu二缺性平板和SD/-Trp-leu- His-Ade四缺性平板上,在二缺平板上试验组和对照组菌落长势良好(图4-A),说明质粒均成功转入酵母菌中;而在四缺培养基上,只有阳性对照才能生长,试验组和阴性对照均不能生长,说明在酵母水平中,MYBA1蛋白与UFGT、DFR蛋白均不互作(图4-B)。2.6 酵母单杂交分析
将VvUFGT、VvDFR启动子的MBS元件连接到pAbAi质粒上为pMBS(UFGT)-AbAi、pMBS(DFR)- AbAi重组质粒,以pGADT7-MYBA1分别与pMBS (UFGT)-AbAi、pMBS(DFR)-AbAi共转化入酵母菌Y1Hgold细胞中作为试验组;将pGADT7-MYBA1分别与p[Mutant(UFGT)]-AbAi、p[Mutant(DFR)]-AbAi共转化入Y1Hgold酵母菌中为阴性对照;将p53-AbAi与pGAD-Rec-p53共转化入酵母菌中为阳性对照。分别将试验组、阳性对照和阴性对照涂于SD/-Ura/- Leu/100 mmol·L-1 Aba固体平板上,结果显示,试验组与阳性对照均能在固体平板上生长,而阴性对照不能生长,说明VvMYBA1编码的蛋白能够特异性结合VvUFGT、VvDFR启动子序列(图5)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3转录激活活性分析
-->Fig. 3Transcriptional activation activity analysis
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4酵母双杂交结果
-->Fig. 4Result of yeast two-hybrid
-->
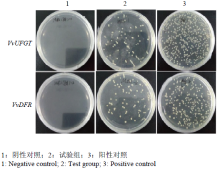 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5酵母单杂交结果
-->Fig. 5Results of yeast one-hybrid
-->
3 讨论
花色苷生物合成相关的基因分为结构基因和调节基因两类。其中,结构基因直接编码花青素/苷生物合成过程中生物合成酶类(如CHS、CHI、F3H、DFR、ANS、ANR、UFGT等);调节基因则通过调控花青素/苷生物合成结构基因的表达强度和模式,调控花青素/苷的时空积累(如MYB、MYC、WKRY、WD40等)[27]。RINALDO等[28]的研究表明VvMYBA调节葡萄花青素酰基转移酶的表达,使葡萄果皮中花青素酰基化水平提高。‘巨峰’葡萄的UFGT cDNA进入体细胞胚中,可以引发红紫色斑点,表明UFGT在花青素生物合成中起关键作用[29-30]。通过对苹果、葡萄等研究表明,UFGT表达强度以及酶活性与花色苷积累量有关[15-16,19,31-32]。DFR不仅决定着花青素/苷的种类,而且还是花青素/苷合成的入口酶[7-8,10-12]。王海竹等[33]研究发现,DFR和MYB在紫萼长茄果萼中表达明显高于绿萼长茄,推测DFR和MYB参与花色苷的生物合成。NAKATSUKA[34]、TAKOS等[35]指出,MdMYB10经过上调DFR的基因表达从而提高苹果中花色素的含量,而MdMYB1可以同时调控UFGT和DFR这两类结构基因。在葡萄中,VlMYBA也被发现可以诱导UFGT表达[29-30],且VvMYBA1在白色葡萄中不表达,只在有色葡萄品种的果皮中表达[36]。本文通过实时荧光定量和相关性分析研究发现,在‘赤霞珠’葡萄果实中,VvMYBA1、VvDFR、VvUFGT表达量与花色苷积累量呈正相关,且VvMYBA1转录因子与VvDFR、VvUFGT结构基因表达强度之间呈正相关,这一结果与前人研究结果基本一致[19,21-22,29-31]。在转录水平上,植物常通过转录因子来调控目的基因的表达,从而调控其次生代谢、应答激素和环境胁迫等[37],且大多数MYB转录因子具有转录激活功能[38]。酵母杂交试验表明,转有重组质粒pGBKT7-MYBA1的酵母转化子可以在SD/-Trp/X-α- Gal显色平板上呈现明显的蓝色,因此,VvMYBA1具有明显的转录激活功能。而VvDFR、VvUFGT在SD/-Trp/X-α-Gal显色平板上不能够呈现蓝色,且长势与对照基本一致,说明pGBKT7-DFR、pGBKT7- UFGT无毒性且不能自激活,因此可以作为酵母双杂交的诱饵载体。
植物中MYB家族转录因子与MYB顺式作用元件的结合已有广泛研究,如AtMYB2特异性结合MYB核心序列T/GAACTG/A[39],CpMYB10可以识别结合TAACTG[40],则EgMYB1特异性识别GGTAGGT[41]。前人研究结果可知,VvMYBA1通过调节VvDFR、VvUFGT的时空表达[19,21-22,29-31],笔者前期研究结果同样也证实了这一点(数据待发表),但VvMYBA1与VvDFR、VvUFGT的结合位点,特别是其调控机理尚未明确。UFGT和DFR启动子分析结果显示有多种与生物胁迫和非生物胁迫响应相关的顺式作用元件,其中MBS顺式作用元件在DFR启动子中有两处(+62,-796),且均为CAACTG;而UFGT启动子中有4处MBS位点(+54,+443,-459,-1411),CAACTG和TAACTG顺式元件各有两处,将MBS顺式作用元件串联作为酵母单杂交的诱饵载体,CAACTG核心序列在DFR诱饵载体中重复3次。通过酵母双杂和酵母单杂试验得出,VvMYBA1编码的蛋白与VvDFR、VvUFGT编码的蛋白不具有相互作用,但能特异结合VvDFR启动子的CAACTG顺式作用元件和VvUFGT启动子的CAACTG或TAACTG顺式作用元件。根据SD/-Ura/-Leu/100 mmol∙L-1 Aba固体平板上的长势,可以得出VvMYBA1编码的蛋白与VvDFR启动子作用强度高于VvUFGT启动子。因此,VvMYBA1编码的蛋白可能只识别结合CAACTG顺式作用元件,而不能够识别结合TAACTG顺式作用元件。
4 结论
VvMYBA1、VvUFGT、VvDFR表达模式为先上升后下降的趋势,花色苷积累表现为转色期(花后60 d)急聚增长,之后趋于平稳,且VvMYBA1、VvUFGT、VvDFR表达量与花色苷积累量为显著正相关,VvUFGT、VvDFR表达量与VvMYBA1表达量为显著正相关。VvMYBA1具有转录激活功能,编码的蛋白不能与VvUFGT、VvDFR蛋白相互作用,但能与VvUFGT、VvDFR的启动子结合,表明VvMYBA1可能通过激活VvUFGT、VvDFR的启动子来调控其表达,从而调控葡萄果实发育过程中花色苷的积累。The authors have declared that no competing interests exist.
