0 引言
【研究意义】香气是葡萄酒感官评价的重要指标,也是影响葡萄酒感官质量的重要因素。源于葡萄果实自身风味前体物质的品种香气是形成葡萄酒香气的重要特征[1],这些前体物质通常以非挥发性香气糖苷的形式存在,在葡萄酒酿造过程中主要通过酵母菌产生的糖苷酶酶解释放出游离态成分,表现出香气特征[2]。同时酿造过程中由酵母活动形成的发酵香气也是构成葡萄酒香气的重要方面[3]。‘爱格丽’(Ecolly)是西北农林科技大学葡萄酒学院采用“欧亚种内轮回选择法”选育的一个丰产、抗病的酿酒葡萄新品种。在季风气候的陕西关中地区,葡萄成熟期雨热同季,导致‘爱格丽’常常在达到浆果技术成熟度之前采收,所酿葡萄酒缺乏典型的花果香气。因此,研究高产糖苷酶的优选酵母混合发酵对爱格丽干白葡萄酒的增香酿造具有指导意义。【前人研究进展】近年来,有研究发现,相比酿酒酵母,某些非酿酒酵母可产生较多的利于水解香气前体物质的糖苷酶,并且其在酿酒环境下有更强的稳定性[4],同时,非酿酒酵母的某些代谢产物对葡萄酒的风味与香气具有重要作用[5]。然而,由于非酿酒酵母发酵过程中往往会给葡萄酒带来一些不利的发酵副产物[6],所以非酿酒酵母与酿酒酵母的混合发酵常被用来改善葡萄酒的风味。目前为止,已有许多优选非酿酒酵母菌株应用于混合发酵,如葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)[7]、戴尔有孢圆酵母(Torulaspora delbrueckii)[8]、东方伊萨酵母(Issatchenkia orientalis)[9]、美极梅奇酵母(Metschnikowia pulcherrima)[10]等。然而,不同非酿酒酵母菌株与酿酒酵母混合发酵产生的葡萄酒香气成分以及感官质量有差异,例如,戴尔有孢圆酵母与酿酒酵母混合发酵提高了葡萄酒中某些酯类的含量,增强了葡萄酒的果香特征[8];美极梅奇酵母与酿酒酵母混合发酵可促进葡萄酒中中链脂肪酸、苯乙醇、乙酸异戊酯等成分的生成[10]。研究表明,优选非酿酒酵母菌株与酿酒酵母的接种策略,尤其是接种比例显著影响酿酒酵母的生长,并影响葡萄酒的感官质量[11]。例如,DOMIZIO等[12]研究发现同时接种处理的接种比例为1﹕1时,异常毕赤酵母对酿酒酵母的生长并无影响,而接种比例达到100﹕1和10 000﹕1时,酿酒酵母的生长受到严重抑制。KIM等[9]利用东方伊萨酵母与酿酒酵母按不同比例同时接种发酵,结果发现接种比例为1﹕1时酿造的葡萄酒感官质量的得分最高。之前有研究认为,毕赤酵母属(Pichia)菌株具有高产乙酸乙酯的特性,同时是乙酸异丁酯和乙酸异戊酯的第二大生产者[12],并且添加异常毕赤酵母(P. anomala)的胞外酶可增加葡萄酒中挥发性化合物的含量[4]。MINGORANCE-CAZORLA[13]研究发现,发酵毕赤酵母(P. fermentans)菌株产酒精率较低,但它能促进酒中挥发性化合物的产生,增强酒的香气特征。已有研究报道发酵毕赤酵母与酿酒酵母顺序接种发酵提高了葡萄酒中一些高级醇、酯类和甘油的含量[14]。目前,发酵毕赤酵母与酿酒酵母不同比例接种发酵的香气研究报道还不充分。【本研究切入点】笔者实验室前期在宜宾白酒酒窖中筛选到一株高产糖苷酶的发酵毕赤酵母(P. fermentans)菌株H5Y-28,而目前对于中国本土非酿酒酵母与酿酒酵母混合发酵的增香酿造研究还较少,因此,利用这株中国本土优选菌株与酿酒酵母混合发酵,研究该酵母菌株增香酿造的应用潜力。【拟解决的关键问题】研究优选发酵毕赤酵母菌株H5Y-28与酿酒酵母不同比例接种发酵过程中的菌体生长动力学,结合该菌株的胞外酶处理,分析不同接种比例对‘爱格丽’干白葡萄酒的香气成分与香气特征的影响,获得优选菌株与酿酒酵母混合发酵增香酿造‘爱格丽’干白葡萄酒的最佳接种比例,为干白葡萄酒增香酿造工艺技术的研发提供理论依据。1 材料与方法
试验于2014年在西北农林科技大学葡萄酒学院工艺实验室进行。1.1 葡萄原料
‘爱格丽’(Ecolly)葡萄,由西北农林科技大学葡萄酒学院选育。酿酒原料采自陕西杨凌农业示范区官村葡萄基地,约200 kg,还原糖含量176 g∙L-1,含酸量3.9 g∙L-1(酒石酸计),卫生状况良好。1.2 菌种与培养基
酿酒酵母(S. cerevisiae):Actiflore F5酿酒酵母活性干粉,购于法国Laffort公司。发酵毕赤酵母(P. fermentans):菌株H5Y-28,筛选于中国四川宜宾白酒酒窖,根据该菌株在WL鉴别培养基上的菌落形态和显微细胞形态以及经26S rDNA D1/D2区域序列鉴定,确定其为发酵毕赤酵母(序列相似度99%)。
模拟葡萄汁培养基:培养基配制参照文献[15],略有改动。100 g∙L-1葡萄糖,100 g∙L-1果糖,0.2 g·L-1柠檬酸,3 g∙L-1苹果酸,2.5 g∙L-1酒石酸氢钾,1.1 g∙L-1 K2HPO4,1.5 g∙L-1 MgSO4·7H2O,0.4 g∙L-1 CaCl2·2H2O,0.04 g∙L-1 H3BO3,10 g∙L-1酵母浸粉,调节pH至3.5。
其他培养基,如YPD培养基[16]、发酵培养基[7]。所有培养基配制后均需121℃灭菌20 min。
1.3 仪器与试剂
DVB/CAR/PDMS萃取纤维(50/30 μm film thickness,2 cm stableflex,Supelco,Bellefonte PA,USA),配有57330-U联用手柄;TRACE 1310气相色谱联用ISQ LT单四极质谱检测仪(Thermo SCITNTIFIC,USA),色谱柱为DB-WAX毛细管柱(60 m×0.25 mm×0.25 µm,Alilent J&W,USA)分析纯化学试剂:葡萄糖、蛋白胨、酵母浸粉、琼脂、亚硫酸溶液(含SO2 6%)、Na2CO3、Na2HPO4、柠檬酸、NH4NO3、KH2PO4、MgSO4·7H2O、吐温80、醋酸钠购于天津化学试剂公司。
色谱纯化学标准品(纯度≥97%):乙酸乙酯、乙酸异戊酯、丁酸乙酯、己酸乙酯、辛酸乙酯、1-己醇、异丁醇、1-丁醇、异戊醇、1-辛醇、里哪醇、异丁酸、2, 3-丁二醇、癸酸乙酯、丁二酸二乙酯、β-大马酮、橙花叔醇、月桂酸乙酯、己酸、1-癸醇、2-辛醇、苯甲醇、苯乙醇和辛酸等色谱纯标品购于北京Sigma-Aldrich公司。
1.4 试验方法
1.4.1 菌体生长动力学模型建立 模拟汁发酵:发酵毕赤酵母H5Y-28经YPD培养基扩增培养3 d,与活化的酿酒酵母按照不同菌数比10﹕1、4﹕1、1﹕1、1﹕4、1﹕10等比例同时接种于装有600 mL灭菌模拟葡萄汁的1 L锥形瓶中,单位接种量为1×106 cells/mL,文中分别用C10:1、C4:1、C1:1、C1:4、C1:10表示以上不同比例接种发酵的酒样。试验以酿酒酵母单一发酵作为对照(CK),每一处理重复2次。接种后于25℃恒温培养箱静置发酵,并从接种当天起,每隔24 h取样,根据菌落形态的差异(图1:H5Y-28菌落呈米白色,表面粗糙,有褶皱,不透明;F5菌落呈白色,表面光滑,中心凸起,有光泽),采用平板菌落计数法记录WL平板上不同酵母的菌落数,用血细胞计数板计数法记录酵母总菌数[17],建立菌体生长动力学模型。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1优选发酵毕赤酵母菌株H5Y-28(a)和酿酒酵母F5(b)在WL培养基上的菌落形态
-->Fig. 1Colony morphology of selected strain Pichia fermentans H5Y-28 (a) and S. cerevisiae F5 (b) on WL medium
-->
模型建立[16]:菌体生长使用Logistic方程进行曲线拟合,方程如下,其中y反映酵母总菌数,以Lg(cells/mL)表示;x为发酵时间(hours),a为发酵过程中酵母最大生物量,b、k为模型系数。
$y=\frac{a}{1+b\text{*}\exp (\text{-}k\text{*}x)}$
1.4.2 优选菌株胞外酶提取液的制备 优选菌株胞外酶提取制备参考HU等[18]的方法,有所改动。将-20℃甘油保藏的优选菌株H5Y-28接入5 mL的YPD培养基中,于28℃恒温培养箱中培养72 h活化,然后以5%的接种量接入50 mL的YPD培养基中,在28℃、180 r/min摇床中培养48 h,之后再以10%接种量接入100 mL发酵培养基,摇床(28℃、150 r/min)培养72 h后取适量发酵液,离心(4℃、8 000 r/min、15 min)并取上清液,将上清液经孔径为0.45 μm的过滤膜滤去上清液中的细胞碎片等大分子物质,即可得到优选酵母菌株的胞外酶提取液。该提取液应用于葡萄酒酿造试验。
胞外酶提取液的糖苷酶活性[7]:以β-葡萄糖苷酶活力表示,采用p-NPG法测定。将200 μL胞外酶提取液、750 μL柠檬酸-磷酸缓冲液(pH 5.0)、250 μL 1 mmol∙L-1的对硝基苯-β-葡萄糖苷(p-NPG)溶液混匀,在40℃水浴条件下反应30 min,然后加入1 mL 1 mol∙L-1的Na2CO3终止反应,并用分光光度计测400 nm处的吸光值,根据标准曲线计算出优选菌株胞外酶提取液的β-葡萄糖苷酶活力为0.106 U∙mL-1。糖苷酶酶活力单位(U)定义为:40℃下1 min内催化生成1 μmol对硝基苯酚所要的酶量。
1.4.3 葡萄酒酿造试验 发酵处理:按照上述模拟汁发酵的接种比例对‘爱格丽’葡萄汁进行混合接种发酵,试验以酿酒酵母单一发酵和添加优选菌株胞外酶提取液处理的酿酒酵母纯发酵为对照,每一酿造处理重复2次。
酿造工艺:‘爱格丽’葡萄经除梗破碎后分装至20 L玻璃罐,同时加入60 mg∙L-1的SO2,在4℃条件下浸渍24 h后压榨取汁,转入10 L玻璃罐,加入1.0 g∙L-1膨润土下胶澄清,24 h后分离澄清汁接种酵母菌(胞外酶处理需要同时添加0.5 U∙L-1优选菌株胞外酶提取液)启动发酵,在发酵过程中实时监测比重和温度,控制发酵温度16—20℃,并在发酵旺盛期添加蔗糖使最终酒度达到(11±0.5)% vol,添加酒石酸调整酸度到6.0 g∙L-1。当含糖量低于2.0 g∙L-1时,添加60 mg∙L-1的SO2终止发酵,并将葡萄酒转入干净卫生的5 L玻璃罐中满罐、密封,进行正常的澄清、稳定。最后,装瓶贮藏,直至次年4月采样分析。
1.4.4 香气特征的感官分析 葡萄酒香气特征采用感官量化分析法进行感官评价,每一供试酒样重复分析2次,使用最终量化强度值MF(%)对某一香气特征进行描述,具体方法参考TAO等[19]的方法进行设计。品评小组由30名葡萄酒专业的学生组成,经由54香气系列的“酒鼻子”(Le Nez du Vin®,法国)闻香训练6—8周,直至品评小组成员对葡萄酒香气特征辨别定性的正确率大于95%。在分析过程中,将所有供试酒样随机编号,采用随机区组设计,常温20℃条件下,黑色郁金香杯盛放酒样30 mL,每个成员需用葡萄酒标准香气里的5—6个特征词汇描述样品香气特征,并用“五点标度法”(“1”—弱;“2”—较弱;“3”—中等;“4”—较强;“5”—强)对每一香气特征进行量化。最终量化强度值MF(%)由品尝小组对某一香气特征词汇的使用频率F(%)和强度平均值I(%)表示,计算公式:MF(%)=$\sqrt{\text{F}(\%)\text{I}(\%)}$。
1.4.5 香气成分的仪器分析 SPME样品处理:取8 mL葡萄酒样和内标溶液(2-辛醇为内标物,浓度为0.4 mg∙L-1)置于15 mL装有磁力搅拌子的顶空瓶中,加入1.0 g的NaCl,启动搅拌子,在4℃水浴中平衡15 min,然后插入萃取纤维,40℃下搅拌吸附30 min,立即将萃取头在GC进样口解吸5 min后立即手动进样,用于GC-MS分析。
GC-MS分析条件:无分流进样,离子源温度250℃,连接杆温度250℃,进样口温度250℃,电子源电压70 eV,灯丝流量0.2 mA,检测器电压350 V。载气:He(纯度99.999%),流速1 mL∙min-1。柱升温程序:以3℃∙min-1从40℃升至130℃,再以4℃∙min-1从130℃升至250℃,保持8 min。质谱为电离轰击(EI)模式,全扫描质谱范围25—350 amu,扫描频率0.2次/s。
定性定量方法:采用标准品保留时间比对、Wiley 275.L谱库查询和文献保留指数比对法进行化合物定性。采用内标-标准曲线法定量,2-辛醇为内标物,具体定量方法参考TAO等[20]的方法。
1.5 数据处理方法
数据分析采用方差分析(ANOVA)进行不同酒样中挥发性香气物质间的显著性检测,采用主成分分析(Principal component analysis,PCA)进行不同处理供试酒样中香气成分分布规律的研究,数据处理采用SPSS 19. 0(SPSS Inc.,Chicago,IL,USA)软件。使用Origin 8.5软件进行酵母菌体生长动力学的Logistic模型建立。2 结果
2.1 菌体生长动力学
本研究建立了发酵毕赤酵母和酿酒酵母以不同比例接种的混合发酵过程中酵母菌体的生长动力学模型,如图2。菌体生长动力学模型拟合的相关系数R2在0.928—0.989,拟合效果理想。不同模拟发酵体系中酵母的生长均呈现典型的单“S”型曲线,自接种之后的24 h内,酵母菌体开始快速繁殖,随后生长缓慢,分别在36—48 h进入平衡期,菌数达到最大值108 cells/mL,直至发酵结束。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2模拟体系酒精发酵过程中酵母总量模型建立及动力学参数
图中C10:1、C4:1、C1:1、C1:4、C1:10表示发酵毕赤酵母(H5Y-28)与酿酒酵母(F5)分别以10﹕1、4﹕1、1﹕1、1﹕4、1﹕10的比例同时接种发酵,CK表示酿酒酵母纯发酵。下同
-->Fig. 2Model diagram and kinetic parameters of yeast biomass during alcohol fermentation in synthetic must medium
C10:1, C4:1, C1:1, C1:4, C1:10: P. fermentans (H5Y-28) and S. cerevisiae (F5) inoculated simultaneously, and P. fermentans/S. cerevisiae ratios are 10:1, 4:1, 1:1, 1:4, 1:10, respectively, CK: S. cerevisiae inoculated alone. The same as below
-->
图3展示了不同比例接种发酵过程中不同酵母菌株的生长变化趋势,结果显示,发酵毕赤酵母H5Y-28在发酵过程中的存活数量和存在时间随着接种比例的增加而增加,而酿酒酵母F5的生长也受到不同程度的抑制。如图所示,在接种比例为4﹕1、10﹕1的发酵体系中,H5Y-28的存活时间较长,存活数量较多,并且明显抑制了酿酒酵母F5的生长,使其达到最大菌数的时间推迟至第3—4天,同时最大菌数(0.9×108 CFU/mL)也明显低于酿酒酵母纯发酵体系中的酵母数量(1.43×108 CFU/mL),而其他接种比例的发酵体系中,发酵毕赤酵母H5Y-28几乎不影响酿酒酵母的生长数量。总体来看,发酵毕赤H5Y-28的存在并不改变酿酒酵母的生长优势,在发酵旺盛期和后期(第3—10天),酿酒酵母占主导地位,控制整个体系酒精发酵的正常进行。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3模拟体系酒精发酵过程中不同酵母菌生长变化趋势
-->Fig. 3Evolution of different yeasts during alcohol fermentation in synthetic must medium
-->
2.2 香气特征分析
图4显示供试酒样中6种香气特征的MF值较高,混合发酵和发酵毕赤酵母胞外酶处理显著提高了‘爱格丽’干白葡萄酒的果香和花香。与酿酒酵母纯发酵酒样相比,混合发酵和胞外酶处理的酒样中,热带水果香气特征极其显著(P<0.01),胞外酶处理所得酒样中热带水果香气特征的MF值可达到80%,其次是处理C4:1酒样的MF值在70%以上,而处理C1:4的MF值最低(约55%),其他处理所得酒样中热带水果香气特征的MF值较为接近,在65%左右。柑橘类和花香类香气特征在P<0.05水平上显著,处理C1:1酒样中柑橘类香气特征的MF值最高(约50%),而处理C4:1酒样中花香类香气特征的MF值最高(55%以上)。对于酸果类香气特征而言,处理C10:1酒样的MF值最高,达到70%以上。然而,混合发酵和胞外酶处理的不同酒样之间酸果、甜果类香气特征的MF值基本没有差异,且酒样之间花香和柑橘类香气特征的MF值也比较接近。另外,混合发酵和胞外酶处理增加了‘爱格丽’葡萄酒的生青味,但胞外酶处理和C1:1、C4:1处理所得酒样中生青味特征的MF值在25%左右,C10:1、C1:10处理酒样中生青味特征的MF值大于40%。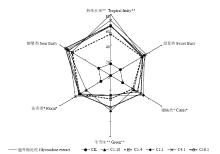 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4爱格丽干白葡萄酒不同处理下香气感官特征的量化强度值MF(%)
*P<0.05水平差异显著;**P<0.01水平差异显著
-->Fig. 4Quantitative value MF (%) of aroma characteristics from different treatments of Ecolly dry white wine
* Difference significant at 95% confidence level; **99% confidence level
-->
2.3 香气成分分析
如表1所示,经SPME-GC-MS对供试酒样中香气成分的定性定量分析,共确定37种香气成分,它们在酒中的总量为204.1—284.3 mg∙L-1,而混合发酵和胞外酶处理的酒样中香气成分的总含量显著高于酿酒酵母纯发酵(CK)酒样中香气成分的总含量(204.1 mg∙L-1),且1﹕1比例接种的酒样中香气成分的总含量最高(284.3 mg∙L-1),品种香气成分与发酵香气成分含量分别比对照酒样(酿酒酵母纯发酵)高26%、39%。其中,15种香气成分在酒中的浓度与其嗅觉阈值的比值(OAV)大于1,10种香气成分的OAV处于0.1—1。品种香气成分主要来源于葡萄果皮中香气糖苷前体物质的水解,对葡萄酒的品种和区域典型性起决定性作用;而发酵香气成分主要为酵母在酒精发酵过程中积累的副产物。Table 1
表1
表1优选酵母与酿酒酵母混合发酵的供试酒样中香气成分含量(μg∙L-1)
Table 1Aroma compounds in the wine samples fermented by mixed inoculation of selected Pichia fermentans and Saccharomyces cerevisiae (μg∙L-1)
| KI* | 化合物 | 供试酒样Wine samples | 阈值 | OAV | 气味描述 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Compounds | CK | 胞外酶处理 | C1:10 | C1:4 | C1:1 | C4:1 | C10:1 | Odor threshold | Odour description | ||
| Extracellular extract | |||||||||||
| 品种香气成分Varietal aroma | |||||||||||
| 萜烯类Terpenols | 109±10c | 186±11a | 132±8b | 138±9b | 143±11b | 151±8b | 156±10b | ||||
| 1464 | 里哪醇氧化物 | 4±1b | 4±0b | 5±0a | 3±0c | 4±0b | 4±0b | 4±0b | 500[21] | <0.1 | 玫瑰,木香 |
| Linalool oxide | Rose, wood | ||||||||||
| 1558 | 橙花叔醇Nerolidol | 0±0d | 9±1a | 3±0bc | 3±0bc | 4±0b | 2±0c | 4±1b | 700[22] | <0.1 | 玫瑰,苹果,柑橘 |
| Rose, apple, citrus | |||||||||||
| 1706 | α-萜品醇 | 23±3c | 41±2a | 28±2bc | 28±2bc | 29±3b | 31±2b | 32±2b | 250[23] | 0.1—1 | 甜味,蘑菇 |
| α-terpineol | Sweet, mushroom | ||||||||||
| 1814 | 橙花醇Nerol | 52±4d | 88±5a | 60±4cd | 67±5bc | 65±5bc | 73±4b | 74±5b | 300[24] | 0.1—1 | 花香,芳香浓郁 |
| Flower, fragrant | |||||||||||
| 1921 | 脱氢里哪醇 | 30±2a | 44±3d | 36±2b | 37±2bc | 41±3bcd | 41±2bcd | 42±2cd | NF | - | 风信子Hyacinth |
| Dehydro linalool | |||||||||||
| C13-去甲类异戊二烯 | 81±8a | 159±15c | 102±13ab | 99±6ab | 101±8ab | 110±6b | 145±10c | ||||
| C13-norisoprenoids | |||||||||||
| 1285 | 葡萄螺烷Vitispirane | 72±7a | 133±13b | 84±11a | 82±5a | 84±7a | 92±5a | 122±8b | 800[24] | 0.1—1 | 桉树,木香,辛辣 |
| Eucalyptus, wood, spicy | |||||||||||
| 1832 | β-大马酮 | 9±1a | 26±2c | 18±2b | 17±1b | 17±1b | 18±1b | 23±2c | 0.05[25] | >1 | 甜苹果,李子 |
| β-damascenone | Honeyed apple, dry plum | ||||||||||
| C6化合物 | 2269±247a | 3150±251c | 2428±142ab | 2573±196ab | 2859±155bc | 2894±194bc | 2855±153bc | ||||
| C6 compounds | |||||||||||
| 1392 | 己醇1-hexanol | 2174±240a | 2995±242c | 2323±135ab | 2467±187ab | 2751±148bc | 2773±187bc | 2722±146bc | 8000[25] | 0.1—1 | 生青味,果香,酒精味,甜味 |
| Green, fruity, alcohol, sweet | |||||||||||
| 1401 | E-3-己烯-1-醇 | 95±7a | 155±9d | 105±7ab | 106±9ab | 108±7ab | 121±7bc | 133±7c | 400[22] | 0.1—1 | 生青味,草药味 |
| E-3-hexen-1-ol | Green, herb | ||||||||||
| 总计Total | 2459±265a | 3495±277c | 2662±163ab | 2810±211ab | 3103±174bc | 3155±208bc | 3156±173bc | ||||
| 发酵香气成分Fermentative aroma | |||||||||||
| 高级醇Higher alcohols | 101904±10414a | 131633±11235d | 104562±5099ab | 110563±5933abc | 124037±9780bcd | 128930±5723cd | 128145±6952cd | ||||
| 1108 | 异丁醇 | 3457±450a | 4205±278b | 3555±168ab | 3574±172ab | 3763±238ab | 3858±261ab | 3881±232ab | 40000[22] | 0.1—1 | 淡甜味,酒精味 |
| Isobutyl alcohol | Mild sweet, alcohol | ||||||||||
| 1165 | 丁醇1-butanol | 753±73a | 1213±64c | 847±120a | 881±49a | 900±45ab | 1064±71bc | 1072±58bc | 150000[23] | <0.1 | 中药,杂醇油,辛辣味 |
| Medicinal, fusel, pungency | |||||||||||
| KI* | 化合物 | 供试酒样Wine samples | 阈值 | OAV | 气味描述 | ||||||
| Compounds | CK | 胞外酶处理 | C1:10 | C1:4 | C1:1 | C4:1 | C10:1 | Odor threshold | Odour description | ||
| Extracellular extract | |||||||||||
| 1230 | 异戊醇 | 97466±9873a | 126018±10873d | 99945±4793ab | 105882±5698abc | 119145±9484bcd | 123823±5376cd | 123034±6653cd | 30000[26] | >1 | 酒精味,苦味,指甲油 |
| Isoamyl alcohol | Alcohol, bitter, nail polish | ||||||||||
| 1328 | 甲基-1-戊醇 | 110±7b | 82±8a | 107±9b | 105±6b | 141±7c | 73±6a | 74±4a | 50000[26] | <0.1 | 杏仁,烤面包 |
| 4-methyl-1-pentanol | Almond, toasted | ||||||||||
| 1450 | 1-庚醇1-heptanol | 90±8d | 51±6b | 64±4c | 79±5b | 33±2a | 67±5c | 42±2ab | 1000[22] | <0.1 | 生青味,甜味 |
| Green, sweet | |||||||||||
| 1605 | 1-辛醇1-octanol | 15±2a | 39±4d | 17±2ab | 24±2c | 21±2bc | 21±1bc | 22±1bc | 40[24] | 0.1—1 | 浓烈柑橘味,玫瑰 |
| Intense citrus, rose | |||||||||||
| 1676 | 1-壬醇1-nonanol | 7±1a | 7±1a | 17±2b | 7±0a | 18±1b | 9±1a | 7±1a | 600[26] | <0.1 | 生青味,玫瑰,橙子 |
| Green, rose, orange | |||||||||||
| 1781 | 1-癸醇1-decanol | 6±0a | 18±1f | 10±1b | 11±1bc | 16±1ef | 15±2de | 13±1cd | 400[22] | <0.1 | 甜味,果香,花香,蜡味 |
| Sweet, fruity, flowery, wax | |||||||||||
| 乙酸酯Acetates | 6833±375a | 7338±490ab | 8306±596bc | 8665±435c | 8825±535c | 8600±420bc | 10627±720d | ||||
| 885 | 乙酸乙酯 | 6365±297a | 6517±449a | 7861±553b | 8109±406b | 8107±507b | 7832±383b | 9850±671c | 7500[25] | >1 | 果香,甜味 |
| Ethyl acetate | Fruity, sweet | ||||||||||
| 1132 | 乙酸异戊酯 | 468±78a | 821±41b | 445±43a | 556±29a | 718±28b | 768±37b | 777±49b | 30[24] | >1 | 果香,鲜香蕉 |
| Isoamyl acetate | Fruity, fresh banana | ||||||||||
| 乙醇酯Ethyls | 16290±1388a | 17131±1203ab | 19509±1429ab | 18618±1574ab | 19647±1253b | 17778±1042ab | 17028±1100ab | ||||
| C3-C5脂肪酸乙酯 | 714±72a | 1487±109d | 784±60ab | 842±64ab | 987±88b | 853±103ab | 1208±79c | ||||
| C3-C5 Fatty Acid Ethyls | |||||||||||
| 951 | 丙酸乙酯 | 32±4a | 107±8e | 39±3a | 55±6b | 69±8bc | 81±7cd | 90±8d | 1800[26] | <0.1 | 果香,苦味 |
| Ethyl propanoate | Fruity, bitter | ||||||||||
| 972 | 异丁酸乙酯 | 40±2a | 450±26e | 91±5b | 97±9b | 136±9c | 155±12c | 291±15d | 15[25] | >1 | 甜果,朗姆酒香 |
| Ethyl isobutyrate | Sweet fruity, rum | ||||||||||
| 1044 | 甲基丁酸乙酯Ethyl 2-methylbutyrate | 95±12c | 162±13d | 65±8ab | 75±9bc | 151±9d | 50±6a | 93±7c | 18[23] | >1 | 生青味,成熟果香 |
| Green, mature fruity | |||||||||||
| 1062 | 异戊酸乙酯 | 187±21bc | 295±24d | 144±8ab | 203±15c | 160±18bc | 107±11a | 261±21d | 3[23] | >1 | 甜果,苹果 |
| Ethyl isovalerate | Sweet fruity, apple | ||||||||||
| 1026 | 丁酸乙酯 | 360±33a | 473±38b | 445±36ab | 412±25ab | 471±44b | 460±67ab | 473±28b | 20[25] | >1 | 酸果,草莓,果香 |
| Ethyl butyrate | Sour fruit, strawberry, fruity | ||||||||||
| C6-C12 脂肪酸乙酯 | 2642±228b | 2980±237b | 1787±111a | 2757±183b | 3579±247c | 2772±133b | 3506±215c | ||||
| C6-C12 Fatty Acid Ethyls | |||||||||||
| KI* | 化合物 | 供试酒样Wine samples | 阈值 | OAV | 气味描述 | ||||||
| Compounds | CK | 胞外酶处理 | C1:10 | C1:4 | C1:1 | C4:1 | C10:1 | Odor threshold | Odour description | ||
| Extracellular extract | |||||||||||
| 1242 | 己酸乙酯 | 853±42bc | 756±43b | 570±29a | 807±47b | 853±62bc | 929±49c | 940±59c | 5[25] | >1 | 青苹果,果香,草莓 |
| Ethyl hexanoate | Green apple, fruity, strawberry | ||||||||||
| 1446 | 辛酸乙酯 | 1294±158b | 1256±105b | 840±54a | 1382±107b | 1767±116c | 1356±56b | 1677±97c | 5[23] | >1 | 果香,甜味,茴香,蜡味 |
| Ethyl octanoate | Fruity, sweet, anise, wax | ||||||||||
| 1651 | 癸酸乙酯 | 478±26ab | 941±87c | 359±27a | 537±27b | 924±66c | 463±27ab | 854±57c | 200[24] | >1 | 果香,脂肪,蜡味 |
| Ethyl decanoate | Fruity, fatty, wax | ||||||||||
| 1849 | 月桂酸乙酯 | 17±2a | 27±2bc | 18±1a | 31±2cd | 35±3d | 24±1b | 35±2d | >800[22] | <0.1 | 甜味,花香,果香,奶油 |
| Ethyl laurate | Sweet, floral, fruity, cream | ||||||||||
| 其他酯类Others | 12934±1088ab | 12664±857ab | 16938±1258c | 15019±1327bc | 15081±918bc | 14153±806ab | 12314±806a | ||||
| 1363 | 乳酸乙酯 | 4220±320a | 3993±254a | 4543±274ab | 4507±234ab | 5348±265c | 6825±376d | 5056±382bc | 154636[23] | <0.1 | 乳香,覆盆子 |
| Ethyl lactate | Lactic, raspberry | ||||||||||
| 1809 | 丁二酸二乙酯 | 8714±768ab | 8671±603ab | 12395±984c | 10512±1093b | 9733±653b | 7328±430a | 7258±424a | 6000[26] | >1 | 生青味,果香 |
| Diethyl succinate | Green, fruity | ||||||||||
| 脂肪酸Fatty acids | 9524±597a | 11923±894bc | 10134±991ab | 12357±784c | 15156±825d | 16258±876de | 18320±1100e | ||||
| 1863 | 己酸Hexanoic acid | 1280±91a | 1354±87a | 1258±163a | 1485±98a | 1892±137b | 2087±117b | 2107±183b | 3000[25] | 0.1—1 | 奶酪,腐臭味 |
| Cheese, rancid | |||||||||||
| 2083 | 辛酸Octanoic acid | 6251±408a | 7334±363ab | 6375±592a | 7684±481b | 8249±440b | 10393±547c | 11209±567c | 500[23] | >1 | 腐败味,刺激味 |
| Rancid, harsh | |||||||||||
| 2296 | 癸酸Decanoic acid | 1991±98a | 3224±443b | 2495±235a | 3180±204b | 5006±248c | 3771±212b | 4995±350c | 15000[25] | 0.1—1 | 牛奶Milk |
| 2481 | 月桂酸Lauric acid | 2±0a | 11±1e | 6±1b | 8±1cd | 9±0d | 7±0bc | 9±0d | 1000[26] | <0.1 | 金属味,月桂油味 |
| Metallic, laurel oil flavor | |||||||||||
| 苯乙基类化合物Phenylethyls | 67144±5057a | 85285±4612b | 124496±4791d | 102377±7028c | 113580±5472cd | 79056±4053ab | 102908±5243c | ||||
| 1829 | 乙酸苯乙酯 | 463±35c | 294±32a | 364±31ab | 371±28b | 407±20bc | 428±32bc | 401±34bc | 250[25] | >1 | 花香,果香,木香 |
| Phenylethyl acetate | Flowery, fruity, wood | ||||||||||
| 1896 | 苯甲醇 | 1344±74a | 1651±122a | 2566±329b | 2667±146b | 2512±173b | 2206±124b | 2556±287b | 200000[23] | <0.1 | 杏仁,脂肪 |
| Benzyl alcohol | Almond, fatty | ||||||||||
| 1931 | 苯乙醇 | 65337±4948a | 83340±4458b | 121566±4431d | 99339±6854c | 110661±5279cd | 76422±3897ab | 99951±4922c | 10000[25] | >1 | 玫瑰,新鲜面包 |
| Phenyl ethanol | Rose, soft tommy | ||||||||||
| 总计 Total | 201695±17831a | 253310±18434b | 267007±12906b | 252580±15754b | 281245±17865b | 250622±12114b | 277028±15115b | ||||
| 总和 Sum | 204154±18096a | 256805±18711b | 269669±13069b | 255390±15965b | 284348±18039b | 253777±12322b | 280184±15288b | ||||
新窗口打开
2.3.1 品种香气成分 供试酒样中共检测出9种品种香气成分,包括5种萜烯类化合物、2种C13-去甲类异戊二烯类化合物、2种C6化合物,其中5种香气成分的OAV在0.1—1,但只有β-大马酮的OAV大于1。整体上,发酵毕赤酵母的接种比例大于1时,供试酒样中品种香气成分的总含量显著增加,而胞外酶处理酒样中的品种香气成分含量最高(3 495 μg∙L-1)。
由表1可见,混合发酵和胞外酶处理增加了大多数萜烯类和C13-去甲类异戊二烯化合物的含量,如α-萜品醇、橙花醇、β-大马酮,尤其是C1:1、C4:1、C10:1酒样中这些物质的含量显著增加。萜烯类物质为葡萄酒带来花香与果香,混合发酵酒样中萜烯类化合物的含量最高可达到CK酒样中的1.5倍,但低于优选酵母胞外酶处理酒样中的含量(186 μg∙L-1)。C13-去甲类异戊二烯化合物中β-大马酮主要赋予葡萄酒甜果香气,葡萄螺烷使葡萄酒具有桉树香气、木香以及辛辣感,优选酵母胞外酶处理的酒样中C13-去甲类异戊二烯化合物的含量比CK酒样高90%。在不同比例的混合接种发酵以及胞外酶处理酒样中,β-大马酮的含量虽低但却远远超出阈值含量,其含量显著高于CK酒样中的含量,但酒样间的β-大马酮含量并无显著差异。
C6化合物含量随着优选酵母接种比例升高而增加,但只有高比例接种优选酵母所得的酒样中的C6化合物含量与CK酒样中的含量存在显著差异,胞外酶处理的酒样中含量最高。
为了揭示不同发酵处理对葡萄酒品种香气成分的整体影响,对供试酒样中OAV大于0.1的品种香气成分及成分类别进行主成分(PCA)分析,香气成分、香气类别在前两个主成分上的载荷及供试酒样的分布见图5。由图可见,PC1和PC2分别占数据总体方差的92.27%和5.07%,PC1是关键主成分。各类品种香气成分及C10:1、C4:1、胞外酶处理主要分布在PC1的正向端。分析可得,随着发酵毕赤酵母接种比例的升高,混合发酵处理酒样中品种香气成分含量增加,而优选菌株胞外酶的发酵处理更利于促进品种香气成分含量的增加。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5前两个主成分上的品种香气成分的载荷值和酒样分布
-->Fig. 5Loadings of varietal aroma compounds and the distribution of the wine samples in the first two PCs
-->
2.3.2 发酵香气成分 供试酒样中共检测出28种发酵香气成分,总含量在201.7—281.2 mg∙L-1,约占相应酒样中总香气成分含量的99%,包括8种高级醇、13种酯类物质、4种脂肪酸和3种苯乙基类化合物,其中14种香气成分的OAV大于1,5种香气成分的OAV在0.1—1。
混合发酵酒样中高级醇总含量(104.5—128.9 mg∙L-1)显著高于CK酒样中的含量(101.9 mg∙L-1),但只有异戊醇在酒中的含量超过其感官阈值。与CK酒样相比,优选酵母接种比例大于1时,异戊醇、1-辛醇的含量显著升高,胞外酶处理酒样中这两种香气成分的含量也显著高于CK酒样中的含量。
本研究中中链脂肪酸(己酸、辛酸、癸酸、月桂酸)的含量随着接种比例的升高而逐渐增加,在优选酵母接种比例大于1的酒样中,其含量大约是CK酒样中的2.0—2.5倍。相对地,供试酒样中中链脂肪酸乙酯的含量也随着优选酵母接种比例的升高而显著增加。当优选酵母接种比例达到10﹕1时,中链脂肪酸乙酯的含量可达到酿酒酵母纯发酵的1.2—1.8倍,然而在1﹕1接种优选酵母的混合发酵酒样中中链脂肪酸乙酯的总量最高,高于酿酒酵母纯发酵的40%。但是,在混合发酵的供试酒样中,短链脂肪酸乙酯和其他酯类的含量并没有显著增加,甚至某些酯类(2-甲基丁酸乙酯、异戊酸乙酯、丁二酸二乙酯)的含量有明显下降。
苯乙基类化合物赋予葡萄酒果香和花香,试验中检测到3种苯乙基类化合物,它们在混合发酵和胞外酶处理酒样中的总含量为79.0—124.4 mg∙L-1,均超出CK酒样中的总量(67.1 mg∙L-1),其中苯乙醇和乙酸苯乙酯的OAV大于1。苯乙醇在供试酒样中的含量显著高于CK酒样中的含量,但不同比例接种优选酵母混合发酵和胞外酶处理却使乙酸苯乙酯的含量有所降低。
对所有OAV大于0.1的发酵香气成分及其类别进行PCA分析,前两个主成分上的发酵香气成分载荷及酒样分布见图6。如图所示,PC1、PC2分别占数据总体方差的46.50%和21.67%,大部分发酵香气成分和处理C4:1、C1:1、C10:1以及胞外酶处理同时分布于PC1正向端,尤其是乙酸酯、中链脂肪酸及其酯类和处理C4:1、C1:1、C10:1主要分布于第一象限,而高级醇、短链脂肪酸乙酯和胞外酶处理分布在第四象限。处理C1:10、C1:4分布在第二象限,周围主要分布了其他酯类和苯乙基类的香气成分。CK处于第三象限,其周围无香气成分分布。分析可得,1﹕1、4﹕1、10﹕1比例接种发酵毕赤酵母混合发酵有利于乙酸酯、中链脂肪酸及其酯类含量的增加,而胞外酶处理对发酵香气成分的贡献较小。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6前两个主成分上的发酵香气成分的载荷值和酒样分布
-->Fig. 6Loadings of fermentative aroma compounds and the distribution of the wine samples in the first two PCs
-->
3 讨论
3.1 混合发酵过程中的菌体生长变化
近年来,许多研究者和酿酒师在葡萄酒酿造过程中已不仅仅局限于酿酒酵母的单一使用,他们开始青睐优选非酿酒酵母与酿酒酵母混合发酵以改善葡萄酒的风味与香气,尤其是对于中性葡萄品种的酿造[6]。混合发酵过程中香气的形成与酵母生长息息相关,WANG等[27]采用干质量称重法测定出在葡萄酒酒精发酵期间酵母菌的菌体生长遵循“S”形曲线增长,同时有研究发现混合发酵过程中酵母的总生长量与酿酒酵母纯发酵的总菌数一致(约108 CFU/mL)[28]。本研究也发现,不同混合发酵体系中菌体的生长遵循“S”形增长,且在酵母生长稳定期总菌数保持一致。然而,在混合发酵过程中不同菌种的生长之间往往存在相互作用。DOMIZIO[12]研究表明,高比例(100﹕1、10 000﹕1)接种异常毕赤酵母(P. anomala)的发酵初期,该酵母的生长会抑制酿酒酵母的生长。李婷等[29]研究发现,发酵毕赤酵母(P. fermentans)与酿酒酵母1﹕1接种混合发酵中的酿酒酵母数量低于酿酒酵母纯发酵时的菌体数量,而非酿酒酵母只存在于发酵的初期阶段,在发酵旺盛期和末期,酿酒酵母占主导地位,控制酒精发酵进程。本研究中,高比例(4﹕1、10﹕1)接种发酵毕赤酵母H5Y-28会延缓酿酒酵母的生长且降低酿酒酵母的生长数量,但是,酿酒酵母仍然在发酵过程中占据主导地位,直到酒精发酵彻底完成。不同的是,发酵毕赤酵母的存活数量和存活时间随着非酿酒酵母接种比例的升高而增加,这可能是高比例接种该酵母影响酿酒酵母生长的直接原因,但它并不改变酿酒酵母的生长优势,能够保证酒精发酵的顺利完成。3.2 混合发酵的接种比例对葡萄酒香气成分的影响
本研究发现,混合发酵所得的酒样中香气成分的含量随着发酵毕赤酵母H5Y-28接种比例的升高而增加,尤其是高比例接种该酵母所得酒样中的香气成分含量显著增加,这可能与发酵过程中该酵母的存活数量和存活时长有关。LEE等[11]将土星拟威尔酵母(Williopsis saturnus)与酿酒酵母按照3种比例接种酿造木瓜酒,结果发现,接种比例是混合发酵调节木瓜酒风味的重要因素,10﹕1接种非酿酒酵母时,该酵母在发酵过程中的存活数量和存活时间更多,同时增加了酒中乙酸酯的含量,而1﹕1和1﹕10的接种比例使酒中的乙醇酯、高级醇和2-乙酸苯乙酯含量增加。同时有研究发现,嗜高压有孢汉逊酵母(H. osmophila)和酿酒酵母不同比例混合发酵的Bobal葡萄酒中2-乙酸苯乙酯的含量大约是酿酒酵母纯发酵酒的3—9倍,所酿酒具有更强烈的果香特征[30]。NAVARRETE- BOLAÑOS[31]研究发酵毕赤酵母与酿酒酵母混合发酵“prickly pear”,所酿酒中富含香气化合物,具有愉悦的果香。而CLEMENTE-JIMENEZ[14]顺序接种发酵毕赤酵母与酿酒酵母发酵,所酿酒中1-丙醇、正丁醇、2,3-丁二醇、乙酸乙酯、辛酸乙酯的含量增加。本研究发现,较高比例同时接种发酵毕赤酵母(C1:1、C4:1、C10:1)更能促进酒中乙酸酯、乙醇酯、异戊醇与苯乙醇的生成,尤其是中链脂肪酸及其酯。脂肪酸是合成乙醇酯不可或缺的前体物质[32],因此,随着优选发酵毕赤酵母接种比例的升高,酒中中链脂肪酸乙酯的含量也随着中链脂肪酸的增加呈现出增加趋势。但是,不同比例接种发酵却使乙酸苯乙酯的含量有所降低,而关于优选菌株H5Y-28导致乙酸苯乙酯含量降低的原因有待进一步研究确定。此外,有研究认为,优选非酿酒酵母菌株分泌的β-葡萄糖苷酶以及某些代谢产物有利于促进葡萄酒风味的复杂化[5]。SWANGKEAW等[4]在塔明内(Traminette)葡萄醪中添加汉逊酵母属(Hanseniaspora sp.)和异常毕赤酵母(P. anomala)分泌的胞内β-葡萄糖苷酶,发现所酿酒中挥发性香气成分含量增加,可达到酿酒酵母纯发酵的1.3—3.0倍。陶永胜等[7]利用葡萄汁有孢汉逊酵母(H. uvarum)的胞外酶进行发酵前处理,所酿的干红葡萄酒中C13-去甲类异戊二烯类和萜烯类物质增加。本研究发现,发酵毕赤酵母H5Y-28的胞外酶处理更有利于促进品种香气成分的形成,尤其是C13-去甲类异戊二烯,约为酿酒酵母纯发酵的1.9倍。同时该研究也发现较高比例接种发酵毕赤酵母(C1:1、C4:1、C10:1)所得酒样中品种香气成分的含量显著高于酿酒酵母纯发酵酒样中的含量,这是因为相比酿酒酵母,非酿酒酵母可产生活性更高且更稳定的β-葡萄糖苷酶,利于水解糖苷前体物质促进挥发性香气成分的释放[4],而随着发酵毕赤酵母H5Y-28接种比例的升高,非酿酒酵母在发酵过程中的存活数量和存活时间也逐渐增加,因此混合发酵过程中的β-葡萄糖苷酶累积量越来越高,从而更有利于促进糖苷前体物质的水解释放,增加混合发酵中品种香气成分的含量。
3.3 混合发酵对葡萄酒香气特征的影响
感官分析表明,优选发酵毕赤酵母与酿酒酵母混合发酵增强了‘爱格丽’干白葡萄酒的果香与花香,尤其是热带水果香气,但酸果类和甜果类香气特征在不同处理的酒样之间并无显著差异。优选菌株胞外酶处理的酒样中热带水果香气最为显著,而C4:1接种处理使得所酿酒表现出较强的花香特征,C1:1处理赋予所酿酒较强的柑橘类香气。之前有研究证实,葡萄酒的果香和复杂性与非酿酒酵母在发酵过程中产生的酯类物质密切相关[8],同时,花香和热带水果香气也是增强葡萄酒香气复杂性的最有利因素[33]。本研究还发现,高比例接种发酵毕赤酵母的酒样中生青味特征明显高于其他接种处理的酒样。但是,C6化合物是葡萄酒生青气味的主要来源[34],本研究中该类化合物含量随发酵毕赤酵母接种比例的升高而增加,这可能是导致高比例接种H5Y-28的酒样中生青味特征较强的原因。4 结论
混合发酵中酵母菌生长遵循典型的“S”型曲线增长,高比例接种发酵毕赤酵母H5Y-28(C4:1、C10:1)会延缓酿酒酵母生长,降低其生长数量,但不影响酒精发酵的顺利完成。混合发酵和胞外酶处理显著增强了葡萄酒的果香与花香,尤其是热带水果香气,但高比例接种发酵毕赤酵母酵母的生青味特征明显。发酵毕赤酵母的胞外酶处理极有利于释放萜烯类(α-萜品醇、橙花醇)、C13-去甲类异戊二烯(β-大马酮)等香气成分,尤其是C13-去甲类异戊二烯比酿酒酵母纯发酵酒样的高90%。较高比例接种发酵毕赤酵母(C1:1、C4:1、C10:1)更能促进乙酸异戊酯、C6-C12脂肪酸(己酸、辛酸、癸酸)及其酯类、异戊醇及苯乙醇等香气成分的形成,混合发酵(1﹕1)显著增加了‘爱格丽’干白葡萄酒中品种香气成分和发酵香气成分的含量,分别比酿酒酵母纯发酵酒样中的含量高26%、39%,尤其是中链脂肪酸含量显著高于对照酒样40%。总体来看,发酵毕赤酵母和酿酒酵母1﹕1接种不影响酿酒酵母生长,并且能够改善葡萄酒香气,所酿酒具有较好的果香与花香。The authors have declared that no competing interests exist.
