0 引言
【研究意义】棉铃虫(Helicoverpa armigera)是一种世界性的农业害虫,并且对多种杀虫剂和转基因作物的抗性逐渐增强[1],为了避免其暴发成灾,需要掌握它的抗药性机制。磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine binding protein,PEBP)是一种能在胞内信号转导过程中发挥重要作用的蛋白,对棉铃虫PEBP的研究不仅可以明确其在有毒物质的代谢过程中是否发挥传递信号的作用,还可为棉铃虫的防控提供新的分子靶标。【前人研究进展】1984年,BERNIER等[2]首次从牛脑中分离提取到PEBP-1,其在体外能与磷脂酰乙醇胺特异性结合,为分子量21—23 kD的胞质可溶性蛋白。PEBP广泛分布于自然界,除了在人、牛、鼠等哺乳动物中存在,在开花植物、真菌、细菌和昆虫等物种中亦存在[3]。PEBP在生物体的多种组织中都有表达且氨基酸序列高度保守,Western bolt结果显示大鼠PEBP在脑、心、肾、肝、小肠等组织均有表达;人、猴、牛、大鼠、小鼠的PEBP序列有超过90%的同源性[4,5]。对PEBP的功能研究表明该蛋白参与多个胞内信号通路,从而具有多种生物学功能[6,7,8]。例如参与MAPK/ERK信号通路调节细胞分化、迁移和黏附,参与NF-κB信号通路调节细胞凋亡,参与GPCR信号通路调控G蛋白的信号转导等。PEBP还可在神经系统中发挥作用,研究发现大鼠PEBP是海马胆碱能神经刺激肽(hippocampal cholinergic neurostimulating peptide,HCNP)的前体,PEBP的N端第2—14位可被切割成一个11肽,此肽能提高胆碱乙酰基转移酶(choline acetyl transferase,ChAT)的表达从而调控乙酰胆碱的合成[9]。一些阿尔兹海默病患者的大脑中PEBP的mRNA水平显著降低,造成ChAT含量减少从而引起记忆力减退[10]。还有研究发现在大鼠精子顶体和鞭毛的细胞外,PEBP可作为一种去能因子(decapacitation factor,DF)的受体与DF结合,使精子无法穿透卵子外围保护层,从而调控精子与卵子的结合过程[11]。【本研究切入点】目前对于PEBP的功能研究主要集中在哺乳动物体内,对于昆虫的PEBP研究报道较少。前期试验中,笔者实验室通过酵母单杂交技术筛选针对棉铃虫CYP6B6的2-十三烷酮响应元件的转录因子,其中一个阳性克隆的部分片段与家蚕PEBP保守域有较高的相似性。2-十三烷酮是一种常见的植物次生物质,天然存在于多种茄科植物中[12]。它能诱导细胞色素P450家族中CYP6B6的过量表达,从而提高昆虫对杀虫剂的忍耐力[13]。【拟解决的关键问题】运用RACE技术获得棉铃虫PEBP(HaPEBP)的cDNA序列,并将该基因克隆至pET32a载体使其在大肠杆菌中诱导表达,然后通过实时荧光定量PCR(qRT-PCR)技术测定HaPEBP在棉铃虫幼虫各龄期和6龄幼虫不同组织中的表达情况,并检测不同浓度2-十三烷酮处理后幼虫中肠内HaPEBP的表达规律,为进一步明确PEBP在棉铃虫体内的功能和选择该基因作为调控棉铃虫种群数量的分子靶标提供依据。1 材料与方法
试验于2016年9月至2017年4月在新疆大学新疆生物资源和基因工程重点实验室完成。1.1 试验材料
棉铃虫为笔者实验室人工饲料长期饲养的品系,大肠杆菌DH5α和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司,表达载体pET32a为笔者实验室保存。DNA Marker、BamH І、Hind Ш、T4 DNA ligase、pMD18-T vector Kit、ExTaq DNA polymerase Kit和Reverse Transcriptase M-MLV(RNase H-free)Kit购自TaKaRa公司;SMARTer RACE 5′/3′ Kit购自Clontech公司;DNA凝胶回收试剂盒、PCR产物回收试剂盒及质粒提取试剂盒、引物合成和DNA序列测定均购自上海生工生物有限公司;TansZol Up Plus RNA Kit购自北京全式金生物技术有限公司;蛋白Marker购自Fermentas公司;miScript SYBR Green PCR Kit购自QIAGEN公司;鼠抗His-Tag单克隆抗体、辣根过氧化物酶标记的羊抗鼠IgG抗体购自中杉金桥公司;DAB显色试剂购自上海碧云天生物技术有限公司;其他化学试剂均为国产分析纯试剂。
1.2 方法
1.2.1 HaPEBP cDNA克隆及序列分析 将棉铃虫6龄幼虫的中肠在液氮中研磨,按照TansZol Up Plus RNA Kit提供的方法提取总RNA,并分别逆转录成普通cDNA、5′ RACE cDNA和3′ RACE cDNA,-80℃保存备用。根据酵母单杂交捕获的HaPEBP部分序列设计RACE扩增所需的特异引物(表1)。分别以5′ RACE cDNA和3′ RACE cDNA为模板进行Outer PCR。5′ RACE扩增反应条件:94℃预变性5 min;94℃ 30 s,68℃ 30 s,72℃ 3 min,25个循环。3′ RACE扩增反应条件:94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;最后72℃延伸7 min。将Outer PCR产物稀释20倍后作为模板进行Inner PCR。5′ RACE扩增反应条件:94℃预变性5 min;94℃ 30 s,58℃ 30 s,72℃ 3 min,30个循环。3′ RACE扩增反应条件:94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;最后72℃延伸7 min。Inner PCR的扩增产物经切胶回收后,将目的条带连接pMD18-T载体并转化大肠杆菌DH5α感受态,挑取阳性克隆进行PCR检测并送上海生工生物公司测序。利用DNAMAN软件将测序得到的HaPEBP的5′和3′片段进行拼接,获得HaPEBP的cDNA序列,并预测HaPEBP序列的开放阅读框。针对HaPEBP的ORF设计引物(表1),以普通cDNA为模板进行PCR验证。反应条件:94℃预变性5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,35个循环;最后72℃延伸7 min。PCR产物的回收和测序同上。
Table 1
表1
表1本研究所用引物
Table 1Primers used in this study
| 引物Primer | 序列Sequence (5′-3′) | 用途Purpose |
|---|---|---|
| PEBP-5O | AGTTTGGCGGGCTGCTGGTA | 5′末端cDNA扩增 5′ RACE PCR |
| PEBP-5I | CCCGCACAGATGTTGTTCCC | |
| PEBP-3O | ATGGAATGCCTCCGCAGATG | 3′末端cDNA扩增 3′ RACE PCR |
| PEBP-3I | CCACTGGCTGGTCGGCAATA | |
| PEBP-F | CGGGATCCATGGTCAATTTTAGGGT, BamH Ι | 开放阅读框扩增 ORF amplification |
| PEBP-R | CCAAGCTTTTAAGCGCCGAGTTG, Hind ІІІ | |
| PEBP-QF | AAAGACCCGAAGTTCCGTGAAT | 实时荧光定量PCR qRT-PCR |
| PEBP-QR | TCTTGGCGAACTTGGAAATC | |
| Tubulin-QF | TCCAACTCACACACTCGCT | |
| Tubulin-QR | GGAAGCAGATGTCGTATAATG |
新窗口打开
1.2.2 HaPEBP氨基酸序列分析 通过NCBI数据库的ORF Finder和Protein Blast进行ORF的预测和氨基酸序列比对;用MEGA软件按照邻近相接法(neighbor-joining method,NJ)构建系统发育树,确定棉铃虫PEBP与其他物种PEBP的亲缘关系;利用Expasy软件的Protparam和Protscale工具进行理化参数分析和亲疏水性分析;通过CBS Prediction Servers软件的SignalP、TargetP和TMHMM等工具进行信号肽、跨膜域和亚细胞定位等预测;利用PredictProtein软件进行蛋白质的二级结构预测;利用SWISS-MODEL软件和PDB数据库进行蛋白质的三级结构预测。
1.2.3 HaPEBP蛋白的原核表达 将HaPEBP的ORF通过酶切位点BamH І和Hind Ⅲ连接至pET32a载体上,并转化DH5α感受态。PCR筛选阳性重组子后,提取重组质粒pET32a-HaPEBP进行酶切鉴定。将正确的重组质粒转化至大肠杆菌BL21(DE3)细胞中,进行菌落PCR验证和质粒酶切鉴定。将阳性克隆BL21(DE3)-pET32a-HaPEBP接种到LB液体培养基中,37℃,200 r/min培养至OD600为0.6—0.8后,加入IPTG至终浓度为1 mmol·L-1,37℃振荡培养4 h。离心收集重组菌体后用少量1×PBS(pH 7.0)重悬,经超声破碎至相对透亮(间隔5 s,共30 min),分开处理上清和沉淀,15%的SDS-PAGE检测融合蛋白的可溶性。
1.2.4 His-HaPEBP蛋白的纯化 将1 L的BL21(DE3)-pET32a-HaPEBP菌株诱导超声后,将上清液与Ni-NTA柱结合,用不同浓度的咪唑溶液(10、10、20、20、50、100、200、200 mmol·L-1)去除杂蛋白,用孔径大小为10 kD的超滤管浓缩目的蛋白(6 000 r/min离心45 min),15% SDS-PAGE检测蛋白纯化时的流出液。Western blot验证融合蛋白His-HaPEBP的大小和纯度,用5%脱脂奶粉4℃过夜封闭,PBST冲洗3次;1﹕1 000稀释的抗His标签的抗体室温孵育2 h,PBST冲洗3次;1﹕5 000稀释的辣根过氧化物酶标记的羊抗鼠IgG抗体室温孵育1.5 h;最后用DAB显色试剂盒显色10 min,LAS-4000成像系统(美国)进行观察。
1.2.5 HaPEBP表达模式分析 收集孵化后第2天的1龄、蜕皮后第2天的2—6龄和建蛹室第3天的预蛹的幼虫全虫;蜕皮后第2天的6龄幼虫解剖收集脂肪体、中肠、体壁和头部。通过qRT-PCR方法检测HaPEBP在棉铃虫不同发育时期和不同组织的表达量,提取各组棉铃虫的总RNA,进行DNaseⅠ的消化回收后逆转录获得各组cDNA。分别取1 µL的cDNA根据miScript SYBR Green PCR Kit的说明书进行荧光定量,以Tubulin作为内参基因[14,15],HaPEBP和Tubulin的荧光定量引物见表1,每组3个生物学重复和2个技术重复。对于不同发育时期,以1龄为对照;对于不同组织,以脂肪体为对照。试验数据处理根据公式2-∆∆CT,并利用Prism5.0软件进行One-way ANOVA分析。
1.2.6 HaPEBP响应2-十三烷酮处理的表达规律 将所需2-十三烷酮溶于等体积的无水乙醇中,添加于等质量的棉铃虫人工饲料中,配制成2.5、5、10和15 mg·g-1,对照组为只添加无水乙醇的人工饲料。取蜕皮第1天内的6龄幼虫,在2-十三烷酮处理前使其饥饿5 h。运用qRT-PCR方法检测不同浓度2-十三烷酮处理下,幼虫中肠组织中HaPEBP在不同时间(6、12、20、30、48 h)的表达情况。在各时间点上,以不添加2-十三烷酮作为对照,Tubulin作为内参基因,采用2-∆∆CT法进行mRNA相对表达量的计算。运用Prism5.0软件进行数据分析,同一浓度不同时间的数据进行One-way ANOVA分析,同一时间与对照组的数据进行paired t test分析。
2 结果
2.1 HaPEBP全长克隆和序列分析
将5′和3′ RACE扩增得到的产物经过测序和序列拼接,图1表明获得的HaPEBP cDNA序列长760 bp,其中5′-UTR为77 bp,3′-UTR为95 bp,含有加尾信号AATAAA,ORF为588 bp,可编码195个氨基酸。该蛋白预测分子量为21.76 kD,理论等电点为5.93。经NCBI Blast分析,确定该蛋白属于PEBP超家族,含有该蛋白家族特有的保守位点,其中包括79—83位的DPDXP基序、95位的组氨酸残基和125—128位的GXHR基序,这些是与配体结合的关键区域。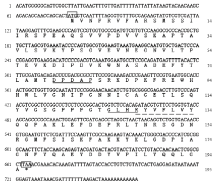 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1HaPEBP的核酸序列和氨基酸序列
方框内为起始密码子和终止密码子The start and stop codons are boxed;下划线表示配体结合的保守位点The conserved sites of HaPEBP combined with ligand are underlined;虚线表示核苷酸结合基序有同源性的位点Imaginary lines indicate the homology sites of nucleic acid binding motif
-->Fig. 1The nucleotide and amino acid sequences of HaPEBP
-->
2.2 HaPEBP蛋白结构及系统发育分析
将多种动物的PEBP序列进行多序列比对及系统进化发育分析,图2显示节肢动物门昆虫纲的PEBP聚在一起,HaPEBP蛋白与鳞翅目家蚕(Bombyx mori)、菜青虫(Pieris rapae)和小菜蛾(Plutella xylostella)的PEBP同源性较高,分别为70.77%、77.95%和70.62%。HaPEBP与小菜蛾PEBP分别为一个支的两个分支,两者的Bootstrap检验值为43,表明它们的分化时间和进化速率可能较为一致。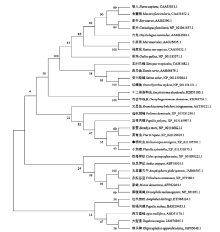 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2以邻接法构建的HaPEBP系统进化树
-->Fig. 2The phylogenetic tree of HaPEBP by neighbor-joining method
-->
氨基酸序列分析显示HaPEBP蛋白无信号肽、跨膜结构域和二硫键,为胞内稳定的亲水性蛋白质。图3的二级结构显示其含有5个α螺旋、10个β折叠片、23个β转角和2个γ转角,其中螺旋1和2因螺旋-螺旋的相互作用可视为一个螺旋(14—26位的IIRSFEAQSVVPD序列),而折叠片7和8因位置相邻可视为一个折叠片(110—113位的ETLS序列)。蛋白质三级结构预测HaPEBP为紧凑的球形单体结构,含有一个与配体结合的口袋。三级拓扑结构表明6个β折叠片(1、5、6、7—8、9和10)可形成一个较大的中心β折叠区,含有一个结合口袋;而另外3个β折叠片(2、3和4)形成一个较小的反向平行β片层,位于中心β折叠区的转角处。
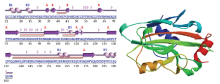 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3HaPEBP二级结构和三级结构
左图为二级结构The left figure is secondary structure;H1—H5:α螺旋α helixes;A、B:β折叠片β sheets;β:β转角β turns;γ:γ转角γ turns;形状∩表示前后两个β折叠片形成的β发卡结构Shape ∩ indicates β hairpins between two β sheets。右图为三级结构The right figure is tertiary structure;深蓝色为蛋白N端Dark blue indicates protein N terminal;红色为蛋白C端Red indicates protein C terminal
-->Fig. 3The secondary and tertiary structure of HaPEBP
-->
2.3 融合蛋白His-HaPEBP的诱导表达
HaPEBP的ORF经扩增后连接pET32a载体,将BamH І和Hind Ⅲ酶切鉴定正确的重组质粒转化大肠杆菌BL21(DE3),获得菌株BL21(DE3)-pET32a- HaPEBP。图4-A表明该菌株经1 mmol·L-1 IPTG 37℃诱导4 h后,可大量产生一种小于45 kD的蛋白,此蛋白与融合蛋白His-HaPEBP(39.1 kD)大小相近。将诱导后的菌体进行超声破碎后,分别收集上清和沉淀,融合蛋白能以可溶的形式存在于大肠杆菌中。将1 L的菌液按同样的条件诱导,超声破碎细胞后收集上清液,对上清液进行Ni-NTA柱His标签的亲和层析,分别用10、10、20、20、50、100、200和200 mmol∙L-1的咪唑缓冲液洗涤柱料,图4-B显示在第2次200 mmol∙L-1的咪唑溶液洗涤后,流出液中含有较纯的、符合预期大小的融合蛋白。将此流出液超滤浓缩后进行蛋白定量,结果显示浓缩的融合蛋白含量为183.3 ng·μL-1。用抗His-Tag的单克隆抗体与浓缩后的蛋白进行免疫反应,图4-C结果表明纯化浓缩后的蛋白确实为His-HaPEBP融合蛋白。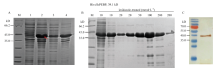 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4融合蛋白His-HaPEBP的诱导表达
A:SDS-PAGE检测融合蛋白的表达Induced expression product of the fusion protein by SDS-PAGE analysis;M:蛋白标记物 Protein Marker;1—4:重组菌体诱导前、诱导后、超声处理后上清和沉淀的总蛋白The total proteins of BL21(DE3)-pET32a-HaPEBP strain without IPTG induced, with IPTG induced, ultrasonic supernatant with IPTG induced and ultrasonic precipitation with IPTG induced。B:SDS-PAGE检测融合蛋白的纯化The purification of fusion protein by SDS-PAGE analysis;M:蛋白标记物 Protein Marker。C:Western blot验证纯化和超滤后的融合蛋白Western blot analysis of the fusion protein after purified and concentrated;M:预染蛋白标记物 Prestained protein Marker
-->Fig. 4The prokaryotic expression of His-HaPEBP fusion protein
-->
2.4 棉铃虫不同龄期和组织中HaPEBP 的表达规律
通过qRT-PCR方法检测棉铃虫不同发育时期和组织中HaPEBP的表达量,HaPEBP在幼虫的每个龄期均有表达,在6龄中的表达量最高,其次是预蛹期,在4龄中的表达量最低,且与6龄相比差异显著(P<0.05),而其他龄期中的表达量变化不大(图5-A)。HaPEBP在6龄幼虫的脂肪体、中肠、体壁和头部中均有表达,其表达量依次降低且差异显著(P<0.05),头部的表达量仅是脂肪体中的一半(图5-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5HaPEBP在棉铃虫不同龄期(A)和不同组织(B)的表达分析
柱上不同字母表示差异显著
-->Fig. 5The expression analysis of HaPEBP in different instars (A) and tissues (B) of H. armigera
Different letters above the bars indicate significant difference (P<0.05, one-way ANOVA test)
-->
2.5 HaPEBP响应2-十三烷酮的表达
用4种浓度的2-十三烷酮处理棉铃虫不同时间,检测中肠内HaPEBP的表达量。结果显示与对照组相比,2-十三烷酮处理后HaPEBP的表达量降低。2.5 mg·g-1处理组中,6 h的表达量与对照相比显著降低(P<0.001),且随时间的延长表达量明显上升至正常水平;5 mg·g-1处理组中,HaPEBP的表达量随时间的延长增幅不大(F=1.835,P=0.154),但都显著低于正常水平;10 mg·g-1处理组的变化趋势与5 mg·g-1相反,随着时间的延长逐渐降低,只在6 h处与对照相比无显著差异(P>0.05);而15 mg·g-1处理组中HaPEBP的表达量随着时间的延长先降至最低(20 h,0.50)后回升至最高(48 h,1.44),且48 h的表达量明显高于正常水平(图6)。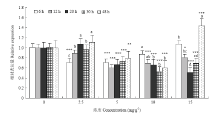 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6HaPEBP响应2-十三烷酮表达的剂量和时间效应
不同字母表示同一浓度下不同时间的差异显著Different letters above the bars indicate significant difference in the same concentration group (P<0.05, one-way ANOVA test);星号代表同一时间与对照组的差异显著The asterisks indicate significant difference at the same time compared with the control group (P<0.05, paired t test)
-->Fig. 6The dose and time effects of 2-tridecanone for HaPEBP expression
-->
3 讨论
磷脂酰乙醇胺结合蛋白是一类分布广泛且有独特结构的蛋白质,该蛋白参与MAPK、NF-κB和G蛋白受体等多条信号通路调控,引起多种不同的生物学反应,从而在老年痴呆症、糖尿病、肿瘤等多种疾病发生中起重要作用。随着PEBP在哺乳动物中的研究增多,该蛋白也逐渐成为一个药物靶点来抑制相关病症的产生[16,17,18]。本研究以鼠鞭虫(Trichuris muris)的Tm16蛋白(属于PEBP-1家族,PDB code: 5tvd)为模板,利用SWISS-MODEL软件对棉铃虫PEBP进行同源建模[19]。结果显示这两个蛋白氨基酸序列相似性为63.04%,HaPEBP的三级结构中91.4%的氨基酸位于最佳区域且没有氨基酸位于不允许区,表明该三级结构构象稳定。且HaPEBP的三级结构与人PEBP相似,同样是由4个螺旋和9个折叠片形成球状的单体,由6个β折叠片构成一个较大的中心β折叠区,其余3个β折叠片组成一个较小的反平行β折叠层,2个α螺旋位于中心β折叠区的两边,其余2个α螺旋分别位于蛋白N端和C端,且位于C端的α螺旋可调节蛋白与配体相互结合的过程,从而使整个蛋白为一紧凑的球形结构[20,21]。HaPEBP序列中同样含有该家族与配体结合的保守基序,同时在128—134位的RYVFLVY基序与核苷酸结合折叠基序有同源性,可能是该蛋白与核酸结合的主要位点,这也许能够解释前期酵母单杂交实验中捕获到该蛋白与棉铃虫CYP6B6启动子元件的相互作用。
棉铃虫是一种完全变态发育的昆虫,同一基因在不同的发育时期或不同的组织中表达量会出现差异。研究表明,昆虫PEBP在不同阶段或不同组织中的含量不同。对6种果蝇PEBPs在不同组织中的表达量进行检测,结果表明这6种PEBPs在不同组织中的表达量有极大的差异,其中CG10298只表达于精巢组织中,且只存在于精子分化过程中[22]。本研究表明,HaPEBP在幼虫所有龄期均有表达,且在6龄和预蛹期中的表达量较高。预蛹期是棉铃虫从幼虫至蛹的过渡阶段,也是参与变态发育所需相关激素变化较大的时期[23]。例如大黄蜂的PEBPX1和PEBPX2均为在10龄幼虫和蛹期的表达量明显高于5龄幼虫[24]。HaPEBP在6龄幼虫的脂肪体、中肠、头部和体壁中均表达且在脂肪体中的表达量最高。昆虫的脂肪体是昆虫生长、发育、变态和生殖等代谢活动的中心组织,其中含有多种类型的细胞,且可在激素作用下发生变态[25]。REUMER等[26]研究发现,果蝇PEBP1在幼虫的脂肪体中高表达,推断PEBP1作为一种免疫保护蛋白来抵抗细菌感染,过量表达的PEBP1提高了抗细菌的蛋白进入血淋巴的能力。
植物PEBP对光周期的变化较为敏感,不同的光周期下其表达量也会发生改变[27]。虽然没有足够的证据表明昆虫PEBP也会响应光周期的变化,但对亚洲虎蚊(Aedes albopictus)PEBP的研究发现极端光周期会改变幼虫体内PEBP的表达量[28],这表明昆虫PEBP有可能响应外界环境的变化。本研究在棉铃虫6龄幼虫的2-十三烷酮亚致死剂量以下选择了4个浓度,并处理幼虫不超过48 h,在此范围内大部分幼虫能够正常生长[29]。总的来说,2-十三烷酮处理后HaPEBP的表达量显著降低,但每个浓度下的趋势却不相同。2.5和5 mg·g-1两组趋势相似,在6 h后表达量就显著降低且随着时间的延长逐渐上升,原因可能是这两个浓度的芳香气味较淡,接触后饥饿的幼虫会立即取食;2.5 mg·g-1的剂量太低,使幼虫体内的HaPEBP表达量逐渐回升至正常水平,5 mg·g-1的剂量对于HaPEBP的表达量回升来说较高,故48 h内仍低于对照组。10和15 mg·g-1两组在6 h的表达量与对照相比无显著差异,原因可能是这两个浓度的芳香气味较重,大多数幼虫接触后会拒绝取食,且15 mg·g-1组拒食时间长于10 mg·g-1组。10 mg·g-1组在幼虫开始取食后HaPEBP的表达量持续低于对照组。15 mg·g-1组在处理12—30 h的HaPEBP表达量显著低于对照,同时发现该组幼虫在30 h会大量提前进入预蛹期,而此后的48 h处HaPEBP表达量显著高于对照,这一现象可能是由幼虫的自我保护引起,但诱导过表达的具体生理过程仍需进一步研究。2-十三烷酮作为一种植物次生物质,可以引起包括CYP6B6在内的多种细胞色素P450氧化酶表达量提高[30],但是棉铃虫PEBP和CYP6B6响应2-十三烷酮的表达规律却截然相反。笔者课题组前期研究结果表明CYP6B6被沉默后,棉铃虫的蜕皮和变态过程受阻,表明CYP6B6可能参与棉铃虫蜕皮激素代谢通路[31]。WANG等研究表明,蜕皮激素响应的G蛋白偶联受体可以转移20-羟基蜕皮激素信号并控制其穿过细胞膜进入细胞质中[32],而PEBP参与了G蛋白偶联受体的信号转导过程,因此HaPEBP也有可能在棉铃虫蜕皮激素代谢通路中发挥作用,但HaPEBP是如何参与这一代谢通路,并且是否调控CYP6B6的表达仍需进一步的研究。
4 结论
克隆分析了棉铃虫PEBP(HaPEBP),利用大肠杆菌系统表达出可溶的融合蛋白His-HaPEBP,并通过镍柱-咪唑纯化法得到了高纯度的融合蛋白,时空表达分析显示HaPEBP在6龄幼虫和脂肪体中表达量最高,2-十三烷酮处理影响6龄幼虫中肠HaPEBP的表达量。研究结果为明确棉铃虫PEBP的功能并进一步选择该基因作为调控棉铃虫种群数量的分子靶标提供了依据。The authors have declared that no competing interests exist.
