0 引言
【研究意义】沙门氏菌是一种常见的食源性致病菌,其主要传播方式为人摄入被污染的牛奶、肉类和鸡蛋等动物性食品[1]。大量对沙门氏菌疫情的调查和对志愿者的研究显示出一些特定的沙门氏菌菌株在极低的剂量下即可引发疾病[2],因此,开展沙门氏菌相关检测技术研究,对食源性疾病的预防和控制具有重要作用。【前人研究进展】目前,最常用的沙门氏菌检测方法主要有3种:传统的微生物平板计数法、酶联免疫法(ELISA)以及聚合酶链式反应。传统的微生物平板计数法操作繁琐、耗时过长且准确度低,不便用于沙门氏菌的检测。ELISA和PCR可将检测时间由传统的几天缩短至数小时[3],但ELISA法依靠的是抗原抗体间的特异性结合,靶物质为菌体表面的抗原或特征毒素,而PCR法是将目标DNA体外扩增来完成定性或定量检测的,这两种方法均无法直接测定菌体本体。因此,建立简便、快速、高效和成本低廉的沙门氏菌检测方法成为目前食品现场快速检测的迫切需求。近年来,材料学、生物学、电化学等学科的迅速发展给电化学传感技术的研究提供了极大的便利,新型电化学传感器的研发与实际应用已经成为当下热点。在食品检测领域,电化学生物传感器凭借其检测迅速、操作简便、成本低廉、灵敏度高、特异性强、重复性好、无需对样本进行特殊处理,能在复杂的电化学体系中进行实时监测甚至活体分析等独有的优越性得到了广泛的应用[4-6]。目前已有报道表明电化学免疫传感器、电化学DNA传感器和电化学适体传感器等电化学生物传感器可用于食源性致病菌的检测。其中,相较于电化学免疫传感器中抗体的不易合成、不稳定性和不易修饰[7]以及电化学DNA传感器中复杂的PCR技术,电化学适体传感器在食源性致病菌检测上显示出了明显的优势。电化学适体传感器的适配体是一段DNA或RNA序列,其具有能与目标物特异并紧密的结合、易于合成、性质稳定、成本低廉、化学修饰简便、检测限低等优点[8-9]。此外,适配体可以被许多荧光染料或标签所修饰,这为检验检测提供了极大的便利[10]。还原氧化石墨烯(rGO)是以石墨烯为原料,经过一系列修饰及还原得到的新型纳米材料。在生物传感器的应用中,还原氧化石墨烯因其硬度大、机械强度高、导电能力和力学性能优异、比表面积大,生物相容性、亲水性和分散性良好,原料易得及价格便宜等特点而被广泛用于提高电子传输[11-17]。甲苯胺蓝(Tb)是一种应用广泛的电化学活性物质,能与rGO作用得到Tb-rGO复合物,从而使rGO的溶解度和自组装性能得到提升,使Tb能够更好地固定,并使电化学信号增强而易于检测[18]。纳米金是指直径在1—100 nm金的微小颗粒。在电化学方面,金纳米粒子的使用可以显著增加电化学反应的反应表面积,提高电子的传输速率,从而使电化学信号得到明显放大,以便于实际检测[19]。核酸外切酶I(Exo I)是一种从3′到5′方向按序催化水解磷酸二酯键,最终产物为单个核苷酸的酶。Exo I不依赖特异性核酸序列,无需靶DNA存在特异性识别位点即可协助信号放大,在生物传感器的应用中具有良好的通用性[20]。【本研究切入点】已有的关于应用电化学适配体传感器进行沙门氏菌定量检测的报道并不多见,但在已报道的数篇成功构建的沙门氏菌电化学适配体传感器的研究中,检测时间缩短、检测范围变宽和最低检测限下降等优势十分明显[21-23]。这表明电化学适配体传感器在沙门氏菌的定量检测上具有良好的应用前景,传感器的各方面性能有望进一步优化。【拟解决的关键问题】本研究利用DNA与AuNPs的相互作用制备DNA-复合纳米材料S1-AuNPs-Tb-rGO;在金电极表面自组装沙门氏菌适体链及其互补链。通过目标物沙门氏菌的特异性识别,将适体链从电极表面脱离,残留在电极表面的互补链与S1-AuNPs-Tb-rGO互补配对,通过评价其电化学活性间接完成对沙门氏菌的检测,建立一种用于沙门氏菌定量检测的电化学生物传感分析新方法。1 材料与方法
试验于2016年9—11月在陕西师范大学食品工程与营养科学学院畜产品加工实验室进行。1.1 菌株和DNA序列
沙门氏菌适配体(Apt,5′-GAGTTAATCAATAGG GGGAACATCCTTGGCGGTGC-3′)、氨基化的DNA链(S1,5′-NH2-(CH)6-GAGTTAATCAATACAAGGC GGGAACATCCTTGGCGGTGC-3′)、沙门氏菌适配体互补链(S2,5′-HS-(CH)6-GCACCGCCAAGGATGT TCCCGCCTTGTATTGATTAACTC-3′),均来源于上海生工生物工程有限公司。鼠伤寒沙门氏菌CMCC 50115、大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 25923、福氏志贺氏菌CMCC 51572、单核增生李斯特菌ATCC 19115、阪崎肠杆菌ATCC 51329均购自北纳创联生物技术有限公司。1.2 仪器和试剂
所有电化学试验操作均在CHI660C型电化学工作站上(上海辰华仪器有限公司)完成。试验采用三电极系统:金电极为工作电极,铂丝为对电极,银/氯化银(饱和氯化钾)电极为参比电极。本研究还需要的主要仪器包括KQ-100V型超声波清洗器(上海京工实业有限公司),DF-101系列集热式恒温加热磁力搅拌器(金坛市金祥龙电子有限公司),漩涡振荡器(北京中西远大科技有限公司),离心机(HERMLE),隔水式恒温培养箱(上海博迅实业有限公司医疗设备厂),真空干燥箱(上海圣科仪器设备有限公司)。试验试剂核酸外切酶I(Exonuclease I,Exo I)购自纽英伦生物技术(北京)有限公司;氯金酸(HAuCl4)、甲苯胺蓝(Tb)、己硫醇(96%,HT)购自美国Sigma Aldrich公司;铁氰化钾(K3[Fe(CN)6])、亚铁氰化钾(K4Fe(CN)6∙3H2O)、Na2HPO4、NaH2P04、KCl、柠檬酸三钠、浓硫酸、无水乙醇等购自天津科密欧化学试剂有限公司;石墨烯(Gra)购自南京吉仓纳米科技有限公司;其他所用试剂均为分析纯;试验用水为蒸馏水。
1.3 溶液的配制
沙门氏菌适配体、DNA-复合纳米材料和沙门氏菌适配体互补链均在12 000 r/min下离心30—60 s后加入适量无菌水充分震荡均匀,置于-20℃冷藏。核酸外切酶I反应缓冲液:将随酶提供的10×核酸外切酶I反应缓冲液用无菌水稀释成1×核酸外切酶I反应缓冲液。
各浓度菌液均以pH 7.0的0.1 mol∙L-1 PBS缓冲溶液配制,4℃保存。
甲苯胺蓝以pH 7.0的0.1 mol∙L-1 PBS缓冲溶液配制成浓度为1 mmol∙L-1的溶液,保存4℃。
己硫醇(HT)溶液以无水乙醇溶液配制成浓度为1 mmol∙L-1的溶液,4℃保存。
1.4 样品处理
根据LUO等[24]的方法在无菌羊奶中滴加不同浓度的菌液,放置1 h后,再滴加1 mL的PBST溶液,振荡混合,采用离心的方式去除上清液中的脂质和蛋白,最后用PBS缓冲液重悬细菌。1.5 金纳米粒子的制备
根据 Turkevich-Frens法[25-26],采用柠檬酸三钠还原氯金酸完成金纳米粒子的制备。金纳米粒子的粒径以改变还原剂使用量的方式控制。在搅拌状态下将0.5 mL 1 mmol∙L-1的HAuCl4与18.5 mL的水加热,沸腾后迅速将其加入到0.5 mL 0.01 mol∙L-1的柠檬酸三钠溶液中。等待约数分钟后,可观察到溶液颜色变为酒红色,此时不再加热,搅拌溶液并将其在室温下自然冷却。将还原生成的金纳米粒子置于棕色试剂瓶内保存于4℃。1.6 氧化石墨烯的制备
采用传统的Hummers方法[27-28]完成氧化石墨烯的制备。详细步骤为:在冰浴条件下,依次将2.0 g的石墨片和1.6 g的硝酸钠加入体积为67.5 mL的98%的H2SO4中;然后加入9.0 g KMnO4并磁力搅拌35 min;室温下搅拌5 d后取560 mL超纯水缓慢加入反应釜后,用30% H2O2溶液处理至悬浮液变为亮黄色;最后离心处理悬浮液,清洗烘干,即得氧化石墨烯。1.7 DNA-复合纳米材料的制备
在10 mL稳定分散的氧化石墨烯(1 mg∙mL-1)中加入80 µL质量分数为80%的水合肼,加热至90℃后不断搅拌12 h,制得的黑色还原氧化石墨烯经双蒸水多次洗涤后离心收集。将5 mL 1 mg∙mL-1的还原氧化石墨烯与5 mL 1 mg∙mL-1的甲苯胺蓝溶液在室温下搅拌24 h混合均匀,在π-π键的作用下[29],甲苯胺蓝与还原氧化石墨烯相结合而得到Tb-rGO杂化复合纳米材料。取5 mg Tb-rGO复合纳米材料经多次离心水洗分散到10 mL金纳米溶胶(AuNPs)中后搅拌30 min。将按上述方法制备的AuNPs-Tb-rGO复合纳米材料再次离心后重悬在 10 mL双蒸水中,之后与200 µL 2 µmol ∙L-1带有氨基的DNA链(S1)在4℃下孵育12 h。在氨基与纳米金溶胶的强作用下[30],S1被标记到AuNPs-Tb-rGO上得到DNA-复合纳米材料S1-AuNPs-Tb-rGO。离心除去未结合的DNA,再将得到的DNA-复合纳米材料重新分散在10 mL的双蒸水中置于4℃下保存备用[18]。1.8 基于酶切信号放大的电化学适体传感器的构建
整个构建过程如图1所示。将裸金电极在加入了0.05 µm三氧化二铝粉末的鹿皮上反复打磨至金电极表面光滑。然后将电极用去离子水冲洗后超声处理5分钟。将浓硫酸滴加到金电极表面保持10 min,然后用去离子水冲洗掉残留在金电极表面的污染物。在金电极上滴涂浓度为2 µmol∙L-1的沙门氏菌适配体互补链(S2)10 µL,室温下孵育一段时间后用PBS缓冲液冲洗,再将10 µL 1 mmol∙L-1的己硫醇(HT)溶液滴涂于电极表面反应1 h以起到封闭电极的作用[18]。然后将浓度为2 µmol∙L-1 的沙门氏菌适体链(Apt)10 µL滴涂于电极表面,一段时间后用PBS缓冲液冲洗。随后将电极浸入含不同浓度沙门氏菌和一定浓度核酸外切酶I(Exo I)中37℃下反应30 min后,用PBS缓冲液冲洗。最后与10 µL S1-AuNPs-Tb-rGO杂交反应2 h。采用循环伏安法(CV)和电化学阻抗法(EIS)记录S1-AuNPs-Tb-rGO中Tb的电化学信号,实现对沙门氏菌的检测。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1电化学适配体传感器检测沙门氏菌原理图
-->Fig. 1Principles of the electrochemical aptasensor for detection of Salmonella
-->
1.9 电化学测试方法
循环伏安(CV)、差分脉冲伏安(DPV)和电化学阻抗(EIS)检测采用三电极系统,被互补链修饰的金电极为工作电极,Ag/AgCl电极为参比电极,铂电极为对电极。CV和EIS的检测环境为5 mmol∙L-1 K3[Fe(CN)6]/K4[Fe(CN)6]溶液,由200 mmol∙L-1 PBS (含100 mmol∙L-1 KCl,pH 7.0)配制。DPV的检测环境为10 mmol∙L-1 PBS缓冲溶液(含20 mmol∙L-1 KCl, pH 7.0)。CV扫描范围为-0.2—0.6 V,扫描速率为100 mV∙s-1。DPV初始电位为0 V,终止电位为0.4 V,电位增量为0.004 V,振幅为0.05 V,脉冲宽度为0.05 s,采样宽度为0.016 s。EIS振幅为0.005 V,频率范围为1—100 000 Hz。2 结果
2.1 修饰电极的电化学表征
采用电化学阻抗法(EIS)和循环伏安法(CV)检测本研究所构建的传感器,以完成对各步骤电极修饰情况的验证。对于EIS,[Fe(CN)6]4-/3-耦合作为氧化还原探针,电荷转移所受到的阻力(Ret)由阻抗图谱来判断。如图2-A所示,裸金电极(a)呈现的半圆很小,这是因为电子可以在裸金电极上自由移动。当沙门氏菌适配体互补链自组装到金电极上后,由于单链DNA上的负电荷磷酸盐骨架对电子在电极和 Fe(CN)63-/4-溶液中的转移形成阻碍,而导致Ret(b)增大。当滴加的沙门氏菌适配体与其互补链杂交形成双链DNA结构后,金电极上负电荷的增加导致Ret(c)进一步增加。当沙门氏菌被检测到后,由于沙门氏菌与适配体结合将适配体带离金电极表面,会导致电极上负电荷减少,对电子移动的空间阻力减小,同时,Exo I将适配体不断剪切从而释放沙门氏菌循环利用,使得未滴加Exo I的电极Ret(d)减小程度较滴加Exo I的电极Ret(e)小。加入S1-AuNPs-Tb-Gra后,由于Tb是一种电化学活性物质,可以促进电子的传递,故半圆直径明显减小(f)。同时用CV法进行验证,结果如图2-B所示。由图可知CV法与EIS法所得出的结果相吻合。通过这两种方法可以证明本试验每一步得到了准确的修饰。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2在铁氰化钾溶液中电极的表征图EIS(A)和CV(B)
-->Fig. 2EIS (A) and CV (B) at different electrodes in Fe(CN)63-/4-
-->
2.2 条件优化
为了优化传感器性能,本研究对沙门氏菌的孵育时间、Exo I的浓度、S1-AuNPs-Tb-rGO的浓度进行了优化。图3-A主要反应的是电化学信号与沙门氏菌孵育时间的关系,由图可知电化学信号随着孵育时间的增加不断增大,但当孵育时间超过60 min后,电化学信号的增大趋于稳定,说明60 min足够让沙门氏菌将适配体带离,因此选择60 min作为试验的最优孵育时间。Exo I的浓度也对电化学信号存在影响,因此也对Exo I的浓度进行了优化,从图3-B可以看出当Exo I浓度达到0.6 U∙µL-1时,电化学信号达到最大,因此选择0.6 U∙µL-1作为最适酶浓度。在一定范围内,S1-AuNPs-Tb-Gra的加入浓度对电化学信号的增加有着很大的影响,由图3-C可知当加入浓度从0升高到200 nmol∙L-1,电化学信号增加明显,200 nmol∙L-1后趋于稳定,因此选择200 nmol∙L-1作为S1-AuNPs- Tb-GO的最适浓度。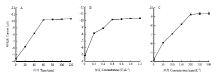 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3试验条件的优化:(A)孵育时间(B)Exo I浓度(C)S1-AuNPs-Tb-Gra浓度
-->Fig. 3Dependences of DPV peak currents on incubation time (A), Exo I concentration (B), and S1-AuNPs-Tb-Gra concentration (C) when one parameter changed and the others were under their optimal conditions
-->
2.3 电化学传感器检测分析性能的考察
在最优的试验条件下考察本试验所构建的电化学适配体传感器对沙门氏菌的检测性能。图4-A为将传感器电极在不同浓度的沙门氏菌菌液中孵育1 h后所得到的差分脉冲伏安(DPV)曲线图,包括空白对照组及不同稀释梯度的沙门氏菌菌液的检测结果。当菌液浓度增大,峰电流也随之逐渐增大,并且在菌液浓度为6×102—6×106 cfu/mL时,传感器差分脉冲伏安曲线(DPV)的峰电流差值与菌液浓度的对数保持良好的线性关系,线性方程为I(µA)=-2.5085x-2.8573(r2=0.9991),检测限为200 cfu/mL(S/N=3)(图4-B)。该方法能在1 h内实现对沙门氏菌的检测,与传统的分离培养法相比,该方法更加简便、经济、高效(表1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同浓度的沙门氏菌(0—6×107 cfu/mL )对应的DPV曲线(A)及DPV峰电流差值与沙门氏菌浓度的校正曲线(B)
-->Fig. 4The DPV curves obtained when detecting Salmonella in different concentrations (0-6×107 cfu/mL) and the calibration curve
-->
Table 1
表1
表1本研究与其他文献报道的沙门氏菌传感器性能的比较
Table 1Performance compared with other reported aptasensors for Salmonella detection
| 检测方法 Detection method | 线性范围 Linear range (cfu/mL) | 最低检出限 LOD (cfu/mL) | 检测时间 Detection time | 参考文献 Reference |
|---|---|---|---|---|
| 电化学免疫传感器 Electrochemical immunosensor | 1×102—1×106 | 1×105 | 2 h | [31] |
| 电化学磁弛豫时间免疫传感器 Electrochemical magnetic relaxation switch (MRS) immunosensor | 5×103—1×106 | 1×103 | 30 min | [32-34] |
| 电化学纳米传感器 Electrochemical nano immunosensor | 1×103—1×107 | 5×102 | NG | [35] |
| 电化学磁性硅纳米管免疫传感器 Electrochemical magnetic silica nanotube immunosensor | 1×103—1×107 | 1×103 | 30 min | [36] |
| 电化学纳米免疫传感器 Electrochemical nano immunosensor | 1×103—1×106 | 143 | 1.5 h | [37] |
| 电化学纳米适配体传感器 Electrochemical nano aptasensor | 1×103—1×108 | 1×102 | NG | [38] |
| 电化学纳米适配体传感器 Electrochemical nano aptasensor | 6×102—6×106 | 2×102 | 1 h | 本研究This study |
新窗口打开
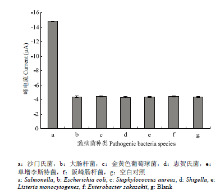
为了验证该传感器的特异性,在相同的条件下对另外5种细菌进行了检测,5种细菌分别为大肠杆菌、金黄色葡萄球菌、志贺氏菌、单增李斯特菌和阪崎肠杆菌。结果如图5所示,其他5种非沙门氏菌细菌的电化学响应信号接近于空白信号,且明显低于沙门氏菌的电化学响应信号,由此可以得出本试验所构建的电化学传感器在对于沙门氏菌的检测上特异性良好。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同细菌的电化学信号柱状图
-->Fig. 5Comparison of DPV peak currents after reaction with different target bacteria
-->
为了确保该传感器的重复性,本研究进行了一组平行试验:以相同的方法制备同批次的7根工作电极,在最优条件下,将工作电极在稀释倍数为10-6的沙门氏菌菌液中孵育30 min,并分别测量各峰电流值的变化,计算出RSD为4.2%(n=7),证明本研究所构置的电化学适配体传感器具有良好的重复性。
2.4 实际样本测定和加标回收试验
利用本研究构建的电化学适配体传感器对按1.4的方法预处理的含不同浓度沙门氏菌的羊奶样品进行检测,并与平板计数法作对比,计算回收率。由表2可知本方法与平板计数法检测结果相吻合,回收率为91.6%—106.3%。这表明本研究构建的电化学适配体传感器检测沙门氏菌准确性高,可以用于实际样本的检测。Table 2
表2
表2羊奶样品中沙门氏菌的检测回收率
Table 2The recovery of Salmonella detection in goat milk
| 样本编号 Sample number | 初始浓度 Initial concentration (cfu/mL) | 加入量 Adding amount (cfu/mL) | 检出量 Detectable amount (cfu/mL) | 回收率 Recovery rate (%) | 相对标准偏差 RSD (%) |
|---|---|---|---|---|---|
| 1 | 0 | 128 | 未检出 Not found | 未检出 Not found | — |
| 2 | 0 | 230 | 211 | 91.7 | 5.0 |
| 3 | 0 | 464 | 493 | 106.3 | 4.2 |
| 4 | 0 | 690 | 715 | 103.6 | 2.9 |
新窗口打开
3 讨论
本研究所构建的电化学适配体传感器具有良好的灵敏性、特异性和稳定性,其成功构建的关键因素主要有以下3个方面:首先,石墨烯的比表面积大,导电性能优异,热稳定性极佳,是当下最热门的纳米材料之一[11-17]。将石墨烯通过强氧化剂处理,在其表面修饰羟基、羧基、环氧基团等含氧官能团可以大幅度提高其亲水性和分散性从而得到氧化石墨烯 [39]。但氧化石墨烯导电能力差,限制了其在生物传感器中的应用,为了克服这一缺点,氧化石墨烯通常要通过强还原剂或电化学还原法还原为还原氧化石墨烯(reduced graphene oxide,rGO),使其在具有氧化石墨烯良好性能的同时拥有优异的导电性[40]。现已有报道表明还原氧化石墨烯可以通过π-π堆积、氢键、静电力等方式有效吸附多种有机染料[41-42],本研究将电化学活性有机染料甲苯胺蓝与rGO结合形成Tb-Gra复合物,在提高rGO溶解性的同时也使Tb的固载量大幅度增加,实现了电化学信号的放大。
其次,由于核酸外切酶I的剪切特点是从3′到5′方向按序催化水解磷酸二酯键,最终产物为单个核苷酸,仅作用于单链DNA,且不依赖特定的DNA序列,故本研究引入此酶进行电化学信号的放大。当传感器检测到沙门氏菌后,由于沙门氏菌与其适配体的高强度特异性结合,适配体被带离电极表面,此时核酸外切酶I迅速作用于适配体链,将其剪切为单个核苷酸。当适配体被剪切后,沙门氏菌被释放出来继续作用于电极上的适配体,将更多的适配体链带离,以此实现沙门氏菌的循环作用。
另外,由SELEX技术筛选出的适配体通常为15—40个碱基对长的DNA或RNA序列,其化学性质稳定,靶分子不仅包括小分子,也包括细胞核大分子生物分子,氨基酸、各种种类的蛋白质(酶、膜蛋白、病毒蛋白、细胞因子、生长因子和免疫球蛋白)、药物、金属离子、甚至整个细胞都可与适配体特异性结合[43]。本研究利用沙门氏菌适配体与沙门氏菌菌体的高强度结合,使适配体链与互补链分离,标记有电化学活性物质Tb的S1-AuNPs-Tb-rGO链与固定在电极表面的互补链杂交,实现电化学信号的放大。同时由于适配体与菌体的特异性结合,保证了传感器的高度特异性。
4 结论
本研究成功构建了一种基于复合纳米材料及酶切循环双重信号放大的沙门氏菌电化学适配体传感器。该传感器对沙门氏菌的电化学检测具有线性范围宽,检出限低,灵敏度高,特异性好的特点,所构建的传感器也成功用于实际样品羊奶中沙门氏菌的检测。因此,本研究所构建的沙门氏菌电化学适配体传感器有望应用于食品工业中沙门氏菌的定量检测,同时也可以为其他食源性致病菌的检测提供一种新型的检测平台。The authors have declared that no competing interests exist.
