0 引言
【研究意义】近年来,随着东西方文化的碰撞渗透、交汇融合,西餐文化在中国不断发展。西餐重营养而轻美味,多数西方人喜欢半熟偏生的牛排;而中国传统烹饪要求原料入味,多数菜肴完全成熟后才会食用,肉制品更会达到高熟度的要求。高熟度牛肉是独具中国特色的肉制品,产品加工时间长,终点温度高,具有独特的嫩度特性。中国传统烹饪下的高熟度牛肉加工时间至少1 h,其中心温度接近100℃,甚至更高。本研究根据中国特色高熟度牛肉,通过提高加热温度、延长加热时间来探究胶原蛋白特性对嫩度的影响,探讨高熟度牛肉嫩度特性的形成原因,为中国传统烹饪文化提供理论基础。【前人研究进展】牛肉一直以来在中国倍受青睐,但牛肉的品质问题一直是影响消费者选择的关键因素[1]。肉的食用品质包括风味、嫩度和多汁性。其中嫩度是消费者在评估饮食可接受性时最重要的因素[2]。影响嫩度的因素有很多,目前认为肌纤维、结缔组织、肌内脂肪是影响牛肉嫩度的首要因素[3]。有****将影响肉嫩度的因子进行了排序,分别是肌纤维强度、肌节长度、pH和结缔组织特性,该次序并不受肌肉类型、动物种类、年龄和性别影响。加热对肉嫩度的影响一直以来是****的研究重点,DYMIT[4]在178℃下将牛肋骨肉加热1.5 h,然后在60℃下保持3—48 h,牛肉的风味、嫩度和多汁度均有所改善。CHRISTENSEN等[5]在53℃下加热老年母牛肉和幼年公牛肉,老年母牛剪切力明显较高。在63℃下加热15 h后,二者嫩度相当。显然,老年母牛需要更高的温度和更长的加热时间才能和年轻公牛达到一样的嫩度水平。两者的一个明显区别是结缔组织耐热强度不同,这是胶原蛋白分子不同程度的共价交联造成的。幼年公牛从53℃到55℃增加温度2℃或在53℃的加热温度下延长加热时间5 h,结缔组织强度显著降低。由于延长了加热时间、提高了加热温度,胶原蛋白溶解度随之增加。这表明长时间加热对于肉嫩度的改善涉及到了胶原蛋白的溶解。SÁNCHEZ等[6]利用组织学分析研究了60℃和80℃长时间加热下猪脸肉胶原纤维的变化情况,研究表明在60℃下加热12 h,组织大多被破坏,与在80℃加热12 h相比胶原纤维没有完全变性。由此说明加热温度和时间均会对肉嫩度产生一定的影响,尤其是长时间加热导致肉嫩度的改善主要涉及到结缔组织胶原蛋白特性的变化。结缔组织的主要存在形式肌内膜和肌束膜是由镶嵌在蛋白多糖基质中胶原蛋白和弹性纤维构成的复合网状结构形成的[7]。一些研究认为随着动物年龄的增长,肉嫩度降低、剪切力增加的原因有很多,其中包括胶原蛋白含量增加以及肌束膜变厚[8,9]。GIRARD等[10]认为肌原纤维和肌束膜、肌内膜的结构完整性是影响熟肉嫩度的主要原因。胶原蛋白和嫩度的复杂关系引起了广大****的关注,早期的研究表明嫩度主要由胶原蛋白决定[11]。然而,也有报道称,胶原蛋白的作用力远不及肌纤维[12]。有****研究瑞士布朗公牛得出,在生肉中,剪切力与总的胶原蛋白含量有很高的相关性[13]。DRANSFIELD等[14]研究也得出在生肉中嫩度与胶原蛋白的含量有极高的相关性。TORRESCANO[13]在研究中发现,胶原蛋白总量和剪切力在生肉中呈现很强的正相关,然而在熟肉中,相关性很低。KIM等[15]研究得出,胶原蛋白热溶解性越大,肉质越嫩。越来越多的研究证实,嫩度与胶原蛋白的空间结构也有一定的关系。胶原蛋白分子主要形成两种类型的交联,一种是基于半胱氨酸的二硫键[16],另一种是基于赖氨酸和羟赖氨酸的吡啶交联,分别形成羟赖氨酸吡啶啉(HP)与赖氨酸吡啶啉(LP)[17]。胶原蛋白之间的成熟交联为结缔组织提供其所需的物理化学性质和生物学稳定性[18]。纵观动物的生命周期,胶原纤维之间的共价交联数目会逐渐增加,并会反过来提高胶原蛋白的热稳定性,不同类型的交联或多或少都具有一定的热稳定性,共价交联成熟度与胶原蛋白含量协同影响牛肉嫩度。ROY等[19]提出了胶原蛋白的橡胶理论,经研究发现每单位体积熟肉中胶原蛋白交联数量的增加与肉嫩度降低的比例接近一致,也就是说胶原蛋白共价交联总量越少,牛肉越嫩。【本研究切入点】加热是将肉从不可食变到可食的过程,通过破坏肉的完整性使肉更容易被肠胃消化[20],在加热过程中牛肉发生了一系列感官特性的变化,通过人的感知可以被一些与风味、口感和质地有关的描述词描述出来,那就是多汁性、嫩度、质构特性。这些“感官特性”受到了内在因素和外在因素的影响,外在因素受到一些技术参数的影响,对于热处理来说,主要技术参数便是加热时间和温度。加热温度和加热时间都会影响到肉的最终嫩度。加热过程中结缔组织特性起到了很大的作用,但是以往的众多研究中,大多只是加热温度恒定,或者加热时间恒定,因此不能实际动态反映胶原蛋白对肉质变化的影响。加热过程中胶原蛋白会发生一系列变化如变性溶解凝胶化等,但这些变化究竟是如何影响嫩度的还未知。【拟解决的关键问题】本研究通过测定牛半腱肌肉的剪切力、蒸煮损失、质构特性、结缔组织机械强度、胶原蛋白含量及热溶解性、共价交联等指标来探究牛肉胶原蛋白特性以及食用品质的变化,拟解决不同加热温度和加热时间如何通过胶原蛋白特性影响肉的最终嫩度,以及胶原蛋白的特性变化如何影响嫩度这两个问题。1 材料与方法
试验于2017年在北京畜牧兽医研究所畜产品质量安全研究室进行。1.1 试验材料
牛半腱肌,选自同一牛场、品种和饲养管理均一致的河南夏南牛6头,24月龄。屠宰后牛半胴体在4℃冷库中倒挂成熟48 h后取样,从半胴体上取下整条左侧半腱肌,所选胴体其大理石花纹、生理成熟度和背标厚度等指标水平一致。真空包装, -20℃贮运。1.2 试剂与仪器
浓硫酸、一水柠檬酸、氢氧化钠、无水乙酸钠、正丙醇、异丙醇、氯胺T、对二甲基氨基苯甲醛、4-羟基-α-吡咯甲酸、戊二醛、乙醇、丙烯酰胺、过硫酸铵、四甲基乙二胺均为分析纯,购于国药集团化学试剂北京有限公司。数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;TA-XT plus物性测试仪,英国Stable Micro System公司;电热恒温鼓风干燥箱,上海森信实验仪器有限公司;DHP-9052型电热恒温培养箱,上海一恒科技有限公司,上海益恒实验仪器有限公司;FJ-200高速分散均质机,上海标本模型厂制造;电子天平,北京赛多利斯仪器系统有限公司; TGL16MB高速冷冻离心机,湘智离心机仪器有限公司;6100型紫外可见分光光度计,上海元析仪器有限公司。
1.3 试验设计
1.3.1 加热处理 在4℃条件下将冻存肉样解冻24 h,去掉肉块表面的脂肪和肌外膜,切割成大小为2.5 cm×5.0 cm×5.0 cm的肉块若干并称重,用蒸煮袋包装,分组,在60、70、80、90和100℃不同温度水浴锅中加热,分别加热30、60、90、120和150 min,当达到时间后,立即取出流水冷却至室温,用吸水纸吸干肉块表面汁液,称重,待分析。1.3.2 蒸煮损失测定 参照LI等[21]的方法。蒸煮前后的肉重分别是 W1、W2。
蒸煮损失(%)=$\frac{{{W}_{1}}-{{W}_{2}}}{{{W}_{1}}}$×100
1.3.3 剪切力值测定 用直径为1.27 cm的圆柱形空心取样器沿肌纤维方向取5个长条肉柱,使用TA.XY Plus物性测试仪的HDP/BS刀具进行检测,使肌纤维与刀口运动方向垂直。
1.3.4 质构剖面分析 将1.5 cm×1.5 cm×1.5 cm的肉丁按肌纤维垂直于托板的方向放置,对肉丁进行二次压缩模式质地剖面分析。对硬度、弹性、凝聚性、黏着性、胶黏性、咀嚼性和回弹性等7个指标进行测定。
质构分析参数设定如下:
测前速度:2.00 mm∙s-1,测试速度:1.00 mm∙s-1,测后速度:1.00 mm∙s-1,压缩率:50%,两次压缩间隔时间:5.0 s,触发力:0.98 N,活塞:P/50,温度:20℃,数据获取率:200 PPS。
1.3.5 胶原蛋白热溶解性测定
1.3.5.1 可溶性胶原蛋白和不溶性胶原蛋白的分离 可溶性胶原蛋白和不溶性胶原蛋白的分离采用Ringer’s试剂溶解法。配制Ringer’s试剂(1.8 g NaCl、0.25 g KCl、0.06 g CaCl2·6H20、0.05 g NaHCO3、0.186 g碘乙酸,溶于1 L蒸馏水),精确称量样品5 g(0.0001 g),加入8 mL Ringer’s试剂,用高速分散器将肉样打碎,混匀溶胀60 min后在77℃水浴中加热60 min。加热后冷却至室温,3 300× g离心20 min,收集上清液(此过程重复两次),分离沉淀。
1.3.5.2 水解 按照GB/T9695.23—2008/ISO 3496:1994测定可溶性胶原蛋白和不溶性胶原蛋白中羟脯氨酸的含量。将上清和沉淀分别放入烧瓶中,称取30mL硫酸加入烧瓶,于105℃干燥箱内恒温16 h。趁热将水解产物用滤纸过滤至250 mL容量瓶中,取10 mL硫酸洗涤烧瓶和滤纸,合并至上述容量瓶中,用水定容,摇匀。
1.3.5.3 测定 用移液管移取一定体积(上清液40 mL,沉淀10 mL)的水解产物至250 mL容量瓶中,定容。移取4.00 mL上述溶液于比色管中,加入2 mL氯胺T(缓冲液配制:26.0 g一水柠檬酸,14.0 g氢氧化钠,78 g无水乙酸钠,用500 mL水溶解上述试剂后转入1 L的容量瓶中,加入250 mL正丙醇,用水定容;称取1.41 g三水·对甲苯磺酰胺钠盐,用100 mL上述缓冲液溶解后即得氯胺T),混合后在室温下放置20 min。加入2.00 mL显色剂(用35 mL高氯酸溶液溶解10.0 g对二甲氨基苯甲醛后缓慢加入65 mL异丙醇)于比色管中,摇匀封口。将比色管迅速放入60℃水浴中,加热20 min后用流动水冷却比色管至少3 min,在室温下放置30 min。用水做参比,于(558±2)nm处用分光光度计测定吸光度值。
将测得的羟脯氨酸含量乘以系数7.25换算为胶原蛋白含量,沉淀中羟脯氨酸换算为不溶性胶原蛋白,上清中羟脯氨酸换算为可溶性胶原蛋白,两者相加即为胶原蛋白总量。
1.3.6 肌内结缔组织机械强度测定 按照NISHIMURA等[22]的方法,取1.0 cm×1.0 cm×1.5 cm肉柱,用2.5%戊二醛溶液固定3 d,再在10% NaOH溶液中浸泡5 d(每天换水2次),用蒸馏水充分冲洗肉块,最后将样品浸入7.5%丙烯酰胺(含过硫酸铵(1.5 mg∙mL-1)、TEMED(0.75 μL∙mL-1))聚合3 h,用质构仪检测丙烯酰胺包埋的结缔组织机械强度。
1.3.7 HP和LP的测定 用预冷的PBS(0.1 mol∙L-1,pH 7.4)冲洗组织,称重后将组织破碎,后加入对应体积的PBS于玻璃匀浆器中充分研磨,最后将匀浆液于5 000× g离心8 min,留取上清检测。从室温平衡20 min后的铝箔袋中取出板条,设置标准品孔和样品孔,标准品孔各加不同浓度的标准品50 μL,样品孔中加入待测样本50 μL,除空白孔不加外,标准品孔和样本孔中每孔各加入辣根过氧化物(HPR)标记的检测抗体100 μL,用封板膜封住反应孔,于37℃恒温箱温育60 min,甩去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,弃去洗涤液,吸水纸拍干,如此重复洗板5次。每孔加入底物A、B(试剂盒自带)各50 μL,37℃避光孵育15 min,每孔加入终止液50 μL,15 min内,在450 nm波长处测定各孔的OD值。
1.4 数据处理和统计分析
所有试验数据采用SPSS 22统计软件进行统计分析,处理组之间差异显著性分析采用邓肯氏多重比较法,数据采用平均值±标准差的表示方法,相关性分析采用Spearman相关系数分析法。2 结果
2.1 不同加热时间下蒸煮损失及水分含量的变化
在不同的水浴温度下加热,延长加热时间,牛半腱肌肉的蒸煮损失和水分变化如图1所示。随着加热温度的升高和时间的延长,蒸煮损失呈上升趋势。60℃下加热90和120 min蒸煮损失差异不显著,其余各加热时间蒸煮损失差异均显著( P<0.05);80℃下加热30 min、60 min与120 min和150 min差异均显著( P<0.05);100℃下加热60—150 min变化较稳定。随着加热时间的延长,蒸煮损失逐渐增加,这一现象与ZIELBAUER等[23]的研究结果一致。水分含量随着加热温度时间的延长呈下降趋势,在60℃下加热30—90 min与120—150 min牛肉水分含量差异显著( P<0.05);在80℃下加热30—60 min与90—150 min差异显著( P<0.05);在90℃下加热30—90 min与120 min、150 min牛肉水分含量差异显著( P<0.05)。除了在70℃和80℃下加热30 min水分含量差异不显著外,其他不同温度组间水分含量差异均显著( P<0.05)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同加热温度和时间下蒸煮损失和水分的变化不同大写字母表示相同加热时间不同加热温度间差异显著( P<0.05);不同小写字母表示相同加热温度不同加热时间差异显著( P<0.05)。下同
-->Fig. 1Changes in cooking loss and moisture contends at different heating temperatures and timesDifferent capital letters indicate significantly differences among different heating temperatures and the same heating time ( P<0.05); Different lowercase letters indicate significantly differences among same heating temperature and different heating time ( P<0.05). The same as below
-->
2.2 不同加热时间下剪切力的变化
如图2所示,随着加热时间的延长,剪切力呈下降趋势。100℃加热30 min和60—150 min呈显著性差异( P<0.05),70℃加热各时间点间差异不显著( P>0.05),60℃加热30 min、90 min和60 min、120 min、150 min之间差异显著( P<0.05)。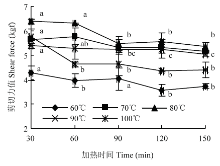 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同加热温度和时间下剪切力的变化
-->Fig. 2Changes in shear force under different heating temperatures and times
-->
2.3 不同加热时间牛肉质构特性的变化
对牛半腱肌肉进行质构特性分析,结果如图3所示。TPA质地多面分析法可以直观反映加热过程中牛肉半腱肌肉质构特性的变化情况,除弹性变化不明显外,硬度、凝聚性、回弹性、胶黏性和咀嚼性均大体呈下降趋势,黏着性呈上升趋势。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同加热温度和时间下质构特性的变化
-->Fig. 3Changes of texture characteristics under different heating temperatures and time
-->
2.4 不同加热时间下牛半腱肌肉中胶原蛋白的变化情况
图4分别反映了不同加热温度与时间下牛半腱肌中总胶原蛋白、可溶性胶原蛋白、不溶性胶原蛋白含量以及胶原蛋白热溶解性的变化情况。在100℃时,随着加热时间延长到90 min后,可溶性胶原蛋白的含量和胶原蛋白的热溶解性显著上升( P<0.05);其他温度下随着加热时间的延长,可溶性胶原蛋白的含量以及热溶解性变化不明显,大体上呈上升趋势。总胶原蛋白和不溶性胶原蛋白的含量随着加热时间的延长,变化不明显,大体呈轻微下降趋势。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同加热时间下胶原蛋白的变化
-->Fig. 4Changes in collagen at different heating temperatures and times
-->
2.5 不同加热时间下牛半腱肌肉结缔组织机械强度的变化情况
由图5可以看到,随着加热时间的延长,牛半腱肌肉结缔组织机械强度大体呈3阶段变化。在30—60 min,机械强度明显下降,60—120 min,机械强度显著增加( P<0.05),120—150 min,机械强度又显著降低( P<0.05)。有研究认为结缔组织机械强度与每单位熟肉中交联链的数目成正比,并具有很高的相关性。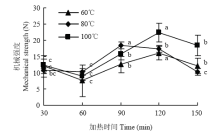 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同加热温度时间下结缔组织机械强度的变化
-->Fig. 5Changes in mechanical strength under different heating temperatures and times
-->
2.6 不同加热时间下胶原蛋白共价交联的变化情况
从图6可以看出,各个温度下,随着加热时间的延长,羟赖氨酸吡啶啉的含量呈上升趋势,赖氨酸吡啶啉的含量大体呈下降趋势。牛肉在70℃、80℃和100℃下延长加热时间,HP的含量呈现部分组内差异显著( P<0.05);LP的含量在60℃下加热30 min与90、150 min,70℃下加热30 min与60、150 min,90℃下加热90 min与30、60、150 min差异显著( P<0.05)。说明加热时间对牛肉共价交联量有显著影响( P<0.05)。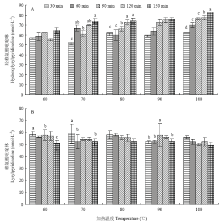 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6不同加热温度和时间下胶原蛋白共价交联的变化
-->Fig. 6Changes in collagen cross-linkig under different heating temperatures and times
-->
2.7 扫描电镜观察
从图7可以看出不同温度、不同时间下结缔组织的变化情况,发现结缔组织的破损情况比肌纤维严重得多。60℃下加热30—60 min,肌束膜和肌内膜结构相对规则清晰,肌束膜将肌纤维紧密束在一起,肌纤维和肌内膜贴合较紧密;从纵截面图中可以看到此时肌束膜和肌内膜发生了较为轻微的破裂。延长加热时间至90—120 min时,肌束膜收缩,肌纤维束间出现细小空隙;从纵截面来看,肌内膜破损程度较之前严重。加热至150 min,肌束膜收缩程度变大,肌纤维束间空隙变大,单根肌纤维间仍然较为紧密;观察纵切面可以看到肌纤维与肌内膜剖离,肌纤维表面略微斑驳。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7不同加热时间下牛肉微观结构变化(×500)左列为横截面,右列为纵截面
-->Fig. 7Micro-structural changes of beef at different heating times (×500) The left column show cross section, the right column show longitudinal section
-->
当加热温度为100℃时,加热30 min可以看到肌束膜轻微收缩,各肌纤维束间出现间隙,但观察其纵截面肌纤维束则排列紧密,肌内膜结构较为完整;加热60 min,肌束膜进一步收缩,肌束间空隙增大,肌内膜破损,单根肌纤维之间出现空隙;加热至90—120 min,各肌纤维之间空隙持续增大,肌内膜的完整性完全破坏;继续加热至150 min时,肌束膜肌内膜破损严重,肌纤维束之间、肌纤维之间空隙很大,各肌纤维连接松散,从纵截面也可以看到单根肌纤维断裂,肌内膜破碎呈丝状。
2.8 相关性分析
2.8.1 不同加热时间下剪切力与牛肉品质相关性 由表1可以看出,牛肉剪切力与蒸煮损失呈显著负相关( P<0.05);与水分含量、硬度、凝聚性、胶黏性、咀嚼性和回弹性呈极显著正相关( P<0.01);与总胶原蛋白、可溶性胶原蛋白、不溶性胶原蛋白、胶原蛋白热溶解性及羟赖氨酸吡啶啉含量呈极显著负相关( P<0.01)。然而CHAMBAZ[24]以及BERGE[25]等均研究发现肉嫩度与胶原蛋白的热溶解性相关性很低( r=0.17; r=019),也有****研究得出胶原蛋白间的共价交联与熟肉的嫩度并没有很强的相关性[26],该现象可能与加热时间的长短有关。Table 1
表1
表1不同加热时间下剪切力与牛肉品质相关性分析
Table 1Correlation analysis between shear force and beef quality under different heating times
| 蒸煮损失 Cooking loss | 水分含量 Moisture contents | 总胶原蛋白 Total collagen | 可溶性胶原蛋白 Soluble collagen | 不溶性胶原蛋白 Insoluble collagen | 胶原蛋白热溶解性 Collagen solubility | 羟赖氨酸吡啶啉 HP | |
|---|---|---|---|---|---|---|---|
| 剪切力Shear force | -0.496* | 0.613** | -0.627** | -0.782** | -0.484** | -0.770** | -0.298** |
| 硬度 Hardness | 黏着性 Adhesiveness | 弹性 Springiness | 凝聚性 Cohesiveness | 胶黏性 Gumminess | 咀嚼性 Chewiness | 回弹性 Resilience | |
| 剪切力Shear force | 0.879** | -0.188 | -0.263 | 0.571** | 0.760** | 0.760** | 0.702** |
新窗口打开
2.8.2 不同加热时间下胶原蛋白特性与牛肉品质相关性 由表2可以看到,总胶原蛋白、不溶性胶原蛋白的含量与蒸煮损失呈极显著正相关( P<0.01),可溶性胶原蛋白含量、胶原蛋白热溶解性与蒸煮损失呈显著正相关( P<0.05)。这与MODZELEWSKA-KAPITULA等[27]研究结果相一致,报道称在蒸煮损失和胶原蛋白热溶解性之间存在显著正相关。总胶原蛋白与牛肉硬度、凝聚性、胶黏性、咀嚼性和回弹性呈极显著负相关( P<0.01),与黏着性、弹性呈极显著正相关( P<0.01);可溶性胶原蛋白与牛肉硬度、凝聚性、胶黏性、咀嚼性、回弹性呈极显著负相关( P<0.01);不溶性胶原蛋白与牛肉硬度呈显著负相关( P<0.05),与胶黏性、咀嚼性呈极显著负相关,与黏着性和弹性呈极显著正相关( P<0.01)。
Table 2
表2
表2不同加热时间下胶原蛋白特性与牛肉品质相关性分析
Table 2Correlation analysis between collagen properties and beef quality at different heating times
| 剪切力 Shear force | 蒸煮损失 Cooking loss | 水分含量 Moisture contents | 总胶原蛋白 Total collagen | 可溶性胶原蛋白 Soluble collagen | 不溶性胶原蛋白 Insoluble collagen | 热溶解性Collagen solubility | 羟赖氨酸吡啶啉 HP | |
|---|---|---|---|---|---|---|---|---|
| 总胶原蛋白 Total collagen | -0.627** | 0.832** | -0.775** | 1 | 0.631** | 0.969** | 0.453* | 0.533** |
| 可溶性胶原蛋白 Soluble collagen | -0.782** | 0.474* | -0.442* | 0.631** | 1 | 0.419* | 0.963** | 0.458* |
| 不溶性胶原蛋白Insoluble collagen | -0.484* | 0.822** | -0.766** | 0.969** | 0.419* | 1 | 0.223 | 0.478* |
| 热溶解性 Collagen solubility | -0.770** | 0.258* | -0.294 | 0.453* | 0.963** | 0.223 | 1 | 0.328 |
| 赖氨酸吡啶啉 LP | 硬度 Hardness | 黏着性 Adhesiveness | 弹性 Springiness | 凝聚性 Cohesiveness | 胶黏性 Gumminess | 咀嚼性 Chewiness | 回弹性 Resilience | |
| 总胶原蛋白 Total collagen | -0.389 | -0.648** | 0.616** | 0.681** | -0.516** | -0.679** | -0.679** | -0.526** |
| 可溶性胶原蛋白 Soluble collagen | -0.396 | -0.884** | 0.201 | 0.238 | -0.832** | -0.799** | -0.799** | -0.849** |
| 不溶性胶原蛋白 Insoluble collagen | -0.329 | -0.477* | 0.656** | 0.721** | -0.339 | -0.540** | -0.540** | -0.345 |
| 热溶解性 Collagen solubility | -0.283 | -0.883** | -0.026 | 0.028 | -0.803** | -0.782** | -0.782** | -0.815** |
新窗口打开
2.8.3 不同加热时间下胶原蛋白共价交联与牛肉
品质相关性 由表3可以看出,HP与剪切力呈极显著负相关( P<0.01),与蒸煮损失、总胶原蛋白含量以及黏着性呈极显著正相关( P<0.01);与可溶性胶原蛋白含量、不溶性胶原蛋白含量及弹性呈显著正相关( P<0.05);与胶黏性和咀嚼性呈显著负相关( P<0.05)。LP与蒸煮损失、弹性呈显著负相关( P<0.05),与凝聚性呈显著正相关( P<0.05),与回弹性呈极显著正相关( P<0.01)。ROY等[19]认为胶原蛋白的热溶解性与共价交联的密度之间没有相关性,与本研究结果一致。
Table 3
表3
表3不同加热时间下胶原蛋白共价交联与牛肉品质相关性分析
Table 3Correlation analysis between collagen crosslinking and beef quality at different heating times
| 剪切力 Shear force | 蒸煮损失 Cooking loss | 水分含量 Moisture contents | 总胶原蛋白 Total collagen | 可溶性胶原蛋白 Soluble collagen | 不溶性胶原蛋白 Insoluble collagen | 热溶解性 Collagen solubility | |
|---|---|---|---|---|---|---|---|
| HP | -0.298** | 0.665** | -0.479* | 0.533** | 0.458* | 0.478* | 0.328 |
| LP | 0.122 | -0.402* | 0.302 | -0.389 | -0.396 | -0.329 | -0.283 |
| 硬度 Hardness | 黏着性 Adhesiveness | 弹性 Springiness | 凝聚性 Cohesiveness | 胶黏性 Gumminess | 咀嚼性 Chewiness | 回弹性 Resilience | |
| HP | -0.337 | 0.553** | 0.425* | -0.359 | -0.410* | -0.410* | -0.373 |
| LP | 0.276 | -0.230 | -0.420* | 0.450* | 0.237 | 0.237 | 0.526** |
新窗口打开
3 讨论
3.1 加热过程中肉品质变化分析
在加热过程中,随着加热时间的延长,牛肉半腱肌肉蒸煮损失随着中心温度的升高、加热时间的延长而增加,肌内水分含量随着中心温度的升高、时间的延长而降低。肉中的蛋白质组织分为肌原纤维(50%—55%)、肌质(30%—34%)和结缔组织(10%—15%)。加热使这些蛋白质热变性,从而使肌肉的化学物理特性发生变化。加热过程中,肌浆蛋白膨胀并形成凝胶,肌原纤维和结缔组织收缩[28]。变性程度主要取决于温度和时间,加热温度超过60℃,随着加热时间的延长,肌浆蛋白、肌动蛋白和肌球蛋白逐步变性,由于以上蛋白的变性凝固收缩,肌纤维完整性被破坏,致使纤维间的水分储存空间减少,同时变性导致蛋白疏水基团暴露,使蛋白自身的亲水能力下降,肉内水分流失。而也有一些研究指出,将牛肉组织研磨至肌束膜完全破裂,其蒸煮损失并没有比相同条件下完整肌肉的蒸煮损失低很多。嫩度是最重要的适口性指标之一,剪切力是衡量嫩度的常用指标之一,在本研究的加热过程中,随着时间的延长,剪切力随着加热时间的延长而降低,肉的质构也发生了一系列的变化,除弹性变化不大以外,硬度、凝聚性、回弹性、胶黏性和咀嚼性均大体呈下降趋势,黏着性呈上升趋势。由相关性分析可知,质构特性包括硬度、凝聚性、胶黏性、咀嚼性和回弹性等均与胶原蛋白特性显著相关,所以肉的质构特性与结缔组织的含量以及结构有关不无道理。本研究前期探究了不同中心温度下牛肉质构特性与胶原蛋白特性的关系,发现只有弹性与胶原蛋白的含量有关,由此可见延长加热时间会凸显胶原蛋白特性对肉嫩度的贡献。肌束膜、肌内膜等结缔组织在结构上是弹性十足粘连在一起的网状结构,通过其网状结构将肌纤维连接起来,当胶原蛋白共价交联程度比较大的时候,肉更不容易嚼烂,肉质偏老。
加热过程中肌纤维的收缩不仅会造成其直径和长度的缩短,还会增加胶原纤维热收缩的幅度,有研究表明肌纤维对肉嫩度的贡献之一是调节结缔组织的机械强度[29]。TORNBERG等[28]研究表明,肉的嫩度与60℃以上的弹性呈正相关,强调了结缔组织收缩,弹性与嫩度之间的联系。更准确地说,60℃以上的胶原蛋白的收缩使得结缔组织具有高弹性,造成肉嫩度降低的原因可能是收缩导致肌纤维对外的抵抗力增加。
3.2 加热过程中胶原蛋白特性变化分析
本研究中胶原蛋白的含量以及热溶解性变化均不大。而在100℃下延长加热时间,可溶性胶原蛋白的含量及其热溶解性显著增加,这种现象与高温长时加热下蒸煮损失的增加、肌浆蛋白的流失等造成的肌肉干物质含量下降有关。常海军等[30]采用水浴和微波加热牛肉,两种方法下蒸煮损失有显著性差异,对应的胶原蛋白含量也呈显著性差异,说明胶原蛋白含量的变化主要原因就是蒸煮损失。前人研究认为剪切力值与胶原蛋白含量以及溶解性具有较强的相关性[31],而根据前文的相关性分析可以看出,剪切力值与总胶原蛋白的含量以及胶原蛋白的热溶解性呈显著正相关,除此之外,胶原蛋白的含量越大,肉的弹性也越大。胶原分子由3条左旋的蛋白质α-链组成,α-链进一步缠绕形成右旋的三重超螺旋结构。对于可溶性胶原,是由于加热导致分子的三重螺旋解旋成单股,胶原分子的棒状结构就会变为线圈状结构,而相邻胶原分子间的共价交联就会限制这种转变[32],这些共价交联是由赖氨酸或羟赖氨酸的残基及它们的醛类物质缩合形成。在生肉中吡啶啉的数量与剪切力的大小无关,本研究中随着加热时间的延长,羟赖氨酸吡啶啉的含量呈递增趋势,而赖氨酸吡啶啉的含量呈下降趋势,原因可能是由于醛基酮途径形成的HP的热稳定性要比醛亚胺途径形成的LP的热稳定性高。值得注意的是,经过相关性分析可知,剪切力与HP的含量呈极显著负相关,说明胶原蛋白中羟赖氨酸吡啶啉的含量越高,剪切力越低,而HP具有较强的热稳定性,所以随着加热时间的延长,HP的相对含量增加,剪切力随之下降。有****研究得出胶原蛋白的热溶解性与共价交联的密度之间并没有相关性[19],与本研究结果相一致。HP与肌肉黏着性呈极显著正相关,与弹性呈显著正相关,与胶黏性和咀嚼性呈显著负相关,说明肉的质构特性在很大程度上与胶原蛋白的分子间共价交联有关。本研究中的LP与弹性呈显著负相关,与凝聚性呈显著正相关,与回弹性呈极显著正相关,而短时加热过程中LP的含量与肉的若干质构特性并没有相关性,说明加热时间的确会加重胶原蛋白特性对肉嫩度的影响。
4 结果
加热时间越长,胶原蛋白对牛肉的嫩度影响越大,因此,牛肉的食用品质很大程度上取决于加热时长与胶原蛋白特性,胶原蛋白含量以及共价交联量通过影响肉的质构来改善嫩度。随着胶原蛋白逐步热溶解,可溶性胶原蛋白含量增加,牛肉硬度、凝聚性、胶黏性、咀嚼性、回弹性随之降低,说明牛肉质地改善与胶原蛋白特性有关。羟赖氨酸吡啶啉(HP)与赖氨酸吡啶啉(LP)的形成使胶原蛋白具有很高的机械强度,由于HP具有热稳定性,随着加热时间延长,其占干物质的比重上升,相对含量增加。HP含量与剪切力和胶原蛋白含量有关,与胶原蛋白热溶解性无关。HP相对含量增加,牛肉黏着性和弹性增大,胶黏性和咀嚼性减小,剪切力降低,原因可能是结缔组织强度的增加降低了肌纤维对外的抵抗力度,从而使嫩度得到改善。(责任编辑 赵伶俐)
The authors have declared that no competing interests exist.
