0 引言
【研究意义】由青枯雷尔氏菌(Ralstonia solanacearum)[1]引起的青枯病堪称植物“癌症”,一旦发病,难以防治,造成植物大面积枯萎死亡[2]。生产上主要依靠化学农药[3]、抗性品种[4]、轮作[5]、土壤修复剂[6]等防治方法,但由于各种条件限制,均未能达到预期的防治效果。青枯雷尔氏菌的无致病力菌株可以侵染植株,不引起寄主植物产生病害,可在导管及相邻组织内广泛分布,利用生态位点竞争和营养竞争阻止或延迟强致病力病原菌的侵入,或者激发植物免疫系统产生抗病反应,从而防止或延迟植株发病[7]。利用青枯雷尔氏菌的无致病力菌株研发植物疫苗,在作物苗期预先接种(类似动物的疫苗接种),可对青枯病防治起到良好作用[8]。【前人研究进展】利用无致病力青枯雷尔氏菌防治作物青枯病已有许多成功的报道。FREY等[9,10,11]利用基因工程法获得的无致病力hrp-突变体防治番茄青枯病,均取得良好的防病效果;肖田等[12]从茄子、番茄、辣椒、烟草青枯病株中分离出116株无致病力青枯雷尔氏菌,其中有2株菌具有较好的温室控病效果,20 d后的相对防治效果分别为58.4%和97%;此外,TRIGALET等[13,14,15]分别通过转座子Tn5插入诱变、紫外诱变法、生防菌致弱等途径获得青枯雷尔氏菌无致病力突变菌株防治青枯病,均取得较好的防治效果。然而,在自然状态下,青枯雷尔氏菌致病力分化严重[16,17,18],存在不同致病力菌株混杂现象[19],经继代培养和回接植株也会出现菌株致病力分化现象[20,21]。郑雪芳等[22]研究发现,青枯雷尔氏菌无致病力突变菌株对番茄青枯病的防治效果差异大(8.3%—100%),可能与青枯雷尔氏菌存在不同致病力菌株混杂现象有关。利用青枯雷尔氏菌无致病力菌株研发植物疫苗,要求菌株必须具有高纯度,才能保证其在生防应用中生物学特性和防治效果都具有很好的稳定性。传统的平板划线、稀释培养、毛细管电泳等分离方法,很难鉴定出高纯度的青枯雷尔氏菌[23,24,25]。【本研究切入点】青枯雷尔氏菌在致病力分化过程中,不同致病力菌株的细胞表面特性会发生相应改变[19]。林娟等根据青枯雷尔氏菌单细胞表面化学组成和所带电荷的不同,以强阴离子交换树脂为介质,利用高效离子交换色谱成功实现对不同致病力的青枯雷尔氏菌的快速分离[19,26]。目前已对青枯雷尔氏菌高效离子交换色谱分离条件进行优化,缩短了分离时间(分离一个样品仅需15 min),提高了分离效率[27]。【拟解决的关键问题】笔者前期利用Tn5插入诱变获得一批不同致病力的青枯雷尔氏菌突变菌株,本研究利用高效离子交换色谱对不同致病力突变菌株进行色谱行为分析,进而分析青枯雷尔氏菌突变菌株的色谱行为与其致病力和病害防治效果的相互关系,为青枯雷尔氏菌的致病力快速鉴别和高防治效果无致病力菌株的筛选提供技术支撑。1 材料与方法
试验于2016—2017年在福建省农业科学院农业生物资源研究所完成。1.1 仪器及材料
高效液相色谱仪(Agilent HPLC 1100,美国Agilent公司)、紫外-可见分光光度计(UV-2550,日本岛津公司)、Leica体式显微镜(Leica DMI3000,德国Leica公司)、高速冷冻离心机(Eppendorf 5418R,德国Eppendorf公司)、恒温培养箱(BI250AG,施都凯仪器设备有限公司)、超净工作台(SW-CJ-1F,苏州安泰空气技术有限公司)。不同致病力青枯雷尔氏菌突变菌株是以青枯雷尔氏菌强致病力菌株FJAT-91为出发菌株,利用转座子EZ-Tn5插入诱变获得,供试菌株信息详见表1。番茄种苗购自厦门如意情集团开发有限公司,品种为金石王1号。青枯雷尔氏菌鉴别培养基为TTC(1%蛋白胨、0.1%水解酪蛋白、0.5%葡萄糖、1.8%琼脂和0.05% 2,3,5-氯化三苯基四氮唑),液体培养基为SPA培养基(2%蔗糖、0.5%蛋白胨、0.05% KH2PO4和0.0025% MgSO4)。色谱分离所需平衡缓冲液(A液):0.02 mol·L-1哌嗪-HCl,洗脱缓冲液(B液):0.02 mol·L-1哌嗪-HCl+1 mol·L-1 NaCl。
1.2 试验方法
1.2.1 青枯雷尔氏菌突变菌株的致病力鉴定(1)形态鉴定:供试菌株在TTC平板上活化,30℃、48 h后,在Leica M165FC体视显微镜观察菌落形态。参照刘波等[15]方法,用弱化指数(attenuation index,AI)作为青枯雷尔氏菌致病性力的鉴别指标,AI为青枯雷尔氏菌菌落的红斑直径与菌落直径的比值,AI<0.65为强致病力菌株,AI>0.75为无致病力菌株,AI介于0.65—0.75为中间型菌株。在TTC平板上,每个菌株随机选取10个单菌落,在Leica M165FC电动荧光体视显微镜下测量并计算弱化指数,取平均值。
(2)生物测定:供试菌株在TTC平板活化后,接种SPA培养基中,170 r/min、30℃振荡培养48 h,菌液稀释至1×108 CFU/mL,采用伤根灌注法接种至2—3叶龄的番茄盆栽苗(80 mL/盆),以清水为对照,每处理10盆(4株/盆),3次重复,每天观察植株发病情况,计算发病率。
1.2.2 无致病力突变菌株的防治效果试验 将无致病力突变菌株在TTC平板活化后,接种SPA培养基中,30℃、170 r/min振荡培养48 h,菌液稀释至1×108 CFU/mL,接种2—3叶龄的番茄盆栽苗(80 mL/盆),3 d后再接种强致病力青枯雷尔氏菌FJAT-91(接种浓度1×108 CFU/mL,接种量80 mL/盆),单接种FJAT-91作为对照,每处理10盆(4株/盆),3次重复,每天观察植株发病情况,计算防治效果。
1.2.3 青枯雷尔氏菌的高效离子交换色谱分析
(1)样品制备:供试菌株经TTC培养基活化后,转接于SPA液体培养基中,30℃、170 r/min振荡培养24 h后,取1 mL菌液,8 000 r/min离心10 min,用双蒸水洗涤沉淀物2次,加入200 μL双蒸水溶解,4℃冰箱保存备用。
(2)色谱体系及分离方法:色谱分离材料采用的是强阴离子交换树脂,色谱柱规格200 mm×4.6 mm i.d,流速2 mL·min-1,温度范围23—28℃。色谱分离方法:样品(20 μL)上样后,在0—3 min时用A液进行平衡;在3—8 min时进行线性梯度洗脱,洗脱梯度为0—75%的B液;在8—12 min时,为100%洗脱缓冲液(B液);在12—15 min时转换为平衡缓冲液(100% A液)以平衡系统,从而为下一次试验做准备。
(3)检测系统:整个系统采用紫外检测器进行检测,检测波长为260 nm。
1.2.4 青枯雷尔氏菌色谱效价指数的构建 前期研究发现[24],青枯雷尔氏菌经高效离子交换色谱分离出3个特征谱峰:P1、P2和P3,其中P1和P3分别是无致病力菌株和强致病力菌株的特征峰。构建青枯雷尔氏菌色谱效价指数(chromatography titer index,CTIi),CTIi=Si/(S1+S2+S3)×100%(i=1、2或3;S1、S2和S3分别对应P1、P2和P3的峰面积),i=1且CTI1为100%时,只有P1峰;i=3且CTI3为100%时,只有P3峰;i=1、2或3且0<CTIi<100%时,有2个或3个色谱峰。
1.2.5 青枯雷尔氏菌色谱效价指数与其致病力和病害防治效果的相互关系 用皮尔逊相关系数(Pearson correlation coefficient,PCC)分析青枯雷氏菌强致病力菌株的色谱效价指数CTI3与其致病力的相互关系,无致病力菌株CTI1与病害防治效果的相互关系。(1)将强致病力菌株的色谱效价值CTI3和其致病力(以接种后番茄植株发病率为致病力指标)构成矩阵,以CTI3和致病力为指标,以不同强致病力菌株为样本计算PCC;(2)将无致病力菌株的色谱效价值CTI1和其病害防治效果构成矩阵,以CTI1和病害防治效果为指标,以不同无致病力菌株为样本,计算PCC。PCC计算公式如下[28]:
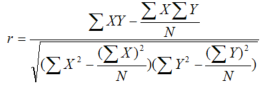
其中,变量X表示强致病力菌株的CTI3或无致病力菌株的CTI1,Y分别表示强致病力菌株的致病力或无致病力突变菌株的防治效果值,N表示样本总数。
2 结果
2.1 青枯雷尔氏菌突变菌株的致病力鉴别
供试青枯雷尔氏菌突变菌株在TTC平板上呈现3种菌落形态:强致病力菌株的菌落表面湿润、流动性强、中间为粉红色、白边较宽(图1-A);无致病力菌株的菌落表面干燥、无流动性、中间为暗红色,白边窄(图1-B);过度型菌株菌落表面湿润、中间为暗红色,白边比较窄(图1-C)。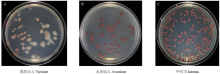 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1青枯雷尔氏菌突变菌株在TTC平板上的菌落形态
-->Fig. 1Colony morphology of R. solanacearum mutants on TTC plate
-->
供试的60株不同致病力青枯雷尔氏菌突变菌株的弱化指数测定结果如表1所示,AI介于0.49—0.89。番茄盆栽试验表明,不同致病力青枯雷尔氏菌突变菌株接种15 d后,番茄植株发病率为0—100%,7株菌株在接种15 d后植株发病率达100%,20株菌株接种15 d后植株发病率为0,继续观察至60 d植株发病率仍然为0。根据AI值和番茄盆栽试验鉴定为强致病力菌株共有33株,AI介于0.49—0.63,植株发病率为66.33%—100%;无致病力菌株共有20株,AI介于0.78—0.89,植株发病率为0;中间型菌株共有7株,AI介于0.68—0.73,植株发病率为24.17%—45.92%。
Table 1
表1
表1供试菌株致病力鉴定
Table 1Pathogenic identification of tested strains
| 菌株Strain | 致病力 Pathogenicity | 弱化指数 Attenuation index (average±SD) | 发病率 Disease incidence (average±SD, %) | 菌株 Strain | 致病力 Pathogenicity | 弱化指数 Attenuation index (average±SD) | 发病率 Disease incidence (average±SD, %) | |
|---|---|---|---|---|---|---|---|---|
| T100 | 强致病力Virulent | 0.52 ±0.04 | 100 | T902 | 强致病力Virulent | 0.61±0.05 | 75.24±1.16 | |
| T183 | 强致病力Virulent | 0.58 ±0.01 | 98.21±2.03 | T906 | 强致病力Virulent | 0.62±0.04 | 66.33±2.81 | |
| T188 | 强致病力Virulent | 0.51 ±0.01 | 100 | T911 | 强致病力Virulent | 0.62±0.08 | 78.98±3.37 | |
| T192 | 强致病力Virulent | 0.49 ±0.05 | 100 | T659 | 无致病力Avirulent | 0.85±0.03 | 0 | |
| T246 | 强致病力Virulent | 0.53±0.02 | 100 | T738 | 无致病力Avirulent | 0.87±0.01 | 0 | |
| T251 | 强致病力Virulent | 0.56±0.03 | 92.85±3.17 | T780 | 无致病力Avirulent | 0.89±0.01 | 0 | |
| T253 | 强致病力Virulent | 0.58 ±0.01 | 87.06±3.52 | T831 | 无致病力Avirulent | 0.88±0.03 | 0 | |
| T256 | 强致病力Virulent | 0.53±0.01 | 100 | T916 | 无致病力Avirulent | 0.87 ±0.01 | 0 | |
| T262 | 强致病力Virulent | 0.56 ±0.05 | 96.46±2.33 | T927 | 无致病力Avirulent | 0.82±0.01 | 0 | |
| T272 | 强致病力Virulent | 0.58 ±0.03 | 86.70±1.43 | T200 | 无致病力Avirulent | 0.81±0.04 | 0 | |
| T312 | 强致病力Virulent | 0.52 ±0.01 | 100 | T443 | 无致病力Avirulent | 0.80±0.02 | 0 | |
| T317 | 强致病力Virulent | 0.56±0.02 | 85.32±2.76 | T520 | 无致病力Avirulent | 0.83±0.05 | 0 | |
| T320 | 强致病力Virulent | 0.53±0.02 | 100 | T838 | 无致病力Avirulent | 0.79±0.02 | 0 | |
| T448 | 强致病力Virulent | 0.54±0.05 | 95.81±5.73 | T917 | 无致病力Avirulent | 0.81±0.03 | 0 | |
| T901 | 强致病力Virulent | 0.56±0.03 | 88.42±3.58 | T996 | 无致病力Avirulent | 0.83±0.04 | 0 | |
| T908 | 强致病力Virulent | 0.58 ±0.04 | 85.75±1.87 | T921 | 无致病力Avirulent | 0.84±0.01 | 0 | |
| T182 | 强致病力Virulent | 0.63 ±0.05 | 76.78±1.75 | T316 | 无致病力Avirulent | 0.78 ±0.02 | 0 | |
| T191 | 强致病力Virulent | 0.56±0.03 | 73.97±2.81 | T343 | 无致病力Avirulent | 0.79±0.05 | 0 | |
| T264 | 强致病力Virulent | 0.60±0.02 | 81.39±3.08 | T474 | 无致病力Avirulent | 0.80±0.05 | 0 | |
| T307 | 强致病力Virulent | 0.62±0.04 | 74.92±4.20 | T497 | 无致病力Avirulent | 0.81±0.03 | 0 | |
| T310 | 强致病力Virulent | 0.58±0.02 | 84.14±1.26 | T499 | 无致病力Avirulent | 0.79±0.02 | 0 | |
| T314 | 强致病力Virulent | 0.59±0.06 | 73.59±2.30 | T912 | 无致病力Avirulent | 0.79±0.05 | 0 | |
| T318 | 强致病力Virulent | 0.63±0.09 | 69.44±1.39 | T913 | 无致病力Avirulent | 0.78±0.03 | 0 | |
| T319 | 强致病力Virulent | 0.62±0.01 | 73.94±1.77 | T278 | 中间型Interim | 0.72±0.02 | 24.17±1.72 | |
| T326 | 强致病力Virulent | 0.56±0.03 | 84.35±2.86 | T322 | 中间型Interim | 0.69±0.06 | 45.92±2.18 | |
| T328 | 强致病力Virulent | 0.60±0.01 | 78.43±1.82 | T199 | 中间型Interim | 0.71 ±0.01 | 36.48±1.21 | |
| T190 | 强致病力Virulent | 0.63±0.03 | 76.92±2.41 | T313 | 中间型Interim | 0.72 ±0.04 | 37.43±1.76 | |
| T193 | 强致病力Virulent | 0.61±0.02 | 76.49±3.97 | T321 | 中间型Interim | 0.70±0.03 | 34.65±3.06 | |
| T306 | 强致病力Virulent | 0.60±0.03 | 79.33±3.90 | T905 | 中间型Interim | 0.73 ±0.03 | 31.83±1.32 | |
| T793 | 强致病力Virulent | 0.63±0.05 | 72.58±2.45 | T910 | 中间型Interim | 0.68 ±0.03 | 40.93±2.34 |
新窗口打开
2.2 青枯雷尔氏菌无致病力突变菌株的防治效果测定
对20株经鉴定为无致病力的菌株进行番茄青枯病的防治效果测定。不同无致病力突变菌株的防治效果差异明显,介于16.68%—92.45%,菌株T831防治效果最好,达91.74%,其次是菌株T780,防治效果为87.51%,菌株T497防治效果最差,为16.68%(表2)。Table 2
表2
表2青枯雷尔氏菌无致病力突变菌株对番茄青枯病的防治效果
Table 2Control efficiency of tested strains against tomato bacterial wilt
| 菌株 Strain | 防治效果 Control efficiency (average±SD, %) | 菌株 Strain | 防治效果 Control efficiency (average±SD, %) | |
|---|---|---|---|---|
| T659 | 80.20±7.09 | T917 | 55.35±2.64 | |
| T738 | 84.17±2.65 | T996 | 68.34±1.41 | |
| T780 | 87.51±4.93 | T921 | 26.72±0.71 | |
| T831 | 91.74±5.57 | T316 | 42.54±0.80 | |
| T916 | 84.88±6.35 | T343 | 63.33±2.16 | |
| T927 | 82.96±5.43 | T474 | 63.62±1.86 | |
| T200 | 32.45±2.68 | T497 | 16.68±0.43 | |
| T443 | 38.97±2.71 | T499 | 53.47±1.68 | |
| T520 | 70.03±1.78 | T912 | 21.33±0.64 | |
| T838 | 37.54±1.02 | T913 | 38.49±1.74 |
新窗口打开
2.3 青枯雷尔氏菌突变菌株的色谱行为分析
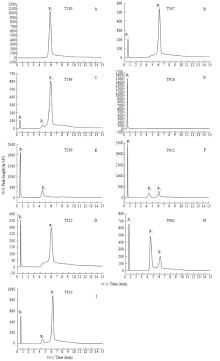
在色谱柱饱和吸附范围内,60株不同致病力突变菌株经过高效离子交换色谱分离得到3种不同峰类型:单峰、双峰和3个峰(表3、图2)。33株强致病力菌株中单峰(只有P3)16株,占48.5%,CTI3为100%;双峰(P1和P3)10株,占30.30%,CTI1介于0.6%—5.9%,CTI3介于94.1%—99.4%;3个峰(P1、P2和P3)7株,占21.2%,CTI1介于1.4%—6.3%,CTI2介于2.0%—15.6%,CTI3介于79.2%—95.9%。20株无致病力菌株中单峰(只有P1)6株,占30.0%,CTI1为100%;双峰(P1和P2)7株,占35.0%,CTI1介于52.5%—97.7%,CTI2介于3.6%—47.5%;3个峰(P1、P2和P3)7株,占35.0%,CTI1介于46.4%—90.7%,CTI2介于4.0%—35.0%,CTI3介于3.7%—31.0%。中间型菌株中只有双峰和3个峰类型,菌株T278有P1和P2两个峰,CTI1和CTI2分别为39.7%和60.3%;菌株T322有P1和P3两个峰,CTI1和CTI3分别为12.0%和88.0%;3个峰的菌株共有5株,CTI1值介于36.5%—52.6%,CTI2值介于22.6%—35.0%,CTI3值介于13.0%—28.5%。Table 3
表3
表3不同青枯雷尔氏菌突变菌株的色谱行为异质性
Table 3Chromatographic behavior heterogeneity of different pathogenic mutants of R. solanacearum
| 菌株Strain | 致病力Pathogenicity | 峰类型Type of peak | 峰1 The first peak (P1) | 峰2 The second peak (P2) | 峰3 The third peak (P3) | CTIi=Si/( S1+S2+S3) × 100% (i=1, 2 or 3) | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| P1保留时间Retention time of P1 (min) | P1 面积 Area of P1 (S1) / (mAU·s) | P2保留时间Retention time of P2 (min) | P2面积 Area of P2 (S2) / (mAU·s) | P3保留时间Retention time of P3 (min) | P3面积 Area of P3 (S3) / (mAU·s) | CTI1 | CTI2 | CTI3 | |||
| T100 | 强致病力 Virulent | 单峰 Single peak | - | - | - | - | 5.9 | 30338.1 | - | - | 100.0 |
| T183 | - | - | - | - | 5.9 | 17268.0 | - | - | 100.0 | ||
| T188 | - | - | - | - | 5.9 | 23028.7 | - | - | 100.0 | ||
| T192 | - | - | - | - | 5.9 | 37787.5 | - | - | 100.0 | ||
| T246 | - | - | - | - | 6.0 | 9333.5 | - | - | 100.0 | ||
| T251 | - | - | - | - | 5.9 | 13910.5 | - | - | 100.0 | ||
| T253 | - | - | - | - | 5.9 | 26125.1 | - | - | 100.0 | ||
| T256 | - | - | - | - | 6.0 | 16990.5 | - | - | 100.0 | ||
| T262 | - | - | - | - | 6.0 | 20070.6 | - | - | 100.0 | ||
| T272 | - | - | - | - | 6.0 | 19825.3 | - | - | 100.0 | ||
| T312 | - | - | - | - | 6.0 | 20883.7 | - | - | 100.0 | ||
| T317 | - | - | - | - | 6.0 | 21666.6 | - | - | 100.0 | ||
| T320 | - | - | - | - | 6.0 | 17994.4 | - | - | 100.0 | ||
| T448 | - | - | - | - | 5.9 | 41057.8 | - | - | 100.0 | ||
| T901 | - | - | - | - | 6.0 | 27884.9 | - | - | 100.0 | ||
| T908 | - | - | - | - | 6.0 | 22128.7 | - | - | 100.0 | ||
| T182 | 双峰 Double peaks | 0.6 | 220.8 | - | - | 6.0 | 16730.5 | 1.3 | - | 98.7 | |
| T191 | 0.6 | 153.5 | - | - | 6.0 | 24553.6 | 0.6 | - | 99.4 | ||
| T264 | 0.6 | 274.3 | - | - | 6.0 | 18029.3 | 1.5 | - | 98.5 | ||
| T307 | 0.6 | 1049.8 | - | - | 6.0 | 16829.8 | 5.9 | - | 94.1 | ||
| 续表3 Continued table 3 | |||||||||||
| 菌株Strain | 致病力Pathogenicity | 峰类型Type of peak | 峰1 The first peak (P1) | 峰2 The second peak (P2) | 峰3 The third peak (P3) | CTIi=Si/( S1+S2+S3) × 100% (i=1, 2 or 3) | |||||
| P1保留时间Retention time of P1 (min) | P1 面积 Area of P1 (S1) / (mAU·s) | P2保留时间Retention time of P2 (min) | P2面积 Area of P2 (S2) / (mAU·s) | P3保留时间Retention time of P3 (min) | P3面积 Area of P3 (S3) / (mAU·s) | CTI1 | CTI2 | CTI3 | |||
| T310 | 0.6 | 320.6 | - | - | 6.0 | 18397.6 | 1.7 | - | 98.3 | ||
| T314 | 0.6 | 145.1 | - | - | 6.0 | 21489.9 | 0.7 | - | 99.3 | ||
| T318 | 0.6 | 676.5 | - | - | 6.0 | 17284.0 | 3.8 | - | 96.2 | ||
| T319 | 0.6 | 310.6 | - | - | 6.0 | 17316.3 | 1.7 | - | 98.2 | ||
| T326 | 0.6 | 327.6 | - | - | 6.0 | 16281.1 | 2.0 | - | 98.0 | ||
| T328 | 0.6 | 758.3 | - | - | 6.0 | 16952.7 | 4.3 | - | 95.7 | ||
| T190 | 3个峰 Three peaks | 0.60 | 316.1 | 4.5 | 304.4 | 6.0 | 14373.6 | 2.1 | 2.0 | 95.9 | |
| T193 | 0.6 | 773.5 | 4.5 | 1088.7 | 6.0 | 21139.1 | 3.4 | 4.7 | 91.9 | ||
| T306 | 0.6 | 1221.8 | 4.5 | 1592.2 | 6.0 | 16692.4 | 6.3 | 8.2 | 85.6 | ||
| T793 | 0.6 | 538.9 | 4.4 | 5838.2 | 6.0 | 30978.6 | 1.4 | 15.6 | 82.9 | ||
| T902 | 0.6 | 732.5 | 4.5 | 2666.8 | 6.0 | 22682.1 | 2.8 | 10.2 | 87.0 | ||
| T906 | 0.6 | 1446.4 | 4.4 | 3497.9 | 6.0 | 18823.9 | 6.1 | 14.7 | 79.2 | ||
| T911 | 0.6 | 1001.4 | 4.4 | 925.4 | 6.0 | 23523.8 | 3.9 | 3.6 | 92.4 | ||
| T659 | 无致病力 Avirulent | 单峰 Single peak | 0.6 | 4329.6 | - | - | - | - | 100.0 | - | - |
| T738 | 0.6 | 12930.9 | - | - | - | - | 100.0 | - | - | ||
| T780 | 0.6 | 5443.3 | - | - | - | - | 100.0 | - | - | ||
| T831 | 0.6 | 8304.2 | - | - | - | - | 100.0 | - | - | ||
| T916 | 0.6 | 8146.0 | - | - | - | - | 100.0 | - | - | ||
| T927 | 0.6 | 9535.4 | - | - | - | - | 100.0 | - | - | ||
| T200 | 双峰 Double peaks | 0.6 | 17214.6 | 4.5 | 9214.6 | - | - | 65.1 | 34.9 | - | |
| T443 | 0.6 | 5401.3 | 4.5 | 3414.6 | - | - | 61.3 | 38.7 | - | ||
| T520 | 0.6 | 3274.9 | 4.5 | 123.8 | - | - | 96.4 | 3.6 | - | ||
| T838 | 0.6 | 4528.34 | 4.5 | 708.3 | - | - | 86.5 | 13.5 | - | ||
| T917 | 0.6 | 4421.0 | 4.5 | 3992.4 | - | - | 52.5 | 47.5 | - | ||
| T996 | 0.6 | 7497.8 | 4.5 | 179.2 | - | - | 97.7 | 2.3 | - | ||
| T921 | 0.6 | 14202.4 | 4.5 | 8411.5 | - | - | 62.8 | 37.2 | - | ||
| T316 | 3个峰 Three peaks | 0.6 | 6782.0 | 4.5 | 2503.5 | 6.0 | 1283.6 | 64.2 | 23.7 | 12.1 | |
| T343 | 0.6 | 5329.5 | 4.4 | 234.7 | 6.0 | 317.4 | 90.7 | 4.0 | 5.4 | ||
| T474 | 0.6 | 4974.8 | 4.4 | 395.2 | 6.0 | 208.8 | 89.2 | 7.1 | 3.7 | ||
| T497 | 0.6 | 3726.3 | 4.5 | 688.3 | 6.0 | 291.4 | 79.2 | 14.6 | 6.2 | ||
| T499 | 0.6 | 4981.7 | 4.4 | 296.8 | 6.0 | 286.2 | 89.5 | 5.3 | 5.1 | ||
| T912 | 0.6 | 12128.8 | 4.4 | 5889.9 | 6.0 | 8095.1 | 46.4 | 22.6 | 31.0 | ||
| T913 | 0.6 | 11700.4 | 4.4 | 7631.2 | 6.0 | 2895.1 | 52.6 | 34.3 | 13.0 | ||
| T278 | 中间型 Interim | 双峰 Double peaks | 0.6 | 5302.2 | 4.5 | 8039.9 | - | - | 39.7 | 60.3 | - |
| T322 | 0.6 | 1783.1 | - | - | 6.0 | 13030.9 | 12.0 | - | 88.0 | ||
| T199 | 3个峰 Three peaks | 0.6 | 8184.4 | 4.5 | 3988.1 | 6.0 | 27328.3 | 20.7 | 10.1 | 69.2 | |
| T313 | 0.6 | 3105.4 | 4.5 | 1859.4 | 6.0 | 12606.8 | 17.7 | 10.6 | 71.7 | ||
| T321 | 0.6 | 2584.5 | 4.5 | 1191.8 | 6.0 | 9038.6 | 20.2 | 9.3 | 70.5 | ||
| T905 | 0.6 | 2899.4 | 4.4 | 11904.3 | 6.0 | 8261.8 | 12.6 | 51.6 | 35.8 | ||
| T910 | 0.6 | 2281.9 | 4.4 | 1885.5 | 6.0 | 23252.4 | 8.3 | 68.8 | 84.8 | ||
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2青枯雷尔氏菌强致病力(A-C)、无致病力(D-H)和中间型突变菌株(G-I)色谱图
-->Fig. 2HPLC spectra of R. solanacearum virulent (A-C), avirulent (D-F) and interim (G-I) mutants
-->
2.4 青枯雷尔氏菌色谱效价指数与其致病力和病害防治效果的相互关系
供试的强致病力菌株中CTI3为100%的菌株,致病力最强,诱导番茄植株发病率均达85%以上,CTI3<100%的菌株,接种后番茄植株发病率介于66.33% —84.14%(表1、表3),分析青枯雷尔氏菌强致病力突变菌株色谱效价值CTI3与其致病力的相互关系,结果表明二者呈极显著正相关(P<0.01),PCC为0.62(表4)。青枯雷尔氏菌无致病力突变菌株色谱效价值CTI1达100%的菌株,其防治效果高,均>80%,CTI1值<90%的菌株,其防治效果低,介于16.68%—63.62%(表2、表3)。分析青枯雷尔氏菌无致病力突变菌株CTI1值与病害防治效果的相互关系,结果表明,二者呈极显著正相关(P<0.01),相关系数为0.80(表5)。
Table 4
表4
表4青枯雷尔氏菌强致病力突变菌株的色谱效价值与其致病力的皮尔逊相关系数
Table 4The correlation index between CTI3 and pathogenicity of R. solanacearum virulent mutants
| 皮尔逊相关系数 PCC | 致病力 Pathogenicity (x1) | CTI3 (x2) |
|---|---|---|
| 致病力 Pathogenicity (x1) | 1.00 | 0.62** |
| CTI3 (x2) | 0.62** | 1.00 |
新窗口打开
Table 5
表5
表5青枯雷尔氏菌无致病力突变菌株的色谱效价值与其病害防治效果的皮尔逊相关系数
Table 5The correlation index between CTI1 and control efficiency of R. solanacearum avirulent mutants
| 皮尔逊相关系数 PCC | 防治效果 Control efficiency (x1) | CTI1 (x2) |
|---|---|---|
| 防治效果 Control efficiency (x1) | 1.00 | 0.80** |
| CTI1 (x2) | 0.80** | 1.00 |
新窗口打开
3 讨论
对于青枯雷尔氏菌的致病力鉴定,LEMESSA等[29,30,31]均采用鉴别寄主植物方法。刘波等[15]根据青枯雷尔氏菌在TTC平板上菌落红斑直径与菌落直径的比值,提出了弱化指数(AI),为青枯菌的致病力鉴定提供了参考指标,将青枯雷尔氏菌分为3种致病力类型:强致病力菌力(AI<0.65)、无致病力菌株(AI>0.75)、中间型菌株(AI介于0.65—0.75)。本研究结合AI和接种番茄寄主法,将供试的60株青枯雷尔氏菌突变菌株分为强致病力、无致病力和中间型。以AI为指标对青枯雷尔氏菌的致病力划分结果与其接种番茄盆栽苗的致病性测定结果相吻合,说明AI作为青枯雷尔氏菌致病力判别指标是可行的。在一定条件下,细菌是一个带电的颗粒,细菌细胞表面覆盖着糖类、脂类、蛋白质、肽聚糖等物质,在不同pH条件下,这些物质的电离状态不同,从而使细菌表面带上不同的电荷[32],因此,可通过高效离子交换色谱将带不同电荷的细菌进行分离。DANIELS[33]利用强阴离子交换树脂,通过控制缓冲液pH和盐浓度来选择性地吸附或洗脱,实现了对6种不同细菌的分离;MARQUIS等[34]利用阳离子交换色谱柱成功地对金黄色葡萄球菌和大肠杆菌混合菌进行了分离,且回收率分别为87%和97%;谢俊斌[35]首次使用高效离子交换色谱对活的细菌进行了分离,成功地将木糖氧化无色杆菌、普通大肠杆菌、短小芽孢杆菌等不同属的细菌进行色谱分离;林娟等[19]应用高效离子交换色谱将青枯雷尔氏菌纯培养物分离出3个致病力不同的特征峰,不同致病力青枯雷尔氏菌的色谱行为不同。本研究利用高效离子交换色谱对3种不同致病力青枯雷尔氏菌突变菌株的色谱行为进行分析,强致病力菌株的主峰为P3峰,出峰时间为5.9或6.0 min;无致病力菌株的主峰为P1峰,出峰时间为0.6 min,本研究结果与林娟等[19]研究结果相吻合,进一步证实可以利用高效离子交换色谱区分不同致病力的青枯雷尔氏菌。
程本亮等[36]研究表明,Tn5转座子插入青枯雷尔氏菌,影响菌株的致病性,形成了菌株改造后致病力的多样性,插入位点在phcA和phcS区域内,菌株致病力就会发生变化,在这两个基因区域之外不发生致病力变化,致病力多样性机理有待进一步研究。本研究选取Tn5转座子插入的60株青枯雷尔氏菌,存在着致病力的分化,表现出不同的色谱行为,反映在致病力强弱上,形成了3种色谱峰型,即单峰、双峰和3个色谱峰。单峰型菌株中,强致病力菌株只有P3峰,无致病力菌株只有P1峰。Tn5转座子插入的大多数菌株(63.33%)表现出双峰或3个色谱峰。笔者根据菌株色谱分离的3个特征峰面积S1(指示无致病力菌株的P1峰面积)、S2(P1峰面积)和S3(指示强致病力菌株P3峰面积),建立色谱效价指数(CTIi),CTIi=Si/(S1+S2+S3)×100%, CTI1为100%的无致病力菌株,其对番茄青枯病的防治效果均>80%,而CTI1值<90%的菌株,其防治效果低,介于16.68%—63.62%;CTI3为100%的强致病力菌株,接种番茄青枯发病率均>85%。分析无致病力菌株的CTI1与病害防治效果的相互关系,表明二者的PCC为0.80,呈极显著正相关;分析强致病力菌株的CTI3与植株发病率的相互关系,表明二者的PCC为0.62,呈极显著正相关。因此,CTI1可作为无致病力高效生防菌株筛选的关键指标,CTI3可作为青枯雷尔氏菌致病力的参考指标。
4 结论
基于弱化指数和生物测定将青枯雷尔氏菌Tn5转座子突变菌株划分为3种致病力类型:强致病力、无致病力和中间型。不同致病力突变菌株的色谱行为不同,存在3种色谱峰类型:单峰、双峰和3个色谱峰。构建了色谱效价指数CTIi,其中CTI1与无致病力突变菌株的防治效果呈极显著正相关,可用于快速筛选出无致病力高效生防菌株;CTI3与突变菌株的致病力呈极显著正相关,可作为青枯雷尔氏菌致病力的参考指标。The authors have declared that no competing interests exist.
